Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.21 no.1 Medellín Jan./Mar. 2008
ARTÍCULO DE INVESTIGACIÓN
Sensibilidad y especificidad del recuento de leucocitos en las materias fecales para predecir la presencia de Salmonella o Shigellaen pacientes con enfermedad diarreica aguda
Sensitivity and specificity of leukocyte count in feces as a predictor of stool culture positivity for Samonella or Shigella
Mónica Cecilia Cuartas Trujillo1, Olga Lucía Molina Upegui1, Ana Cristina Restrepo Ceballos1, Claudia Yarely Maya Carmona1, Sergio Jaramillo Veláquez1, Jorge Hernando Donado Gómez1, John Jairo Zuleta Tobón1, Jaime Aberto López Vargas1
- Hospital Pablo Tobón Uribe (HPTU), Medellín, Colombia.
Nombre del autor responsable de la correspondencia: Jaime Alberto López Vargas. Dirección: Calle 78B No. 69–240, Medellín, Colombia. Teléfono: 4459286. Fax: (4) 4417955. Dirección electrónica: jlopez@hptu.org.co
Recibido: abril 24 de 2007
Aceptado: julio 26 de 2007
Resumen
En la mayoría de los estudios que evalúan la presencia de leucocitos en las materias fecales no se determinan la sensibilidad y especificidad del examen de acuerdo con el recuento de dichas células. Objetivo: evaluar el recuento de leucocitos en las materias fecales como prueba diagnóstica para predecir la presencia de Salmonella o Shigella. Diseño: estudio descriptivo de corte transversal en el Hospital Pablo Tobón Uribe, de Medellín, Colombia, en 905 coprocultivos hechos a pacientes hospitalizados con enfermedad diarreica aguda. Métodos: se registraron el recuento de leucocitos y el resultado del coprocultivo. Este último se tomó como el estándar de oro para evaluar el rendimiento de los diferentes valores del recuento. Resultados: los porcentajes de sensibilidad y especificidad de la prueba, de acuerdo con el recuento de leucocitos fueron, respectivamente: 1–5: 89,2% y 57,1%; 6–10: 86,2% y 52,8%; 11–20: 77,7% y 62,7%; 21–30: 63,9% y 76,3%; 31–50: 45,2% y 85,5%; más de 50: 28,3% y 90,9%. El área bajo la curva fue de 0,7699 (IC 95%: 0,7275–0,8123). Conclusiones: la sensibilidad de la prueba descendió y su especificidad aumentó en la medida en que se incrementaba el recuento de leucocitos en la materia fecal. La baja especificidad con los valores inferiores del recuento de leucocitos puede deberse a la presencia de otros agentes enteroinvasores o a enfermedades diarreicas de causas no infecciosas.
Palabras clave
Enfermedad diarreica aguda, Recuento de leucocitos en materias fecales, Salmonella, Shigella
Summary
In most studies of fecal leukocyte counts as predictors of the result of stool cultures the sensitivity and specificity were not determined.
Objective: to evaluate fecal leukocyte counts as a predictor of the presence of Salmonella and Shigella.
Design: a descriptive, cross section study was carried out in 905 stool cultures at a university hospital in Medellín, Colombia. Results for Salmonella and Shigella were taken as the gold standard to evaluate the sensitivity and specificity of fecal leukocyte counts.
Results: sensitivity and specificity, according to the level of the count, were, respectively: 1–5 leukocytes: 89.2% and 57.1%; 6–10 leukocytes: 86.2% and 52.8%; 11–20 leukocytes: 77.7% and 62.7%; 21–30 leukocytes: 63.9% and 76.3%; 31–50 leukocytes: 45.2% and 85.5%; more than 50 leukocytes: 28.3% and 90.9%. The area under the curve was 0.7699 (CI 95%: 0.7275–0.8123).
Conclusions: sensitivity decreased and specificity increased with higher counts of fecal leukocytes. Low specificity with the lesser values of leukocyte counts may be due to either the presence of enteroinvasive pathogens other than Salmonella and Shigella, or to non–infectious diarrheal disease.
Key words
Acute diarrheal disease, Fecal leukocyte count, Salmonella, Shigella.
INTRODUCCIÓN
La enfermedad diarreica infecciosa es la segunda causa mundial de morbilidad y mortalidad.1 A pesar de su impacto económico y social, existen pocas guías para su diagnóstico y tratamiento.1 La prevalencia de los posibles agentes etiológicos y la disponibilidad de medios diagnósticos y terapéuticos varían de una a otra región. Existen muchas discrepancias en cuanto a la evaluación clínica y de laboratorio de los pacientes con enfermedad diarreica aguda (EDA); por ejemplo, no hay acuerdo en cuanto a la utilidad de los coprocultivos, pues a menudo se los considera, desde el punto de vista de los clínicos, como exámenes de bajo beneficio en relación a su costo, olvidando la valiosa información epidemiológica que de ellos se puede derivar; además, no se debe subestimar la importancia de conocer el agente etiológico ya que puede tener implicaciones directas en el tratamiento con antibióticos. En muchos estudios se han demostrado la baja tasa de positividad de los coprocultivos y, por ende, su alto costo por test positivo; esta situación se deriva de su sensibilidad relativamente baja para la mayoría de los probables patógenos, y de la selección inapropiada de las muestras para cultivo; por eso se han propuesto algunas estrategias para incrementar la utilidad del coprocultivo, entre ellas el uso de medios selectivos, como el destinado a cultivar Escherichia coli O157 en pacientes con diarrea sanguinolenta aguda, o el caldo TCBS para cultivar Vibrio en personas que hayan consumido alimentos de mar en los tres días previos al cuadro diarreico. Otra posibilidad diagnóstica es la detección de toxinas de Clostridium difficile en pacientes que desarrollen una EDA luego de tres días de estar hospitalizados.2 También se han recomendado pruebas de tamización para determinar el carácter inflamatorio o invasivo de la enfermedad diarreica, porque en estos casos es más probable aislar las bacterias que normalmente se intenta demostrar en un coprocultivo (Salmonella y Shigella). Las investigaciones sugieren que cuando las muestras de materia fecal se someten a pruebas de tamización para evidenciar un proceso inflamatorio, aumenta de manera importante la positividad de los cultivos.3,4 Estas pruebas incluyen la detección de lactoferrina y de sangre oculta y la presencia de leucocitos polimorfonucleares en la materia fecal. Las desventajas de la prueba de lactoferrina incluyen su costo, su no disponibilidad en Medellín y los resultados falsos positivos en niños que están siendo amamantados.
Se ha considerado que la presencia de leucocitos en la materia fecal es una prueba de tamización rápida, simple y confiable para identificar a los pacientes con diarrea inflamatoria causada por agentes invasivos. Las investigaciones que han evaluado esta prueba han sido muy heterogéneas en cuanto al número de leucocitos en la materia fecal seleccionado como punto de corte para definir anormalidad, y en cuanto al tipo de bacterias cultivadas que se consideran el estándar de oro; en consecuencia, los porcentajes reportados de sensibilidad y especificidad han variado de 21 a 97% y de 48 a 98%, respectivamente.5 En solo uno de los estudios revisados6 se detalló el rendimiento de la prueba de acuerdo con el número de leucocitos observados en las muestras; este vacío de información nos motivó a realizar el presente trabajo, con el objetivo principal de determinar el rendimiento del recuento de leucocitos en la materia fecal (RLMF) como prueba de tamización para detectar infecciones por Salmonella y Shigella.
MATERIALES Y MÉTODOS
Se hizo un estudio descriptivo de corte transversal con el objetivo de determinar el rendimiento del RLMF para detectar infecciones por Salmonella y Shigella. La población estudiada fue una serie consecutiva de pacientes con diagnóstico de EDA, hospitalizados entre julio de 1998 y diciembre de 2004 en el Hospital Pablo Tobón Uribe, una institución universitaria de cuarto nivel de atención, localizada en el área urbana de la ciudad de Medellín (Colombia); a estos pacientes se les hicieron el RLMF y el coprocultivo para Salmonella y Shigella. Se incluyeron en el estudio todas las muestras provenientes de pacientes con el diagnóstico de EDA adquirida en la comunidad y que fueron hospitalizados por esta u otra causa. Los pacientes se identificaron a partir de la base de datos del Laboratorio de Microbiología del Hospital, en la cual se registraron, entre otras variables, los resultados de los cultivos hechos a los pacientes hospitalizados y el resultado del RLMF. Para la recolección de los datos se empleó el programa Epi Info 6.04.
Métodos
En promedio los recuentos de leucocitos se hicieron en la primera hora después de la recolección de la muestra. Para cuantificar el número de leucocitos por campo de alto poder (40X), se hizo un extendido delgado de la materia fecal, de preferencia del moco si estaba presente. Se lo dejó secar al aire y posteriormente se aplicó el colorante de azul de metileno por 2 minutos. Con objetivo de alto poder (40X) se observó todo el extendido y se procedió a reportar el promedio de leucocitos por campo de alto poder (CAP), distribuido en categorías así: de 1–5, de 6–10, de 11–20, de 21–30, de 31–50 y mayor de 50.
Estándar de referencia
Se consideró el resultado del coprocultivo como el estándar de oro para determinar la presencia de Salmonella o Shigella como causa de la EDA. Las muestras de materia fecal se cultivaron inicialmente en agar XLD y caldo selenito; luego de 18 a 24 horas de incubación se buscaron en el medio sólido colonias sospechosas de Salmonella o Shigella; y se procedió a identificarlas mediante pruebas bioquímicas estándar.7 Del caldo selenito se hizo resiembra en agar Hektoen y se procedió a la identificación de los aislamientos, también por pruebas bioquímicas. Todas las cepas identificadas como Salmonella o Shigella se remitieron al Laboratorio Departamental de Salud Pública del Departamento de Antioquia en donde se confirmó su identificación.
Métodos estadísticos
Se calcularon la sensibilidad y especificidad, los valores predictivos positivo y negativo, y las razones de probabilidad (LR) positiva y negativa con sus respectivos intervalos de confianza del 95%. Se obtuvo la curva ROC para determinar el mejor punto de corte del RLMF y se calculó el rendimiento global de la prueba mediante la exactitud (verdaderos positivos y verdaderos negativos). Para estos cálculos se utilizó el paquete estadístico EPIDAT versión 3.1
RESULTADOS
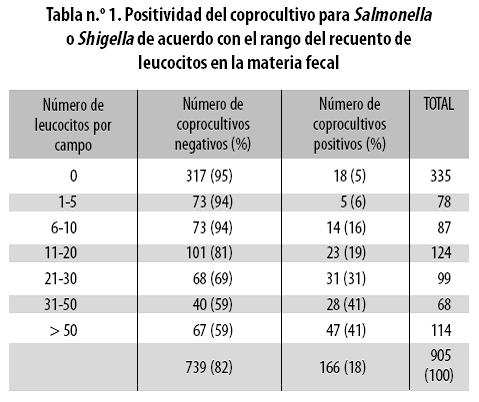
Entre julio de 1998 y diciembre de 2004 se estudiaron 905 coprocultivos provenientes de pacientes con diagnóstico de EDA; no se estudio más de un coprocultivo en un mismo paciente. Sus edades fluctuaron entre 15 días y 98 años; 465 (51,4%) fueron hombres. De los 905 coprocultivos estudiados, en 91 (10%) se aisló Shigella spp y en 75 (8,3%) Salmonella spp, con un total de 166 (18,3%) coprocultivos positivos. En la tabla n.º 1 se presentan los coprocultivos positivos para estas dos bacterias discriminando según el rango de leucocitos detectados en el coprograma.
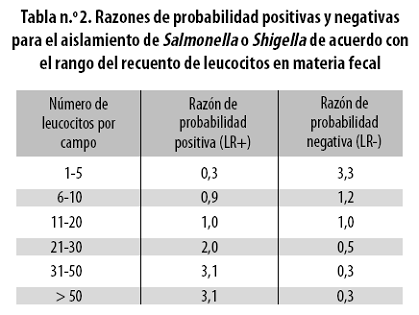
Las razones de probabilidad (Likelyhood ratio, LR) para cada uno de los rangos establecidos en el estudio se presentan en la tabla n.º 2.
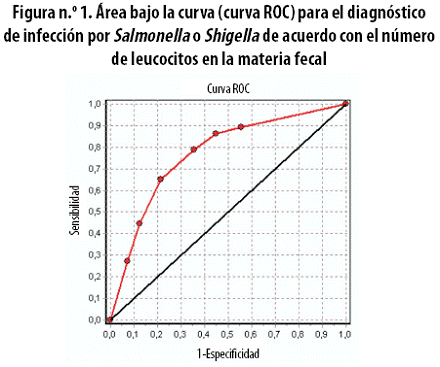
La figura n.º 1 muestra la curva ROC obtenida en el estudio, que tuvo un área bajo la curva de 0,7699 (IC 95%: 0,7275–0,8123).
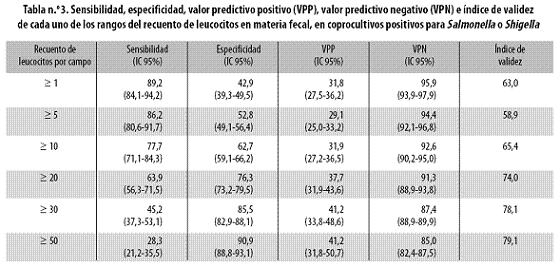
En la tabla n.º 3 se presentan la sensibilidad, la especificidad, y los valores predictivos de cada uno de los posibles puntos de corte de la prueba.
DISCUSIÓN
Se ha reconocido que el examen microscópico de la materia fecal es un método diagnóstico importante en los pacientes con EDA. A principios del siglo XX algunas investigaciones demostraron el potencial diagnóstico del hallazgo de leucocitos en las heces.8
Con base en su patogénesis, la EDA se ha dividido en dos tipos principales según que sea o no inflamatoria. En el primer caso el mecanismo fisiopatológico sucede usualmente en el colon por invasión de la mucosa, y los microorganismos implicados, tales como Shigella spp, Salmonella spp, Escherichia coli enteroinvasiva, y Campylobacter spp se asocian con la presencia de leucocitos en la materia fecal y con el hallazgo clásico de heces disentéricas con moco y sangre; en contraste, los casos de EDA no inflamatoria se deben a agentes no invasores o a productores de enterotoxinas.8,9
El diagnóstico etiológico de la EDA por los síntomas y signos clínicos es difícil: de 55–80% de los pacientes con shigelosis bacteriológicamente comprobada no tienen heces mucosas y sanguinolentas.8–10
Esto lleva a iniciar tratamientos antibióticos con base en hallazgos clínicos de dudosa validez o a esperar los resultados de los cultivos.8 Esta última opción no es práctica debido a la complejidad del coprocultivo y al tiempo requerido para completar las técnicas microbiológicas que actualmente se utilizan, y además, en la mayoría de las investigaciones solo se identifican los agentes causales de EDA en 50–70% de los casos, incluso utilizando muchas de las técnicas de laboratorio disponibles.11 Aunque el coprocultivo es altamente específico para identificar los agentes etiológicos de la diarrea enteroinvasiva, aun considerando la existencia de portadores crónicos asintomáticos, el porcentaje de aislamientos por este medio es menor del 5% en todos los casos de diarrea y el resultado no está disponible antes de 48 horas.1,12,13 Por todo esto se requieren técnicas de laboratorio que permitan el diagnóstico rápido de las causas de EDA.
La detección de leucocitos en materia fecal es un método simple, rápido y económico para hacer una evaluación inicial del paciente con EDA. El reporte de ausencia de leucocitos podría ser una manera rápida y confiable para identificar a los pacientes con EDA de causa viral o inespecífica que no requieran terapia antibiótica. Harris y colaboradores8 propusieron que los recuentos de leucocitos en la materia fecal son valiosos para predecir el posible agente bacteriano implicado. Ellos demostraron que se encontraban leucocitos en la materia fecal en 97% de 68 voluntarios infectados experimentalmente con Shigella, Salmonella o E. coli enteroinvasiva, mientras que el cultivo del agente causal solo era positivo en 60%. Estos mismos autores informaron que eran muy altos los recuentos de leucocitos en la materia fecal de pacientes con shigelosis, colitis por E. coli enteroinvasiva y colitis ulcerativa idiopática, a diferencia de un amplio rango de recuentos en los pacientes con infecciones por Salmonella, quizás debido a la afección más proximal del tracto intestinal en el caso de esta última bacteria.
Se ha especulado acerca de los factores que explican por qué no se encuentran leucocitos en las materias fecales de todos los pacientes en quienes se aíslan bacterias invasoras, y se sugieren los siguientes: los diferentes sitios de infección intestinal, la gravedad variable de la enfermedad, el deterioro en la movilidad de los leucocitos y el estado de portador asintomático de la bacteria en cuestión.11 Algunos autores también han propuesto la teoría de que el número de leucocitos en la materia fecal podría depender de la duración de la enfermedad antes de solicitar atención médica.8 Igualmente, se ha demostrado que el método de recolección de las muestras determina la sensibilidad de la prueba, desde 95% cuando la muestra se recoge en un recipiente hasta 44% cuando se obtiene con aplicador o del pañal.9 En nuestro caso las muestras se recolectaron en recipientes aptos para tal propósito. Algunos investigadores proponen que es crítico el tiempo transcurrido desde la obtención de la muestra hasta su estudio para contar los leucocitos, mientras que otros han reportado que no hay alteración de los recuentos incluso en 24 horas a temperatura ambiente.8
Encontrar leucocitos en pacientes en quienes no se identifica un patógeno invasor se podría deber a la dificultad de aislar agentes como la Shigella con las técnicas bacteriológicas convencionales; en efecto, algunos investigadores han reportado que se la aísla en menos de la mitad de los casos de disentería causada por esta bacteria.8,11 DeWitt y colaboradores10 en un estudio de niños con EDA menores de 4 años, en el que analizaron 16 hallazgos físicos y varias pruebas de tamización en heces, incluyendo pH, sustancias reductoras y sangre oculta, encontraron que la mejor variable predictiva de un coprocultivo positivo era la presencia de leucocitos en las materias fecales.
En la revisión de los estudios de tamización para el diagnóstico de la diarrea infecciosa llevada a cabo por Huicho y colaboradores5 el punto de corte para definir como anormal la presencia de leucocitos en materia fecal varió desde dos o más hasta 50 o más por campo de alto poder. En algunas investigaciones no se mencionaron los puntos de corte pero la sensibilidad y especificidad de la prueba estuvieron entre 21–97% y 48–98%, respectivamente, lo cual se podría explicar por la variedad de puntos de corte, los diferentes estándares de referencia y las variaciones entre las poblaciones estudiadas. En ninguno de los estudios revisados por Huicho y colaboradores,5 y en solo uno de los publicados posteriormente, se establecieron la sensibilidad y especificidad de la prueba considerando el número de leucocitos observados,6 y en éste el estándar de referencia incluyó otros microorganismos capaces de producir una EDA inflamatoria, como por ejemplo, trofozoítos de Entamoeba histolytica, además de las bacterias consideradas por nosotros. Infortunadamente, en el único estudio cuyo estándar de referencia fue igual al nuestro no se especificó el punto de corte establecido para el RLMF;11 por lo tanto, no encontramos una investigación con la cual comparar los resultados de la nuestra. Lo único que se menciona en algunas de las investigaciones relacionado con la cuantificación de los leucocitos es que los pacientes con infecciones por Shigella spp presentan en general un promedio más alto de leucocitos por campo que las causadas por Salmonella spp o por Entamoeba histolytica.14
De acuerdo con nuestros resultados, y como era de esperar, la sensibilidad del recuento de leucocitos en la materia fecal disminuyó a medida que se consideró un nivel más alto, del 89,2% si el recuento era de uno o más, a 28,3% con recuentos superiores a 50 leucocitos por CAP. Ruiz–Peláez y colaboradores6 encontraron una sensibilidad similar a la nuestra (92,3%) con recuentos de 1–5 leucocitos, pero al considerar los recuentos mayores de 50 la cifra obtenida por ellos fue notablemente diferente de la nuestra, de solo 3,2%; pero cabe llamar nuevamente la atención hacia el hecho de que estos autores intentaron el cultivo de más bacterias e incluyeron la Entamoeba histolytica. Gill y colaboradores15 en su metanálisis reportaron, en países en desarrollo, una razón de probabilidad (LR) positiva de 2,94 y una razón de probabilidad negativa de 0,6 cuando establecieron un punto de corte por encima de 5 leucocitos por CAP. Nuevamente, no se establece una escala de valores de los recuentos de leucocitos como la reportada en el presente estudio por lo que no se puede hacer un análisis comparativo de los datos obtenidos. Tal como era de esperar, la especificidad aumentó en la medida en que se incrementó el número de leucocitos establecido como patrón de referencia, pasando del 57,1% para los recuentos de uno o más al 90,9% para los valores mayores de 50.
Se deben tener en cuenta varias limitaciones en nuestro estudio, entre ellas las siguientes: desconocemos cuántos de los pacientes venían recibiendo antibióticos posiblemente efectivos contra las bacterias estudiadas y el tiempo de evolución de la EDA, variable que, según se ha demostrado, afecta el hallazgo de leucocitos en la materia fecal.11 De igual manera, fueron los médicos que solicitaron el coprocultivo y no los investigadores quienes definieron que el paciente tenía una EDA. Tampoco se estableció el número de pacientes con presencia de trofozoítos de Entamoeba histolytica, otra de las posibles causas de disentería12 y no se intentó identificar microorganismos como E. coli enteroinvasiva y Campylobacter jejuni, que podrían causar la presencia de leucocitos en las heces, lo cual explicaría las bajas cifras de especificidad, principalmente en los rangos inferiores de los recuentos de leucocitos. De acuerdo con nuestros resultados, el empleo del recuento de leucocitos como prueba para tamización en el estudio diagnóstico de la EDA depende de los objetivos que se pretenda obtener, teniendo presente que muchas variables pueden afectar la técnica como tal y que no existe un estándar de oro confiable para su evaluación, con los procesos normalmente disponibles en los laboratorios clínicos.
Declaración de conflicto de intereses
La presente investigación se realizó como parte del proceso del día a día del laboratorio de microbiología y por propia iniciativa; por lo tanto, no subyace ningún interés que pudiera haber intervenido en la metodología o en las conclusiones del trabajo.
Financiación
Este estudio no contó con financiación pública o privada.
REFERENCIAS BIBLIOGRÁFICAS
1. Guerrant RL, Van Gilder T, Steiner TS, Thielman NM, Slutsker L, Tauxe RV, et al. Practice guidelines for the management of infectious diarrhea. Clin Infect Dis 2001; 32: 331–350. [ Links ]
2. Valenstein P, Pfaller M, Yungbluth M. The use and abuse of routine stool microbiology. A College of American Pathologists Q–Probes study of 601 institutions. Arch Pathol Lab Med 1996; 120: 206–211. [ Links ]
3. Alvarado T. Faecal leucocytes in patients with infectious diarrhea. Trans R Soc Trop Med Hyg 1983; 77: 316–320. [ Links ]
4. Huicho L, Garaycochea V, Uchima N, Zerpa R, Guerrant RL. Fecal lactoferrin, fecal leukocytes and occult blood in the diagnostic approach to childhood invasive diarrhea. Pediatr Infect Dis J 1997; 16: 644–647. [ Links ]
5. Huicho L, Campos M, Rivera J, Guerrant RL. Fecal screening tests in the approach to acute infectious diarrhea: a scientific overview. Pediatr Infect Dis J 1996; 15: 486–494. [ Links ]
6. Ruiz–Peláez JG, Mattar S. Accuracy of fecal lactoferrin and other stool tests for diagnosis of invasive diarrhea at a Colombian pediatric hospital. Pediatr Infect Dis J 1999; 18: 342–346. [ Links ]
7. York MK, Rodrigues–Wong P. Fecal culture for aerobic pathogens of gastroenteritis. En: Isenberg HD, ed. Clinical Microbiology Procedures Handbook, 2d ed. Washington, D.C.: American Society for Microbiology; 2004. p. 3. 8.1.1.–21. [ Links ]
8. Harris JC, Dupont HL, Hornick RB. Fecal leukocytes in diarrheal illness. Ann Intern Med 1972; 76: 697–703. [ Links ]
9. Korzeniowski OM, Barada FA, Rouse JD, Guerrant RL. Value of examination for fecal leukocytes in the early diagnosis of shigellosis. Am J Trop Med Hyg 1979; 28: 1031–1035. [ Links ]
10. DeWitt TG, Humphrey KF, McCarthy P. Clinical predictors of acute bacterial diarrhea in young children. Pediatrics 1985; 76: 551–556. [ Links ]
11. Pickering LK, DuPont HL, Olarte J, Conklin R, Ericsson C. Fecal leuckocytes in enteric infections. Am J Clin Pathol 1977; 68: 562–565. [ Links ]
12. Guerrant RL, Shields DS, Thorson SM, Scharling JB, Groschel DHM. Evaluation and diagnosis of acute infectious diarrhea. J Clin Microbiol 1985; 78: 91–98. [ Links ]
13. Thielman NM, Guerrant RL. Acute diarrhea. New Engl J Med 2004; 350: 38–47. [ Links ]
14. Speelman P, McGlaughlin R, Kabir I, Butler T. Differential clinical features and stool findings in shigellosis and amoebic dysentery. Trans R Soc Trop Med Hyg 1987; 81: 549–551. [ Links ]
15. Gill CJ, Lau J, Gorbach SL, Hamer DH. Diagnostic accuracy of stool assay for inflammatory bacterial gastroenteritis in developed and resource–poor countries. Clin Infect Dis 2003; 37: 365–375. [ Links ]