Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.21 no.1 Medellín Jan./Mar. 2008
ARTÍCULO DE INVESTIGACIÓN
Relación entre vitamina A y alteraciones mucocutáneas y pilosas en niños de zonas palúdicas
State of the skin, mucous membranes, hair and vitamin A in children of endemic malaria zones of Antioquia (Colombia)
Jaime CarmonaFonseca1, Adriana María Correa Botero1, Rosa Magdalena Uscátegui Peñuela2
- Grupo Malaria, Universidad de Antioquia. Calle 62 Nº 5259, laboratorio 610. Medellín, Colombia. http://medicina.udea.edu.co/Investigacion/Grupos/malaria/index.htm
- Grupo Alimentación y Nutrición Humanas, Universidad de Antioquia.Correspondencia: jaimecarmonaf@hotmail.com
Recibido: agosto 10 de 2007
Aceptado: octubre 30 de 2007
Resumen
Objetivo: conocer la clase y frecuencia de las alteraciones mucocutáneas y del cabello en niños de zonas maláricas de Antioquia (Colombia). Metodología: diseño experimental, balanceado, no ciego, con 93 niños con paludismo, seguidos durante 30 días. Resultados: 61% de los niños presentaron desnutrición crónica o global o ambas según la antropometría. Antes del tratamiento hubo alteraciones de la piel (41%), mucosa labial (12%), mucosa oral (2%), lengua (15%) y cabello (16%). El día 30 hubo mejoría en todos estos sitios corporales, excepto en la piel (alteraciones: 42%). El retinol plasmático fue menor de 20 µg/dL en 56,5% (el día 1, cuando tenían malaria) y en 4,5% el día 30 (sin paludismo). A lo largo del seguimiento el retinol (µg/dL) fue de 19,1 ± 6,8 el día 1; 32,6 ± 7,4 el día 8 y 31,2 ± 7,9 el día 30.
El estado de la piel, las mucosas labial y bucal, la lengua y el cabello no se asoció con el retinol en los días 1 y 30, excepto el del cabello al día 30: 50% con retinol por debajo de 20 µg/dL no tenían el cabello sano, comparados con 9% de los que tenían el retinol en 20 o más µg/dL; tampoco se asoció con el riesgo de desnutrición, excepto por la asociación entre piel alterada y desnutrición crónica + global: 60% de los niños con piel anormal tenían desnutrición crónica + global, contra 20% de los que tenían la piel normal que presentaron esa desnutrición. Conclusiones: fueron muy frecuentes las alteraciones mucocutáneas y capilares en estos niños de zonas maláricas de Antioquia, quienes además presentaron elevada prevalencia de desnutrición crónica, global o ambas (61%) y baja frecuencia de déficit de retinol sérico (4,5%). En general las alteraciones mucocutáneas y capilares no se asociaron con el estado del retinol ni con el estado nutricional.
Palabras clave
Colombia, Desnutrición, Malaria, Paludismo, Retinol, Vitamina A
Summary
Objective: to know the class and frequency of skin, mucous membranes and hair alterations in children of endemic malaria zones of Antioquia (Colombia). Methodology: nonblind balanced experimental design. Ninety three children with malaria were included and followed up during 30 days. Results: 61% of these children had chronic or global or both kinds of malnutrition, according to the anthropometric indexes. Before treatment there were alterations in the following proportions: skin 41%, labial mucous membrane 12%, oral mucous membrane 2%, tongue 15% and hair 16%. At day 30 there had been improvement in all these sites, except for the skin (alterations: 42%). Plasmatic retinol level was lower than 20 µg/dL in 56% of patients at day 1 (with malaria) and in 4.5% at day 30 (without malaria). During followup retinol levels (µg/dL) were as follows: 19.1 ± 6.8 at day 1; 32.6 ± 7.4 at day 8; 31.2 ± 7.9 at day 30. In general, the state of the skin, labial and oral mucous membranes, tongue, and hair was not associated with retinol level either at day 1 or at day 30; the only exception was the state of the hair at day 30: 50% of those with retinol level lower than 20 µg/dL had nonhealthy hair, as compared with only 9% of those with retinol level at 20 µg/dL or higher; such state was also not associated with malnutrition risk, except for the association of abnormal skin with chronic and global malnutrition: 60% of children with abnormal skin had chronic and global malnutrition; the corresponding figure for those with normal skin was 20%. Conclusions: skin, mucous membranes and hair alterations were very frequent in these children of endemic malaria zones of Antioquia, who also had a high prevalence of chronic, global or both kinds of malnutrition (61%) and low frequency of deficiency of plasmatic retinol (4.5%). In general, skin, mucous membranes, and hair alterations were not associated with either retinol levels or nutritional state.
Key words
Colombia, Malaria, Malnutrition, Paludism, Retinol, Vitamin A.
INTRODUCCIÓN
El término vitamina A es descriptivo genérico para designar compuestos que muestran las propiedades biológicas del retinol o de sus ésteres y éteres. El retinol es un compuesto químico específico de la vitamina A, con frecuencia llamado vitamina A1. Retinoide se refiere a la sustancia química retinol o a otros derivados estrechamente relacionados que ocurren de manera natural. Los retinoides también incluyen análogos sintéticos con relación estructural que no necesariamente tienen actividad similar a la del retinol. El retinol es un alcohol primario que existe en forma esterificada en los tejidos animales. El ácido retinoico (vitamina A ácida) comparte algunos de los efectos biológicos del retinol. Los carotenos son compuestos naturales sintetizados por los vegetales y por algunas algas; muchos carotenos, tras procesos metabólicos en los animales y en el ser humano, se convierten en retinol y sus metabolitos, como sucede con los alfa y beta carotenos y la criptoxantina, pero no con la luteína ni el licopeno.1 Las plantas y algas no sintetizan retinoides pero sí lo hacen las halobacterias (conocidas también como halomebacterias, que son una clase de arqueobacterias que se encuentran en el agua saturada o casi saturada de sal). 2,3
La vitamina A está fuertemente implicada en diversos procesos, a saber: 1) la visión [a]fototransducción: transducción de la luz en señales nerviosas; [b] diferenciación normal de las células de la conjuntiva, la córnea y otras estructuras oculares, además de prevenir la xeroftalmía; 2) en la diferenciación celular, la inhibición de la proliferación celular y la apoptosis (todo ello mediante influencia sobre genes); 3) en el desarrollo embrionario y fetal, 4) en la inmunidad 2,3 y 5) en el proceso antinflamatorio.4 Se ha adoptado la expresión 'trastornos por deficiencia de vitamina A' (TDVA) para cubrir el espectro clínico total de enfermedades asociadas a la deficiencia de esta vitamina.5 El consumo de vitamina A (en alimentos de origen animal) y de carotenoides (sus precursores en los alimentos vegetales) está relacionado con menor frecuencia de desarrollo de varios tipos de cáncer y con la mejoría de la función inmune; por medio del ácido retinoico, uno de sus metabolitos, la vitamina A es esencial para la embriogénesis y su deficiencia durante la gestación induce malformaciones en animales y, quizás, en el ser humano. La deficiencia de vitamina A se manifiesta por un conjunto de síntomas y signos, entre los cuales están los problemas oculares, las infecciones y las alteraciones mucocutáneas.6 El suplemento con vitamina A tiene efecto benéfico en procesos inflamatorios como acné vulgar y displasia broncopulmonar, y en algunas formas de cáncer y estados precancerosos. La deficiencia de la vitamina A induce inflamación y agrava la preexistente.4
El consumo excesivo de vitamina A preformada y presente en tejidos animales y en suplementos, pero no como carotenos (fuente vegetal), tiene efectos tóxicos bien establecidos: cefalea, vómito, diplopía, alopecia, sequedad de membranas, descamación, dolores óseo y articular, daño hepático, hemorragia, coma y teratogénesis.2,3
Las reservas tisulares de retinoides en los adultos sanos son grandes y duran un largo plazo antes de que se manifiesten los síntomas y signos de la deficiencia.1 La concentración de vitamina A en el hígado varía ampliamente en una misma persona en diferentes tiempos y entre las personas, pero la mayor parte de la concentración plasmática se mantiene en un estrecho intervalo regulado y solo disminuye cuando las reservas hepáticas se agotan casi por completo. Por eso, en ausencia de inflamación, un bajo nivel sanguíneo de retinol casi siempre indica agotamiento hepático de vitamina A. Se habla de reservas hepáticas bajas cuando hay menos de 20 µg de retinol total por gramo de tejido hepático; con 20 a 300 µg de retinol total por gramo de tejido hepático el retinol plasmático se mantiene en un valor relativamente constante, alrededor de 5060µg/dL.2,3
Todavía hoy, 'la deficiencia de vitamina A es una de las enfermedades más graves por deficiencia nutricional en el mundo'. 1 Los síntomas y signos de la deficiencia de vitamina A pasan inadvertidos con facilidad y las lesiones cutáneas, como hiperqueratosis folicular e infecciones, están entre los más precoces,1 aunque son precedidas por manifestaciones del sistema visual (ceguera nocturna [nictalopía] y luego xeroftalmía). La deficiencia de vitamina A se observa principalmente en pacientes con síndromes de malabsorción; sin embargo, se requiere al menos un año de carencia para agotar las reservas hepáticas. Se manifiesta en la piel con xerosis, hiperpigmentación, hiperqueratosis folicular y cabello fracturado y enroscado. Existe una forma especial de hiperqueratosis folicular, la frinoderma o frinodermia que se asocia clásicamente a la deficiencia de vitamina A, pero se ha descrito también en la deficiencia de vitaminas E y B, en la de ácidos grasos esenciales y en la desnutrición generalizada.7,8
Las deficiencias nutricionales están asociadas a una amplia variedad de hallazgos cutáneos en los niños;9 tales cambios en la integridad estructural de la piel y las mucosas se relacionan con deficiencia de riboflavina, niacina, piridoxina, ácido fólico, vitamina B6, vitamina B12, biotina, vitamina C, vitamina K, hierro, zinc, ácidos grasos esenciales y desnutrición proteicocalórica.10,11 Aunque algunos signos son característicos de la deficiencia específica de un nutriente, se observa un traslapo de las manifestaciones cutáneas en múltiples estados de deficiencia.12,13
La administración de suplementos de vitamina A se lleva a cabo fundamentalmente en dos casos: 1) para tratar pacientes con xeroftalmía aguda y otras situaciones de alto riesgo que requieren un aumento inmediato de vitamina A (ceguera nutricional, sarampión, etc.); 2) para prevenir su deficiencia cuando se ha comprobado que la administración periódica de suplemento es la forma más eficaz y menos costosa de mejorar el nivel de esta vitamina.14
La investigación clínica del estado de vitamina A consiste en un cuidadoso examen (en particular lo visual, mucocutáneo y capilar), y una profunda anamnesis sobre el consumo de alimentos y suplementos, y la historia de infecciones. La evaluación de salud pública (tamización) usa básicamente el nivel sérico de retinol en el grupo o población, pero ese nivel no se considera un buen indicador del estado vitamínico de una persona en particular. También se ha medido el retinol en el líquido lagrimal y en la leche materna. La evaluación de la citología de impresión conjuntival se propone como una prueba para tamización en campo (detecta la ausencia de células caliciformes normales y la presencia de células epiteliales aumentadas de volumen).2,3
Los criterios de la Organización Mundial de la Salud (OMS) para problemas de salud pública por vitamina A incluyen la prevalencia de signos oculares típicos de deficiencia grave (xerosis corneal y las ulceraciones conocidas como manchas de Bitot) y las concentraciones límite basadas en poblaciones como indicadores subclínicos (retinol bajo en suero, en leche materna).15
La deficiencia de vitamina A cursa en varias etapas: a) deficiencia subclínica: corresponde al agotamiento de los depósitos hepáticos; no hay trastorno en los tejidos ni de las funciones (no hay síntomas ni signos); b) deficiencia clínica: aparece xeroftalmía y, más tarde, la córnea se vuelve mate y seca. Después pierde su transparencia y sobre ella surgen opacidades blancas que se engruesan y luego se vascularizan (queratomalacia); también se presentan las manchas de Bitot.16
El estado de la vitamina A en el ser humano va desde la deficiencia sin manifestaciones clínicas evidentes hasta la toxicidad clínica declarada; y entre esos dos extremos se encuentra una gama de situaciones que deben ser evaluadas con ayuda del laboratorio y que incluyen la deficiencia marginal, el estado adecuado y la concentración excesiva; en este intervalo central es muy constante la concentración plasmática de retinol.2,3 Los 'datos típicos' del estado de vitamina A en humanos son:
1. Deficiencia subclínica grave: retinol sérico menor de 0,35 µMol/L (0,35 µMol/L = 10 µg/dL), que indica un agotamiento muy grave de las reservas hepáticas (menos de 10 µg/g).
2. Deficiencia subclínica leve o marginal: retinol sérico de 0,35 a 0,70 µMol/L (10 a 20 µg/dL), que revela grave escasez hepática (1020 µg/g).
3. Estado adecuado: retinol sérico de 0,70 a 3,0 µMol/L (20 a 85 µg/dL), que corresponde a una concentración hepática normal (20300 µg/g).
4. Estado excesivo: retinol sérico mayor de 3,0 µMol/L (más de 85 µg/dL), que revela más de 300 µg/g en el hígado.
5. Estado de toxicidad: retinol sérico y hepático con valores muy altos, concomitantes con manifestaciones clínicas.2,3
En Colombia, el Instituto Nacional de Salud publicó en 1998 los resultados de una investigación sobre 'Deficiencia de hierro, vitamina A y prevalencia de parasitismo intestinal en la población infantil (1259 meses) y anemia nutricional en mujeres en edad fértil. Colombia, 19951996'17. El estudio usó una muestra nacional de población que incluyó cinco grandes regiones (Atlántica, Pacífica, Oriental, Central y Bogotá). La región Central captó personas de Huila, Tolima, Quindío, Risaralda, Caldas y Antioquia; en Antioquia se incluyeron cinco municipios: Medellín, Yolombó, Chigorodó, Santa Bárbara y Betulia, es decir, que las principales zonas maláricas (Urabá y Bajo Cauca) no quedaron incluidas. Respecto a la deficiencia de vitamina A en los niños (n = 1.774), se midió con el método espectrofotométrico de Bessey y colaboradores, y los valores por debajo de 22 µg/dL se confirmaron por cromatografía líquida de alta resolución, (HPLC). Se informó que 1,5% tenían menos de 10 µg/dL, 12,7% de 10 a 19,9 µg/dL, 34,2% de 20 a 29,9 µg/dL, 56,3% tenían 30 o más µg/dL (los intervalos se basan en recomendaciones de la OMS). La población más afectada fue el grupo de 2435 meses de edad. La región Pacífica mostró la mayor prevalencia (20,3%).17
En 2007, en 175 niños de 25 años de las zonas urbana y rural de Funza (Cundinamarca, Colombia), (zona no malárica), se midió el nivel de retinol plasmático, mediante adaptación del método espectrofotométrico de Bessey y colaboradores y cuando los resultados fueron menores de 25 µg/dL se repitieron por HPLC; con base en los intervalos de la OMS, antes referidos, se halló deficiencia (menos de 20 µg/dL) en 4,6% de los niños y hubo riesgo de ella (20 a 29,9 µg/dL) en 36%.18
Nosotros, en 2002, informamos el estudio de un grupo de 49 niños de 4 a 9 años de edad, sin malaria, residentes en El Bagre (Bajo Cauca), en el departamento de Antioquia (Colombia); hallamos bajos niveles séricos de retinol en 35% de ellos (la medición se hizo con un método desarrollado y aplicado en el Laboratorio de Química Farmacéutica de la Universidad de Antioquia).19 En otro grupo de 37 personas sin malaria, residentes en Turbo (Urabá) y El Bagre (Bajo Cauca), hallamos valores de retinol en plasma de 47 ± 22 µg/dL; 11% mostraron menos de 20 µg/dL, 16% tenían niveles entre 21 y 29 µg/dL y el resto (73%) estaban en el intervalo adecuado (30 a 70 µg/dL). En ese grupo hubo cuatro menores de 15 años con retinol entre 15 y 59 µg/dL y valores medios de 35 ± 19 (datos sin publicar). En resumen, los tres informes en niños colombianos hallaron deficiencia en 14,2% (menos de 20 µg/dL) en el país,17 4,6% en Funza, Cundinamarca (zona no malárica ) (menos de 20 µg/dL)18 y en 35% en El Bagre (Antioquia, zona malárica).19
Este informe presenta los resultados obtenidos como parte de un proyecto cuyo objetivo general fue evaluar el efecto que sobre la respuesta terapéutica antimalárica tenían el suplemento con vitamina A oral y el tratamiento antihelmíntico y antiprotozoario de dosis única; como componente del trabajo se evaluaron los síntomas y signos mucocutáneos antes del tratamiento antiparasitario y en los días 8 y 30 del seguimiento (días postratamiento), así como el nivel de retinol.
MATERIALES Y MÉTODOS
Clase de estudio
El estudio hizo parte de un macroproyecto que se diseñó con cuatro grupos de niños (25 por grupo) para evaluar el papel del suplemento con vitamina A y el tratamiento antiparasitario intestinal (albendazol y secnidazol) en la respuesta terapéutica antimalárica. Los cuatro grupos se evaluarían simultáneamente, mediante un diseño experimental, balanceado, con asignación aleatoria al grupo, con determinación no ciega del efecto (la respuesta terapéutica). Aquí se describen los estados de piel, mucosas y cabello de los niños, en relación con el nivel de retinol en sangre, y en general se omite toda referencia a los grupos de tratamiento. En el estudio se logró evaluar a 93 pacientes con paludismo falciparum (n = 11) o vivax (n = 82).
Unidad de análisis y diseño muestral
La unidad de análisis fue cada niño con malaria no complicada, definida según los criterios de la Organización Mundial de la Salud 20 y sometido a tratamiento antipalúdico.
En 20002003, en Turbo y en El Bagre, los niños de 514 años con malaria (no se tiene el dato para niños de 410 años) fueron 3.182 por año, con base en los cuales se calculó la muestra:21
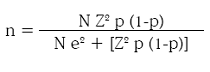
donde: n: tamaño de muestra. N: población de origen, o sea 3.182 niños con malaria con edades de 514 años; Z: unidades Z correspondientes a un intervalo de confianza del 95%, es decir Z = 1,96; e: error de muestreo, definido en 10% en este trabajo; p: proporción del 'fenómeno', definida en 50%, para forzar una muestra de máximo tamaño; 1p: complemento de p.
El interés era estudiar múltiples fenómenos cuyas prevalencias varían, lo que llevó a muestras de diferente tamaño, así: prevalencia de falla del tratamiento antimalárico (estimada en 0,1 y llevó a n = 34), de parásitos intestinales (estimada en 0,8; n = 60), de desnutrición crónica (0,65; n = 85), de pobreza económica (0,6; n = 90), de todos los cuatro anteriores (0,0312; n = 2); para 'p' con valor 0,5 se obtuvo el mayor tamaño de muestra (n = 93). Se decidió trabajar con n = 93 para garantizar que la muestra fuese apropiada para todos los fenómenos. La muestra se aproximó a 100 y se pensó estudiar 50 en El Bagre y 50 en Turbo.
Los pacientes palúdicos se captaron según el orden de llegada al puesto urbano de malaria del respectivo municipio, al que acudieron por iniciativa propia. La captación se hizo entre julio de 2004 y julio de 2005. Los niños se captaron si satisfacían los criterios de inclusión y sus acudientes daban el consentimiento informado escrito. Cada niño fue seguido durante 30 días, con varias evaluaciones en ese lapso.
Población de referencia
La población de referencia la integran personas de 4 a 10 años, de uno u otro sexo, residentes en las zonas urbanas o rurales de los municipios de El Bagre y Turbo, que consulten al puesto de diagnóstico de malaria de cada lugar por presentar síndrome febril y a quienes se les demuestre, mediante examen de gota gruesa, infección con Plasmodium falciparum o P. vivax, excluyendo las infecciones mixtas.
Criterios de inclusión en el estudio
Los pacientes con malaria se admitieron si cumplían con todos estos requisitos:
a) Tener malaria por P. vivax o P. falciparum.
b) Tener parasitemia entre 1.000 y 50.000 parásitos asexuales/µL.
c) Residir en El Bagre o en Turbo, bien fuera en área rural o urbana.
d) Tener entre 4 y 10 años de edad.
e) Acudir voluntariamente al puesto de diagnóstico de malaria.
f) No tener enfermedad aparente distinta de la malaria.
g) No tener malaria complicada según los criterios de la OMS.20
h) Aceptar la participación en el estudio mediante consentimiento informado y escrito firmado por el acudiente.
i) No haber tenido malaria en los 30 días previos.
Criterios de exclusión en el estudio
a) Presentar alguna otra enfermedad, trauma, accidente o envenenamiento.
b) No cumplir con las citas para evaluación los días 1, 2, 3, 78, 1415 y 2831.
Examen clínico y medición de retinol
Dos médicos generales, previamente adiestrados y orientados hacia la búsqueda de signos carenciales en la piel, las mucosas y el cabello, hicieron la evaluación de los niños y se encargaron de los diferentes tratamientos y controles, apoyados por laboratoristas clínicos profesionales.
De cada niño se obtuvo el dato de la fecha de nacimiento y se calculó la edad en meses; para el peso corporal, sin ropa exterior ni zapatos, se usó una báscula electrónica con 100 kg de capacidad y 100 gramos de sensibilidad; para la talla, que se tomó de pie y sin zapatos, se usó un estadiómetro flexible, fijo en la pared, de 2 metros de capacidad y 0,1 cm de sensibilidad; cada medición de peso y estatura se registró dos veces. El estado nutricional se midió con los indicadores antropométricos peso para la talla (peso/talla) para el riesgo de desnutrición aguda, peso para la edad en meses (peso/edad) para el riesgo de desnutrición global, y talla para la edad en meses (talla/edad) para el riesgo de desnutrición crónica, todos ellos construidos con el programa Epinut de EpiInfo 6.00. Se consideró la existencia de riesgo de desnutrición cuando el valor del índice del niño (medido en unidades Z) era menor que la mediana menos 1 desviación estándar.
A cada niño se le tomaron en total 10 mL de sangre, 8 de los cuales se pusieron en un tubo con EDTA para medir el retinol y hacer hemoleucograma; los 2 mL restantes se depositaron en un tubo seco para medir la proteína C reactiva (PCR) y la ferritina. El tubo con la muestra para medir retinol se envolvió en papel de aluminio y luego se depositó en una bolsa plástica para protegerla del aire y la luz, así como del contacto directo con hielo con el fin de evitar la oxidación del retinol; esa muestra fue enviada en hielo seco al laboratorio encargado del análisis.
El retinol se evaluó en el Laboratorio de Nutrición del Instituto Nacional de Salud (Bogotá). La determinación del retinol en plasma se hizo por el método de cromatografía de alta resolución para líquidos (HPLC), con un cromatógrafo líquido Waters 600 E con detector UV. Se tomaron como deficientes los valores inferiores a 20 µg/dL, de acuerdo con un estudio nacional en menores de 5 años.17
Tratamientos antipalúdico, antiparasitario intestinal y suplemento con vitamina A
Todos los tratamientos fueron estrictamente supervisados por el médico y el laboratorista clínico en cada municipio (Turbo, El Bagre).
Los medicamentos antimaláricos se obtuvieron en la Dirección Seccional de Salud de Antioquia (DSSA) y se aplicaron según los esquemas del Ministerio de Protección Social de Colombia y la Dirección Seccional de Salud de Antioquia, acompañados con agua.
Además del tratamiento antipalúdico, los niños recibieron antiparasitarios intestinales y vitamina A. Los primeros se administraron por vía oral, cada uno en dosis única, igual para cada niño, cualquiera que fuese su edad (410 años); cada uno recibió sendos frascos de los siguientes medicamentos: albendazol en suspensión al 4% en frasco de 10 mL (400 mg) de Laboratorios MK (Colombia); secnidazol en suspensión al 33,3% en frasco de 15 mL, con 500 mg de Laboratorios Biogen (Genéricos Medicalex) (Colombia).
De la vitamina A (Retiblan®, Laboratorios Procaps, Colombia), en cápsulas de 100.000 U.I, cada niño recibió 200.000 U.I.
Consideraciones éticas
El acudiente de cada niño recibió una explicación detallada del proyecto y firmó el consentimiento informado. El estudio fue avalado por el Comité de Ética del Centro de Investigaciones Médicas de la Universidad de Antioquia.
Análisis estadístico
Para el análisis de los datos se usaron los programas EpiInfo 6.00 y SPSS versión 10. Se calcularon medidas de tendencia central y dispersión; se compararon grupos independientes (ejemplo: promedios por sexo) con la prueba no paramétrica de Kruskall y Wallis. Las comparaciones entre grupos pareados (ejemplo: los mismos niños en los días 1 y 30) se hicieron con la prueba no paramétrica de Wilcoxon. Se usan estas expresiones: D.E: desviación estándar; gl: grados de libertad; media: promedio aritmético; n: número de personas; X2: chi (ji) cuadrada; p: valor de probabilidad.
RESULTADOS
Según la antropometría, la 'desnutrición de largo plazo' entendida como la presencia de riesgo de desnutrición crónica (talla para la edad), o de desnutrición global (peso para la edad) o de ambas, se halló en forma parcial en 23% de los niños (tenían una de ellas) y en forma plena (tenían ambos tipos de desnutrición) en 38%, para un total de 61% con desnutrición de largo plazo. Otro 15% presentó riesgo de desnutrición aguda (peso para la talla).
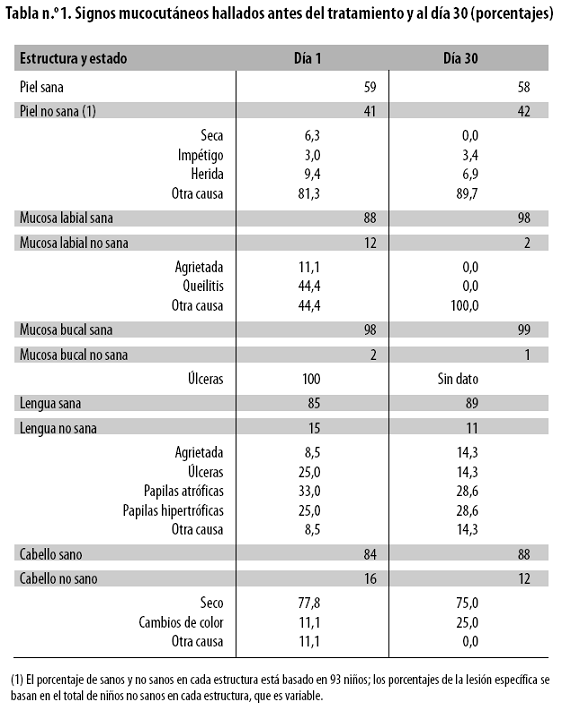
La frecuencia de anomalías en la piel, mucosas labial y oral, lengua y cabello en el momento del ingreso al estudio y al día 30 se aprecia en la tabla n.º 1.
Antes del tratamiento (ingreso) había alteraciones de la piel en 41% de los niños, de la mucosa labial en 12%, de la mucosa oral en 2%, de la lengua en 15% y del cabello en 16%. Los valores del día 30 mostraron mejoría en todos los lugares corporales, excepto en la piel, que pasó de 59% a 58% con el diagnóstico de sana.
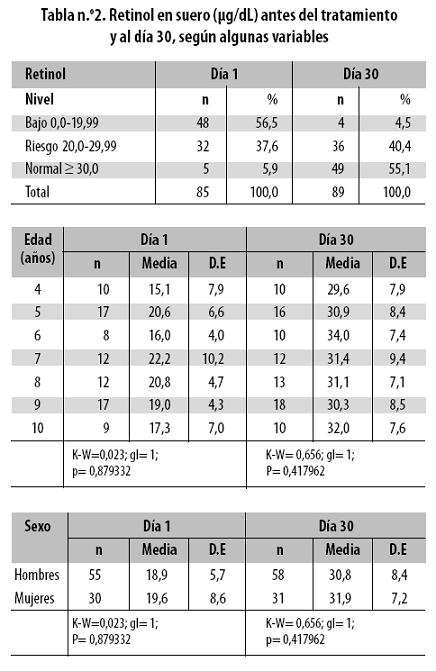
Los valores de retinol estuvieron por debajo de 20 µg/dL en 56,5% de los niños en el momento del ingreso, cuando tenían malaria, y en 4,5% al día 30, cuando estaban sin paludismo, (p = 0,000000) (tabla n.º 2).
A lo largo del seguimiento dichos valores fueron como sigue en µg/dL: 19,1 ± 6,8 al día 1; 32,6 ± 7,4 al día 8 y 31,2 ± 7,9 al día 30, de tal forma que son obvios el bajo nivel del día 1 y los niveles normales al curarse la malaria y cesar el estado inflamatorio superagudo que ella establece; esos valores están hacia el límite inferior del intervalo normal. En todos los grupos de edad (entre 4 y 10 años) el retinol sérico estaba fuertemente disminuido en el momento del ingreso (promedio entre 15,1 y 22,2 µg/dL según el grupo de edad); cuando estaban sin malaria, al día 30, se apreció una importante elevación del retinol, de tal forma que todos los grupos mostraron 29,6 µg/dL o más como promedio. Los valores de retinol en hombres y en mujeres fueron estadísticamente similares tanto al ingreso como al día 30.
Entre quienes recibieron y quienes no recibieron vitamina A, el nivel de retinol fue estadísticamente igual en los tres momentos en que se midió (antes del tratamiento, al día 8 y al día 30), es decir, que el suplemento con vitamina A no elevó el nivel de retinol en sangre.
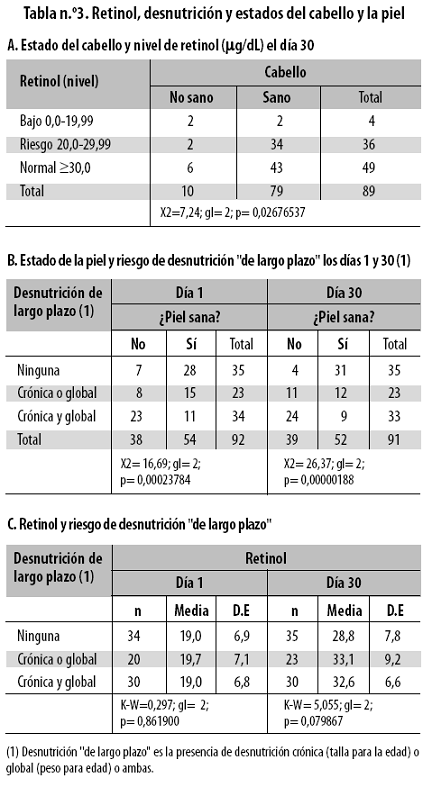
El estado de la piel, las mucosas labial y bucal, la lengua y el cabello no se asoció significativamente con el nivel del retinol en el momento del ingreso ni con el del día 30, excepto el del cabello el día 30 (tabla n.º 3A), que mostró una poderosa asociación (p = 0,02676537), debido a que en 50% (2/4) de quienes tenían menos de 20 µg/dL el cabello no era sano, comparado con solo 10% (8/77) en quienes tenían 20 o más µg/dL.
En el momento del ingreso, la presencia de lesiones en la piel, las mucosas o el cabello no se asoció estadísticamente con el riesgo de desnutrición, excepto por la potente asociación hallada entre piel alterada y riesgo de 'desnutrición de largo plazo' (tabla n.º 3B): en 38 niños la piel era anormal al ingresar al estudio y 60% de ellos (23/38) tenían riesgo tanto de desnutrición crónica como global (desnutrición de largo plazo), mientras que de los niños con piel normal solo 20% (11/54) tenían ambos riesgos de desnutrición, de tal forma que la frecuencia de riesgo de desnutrición fue significativamente mayor en los niños con piel anormal que en aquellos con piel sana (X2 = 16,69; gl = 2; p = 0,00023784). Esta asociación persistía al día 30 (p = 0,00000188). La referida asociación no se halló en ningún día entre la desnutrición de largo plazo y el estado de las mucosas labial y oral y de la lengua; tampoco la hubo con el estado del cabello.
El estado de retinol no se asoció estadísticamente con la presencia de 'desnutrición de largo plazo' en el momento de ingreso ni al día 30, pero en todas las situaciones de riesgo de desnutrición el retinol aumentó fuertemente al día 30 (cuando ya no había malaria) comparado con el día 1 (cuando los niños tenían paludismo) (tabla n.º 3C).
En cualquiera de los tres momentos (antes del tratamiento, al día 8 y al día 30), la presencia de alteraciones en la piel, las mucosas y el cabello mostró una distribución similar entre quienes recibieron y quienes no recibieron suplemento de vitamina A (p > 0,10).
DISCUSIÓN
Los niveles de retinol estuvieron bajos en el momento del ataque agudo de malaria (19,1 µg/dL) pero al ceder éste, con el tratamiento específico y eficaz, pasaron a 31,9 µg/dL los días 8 y 30 (promedio de 31,2 y 32,6 µg/dL), es decir aumentaron 67%; esos niveles indican que antes del paludismo no existía deficiencia de vitamina A pero sí estaban los pacientes al borde del riesgo de ella. El informe nacional para menores de 5 años halló que 56% tenían 30 o más µg/dL17 y un estudio en escolares y adolescentes (618 años) de Medellín informó que solo 3,6% tenía menos de 0,70 mMol/L.22
El nivel de retinol fue igual en los tres momentos en que se lo midió (antes del tratamiento y a los días 8 y 30) entre quienes recibieron y quienes no recibieron vitamina A, lo que implica que el suplemento con esta vitamina no elevó el nivel sanguíneo de retinol. Esto no debe llevar a pensar que el suministro de suplementos sea inútil, sino que debe considerarse que los depósitos hepáticos de la vitamina están relativamente escasos y, entonces, el suplemento se destina a llenarlos. Además, debe recordarse que la mayor parte de la concentración plasmática se mantiene en un estrecho intervalo regulado.
En el momento del ingreso, la frecuencia de desnutrición de largo plazo (crónica, global o ambas) afectaba a 61% de los niños y 38% la padecían de tipo pleno (ambos tipos de desnutrición presentes). La frecuencia de lesiones mucocutáneas fue alta, en particular las de los labios (12%) y, sobre todo, las de la piel (41%). En los días 1 y 30 hubo asociación significativa entre las lesiones cutáneas y la presencia del riesgo de desnutrición a largo plazo, y al día 30, pasada la fase inflamatoria aguda del paludismo, hubo asociación significativa entre las lesiones del cabello y el nivel bajo de retinol.
Los resultados referidos son los esperados (lesiones en la piel y el cabello con bajo nivel de retinol o en presencia de desnutrición de largo plazo), y lo que llama la atención es que no se encuentre asociación entre la desnutrición de largo plazo y las lesiones en otros sitios (labios, boca, lengua), lo que podría deberse a que sean más difíciles de reconocer o a que se manifiestan más tardíamente, con mayores deficiencias de retinol o por un estado más grave de desnutrición. Es claro que el retinol posmalaria está hacia el polo de lo bajo, pero dentro de lo normal, y la desnutrición no fue grave.
Estos niños presentaron, además de paludismo y desnutrición, alta prevalencia de parásitos intestinales patógenos (80%) y la población de la que hacen parte está gravemente afectada por la marginación social y económica (datos sin publicar), lo que concuerda con informes según los cuales, en 2004, en la región del Bajo Cauca las personas con necesidades básicas insatisfechas (NBI) alcanzaban el 55% y en El Bagre el 63%, mientras que en Urabá los afectados eran 59% y en Turbo eran 69%. La miseria golpeaba en ese año 2004 a 23% de los habitantes de Bajo Cauca, a 23% de los de El Bagre, a 25% de los residentes en Urabá y a 32% de los moradores de Turbo.23 Según nuestros datos, más de 50% de la población de Urabá y Bajo Cauca carece de afiliación al Sistema de Seguridad Social en Salud y un porcentaje superior a éste no logra acceso al servicio cuando lo busca, aunque tenga afiliación. Todo lo cual lleva a decir que cuando se tenga contacto con un niño de esta zona, por cualquier causa (paludismo, desnutrición, parasitosis intestinal, otra) es recomendable darle tratamiento simultáneo para todos esos problemas, incluido el suplemento con vitamina A, para mejorar su estado de salud.
Conflicto de intereses
Ninguno para declarar.
AGRADECIMIENTOS
A la Dirección Seccional de Salud de Antioquia (DSSA) y a la Universidad de Antioquia por financiar la investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. Marcus R, Coulson AM. Vitaminas A, K y E. En: Hardman JG, Limbird LE, Molinoff PB, Ruddon RW, eds. Goodman & Gilman. Las Bases Farmacológicas de la Terapéutica, 9a ed. México: McGrawHill Interamericana; 1996. vol 2. p. 16751685. [ Links ]
2. Ross AC. Vitamina A y retinoides. En: Shils ME, Olson JA, Shike M, Ross AC, eds. Nutrición en Salud y Enfermedad, 9a ed. México: McGrawHill Interamericana; 2002. vol 1. p. 353380. [ Links ]
3. Ross AC. Vitamin A and carotenoids. En: Shils ME, Shike M, eds. Modern nutrition in health and disease, 10a ed. Philadelphia: Lippincott Williams and Wilkins; 2006. vol 1. p. 351375. [ Links ]
4. Reifen R. Vitamin A as an antiinflammatory agent. Proc Nutr Soc 2002; 61: 397400. [ Links ]
5. McLaren DS. Vitamin A deficiency disorders. J Indian Med Assoc 1999; 97: 320323. [ Links ]
6. Noy N. Vitamin A. En: Stipanuk MH, ed. Biochemical and Physiological Aspects of Human Nutrition. Philadelphia: W.B. Saunders Co.; 2000. p. 599623. [ Links ]
7. Balint JP. Physical findings in nutritional deficiencies. Pediatr Clin North Am 1998; 45: 245260. [ Links ]
8. PérezCotapos ML, Sáenz de Santa María ML, Lubiano A, Romero W, González S. Manifestaciones cutáneas de deficiencias nutricionales. Rev Chilena Dermatol 2005; 21: 249259. [ Links ]
9. Goskowicz M, Eichenfield LF. Cutaneous findings of nutritional deficiencies in children. Curr Opin Pediatr 1993; 5: 441445. [ Links ]
10. Dreizen S. The mouth as an indicator of internal nutritional problems. Pediatrician 1989; 16: 139146. [ Links ]
11. Miller SJ. Nutritional deficiency and the skin. J Am Acad Dermatol 1989; 21: 130. [ Links ]
12. Prendiville JS, Manfredi LN. Skin signs of nutritional disorders. Semin Dermatol 1992; 11: 8897. [ Links ]
13. Heath ML, Sidbury R. Cutaneous manifestations of nutritional deficiency. Curr Opin Pediatr 2006; 18: 417422. [ Links ]
14. Organización Mundial de la Salud OMS. Suplementos de vitamina A. 2a ed. Ginebra: OMS; 1998. [ Links ]
15. Underwood BA, Arthur P. The contribution of vitamin A to public health. FASEB J 1996; 10: 10401048. [ Links ]
16. Underwood BA. Hipoavitaminosis A: epidemiología de un problema de salud pública y estrategias para su prevención y control. Bol Oficina Sanit Panam 1994; 117: 496505. [ Links ]
17. Castro L, Nicholls RS. Deficiencia de hierro, vitamina A y prevalencia de parasitismo intestinal en la población infantil y anemia nutricional en mujeres de edad fértil, Colombia 199596. Bogotá: Instituto Nacional de Salud (Colombia); 1998. [ Links ]
18. Poveda E, Cuartas A, Guarín S, Forero Y, Villarreal E. Estado de los micronutrientes hierro y vitamina A, factores de riesgo para las deficiencias y valoración antropométrica en niños preescolares del municipio de Funza, Colombia. Biomédica 2007; 27: 7693. [ Links ]
19. Blair S, Carmona J, Correa A. Malaria en niños: relaciones entre nutrición e inmunidad. Rev Panam Salud Pública 2002; 11: 514. [ Links ]
20. World Health Organization. Severe falciparum malaria. Severe and complicated malaria. 3th ed. Trans Roy Soc Trop Med Hyg 2000; 94 (Suppl 1): S1S88. [ Links ]
21. MartínezBencardino C. Muestreo. Bogotá: Ecoe; 1984: 4547. [ Links ]
22. ÁlvarezUribe MC, UscáteguiPeñuela RM, LópezBedoya C, BaracaldoBarrera CM, Castro L, NoyBallesteros V. Plasma retinol concentration according to pubertal maturation in school children and adolescents of Medellin, Colombia. Eur J Clin Nutr 2004; 58: 456461. [ Links ]
23. Gobernación de Antioquia (Colombia). Población con NBI y en miseria, en los municipios de Antioquia, por subregiones, según el censo 1993 y el Sisbén 2004 [sitio n internet]. http://www.gobant.gov.co/anuario2004/indicadores/ind145.xls. Consulta: 23 julio 2006. [ Links ]