Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.21 no.1 Medellín Jan./Mar. 2008
ARTÍCULO DE REVISIÓN
Toxicidad hepática por medicamentos antituberculosos
Hepatotoxicity induced by antituberculosis drugs
Ubier Eduardo Gómez Calzada 1, Yuli Agudelo Berruecos 2, Marie Claire Berrouet Mejía 3, Isabel Eugenia Escobar Toledo 3
- Médico, Toxicólogo clínico, Hospital Universitario San Vicente de Paúl. Profesor del Departamento de Farmacología y Toxicología, Facultad de Medicina, Universidad de Antioquia.
- Médica, Toxicóloga clínica, Hospital Universitario San Vicente de Paúl. Profesora del Departamento de Farmacología y Toxicología, Facultad de Medicina, Universidad de Antioquia.
- Residente de Toxicología Clínica, Departamento de Farmacología y Toxicología, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
Recibido: 21 de junio de 2007
Aceptado: 15 de septiembre de 2007
Resumen
El fenómeno de la toxicidad hepática inducida por medicamentos cobró relevancia hace algunos años con el estudio de las reacciones adversas a medicamentos. El daño producido en el hígado por un xenobiótico que altera su función es lo que se conoce como toxicidad hepática. La importancia de reconocer y diagnosticar la toxicidad hepática por medicamentos estriba en su gravedad potencial; no en vano es la causa más frecuente por la que la industria farmacéutica retira medicamentos. La tuberculosis es una pandemia que afecta a gran parte de la población mundial y junto con el VIH es una enfermedad cada vez más frecuente en Colombia. Esta enfermedad se puede considerar como una situación especial porque para su tratamiento es preciso suministrar, por largos períodos, medicamentos con potencial tóxico para el hígado.
El objetivo de este artículo es revisar algunos aspectos relacionados con la toxicidad hepática secundaria a medicamentos antituberculosos, tales como: epidemiología, factores de riesgo, mecanismos de toxicidad, manifestaciones clínicas, diagnóstico, tratamiento y seguimiento.
Palabras clave
Factores de riesgo para toxicidad hepática, Mecanismos de toxicidad hepática, Medicamentos antituberculosos, Reintroducción del tratamiento antituberculoso, Toxicidad hepática
Summary
Hepatotoxicity is the alteration of liver structure and function induced by either drugs or other substances. The importance of its proper diagnosis rests on its potential severity. It is the most frequent reason by which the pharmaceutical industry withdraws its products. Tuberculosis is a pandemic infection affecting a large proportion of the world population. Together with HIV infection it is becoming ever more frequent in Colombia. Tuberculosis poses a special challenge because its treatment requires the administration, during long periods, of drugs with the potential of inducing liver injury.
In this article some aspects of hepatotoxicity induced by antituberculosis drugs are reviewed, namely: epidemiology, risk factors, mechanisms, clinical manifestations, diagnosis, treatment and followup.
Key words
Antituberculosis drugs, Hepatotoxicity, Hepatotoxicity mechanisms, Reintroduction of antituberculosis treatment, Risk factors for hepatotoxicity.
INTRODUCCIÓN
El hígado es el principal órgano implicado en la biotransformación de cualquier sustancia ajena al organismo. Este hecho lo hace especialmente vulnerable a los fenómenos de toxicidad en vista de la gran cantidad de medicamentos, toxinas y productos herbales que existe actualmente. Se conocen más de mil compuestos que inducen toxicidad hepática; de estos, los medicamentos son responsables del 40 al 50% de los casos de lesión hepática que requieren evaluación por Hepatología, y del 25 al 30% de los casos de hepatitis fulminante.14
La importancia de reconocer y diagnosticar la toxicidad hepática por medicamentos estriba en su gravedad potencial; no en vano es la causa más frecuente por la que la industria farmacéutica retira medicamentos del mercado.3,4
Si bien es cierto que en los estudios epidemiológicos es baja la incidencia reportada de toxicidad hepática por medicamentos en general, de 1 en 10.000 a 1 en 100.000 pacientes, la incidencia real es mayor; esta discrepancia se debe al subregistro por la dificultad para el diagnóstico, y a los períodos incompletos de observación. Es así como en algunas series en la literatura se reporta una incidencia anual de 14 por cada 100.000 habitantes.57
La infección por Mycobacterium tuberculosis es una pandemia que afecta a gran parte de la población mundial; según el reporte de la Organización Mundial de la Salud (OMS) en el año 2005, se calcula que en el mundo se hacen cada año 9 millones de tratamientos para tuberculosis. Esta enfermedad es responsable de dos millones de muertes por año, de las cuales el 98% ocurre en países en desarrollo como Colombia; este país forma parte del grupo que estudia la OMS porque en ellos está presente la resistencia a la terapia antituberculosa, debido a lo cual se requiere utilizar un mayor número de fármacos y, consecuentemente, aumenta la incidencia de reacciones adversas. La infección por M. tuberculosis es una condición especial por las características del patógeno tales como: crecimiento lento, pared rica en lípidos, localización tanto extracelular como intracelular y múltiples mecanismos de resistencia; ello obliga a suministrar siempre un tratamiento combinado que incluya como mínimo tres medicamentos potencialmente hepatotóxicos: isoniazida, rifampicina y pirazinamida, que se administran diaria o intermitentemente por varios meses incrementando la posibilidad de aparición de daño hepático.8
El principal efecto adverso de la terapia antituberculosa es la alteración hepática que incluye un amplio espectro de signos y síntomas.810
GENERALIDADES
La incidencia de toxicidad hepática producida específicamente por medicamentos antituberculosos reportada en la literatura fluctúa entre 4,3 y 19%. Gulbay y colaboradores11 hicieron un estudio retrospectivo durante 17 años en el que describieron los efectos adversos de los medicamentos antituberculosos en una población de 1.149 pacientes; encontraron un 4,9% de alteraciones en el perfil hepático, 2,4% de toxicidad hepática y 0,8% de falla hepática fulminante. La incidencia reportada en la población infantil es más baja: 0,8%.1012
FACTORES DE RIESGO PARA EL DESARROLLO DE TOXICIDAD HEPÁTICA
No se debe analizar la toxicidad hepática por medicamentos antituberculosos como un simple fenómeno de causa a efecto en el que un medicamento específico induce un tipo de lesión hepática, pues se ha demostrado que diferentes factores como la raza, la edad y el sexo incrementan la susceptibilidad al desarrollo de lesión hepática por medicamentos antituberculosos (Tabla n.º 1).
Por otro lado, se han descrito como factores de riesgo algunas comorbilidades: abuso del licor, desnutrición, obesidad, enfermedad pulmonar obstructiva crónica, hipoalbuminemia, infección por VIH y hepatitis virales B y C. Sin embargo, el factor más importante es el polimorfismo genético. El estudio del genotipo y el fenotipo de la Nacetiltransferasa 2 (NAT2) ha revelado alelos diferentes, asociados con la rapidez o la lentitud de la acetilación; en los acetiladores lentos es mayor el riesgo de toxicidad inducida por isoniazida, y la presencia del complejo mayor de histocompatibilidad HLA DQ se asocia con mayor incidencia de alteraciones hepáticas.6,7,13,14
MECANISMOS DE TOXICIDAD HEPÁTICA
En general la toxicidad hepática inducida por medicamentos se puede clasificar en dos grandes tipos de reacciones: intrínsecas e idiosincrásicas.
1) Reacciones intrínsecas: son predecibles y dependientes de la dosis.
2) Reacciones idiosincrásicas: pueden ocurrir con cualquier dosis, tienen un período de latencia variable desde días hasta meses, se producen por un mecanismo inmune o de manera indirecta por un metabolito. La toxicidad hepática producida por la terapia antituberculosa se debe fundamentalmente a este segundo tipo de reacción.1014
DIAGNÓSTICO Y PATRONES DE TOXICIDAD HEPÁTICA
La expresión clínica de la toxicidad hepática es muy variada por lo que puede simular cualquier enfermedad hepática. El tipo de lesión depende fundamentalmente de la célula hepática predominantemente afectada. Así, la lesión de los hepatocitos puede producir hepatitis aguda o crónica, esteatosis, hepatitis colestásica, necrosis o tumores. De todas estas alteraciones, las más frecuentes son la necrosis hepatocelular y la hepatitis colestásica.1315
Como consecuencia de la variedad de lesiones, los hallazgos clínicos y de laboratorio relacionados con la toxicidad hepática incluyen un amplio espectro de signos y síntomas, desde elevaciones asintomáticas de las enzimas hepáticas, sin progresión a pesar de continuar el tratamiento, hasta la falla hepática fulminante. El diagnóstico clínico puede ser muy difícil y se requiere un alto grado de sospecha clínica para llegar a él; se basa fundamentalmente en una historia clínica exhaustiva y en descartar otras causas de lesión hepática.1315
Los criterios diagnósticos para definir toxicidad hepática por medicamentos antituberculosos son los mismos que para otros medicamentos; surgieron en 2001, de un consenso integrado por el Centro de Evaluación e Investigación de Medicamentos de la Administración de Alimentos y Drogas de los Estados Unidos (Food & Drug Administration, FDA), y la Asociación Americana para el Estudio de las Enfermedades Hepáticas; dichos criterios fueron los siguientes:
• Elevación mayor de tres veces por encima del límite superior normal para las aminotransferasas GOA (glutamicoxaloacética) y GP (glutamicopirúvica) y de dos veces para las fosfatasa alcalina (FA), sin síntomas.
• Elevación de las aminotransferasas (GOA y GP) mayor de tres veces el límite superior de lo normal con presencia de síntomas.
• Elevación de las aminotransferasas (GOA y GP) mayor de cinco veces el límite superior de lo normal con o sin presencia de síntomas.
• Incremento de las bilirrubinas más de dos veces el valor normal.
Es importante resaltar que con frecuencia el patrón de alteración hepática ocasionado por los medicamentos antituberculosos es mixto.7,14,16,17
TOXICIDAD HEPÁTICA POR ISONIAZIDA
Desde 1950 se encuentran reportes de hepatitis por exposición a medicamentos antituberculosos pero anteriormente se aceptaba que la monoterapia con isoniazida no se asociaba con toxicidad hepática. Luego de una recomendación dada por la Asociación Americana del Tórax en 1967, se inició un amplio uso de la isoniazida como quimioprofiláctica y al mismo tiempo aparecieron los primeros casos de toxicidad hepática por este medicamento. En 1974 Bailey y colaboradores18 reportaron que el 12% de los pacientes en tratamiento con isoniazida presentaban elevaciones de las aminotransferasas hasta 205 veces por encima del valor normal. Pocos años después, el United States Public Health Service Cooperative Surveillance Study estimó que el riesgo de toxicidad hepática por isoniazida era de 20,7 por cada 1.000 pacientes tratados, y reportó 8 muertes. Estudios posteriores señalaron que las frecuencias de falla hepática y de muerte eran mucho menores (mortalidad alrededor de 0,001%) y plantearon que la alta incidencia reportada en series anteriores se debía a la inclusión de pacientes con un criterio de gravedad menor.1619
Actualmente se considera que la isoniazida es el medicamento de primera línea en el tratamiento de la tuberculosis. Hasta la fecha se han propuesto diferentes mecanismos de toxicidad hepática secundaria a su administración; de ellos, el más aceptado es la producción de un metabolito tóxico, la acetilhidrazina, que actúa como agente acetilador causando daño de las macromoléculas de los hepatocitos. El estrés oxidativo es otro de los mecanismos por los cuales se explica la toxicidad de la isoniazida. Además de este último mecanismo, Santhosh21 propone que la isoniazida, junto con otros medicamentos antituberculosos que producen daño hepatocelular, también ocasiona acumulación de grasa en el hígado; además, producen un aumento del calcio intracelular que a su vez activa la fosfolipasa A2, degradando fosfolípidos de la membrana.12,1822
TOXICIDAD HEPÁTICA POR RIFAMPICINA
Este medicamento bactericida, derivado de la rifamicina B, se sumó a la terapia antituberculosa en 1962. Actúa por inhibición de la ARN polimerasa dependiente de ADN, formando un complejo estable medicamentoenzima que lleva a suprimir la síntesis de ARN. El mecanismo de toxicidad hepática propuesto para este medicamento, al igual que para la isoniazida, es una alteración en los fosfolípidos de la membrana secundaria a un aumento del estrés oxidativo pero, teniendo en cuenta las diferencias en el patrón de lesión hepática, se propone que la rifampicina alteraría la captación hepática de sales biliares y bilirrubina, compitiendo con estos compuestos por la unión con proteínas intracelulares, modificando de esta manera la excreción de bilirrubina y llevando a la aparición de un cuadro colestásico. Más tardíamente se incrementa la producción de glucurónido de bilirrubina, con aumento de la excreción biliar y normalización de los niveles del mismo, debido a la inducción enzimática de la rifampicina.1618,22,23
TOXICIDAD HEPÁTICA POR PIRAZINAMIDA
De todos los medicamentos antituberculosos, la pirazinamida es el que tiene mayor probabilidad de producir daño hepático. Se han descrito casos de falla hepática fulminante, hepatitis crónica activa y hepatitis granulomatosa. El mecanismo de toxicidad está relacionado con la dosis; sin embargo, algunos reportes de casos como el de Corbella y colaboradores25 en 1995 sugirieron un mecanismo de hipersensibilidad. Con este medicamento se ha reportado toxicidad hepática en 15% de los pacientes que reciben diariamente 40 a 50 mg/kg por más de 2 meses, pero cabe resaltar que la dosis actual es de 15 a 30 mg/kg con un máximo de 2 g/día y por solo 2 meses.1618,24,25
COMBINACIONES DE MEDICAMENTOS ANTITUBERCULOSOS Y TOXICIDAD HEPÁTICA
Dado que la infección por M. tuberculosis obliga a suministrar siempre un tratamiento combinado, que incluya como mínimo tres medicamentos, es importante considerar que ello aumenta el riesgo de toxicidad hepática. Para el caso de la combinación de isoniazida con rifampicina, está descrito cómo se potencia el fenómeno de toxicidad. En estas condiciones, los reportes de la frecuencia de falla hepática fulminante fluctúan entre 10 y 30% debido a que la inducción de la isoenzima 2E1 del Citocromo P 450 por la rifampicina aumenta los metabolitos tóxicos de la isoniazida. Chowdhury y colaboradores26 plantearon en 2006 otro mecanismo probable para la toxicidad hepática inducida por esta combinación, según el cual, la mitocondria también sufre un proceso de estrés oxidativo que la lleva a desarrollar alteraciones en la permeabilidad, y esto a su vez produce un incremento en la apoptosis de los hepatocitos, sugiriendo también que la alta reactividad de la acetilhidrazina con los grupos sulfihidrilos ocasiona depleción de los niveles de glutatión, los cuales son necesarios para la supervivencia celular. La Sociedad Americana del Tórax y el Centro para el Control y la Prevención de las Enfermedades (CDC) de los Estados Unidos sugirieron en el año 2000 administrar por dos meses la combinación de rifampicina con pirazinamida. En septiembre del mismo año se reportó el primer caso de hepatitis grave y en agosto de 2001 el CDC había reportado 23 casos de lesión hepática relacionada con esta combinación de medicamentos, de los cuales 16 requirieron trasplante hepático. Se plantea que la unión de estos dos medicamentos antituberculosos incrementa el estrés oxidativo produciendo alteración hepática.17,25
TRATAMIENTO
Con base en varios modelos experimentales se han propuesto diferentes tratamientos para la toxicidad hepática; cabe resaltar que algunos de ellos le dan gran relevancia al desequilibrio entre el estrés oxidativo, el fenómeno de la peroxidación y los sistemas antioxidantes endógenos. Los hallazgos obtenidos hasta el momento pueden ser en el futuro alternativas para el tratamiento de la lesión hepática inducida por los medicamentos antituberculosos, pero hasta ahora son solo modelos experimentales y no hay estudios clínicos que aporten datos confiables sobre la eficacia y la seguridad de estos tratamientos en los seres humanos.2427
Hasta la fecha no se ha encontrado un tratamiento mejor para la toxicidad hepática inducida por medicamentos antituberculosos que suspender la administración de éstos. Esta medida se recomienda cuando haya aumento tres veces por encima del límite superior normal en los niveles de aminotransferasas, hasta que disminuyan a 1,5 veces por encima de dicho límite. Una vez normalizados los niveles de aminotransferasas se reanuda la administración de los medicamentos antituberculosos previamente suspendidos.12,17,18
La razón para considerar la reintroducción del tratamiento antituberculoso con medicamentos como isoniazida y rifampicina se debe a que los esquemas que no incluyen estos fármacos son más prolongados, de menor eficacia y con mayor riesgo de resistencia. Es importante que en el proceso de reintrodución de los medicamentos antituberculosos se haga un seguimiento cuidadoso de las pruebas de función hepática dos veces por semana. 12,17,18
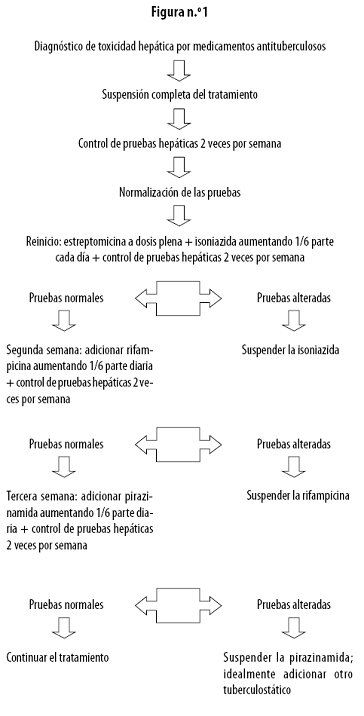
El tratamiento no se reanuda inicialmente con rifampicina, pues induce la isoenzima 2E1 del citocromo P 450 (CYP 2E1), favoreciendo la producción de monoacetilhidrazina; se propone entonces reanudarlo con estreptomicina a dosis plenas e isoniazida, iniciando con una sexta parte de la dosis total, con aumentos diarios de una sexta parte, hasta llegar a la dosis usual, en el lapso de una semana. Si al cabo de este tiempo las pruebas de función hepática están alteradas, se suspende la isoniazida; por el contrario, si son normales, se reanuda la rifampicina en la segunda semana aumentando diariamente una sexta parte de la dosis. Si las pruebas se alteran se suspende este último fármaco, pero si continúan normales se adiciona pirazinamida a la tercera semana de tratamiento con incrementos similares a los usados para los otros medicamentos. Si se alteran las pruebas se suspende la pirazinamida y se adiciona otro medicamento antituberculoso (Figura n.º 1).12,1722
CONCLUSIONES
La toxicidad hepática inducida por los medicamentos antituberculosos es relativamente frecuente; de ahí la importancia de buscar activamente los posibles efectos adversos y tóxicos producidos por ellos. A todo paciente se le deben hacer pruebas hepáticas antes de iniciar el tratamiento, con el fin de descartar otras enfermedades de base, para que posteriormente no exista confusión. El contar con valores iniciales permite evidenciar tempranamente pequeñas alteraciones que sugieran el inicio de una toxicidad hepática asociada a los medicamentos antituberculosos.
Por otra parte, disponer de pruebas hepáticas seriadas en diferentes momentos del tratamiento le permite al clínico tener una visión global de los efectos producidos por estos medicamentos para así poder tomar una decisión acertada y oportuna sin tener que esperar la aparición de efectos adversos graves.
Todavía no hay acuerdo sobre la frecuencia con que se deben hacer las pruebas hepáticas, pero el seguimiento adecuado de un paciente asintomático puede basarse en repetirlas cada cuatro a seis semanas.
Es importante tener en cuenta que si el paciente presenta otros factores de riesgo, este intervalo se puede acortar hasta tres semanas.
Como se expuso anteriormente, son las variaciones del perfil hepático durante el seguimiento las que deben alertar al clínico acerca de un proceso posterior de toxicidad hepática asociada, aunque los valores estén en los rangos de normalidad.
Para ser estricto en la definición de toxicidad hepática inducida por medicamentos cabe acogerse a la propuesta emanada en 2001 de una conferencia de expertos, en la que se estableció como parámetro de toxicidad hepática un incremento mayor de tres veces en el límite superior de lo normal para las aminotransferasas, acompañado de un nivel de fosfatasa alcalina mayor de dos veces el límite superior normal, sin síntomas, o una elevación de las aminotransferasas mayor de cinco veces el límite superior de lo normal, independientemente de la presencia o no de síntomas, o un nivel de bilirrubina total mayor de dos veces su límite superior normal asociado con cualquier grado de elevación de las aminotransferasas y la fosfatasa alcalina. Sin embargo, no es lógico, ante la sospecha de que se está produciendo toxicidad hepática asociada al tratamiento antituberculoso, esperar indefinidamente para suspenderlo hasta que se cumplan en forma estricta los anteriores criterios; por eso se recomienda acogerse a la definición dada en 1989 por un panel de expertos americanos y europeos en el que se definió toxicidad hepática como la elevación en los niveles de aminotransferasas, bilirrubina directa y fosfatasa alcalina por encima de dos veces el límite superior normal.27
Si se suspende tempranamente el tratamiento antituberculoso y se inicia una vigilancia cuidadosa de la función hepática del paciente, hasta lograr la mejoría de las pruebas, se evitarán serias consecuencias sobre el hígado y se podrá reanudar el tratamiento lo que redundará en beneficio del paciente.
Como se planteó anteriormente, no hay hasta el momento un tratamiento aprobado luego de diagnosticar la toxicidad hepática a pesar de que experimentalmente se han desarrollado diferentes alternativas. Cuando se hayan normalizado las pruebas, el clínico puede iniciar el esquema de reanudación anteriormente expuesto; pero si las pruebas continúan alteradas se recomienda suspender los medicamentos implicados e iniciar el tratamiento con otros antituberculosos que tengan menor potencial hepatotóxico como: etambutol, etionamida, aminoglicósidos como la estreptomicina o quinolonas de amplio espectro.
REFERENCIAS BIBLIOGRÁFICAS
1. Edwards IR, Aronson JK. Adverse drug reactions: definitions, diagnosis and management. Lancet 2000; 356 (9237):1212. [ Links ]
2. Larrey D. Epidemiology and individual susceptibility to adverse drug reactions affecting the liver. Semin Liver Dis 2002; 22: 145155. [ Links ]
3. Sgro C, Clinard F, Quazir K. Incidence of druginduced hepatic injuries. A French populationbased study. Hepatology 2002; 36: 451455. [ Links ]
4. Zimmerman J, Ishak K. General aspects of druginduced liver disease. Gastroenterol Clin N Am 1995; 24: 739757. [ Links ]
5. Trey C, Davidson CS. The management of fulminant hepatic failure. Prog Liver Dis 1970; 3: 282298. [ Links ]
6. Ostapowicz G, Fontana RJ, Schiodt FV, Larson A, Davern TJ, Han SH, et al. Results of a prospective study of acute liver failure at 17 tertiary care centers in the United States. Ann Intern Med 2002; 137: 947954. [ Links ]
7. Navarro VJ. Drug related hepatotoxicity. New Engl J Med 2006; 354: 731739. [ Links ]
8. Global tuberculosis control: surveillance, planning, financing. WHO report 2005. Geneva, World Health Organization (WHO/HTM/TB/2005.349). [ Links ]
9. Andrade RJ, Lucena MI, Fernández C, Pelaez G, Pachkoria K, GarcíaRuiz E, et al, On behalf of the Spanish group for the Study of DrugInduced Liver Disease. Toxic and druginduced liver injury: an analysis of 461 incidences submitted to a Registry over a 10year period. Gastroenterology 2005; 129: 512521. [ Links ]
10. FDA Working Group. CDERPhRMAAASLD Conference 2000. Clinical White paper on druginduced hepatotoxicity. November 2000. Disponible en: http://www.fda.gov/cder/livertox/clinical.pdf (consultado septiembre 18 de 2007). [ Links ]
11. Gülbay BE, Gürkan OU, Yildiz OA, Onen ZP, Erkekol FO. Side effects due to primary antituberculosis drugs during the initial phase of therapy in 1149 hospitalized patients for tuberculosis. Respir Med 2006; 100: 18341842. [ Links ]
12. Thiim M. Hepatotoxicity of antibiotics and antifungals. Clin Liver Dis 2003; 7: 381399. [ Links ]
13. Reto L. Hepatotoxicidad por fármacos antituberculosos en Pediatría. Rev Gastroenterol Perú 2005; 25: 362365. [ Links ]
14. Lee WM. Druginduced hepatotoxicity. New Engl J Med 1995; 17: 11181127. [ Links ]
15. Andrade RJ, Camargo R, Lucena MI, GonzálezGrande R. Causality assessment in druginduced hepatotoxicity. Expert Opin Drug Saf 2004; 3: 329344. [ Links ]
16. Benichou C. Criteria of druginduced liver disorders: report of an international consensus meeting. J Hepatol 1990; 11: 272276. [ Links ]
17. Yee D, Valiquette CH, Pelletier M, Parisien I, Rocher I. Incidence of serious side effects from firstline antituberculosis drugs among patients treated for active tuberculosis. Am J Respir Crit Care Med 2003; 167: 14721477. [ Links ]
18. Bailey K. Physiological factors affecting drug toxicity. Regul Toxicol Pharmacol 1983; 3: 389398. [ Links ]
19. Schaberg T, Rebhan K, Lode H. Risk factors for sideeffects of isoniazid, rifampin and pyrazinamide in patients hospitalized for pulmonary tuberculosis. Eur Respir J 1996; 9: 20262030. [ Links ]
20. Shaima SK. Antituberculosis drugs and hepatotoxicity. Infect Genet Evol 2004; 4: 167170. [ Links ]
21. Santhosh S. Effect of chitosan supplementation on antitubercular drugsinduced hepatotoxicity in rats. Toxicology 2006; 219: 5359. [ Links ]
22. Troy C. A model of isoniazidinduced hepatotoxicity in rabbits. J Pharmacol Toxicol Methods 1995; 34: 109116. [ Links ]
23. Attri S, Rana SV. Isoniazid and rifampicin induced oxidative hepatic injury protection by NAC. Hum Exp Toxicol 2000; 19: 517522. [ Links ]
24. Prabakan M. Protective effect of Hemidesmus indicus against rifampicin and isoniazid induced hepatotoxicity in rats. Fitotherapy 2000; 71: 5559. [ Links ]
25. Corbella X, Vadillo M. Hipersensitivity hepatitis due to pyrazinamide. Scand J Infect Dis 1995; 27: 9394. [ Links ]
26. Chowdhury A. Mitochondrial oxidative stress and permeability transition in isoniazid and rifampicin induced liver injury in mice. J Hepatol 2006; 45: 116123. [ Links ]
27. Rao KS. Antihepatotoxic activity of monomethil fumarate isolated from Fumaria indica. Etnopharmacology 1998; 60: 207213. [ Links ]