Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.21 no.1 Medellín Jan./Mar. 2008
ARTÍCULO REVISIÓN
Tratamiento ambulatorio del paciente con neutropenia febril
Outpatient therapy in patients with febrile neutropenia
Andrés Londoño Gallo1
- Médico, Universidad de Antioquia y Hospital Universitario San Vicente de Paúl, Medellín, Colombia.
Recibido: octubre 19 de 2007
Aceptado: diciembre 03 de 2007
Resumen
El tratamiento de los pacientes con neoplasia y neutropenia febril plantea muchas dudas. Una de ellas, que genera ansiedad en el personal de la salud, el paciente y sus familiares, es la necesidad de hospitalización porque ésta implica exponer a gérmenes intrahospitalarios potencialmente resistentes a un paciente cuyo sistema inmune puede no estar en las mejores condiciones; incluso con un aislamiento óptimo existe el riesgo de adquirir una infección nosocomial. Muchos estudios han tratado de validar métodos para clasificar a los pacientes con fiebre y neutropenia en grupos de diferente riesgo, como fundamento para implementar estrategias de tratamiento selectivo; así se ha abierto la posibilidad de utilizar medidas más conservadoras para el tratamiento de los episodios de bajo riesgo, entre ellas la administración de regímenes orales ambulatorios de antibióticos de amplio espectro; ello sin demeritar la necesidad de aplicar un juicio clínico adecuado, hacer un buen seguimiento y tener acceso a la atención médica inmediata. La neutropenia es una de las consecuencias graves de la quimioterapia para el cáncer, y se ha demostrado que el tratamiento del paciente neutropénico febril con antibióticos intravenosos reduce la mortalidad. La terapia oral podría ser una alternativa aceptable para pacientes bien seleccionados. Ella puede mejorar la calidad de vida de los pacientes con cáncer, evitar las complicaciones asociadas con la terapia intravenosa y disminuir los costos del tratamiento.
Palabras clave
Antibióticos orales ambulatorios, Estratificación del riesgo en pacientes con neutropenia, Fiebre y neutropenia en pacientes con neoplasia
Summary
Treatment of patients with neoplasia and febrile neutropenia, as a consequence of chemotherapy, poses many doubts, among them the need for hospitalization, since this implies exposure to potentially resistant nosocomial microorganisms. Even under the best isolation techniques, there may be risks for
individuals whose immune system may not be in optimal conditions. Multiple studies have tried to validate methods for classifying patients with febrile neutropenia according to their risk of complications. Such classification systems could be the base for implementing selective treatment strategies, one of which would be the oral ambulatory administration of widespectrum antibiotics. Neutropenia is one of the serious consequences of cancer chemotherapy, and it has been demonstrated that intravenous antibiotic treatment reduces mortality. Therefore, oral therapy could constitute an acceptable alternative for wellselected patients but the need for applying good clinical judgement, properly following up patients, and the availability of immediate access to medical attention should be emphasized. The following are among the potential benefits of oral treatment: better quality of life for patients and their families, avoidance of the complications associated with intravenous therapy, and diminished costs of health care.
Key words
Fever and neutropenia in patients with neoplasia, Outpatient oral antibiotic treatment, Risk stratification of patients with neutropenia.
INTRODUCCIÓN
La neutropenia febril es una complicación relativamente frecuente en los pacientes que reciben quimioterapia para el tratamiento de diversos tipos de neoplasias: ocurre en el 1050% de los pacientes con tumores sólidos y en más del 80% de los que tienen tumores hematológicos.1,2 Es una enfermedad grave que compromete la respuesta inmune facilitando así la colonización por cualquier patógeno, lo que genera altas tasas de morbilidad y mortalidad.3 Aunque se ha demostrado la efectividad de la hospitalización precoz y del tratamiento intravenoso con antibióticos de amplio espectro para reducir el número de infecciones4 y la mortalidad,5,6 es indiscutible que se plantean muchos problemas: la antibioterapia de amplio espectro puede controlar al patógeno invasor pero también altera la flora normal y aumenta el riesgo de colonización por patógenos nosocomiales con todo lo que ello implica; 7 y durante la estancia en el hospital ocurren alteraciones en la calidad de vida8 y deterioro psicológico secundario a la separación de la familia;28 además, se generan costos adicionales para el sistema de salud de por sí saturado y económicamente limitado.9
En Estados Unidos se han realizado varios estudios sobre el costo, la efectividad y las implicaciones económicas de dar de alta tempranamente al paciente hospitalizado de bajo riesgo con neutropenia y fiebre. Se estima que el ahorro es hasta de 5.000 dólares por paciente si el alta hospitalaria es temprana y que es aún mayor en los pacientes con tratamiento totalmente ambulatorio.911 En ese país el ahorro anual puede ser, como mínimo, de 27 millones de dólares. Aunque estos datos no se pueden extrapolar al sistema colombiano de salud, el ahorro potencial es digno de tener en cuenta.
Además, en muchos casos los cultivos que se le hacen al paciente neutropénico resultan negativos,12 la fiebre suele pasar en poco tiempo y los recuentos celulares aumentan rápidamente;3,13 todos estos argumentos hacen cuestionar la necesidad de la hospitalización.
En años recientes se han llevado a cabo varios estudios en los que se plantea la posibilidad de hacer tratamiento ambulatorio con antibióticos orales a una alta proporción de estos enfermos,1420 lo que hace dudar de la necesidad de recurrir a la vía intravenosa en los pacientes de bajo riesgo.
DEFINICIÓN
Se define la neutropenia febril como la situación clínica del paciente cuyo recuento de neutrófilos es de 500 o menos por µL y en el cual se ha demostrado objetivamente una temperatura aislada mayor de 38,5 ºC o ésta ha sido de 38 ºC en tres tomas hechas en un período de 24 horas, separadas entre sí al menos por 4 horas.2123
Se puede clasificar a los pacientes con cáncer, neutropenia y fiebre asociada en grupos de bajo y alto riesgo, con base en la duración proyectada de la neutropenia y la presencia o ausencia de otras condiciones clínicas subyacentes. Se habla de 'bajo riesgo' cuando el paciente no tiene una condición médica subyacente que aumente la morbilidad o la mortalidad y la duración estimada de la neutropenia no va a exceder de una semana.5,13
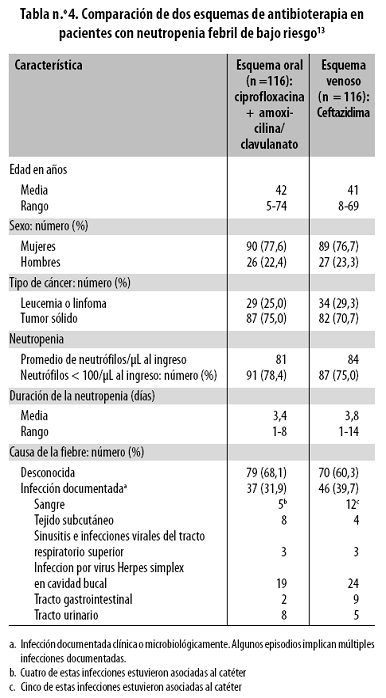
Se han propuesto diferentes modelos para predecir el riesgo de complicaciones en pacientes con cáncer y episodios de fiebre y neutropenia. El primero de ellos fue el presentado por Talcott y colaboradores en 199824 según el cual la población de pacientes con episodios de neutropenia febril se divide en cuatro grupos, de mayor a menor riesgo de presentar complicaciones, según el estado de su neoplasia y la presencia de otras enfermedades. Los pacientes de los tres primeros grupos tienen mayor riesgo de sufrir complicaciones importantes y requieren tratamiento hospitalario. El grupo I está formado por los pacientes hospitalizados para el tratamiento contra el cáncer. El grupo II lo constituyen los pacientes no hospitalizados cuya enfermedad neoplásica está en remisión o no está progresando pero que tienen síntomas de una comorbilidad, dolor, náuseas, deshidratación, etc. El grupo III incluye los pacientes no hospitalizados, sin comorbilidades, pero cuya enfermedad neoplásica aún no está controlada. Y el grupo IV lo forman los pacientes con fiebre y neutropenia en quienes se espera tener pocas complicaciones, como lo señalan Viscoli y colaboradores y Santolaya y colaboradores.5,14 (Tabla n.º 1).
En el año 2000, Klastersky y colaboradores25 publicaron el modelo de predicción de riesgo de la Multinational Association for Supportive Care in Cancer (MASCC), basado en un estudio que analizó cerca de 1.000 episodios de neutropenia febril (Tabla n.º 2).
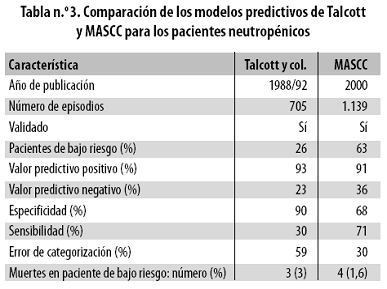
Comparado con el de Talcott, el modelo MASCC presentó mayor sensibilidad, menor error de categorización y similar valor predictivo positivo (Tabla n.º 3).
Recientemente otros estudios están tratando de incluir, como marcadores útiles para la estratificación del riesgo, reactantes de fase aguda cuya utilidad para el pronóstico está demostrada en diversas infecciones. Los más estudiados han sido: proteína C reactiva, procalcitonina, interleucina 6 e interleucina 8.2633 Este es un enfoque promisorio para la clasificación pronóstica de la neutropenia febril, integrando variables clínicas y de laboratorio.34
A la luz de la evidencia médica actual se recomienda el uso del modelo MASCC como escala validada para clasificar el riesgo de complicaciones de los pacientes con neutropenia febril.5,13 Por su simplicidad y porque permite identificar en primera instancia con alta sensibilidad a los pacientes en riesgo de desarrollar complicaciones médicas serias, este sistema de clasificación es útil en la práctica médica diaria.35
Dado que el puntaje que se le asigna a la primera característica ('Dolencias del enfermo') es 5 ó 3, es decir, que son excluyentes, el puntaje máximo en este sistema es 26; un resultado de 21 o más identifica el grupo de bajo riesgo.13,13 Su principal ventaja es el alto valor predictivo positivo: en el estudio original, el 6% de los pacientes identificados como de bajo riesgo tuvieron una complicación importante y el 1% murieron; en contraste, los pacientes considerados como de alto riesgo tuvieron una tasa de complicaciones del 39% y el 14% murieron.
En agosto de 2004 se publicó una validación prospectiva del método MASCC36 realizada entre noviembre de 2000 y julio de 2002, en la que se incluyeron 80 episodios de neutropenia febril; 58 pacientes fueron clasificados como de bajo riesgo y 22, como de alto riesgo. De los 58 de bajo riesgo, 57 se recuperaron sin complicaciones. Uno de ellos desarrolló una infección fúngica pero se recuperó completamente; en comparación, 11 de los 22 pacientes de alto riesgo (50%) desarrollaron complicaciones médicas graves, cuatro ingresaron a la unidad de cuidados intensivos, cuatro adquirieron infecciones virales o fúngicas y tres sufrieron hipotensión grave. Ninguno de los pacientes de bajo riesgo murió. En contraste, ocho (36,4%) de los 22 pacientes de alto riesgo murieron durante el episodio de neutropenia febril, seis de ellos como consecuencia de sepsis y dos por cánceres de progresión rápida no controlados. En esta validación hubo una mejora en los valores estadísticos frente al estudio original: valor predictivo positivo 98,3%, valor predictivo negativo 86,4%, sensibilidad y especificidad ambas de 95%, circunstancia infrecuente que los autores atribuyeron en parte a la mayor proporción de enfermos con neoplasia sólida incluidos en el estudio. Estos datos confirmaron el pronóstico favorable de la neutropenia febril en pacientes con tumores sólidos.37,38
ANTIBIÓTICOS: ¿VENOSOS U ORALES?
En varios estudios se han comparado estos dos regímenes de administración de antibióticos; entre los más representativos están los de Kern y colaboradores y Freifeld y colaboradores que le han dado validez al uso del esquema ambulatorio en los pacientes de bajo riesgo.
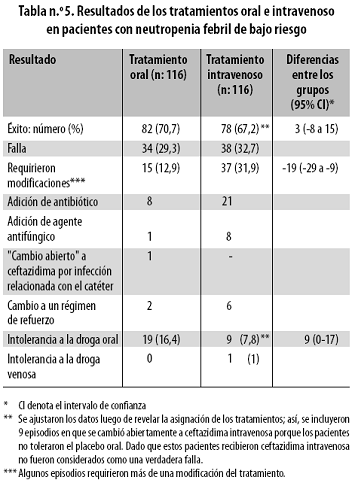
El estudio de Freifeld13 fue doble ciego aleatorizado comparando la monoterapia con ceftazidima intravenosa con la administración oral de ciprofloxacina más amoxicilina/clavulanato en pacientes con neutropenia febril de bajo riesgo. En este estudio se asignaron 116 pacientes a cada grupo: 84 al del esquema oral, que incluyó además a 32 pacientes con placebo, y 79 al del esquema intravenoso, que incluyó también a 37 pacientes tratados con placebo; los dos grupos fueron similares con respecto a edad, sexo y tipo de cáncer; se permitió el uso de factores estimulantes de colonias de granulocitos y granulocitosmacrófagos39 que fueron administrados por igual en ambos grupos. Se documentó infección en 31,9% de los pacientes tratados con el esquema oral y en 39,7% de los que recibieron tratamiento intravenoso; la causa de la fiebre en los restantes pacientes fue desconocida (Tabla n.º 4).
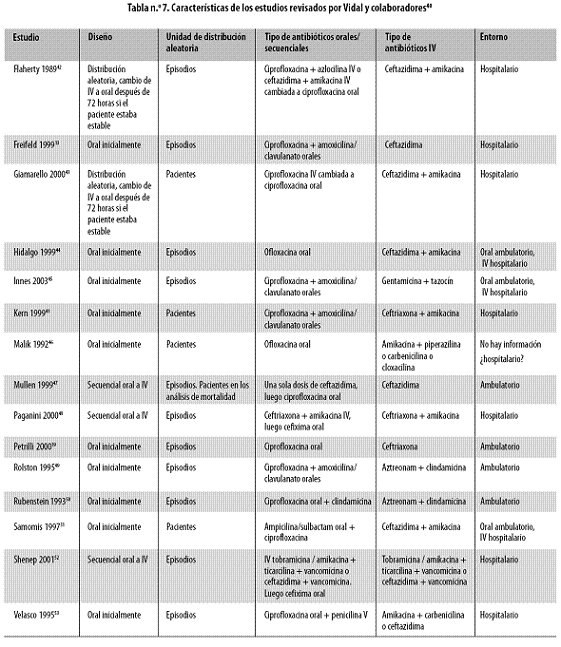
El análisis del estudio revela que el tratamiento fue exitoso en el 71% de los episodios en el grupo de terapia oral y en el 67% de los episodios en el grupo de terapia intravenosa. Los porcentajes de falla fueron similares en ambos grupos. En las siguientes circunstancias se consideró que el tratamiento había fallado: 1) si el régimen tuvo que ser modificado por la adición de uno o más agentes antibacterianos, antivirales o antifúngicos; 2) si el tratamiento era cambiado al régimen establecido como de refuerzo por los investigadores para los casos en que aumentaba la gravedad de la infección; 3) si el tratamiento era cambiado al esquema abierto de antibióticos intravenosos debido a episodios graves de mucositis, náuseas, vómitos, dermatitis y diarrea (Tabla n.º 5).
Cuando la fiebre era de origen desconocido el tratamiento fue exitoso en 67 de los 79 episodios (84,8%) en el grupo de terapia oral y en 63 de los 70 (90%) tratados intravenosamente; cuando había habido una infección comprobada el éxito del tratamiento fue del 40,5% en el grupo de terapia oral (15 de 37) y del 32,6% para el grupo de terapia intravenosa (15 de 46) (diferencia entre los grupos: 7,9%; intervalo de confianza 95%: 1329%; p = 0,4); en los casos de fracaso, la mayoría de los cambios de tratamiento en ambos grupos consistió en la adición de vancomicina, de agentes antianaeróbicos o de aciclovir para tratar las reactivaciones de infecciones orales por el virus Herpes símplex. Se presentaron efectos adversos en 29,3% de los episodios en el grupo de terapia oral y 9,5% requirieron un retiro temprano del estudio principalmente por náuseas y vómito. En 22 de los 23 pacientes en quienes la diarrea fue un efecto adverso no se descontinuó el tratamiento. El principal efecto adverso en los 20 niños incluidos fueron los dolores articulares, que se presentaron en 13 de ellos.
La conclusión fue clara: el estudio demostró que ambos regímenes de antibioterapia proporcionan un cubrimiento similar para la mayoría de los patógenos comúnmente encontrados en los pacientes con neutropenia y fiebre, y que el tratamiento oral con antibióticos de amplio espectro es una alternativa aceptable al esquema con antibióticos parenterales en pacientes hospitalizados de bajo riesgo.13,40
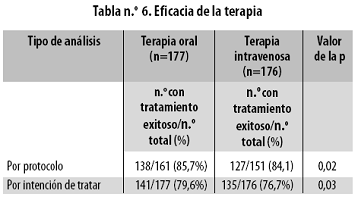
En el estudio prospectivo, abierto, multicéntrico y aleatorizado de Kern41 se compararon la terapia intravenosa con ceftriaxona más amikacina con el tratamiento empírico oral con ciprofloxacina más amoxicilina/clavulanato en pacientes neutropénicos febriles de bajo riesgo. Se incluyeron inicialmente 370 pacientes, pero 17 fueron considerados no elegibles y se los excluyó del análisis por, entre otras, las siguientes razones: no presentar fiebre, no tener granulocitopenia, ser alérgicos a los medicamentos en estudio, no firmar el consentimento informado. El análisis se hizo sobre 353 pacientes. La distribución por grupos (177 pacientes para terapia oral y 176 para tratamiento intravenoso) fue equilibrada con respecto a las características clínicas y demográficas. Dieciséis de los 177 pacientes asignados a terapia oral y 25 de los 176 asignados a terapia intravenosa no pudieron ser evaluados en el análisis por protocolo. La mayoría fueron excluidos por una violación al protocolo: cambios inadecuados en el régimen antibiótico, duración muy corta del tratamiento o dosis inadecuadas. Al realizar el análisis por protocolo las tasas de éxito fueron similares en ambos grupos, así: 85,7% en los tratados oralmente (CI 95%: 8091%) y 84,1% para los tratados intravenosamente (CI 95%: 7890%, diferencia absoluta de los dos grupos 1,6%; CI 95%: 6,39,6%; p = 0,02). Los resultados del análisis por intención de tratar fueron similares, el tratamiento fue exitoso en el 79,6% para los tratados oralmente (CI 95%: 7386%) y 76,7% para los tratados intravenosamente (CI 95%; 7083%; p = 0,03). (Tabla n.º6)
Basados en los pacientes a los que se les pudo hacer seguimiento por 30 días, la tasa de supervivencia fue similar en ambos grupos: habían sobrevivido 163 de los 171 pacientes del grupo de medicación oral (95,3%) y 162 de los 171 del grupo de medicación intravenosa (94,7%). Murieron 8 de los pacientes del grupo de terapia oral y 9 de los tratados intravenosamente. Las causas de muerte de estos 17 pacientes fueron: infección primaria en 6 (2 en el grupo de terapia oral y 4 en el grupo de terapia intravenosa), enfermedades subyacentes en 9 (5 y 4, respectivamente), falla cardíaca en un paciente tratado oralmente que no tenía infección ni enfermedad subyacente y causa desconocida en un paciente del grupo de terapia intravenosa.
El tiempo medio para la resolución de la fiebre en ambos grupos fue de dos días.
A 34 pacientes del grupo de terapia oral y a 39 del grupo de terapia intravenosa se les tuvo que cambiar el régimen de tratamiento (19,2% vs. 22,15%; IC 95% para la diferencia absoluta entre los grupos: 11 5%; p = 0,58).
Los efectos adversos se presentaron en 64 pacientes de los 177 del grupo de terapia oral (36,2%) y en 55 pacientes de los 176 del grupo de la terapia intravenosa (31,3%); en el grupo de terapia oral los más frecuentes fueron la diarrea y otros síntomas gastrointestinales, mientras que en el grupo de tratamiento intravenoso predominaron los efectos adversos relacionados con el catéter intravascular, nefrotoxicidad e hipokalemia. No se reportaron signos o síntomas de artritis.
El estudio concluyó que la terapia empírica oral podría ser un nuevo estándar de tratamiento de los pacientes con neutropenia febril de bajo riesgo, sin olvidar la importancia de que el paciente y su familia tengan claras las reglas de cuidado y dispongan de facilidades para contactar al médico.40,41
Finalmente, en el año 2004 Vidal y colaboradores40 publicaron una revisión sistemática y un metanálisis que tenían como objetivo comparar la eficacia de los tratamientos oral e intravenoso con antibióticos en pacientes con cáncer y neutropenia febril inducida por la quimioterapia. Incluyeron en el análisis 15 estudios aleatorizados (Tabla n.º 7) hechos entre 19891999 con un total de 2.511 pacientes o episodios.
Tanto los antibióticos orales como los intravenosos fueron administrados empíricamente.
Para el propósito de esta revisión se definió como falla del tratamiento uno o más de los siguientes desenlaces: muerte, persistencia, recurrencia o empeoramiento de los signos o síntomas de infección, así como cualquier adición o modificación del esquema asignado.
Algunos criterios de exclusión fueron comunes a todos los estudios: inestabilidad hemodinámica, hipotensión, alteración del estado mental, falla respiratoria o renal, mala condición clínica, pruebas alteradas de función hepática, incapacidad para tomar el medicamento oral, alergia a los medicamentos estudiados, embarazo y lactancia.
Los índices de mortalidad fueron similares al comparar los tratamientos con antibióticos orales e intravenosos (RR: 0,83; IC 95%: 0,491,41; n = 2.224 pacientes). Los índices de falla del tratamiento también fueron similares (RR: 0,94; IC 95%: 0,841,05). Con respecto a los efectos adversos en ningún estudio se reportó muerte o daño permanente debido a los medicamentos usados. En 11 estudios reportaron efectos adversos que obligaron a descontinuar la terapia asignada (RR: 1,79; IC 95%: 0,516,29; n = 1.536 pacientes). Un análisis separado de los estudios que se iniciaron con medicación oral reveló significativamente más efectos adversos que obligaron a descontinuar el medicamento (RR: 6,65; IC 95%: 1,7525,33). Este hallazgo se explica por la alta frecuencia de eventos gastrointestinales adversos con los antibióticos orales y por el hecho de que estos eventos obstaculizan el tratamiento oral lo que no ocurre con el tratamiento venoso (análisis posprotocolo RR: 3,01; IC 95%: 0,999,12; n = 607).
La conclusión, nuevamente, es que se pueden administrar con seguridad antibióticos orales a los pacientes neutropénicos febriles que tengan bajo riesgo de mortalidad. El análisis no ofrece datos que apoyen el uso de un régimen oral específico, pero dada la preponderancia de infecciones por bacterias grampositivas es prudente administrar la combinación de ciprofloxacina con un segundo medicamento activo contra dichas bacterias (por ejemplo: amoxicilina/clavulanato).
CUÁNDO SE ACEPTA EL TRATAMIENTO ORAL PARA LOS PACIENTE CON NEUTROPENIA FEBRIL
Es necesario explorar adecuadamente, desde los puntos de vista clínico y paraclínico, a todo paciente con un episodio de neutropenia febril con el objetivo de evaluar su estado general, detectar los posibles
focos infecciosos y su probable etiología,54 y medir parámetros útiles en la predicción del riesgo. Se recomienda solicitar al momento del ingreso a todos los pacientes hemograma con recuento de plaquetas, pruebas de función renal y hepática, proteína C reactiva cuantitativa, radiografía de tórax, análisis de orina y cultivos de sangre y orina.21, 55
En los últimos 10 a 15 años, distintos grupos de investigadores han intentado adoptar un enfoque terapéutico más racional según la gravedad de los episodios.56 Se ha buscado definir, mediante parámetros objetivos, qué factores predicen el alto o bajo riesgo de un episodio de neutropenia febril.3,4,21,23 En varios estudios se ha clasificado a los pacientes neutropénicos como de bajo o alto riesgo con criterios relativamente simples, sin aplicar tablas que permitan una categorización adecuada. Por esto se ha tratado de estandarizar y utilizar tablas validadas para una clasificación más objetiva. Varias organizaciones internacionales y grupos de investigación han considerado válida la tabla MASCC para identificar y calificar como de alto o bajo riesgo a los pacientes con neutropenia. Si el puntaje es menor de 21 los pacientes deben ser hospitalizados y se les deben administrar antibióticos venosos de amplio espectro. Los pacientes con un puntaje de 21 o más pueden recibir terapia oral con una quinolona (ciprofloxacina, ofloxacina) asociada a un betalactámico (amoxicilina/clavulanato) que sería el tratamiento de elección,57,58 dada la alta frecuencia actual de infecciones por bacterias grampositivas. Otra opción sería la monoterapia con levofloxacina o moxifloxacina, más activas frente a las bacterias grampositivas, que pueden favorecer una mejor adhesión al tratamiento al disminuir los efectos secundarios gastrointestinales.57 El paciente debe permanecer en observación en el hospital por 24 horas al cabo de las cuales se lo evalúa nuevamente y si la clasificación MASCC aún da un puntaje de 21 o mayor, se lo da de alta con igual esquema de antibióticos, siempre que se disponga de una adecuada vigilancia en casa.
Los pacientes deben ser evaluados diariamente hasta que el recuento de neutrófilos sea al menos de 500/µL y estén afebriles durante 48 horas. Se debe hacer una evaluación de la respuesta terapéutica luego de 72 horas de instaurado el tratamiento antimicrobiano (cuarto día) y luego cada 3 días, hasta que se resuelva el episodio. Los pacientes con una evolución desfavorable se reevalúan clínicamente y por medio del laboratorio, se ajusta su terapia antimicrobiana y deben ser hospitalizados.21
La terapia antimicrobiana se extiende hasta que el paciente esté afebril al menos por 48 horas y su recuento de neutrófilos vaya en ascenso; no se recomienda una duración mínima.21
CONCLUSIONES
• La neutropenia febril es una situación clínica en la que se requieren un diagnóstico precoz y un tratamiento adecuado y controlado, con administración temprana de antibióticos, para evitar su gravedad potencial.
• La duración e intensidad de la neutropenia son los principales factores de riesgo para adquirir infecciones.
• La categorización en grupos de diferente riesgo permite implementar estrategias más conservadoras de manejo selectivo para los episodios de bajo riesgo, con lo que se logran beneficios importantes tanto para el paciente como para los sistemas de salud. La clave del buen éxito de cualquier terapia selectiva se basa en una definición acuciosa de los grupos de riesgo.
• Es apropiado dar antibioterapia oral a los pacientes clasificados como de bajo riesgo por un sistema validado para este propósito, que no tengan antecedente de alergia al antibiótico y toleren la vía oral.
• No se puede considerar que el tratamiento ambulatorio sea una estrategia universal, sino que debe limitarse a los pacientes con bajo riesgo de desarrollar una infección bacteriana invasora. Además, hay que asegurarse de que los pacientes puedan acceder al hospital sin restricción horaria, para garantizar su oportuna atención todas las veces que sea necesario.
• La gran mayoría de los pacientes con cáncer y neutropenia febril asociada prefieren un tratamiento domiciliario por la calidad de vida que les proporciona el estar cerca de sus seres queridos, en un ambiente más tranquilo, menos estresante y más familiar. El tratamiento ambulatorio les ofrece ventajas psicológicas y sociales al paciente y su familia.
• Existen recursos útiles que también podrían facilitar el tratamiento ambulatorio de los pacientes con neutropenia febril como el uso de factores estimulantes de colonias de granulocitos, con el que se ha demostrado una reducción en la duración de la neutropenia, acortando la estancia hospitalaria, si llega a necesitarse, y el tratamiento antibiótico.
• Es importante recalcar que el modelo de Talcott y el MASCC han sido validados en adultos y no deben ser aplicados a niños, porque ambas poblaciones difieren significativamente en cuanto a mortalidad, porcentaje de infecciones graves y presencia de enfermedades concomitantes.
• Estas conclusiones apuntan a la importancia de individualizar cada caso, evaluar la existencia de otras enfermedades, el estado físico del paciente, la posible duración de la neutropenia y, más importante aún, su disposición a aceptar un tratamiento ambulatorio, con un control exhaustivo de su evolución. Es preciso conocer las variables pronósticas específicas en cada episodio. El objetivo final es garantizar que no se someta a los pacientes tratados en casa a un riesgo innecesario.
REFERENCIAS BIBLIOGRÁFICAS
1. Klastersky J. Management of fever in neutropenic patients with differents riks of complications. Clin Infect Dis 2004; 39: S32S37. [ Links ]
2. Innes H, Marshall E. Outpatient therapy for febrile neutropenia. Curr Opin Oncol 2007; 19; 294298. [ Links ]
3. Carmona A, Herrero J, Martínez J, Marín M, De Las Heras M, Navarrete A. Neutropenia febril: análisis de los factores pronósticos y el tratamiento adaptado al riesgo. Revisión crítica. Oncol (Barc). 2006; 29: 206218. [ Links ]
4. Klastersky J, Paesmans M, Georgala A, Muanza F, Plehiers B, Dubreucq L, et al. Outpatient oral antibiotics for febrile neutropenic cancer patients using score predictive for complications. J Clin Oncol 2006; 24: 41294134. [ Links ]
5. Viscoli C, Varnier O, Machetti M. Infections in patients with febrile neutropenia: epidemiology, microbiology, and risk stratification. Clin Infect Dis 2005; 40: S240S245. [ Links ]
6. Hughes WT, Armstrong D, Bodey GP, Feld R, Mandell GL, Mayer JD, et al. Guidelines for the use of antimicrobial agents in neutropenic patients with unexplained fever. Clin Infect Dis 1997; 25: 551553. [ Links ]
7. Payá E, Álvarez AM, Avilés CL, Cofré J, Enríquez N, Salgado C, et al. Agentes causantes de infecciones del torrente circulatorio en niños con cáncer, en cinco hospitales de Santiago (19941998). Rev Méd Chile 2001; 129: 12971304. [ Links ]
8. Lugo L, García H, Gómez C. Calidad de vida y calidad de vida relacionada con la atención en salud. Iatreia 2002; 15: 96102. [ Links ]
9. Elting L, Rubenstein E, Rolston K, Cantor S, Martin C, Kurtin D, et al. Time to clinical response: an outcome of antibiotic therapy of febrile neutropenia with implications for quality and cost of care. J Clin Oncol 2000; 18: 36993706. [ Links ]
10. De Lalla F. Outpatient therapy for febrile neutropenia: clinical and economic implications. Pharmacoeconomics 2003; 21: 397413. [ Links ]
11. Bash R, Katz J, Cash J, Buchanan G. Safety and cost effectiveness of early hospital discharge of lower risk children with cancer admitted for fever and neutropenia. Cancer 1994; 74: 189196. [ Links ]
12. Ramphal R. Changes in the etiology of bacteremia in febrile neutropenic patients and the susceptibilities of the currently isolated pathogens. Clin Infect Dis 2004; 39 (Suppl 1): 2531. [ Links ]
13. Freifeld A, Marchigiani D, Walsh T, Chanock S, Lewis L, Hiemenz J, et al. A doubleblind comparision of empirical oral and intravenous antibiotic therapy for lowrisk febrile patients with neutropenia during cancer chemotherapy. New Engl J Med 1999; 341: 305311. [ Links ]
14. Santolaya ME. Neutropenia febril en el niño con cáncer. Conceptos actuales sobre criterios de riesgo y manejo selectivo. Rev Méd Chile 2001; 129: 14491454. [ Links ]
15. Kern W. Risk assessment and riskbased therapeutic strategies in febrile neutropenia. Curr Opin Infect Dis 2001; 14: 415422. [ Links ]
16. Klaassen RJ, Goodman TR, Pham B, Doyle JJ. 'Lowrisk' prediction rule for pediatric oncology patients presenting with fever and neutropenia. J Clin Oncol 2000; 18: 10121019. [ Links ]
17. Santolaya ME, Villarroel M, Avendaño L, Cofré J. Discontinuation of antimicrobial therapy for febrile, neutropenic children with cancer: a prospective study. Clin Infect Dis 1997; 25: 9297. [ Links ]
18. Tordecilla J, Campbell M, Joannon S, Rizzardini C, Soto V. Criterios de alta precoz en niños con cáncer y neutropenia febril. Rev Chil Pediatr 1998; 69: 247251. [ Links ]
19. Petrilli AS, Dantas LS, Campos MC, Tanaka C, Cortez V, Seber A. Oral ciprofloxacin versus intravenous ceftriaxone administered in an outpatient setting for fever and neutropenia in lowrisk pediatric oncology patients: randomized prospective trial. Pediatr Oncol 2000; 34: 8791. [ Links ]
20. Paganini H, Gómez S, Ruvinsky S, Zubizarreta P, Latella A, Fraquelli L, et al. Outpatient, sequential, parenteraloral antibiotic therapy for lower risk febrile neutropenia in children with malignant diseases. Cancer 2003; 97: 17751780. [ Links ]
21. Santolaya M, Rabagliati R, Bidart T, Payá E, Guzmán A, Morales R, et al. Consenso: manejo racional del paciente con cáncer, neutropenia y fiebre. Rev Chil Infectol 2005; 22 (Supl. 2): S79S114. [ Links ]
22. Marcos F, Albo I, Arbol F, Viana A, Juárez F, Durán A. Tratamiento de la neutropenia febril secundaria a quimioterapia, con antibióticos orales de modo ambulatorio. Oncología 2004; 27: 533536. [ Links ]
23. Santolaya M, Álvarez A, Avilés C, Becker A, Cofre J, Payá E, et al. Tratamiento selectivo de los episodios de neutropenia febril en niños con cáncer. Comité de Infectología, Programa Infantil Nacional de Drogas Antineoplásicas (PINDA). Rev Chil Infectol 2004; 21: 213222. [ Links ]
24. Talcott J, Finberg R, Mayer R, Goldman L. The medical course of cancer patients with fever and neutropenia. Clinical identification of a lowrisk subgroup at presentation. Arch Int Med 1988; 148: 25612568. [ Links ]
25. Klastersky J., Paesmans M., Rubenstein E., Boyer M., Elting L. The Multinational Association for Supportive Care in Cancer Risk Index: A multinational scoring system for identifying lowrisk febrile neutropenic cancer patients. J Clin Oncol; 2000; 18: 30383051. [ Links ]
26. Von LilienfeldToal M, Sievers E, Bodemuller V, Mihailescu C, Marten A, Gorschluter M, et al. Markers of bacteremia in febrile neutropenic patients with hematological malignancies: procalcitonin and IL6 are more reliable than Creactive protein. Eur J Clin Microbiol Infect Dis 2004; 23: 539544. [ Links ]
27. Südhoff T, Giagounidis A, Karthaus M. Evaluation of neutropenic fever: value of serum and plasma parameters in clinical practice. Chemotherapy 2000; 46: 7785. [ Links ]
28. Giamarellou H, GiamarellosBourboulis E, Repoussis P, Galani L, Anagnostopoulos N, Grecka P, et al. Potential use of procalcitonin as a diagnostic criterion in febrile neutropenia: experience from a multicentre study. Clin Microbiol Infect 2004; 10: 628633. [ Links ]
29. Manian FA. A prospective study of daily measurement of Creactive protein in serum of adults with neutropenia. Clin Infect Dis 1995; 21: 114121. [ Links ]
30. Engervall P, Granstrom M, Andersson B, Bjorkholm M. Monitoring of endotoxin, interleukin6 and Creactive protein serum concentrations in neutropenic patients with fever. Eur J Haematol 1995; 54: 226234. [ Links ]
31. De Bont ES, Vellenga E, Swaanenburg JC, Fidler V, Visservan Brummen PJ, Kamps WA. Plasma IL8 and IL6 levels can be used to define a group with low risk of septicaemia among cancer patients with fever and neutropenia. Brit J Haematol 1999; 107: 375380. [ Links ]
32. Persson L, Engervall P, Magnuson A, Vikerfors T, Soderquist B, Hansson LO, et al. Use of inflammatory markers for early detection of bacteraemia in patients with febrile neutropenia. Scand J Infect Dis 2004; 36: 365371. [ Links ]
33. Jimeno A, GarciaVelasco A, del Val O, Gonzalez Billalabeitia E, Hernando S, Hernandez R, et al. Assessment of procalcitonin as a diagnostic and prognostic marker in patients with solid tumors and febrile neutropenia. Cancer 2004; 100: 24622469. [ Links ]
34. Chisholm J, Dommett R. The evolution towards ambulatory and daycase management of febrile neutropenia. Brit J Haematol 2006; 135: 316. [ Links ]
33. Kern W. Risk assessment and treatment of lowrisk patients with febrile neutropenia. Clin Infect Dis 2006; 42: 533540. [ Links ]
36. Uys A, Rapoport BL, Anderson R. Febrile neutropenia: a prospective study to validate the Multinational Association of Supportive Care of Cancer (MASCC) riskindex score. Support Care Cancer 2004; 12: 555560. [ Links ]
37. Pizzo PA. Management of fever in patients with cancer and treatmentinduced neutropenia. New Engl J Med 1993; 328: 13231332. [ Links ]
38. Leong DC, Kinlay S, Ackland S, Bonaventura A, Stewart JF. Lowrisk febrile neutropenia in a medical oncology unit. Aust N Z J Med 1997; 27: 403407. [ Links ]
39. Hartmann L, Tschetter L, Habermann T, Ebbert L, Johnson P, Mailliard J, et al. Granulocyte colonystimulating factor in severe chemotherapyinduced afebrile neutropenia. New Engl J Med 1997; 336: 17761780. [ Links ]
40. Vidal L, Mical P, BenDor I, SoaresWeiser K, Leibovici L. Oral versus intravenous antibiotic treatment for febrile neutropenia in cancer patients: a systematic review and metaanalysis of randomized trial. J Antimicrob Chemother 2004; 54: 2937. [ Links ]
41. Kern W, Cometta A, De Bock R, Langenaeken J, Paesmans M, Gaya H. Oral versus intravenous empirical antimicrobial therapy for fever in patients with granulocytopenia who are receiving cancer chemotherapy. New Engl J Med 1999; 341: 312318. [ Links ]
42. Flaherty JP, Waitley D, Edlin B, George D, Arnow P, O’Keefe P, et al. Multicenter, randomized trial of ciprofloxacin plus azlocillin versus ceftazidime plus amikacin for empiric treatment of febrile neutropenic patients. Am J Med 1989; 87: S278–S282. [ Links ]
43. Giamarellou H, Bassaris HP, Petrikkos G, Busch W, Voulgarelis M, Antoniadou A, et al. Monotherapy with intravenous followed by oral highdose ciprofloxacin versus combination therapy with ceftazidime plus amikacin as initial empiric therapy for granulocytopenic patients with fever. Antimicrob Agents Chemother 2000; 44: 32643271. [ Links ]
44. Hidalgo M, Hornedo J, Lumbreras C, Trigo JM, Colomer R, Perea S, et al. Outpatient therapy with oral ofloxacin for patients with low risk neutropenia and fever: a prospective, randomized clinical trial. Cancer 1999; 85: 213219. [ Links ]
45. Innes HE, Smith DB, O’Reilly SM, Clark PI, Kelly V, Marshall E. Oral antibiotics with early hospital discharge compared with inpatient intravenous antibiotics for lowrisk febrile neutropenia in patients with cancer: a prospective randomised controlled single centre study. Brit J Cancer 2003; 89: 4339. [ Links ]
46. Malik IA, Abbas Z, Karim M. Randomised comparison of oral ofloxacin alone with combination of parenteral antibiotics in neutropenic febrile patients. Lancet 1992; 339: 10921096. [ Links ]
47. Mullen CA, Petropoulos D, Roberts WM, Rytting M, Zipf T, Chan KW, et al. Outpatient treatment of fever and neutropenia for low risk pediatric cancer patients. Cancer 1999; 86: 126134. [ Links ]
48. Paganini HR, Sarkis CM, De Martino MG, Zubizareta PA, Casimir L, Fernandez C, et al. Oral administration of cefixime to lower risk febrile neutropenic children with cancer. Cancer 2000; 88: 28482852. [ Links ]
49. Rolston K, Rubenstein E, Elting L. Ambulatory management of febrile episodes in lowrisk neutropenic patients. In: Programs and Abstracts of the Thirtyfifth Interscience Conference on Antimicrobial Agents and Chemotherapy, San Francisco, CA, 1995. Abstract LM81. Washington DC. American Society for Microbiology. [ Links ]
50. Rubinstein EB, Rolston K, Benjamin RS, Loewy J, Escalante C, Manzullo E, et al. Outpatient treatment of febrile episodes in lowrisk neutropenic patients with cancer. Cancer 1993; 71: 36403646. [ Links ]
51. Samonis G, Anaissie EJ, Kalbakis K, Georgoulias V. Therapy for lowrisk cancer patients with fever and neutropenia: results of a prospective, randomized trial with cost analysis. In: Programs and Abstracts of the Thirtyseventh Interscience Conference on Antimicrobial Agents and Chemotherapy, Atlanta, GA, 1997. Abstract LM51. Washington DC. American Society for Microbiology. [ Links ]
52. Shenep JL, Flynn PM, Baker DK, Hetherington SV, Hudson MM, Hughes WT, et al. Oral cefixime is similar to continued intravenous antibiotics in the empirical treatment of febrile neutropenic children with cancer. Clin Infect Dis 2001; 32: 3643. [ Links ]
53. Velasco E, Costa MA, Martins CA, Nucci M. Randomized trial comparing oral ciprofloxacin plus penicillin V with amikacin plus carbenicillin or ceftazidime for empirical treatment of febrile neutropenic cancer patients. Am J Clin Oncol Cancer Clinical Trials 1995; 18: 429435. [ Links ]
54. Sepkowitz K. Treatment of patients with hematologic neoplasm, fever, and neutropenia. Clin Infect Dis 2005: 40: S253S256. [ Links ]
55. American Cancer Society. National Comprehensive Cancer Network. Fever and neutropenia: treatment guidelines for patients with cancer. Version I/May 2002. [ Links ]
56. Rolston K. Challenges in the treatment of infections caused by grampositive and gramnegative bacteria in patients with cancer and neutropenia. Clin Infect Dis 2005; 40: S246S252. [ Links ]
57. Batlle M, Lloveras N. Manejo del paciente con neutropenia de bajo riesgo y fiebre. Enferm Infecc Microbiol Clin 2005; 23 (Suppl. 5): 3034. [ Links ]
58. Hughes W, Armstrong D, Bodey G, Bow E, Brown A, Calandra T, et al. 2002 Guidelines for the use of antimicrobial agents in neutropenic patients with cancer. Clin Infect Dis 2002: 34: 730751. [ Links ]