Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.21 no.2 Medellín Apr./June 2008
ARTÍCULO DE INVESTIGACIÓN
Prueba de esfuerzo cardiopulmonar (PEC) en el síndrome de falla cardíaca. Una propuesta basada en la evidencia
Cardiopulmonary exercise testing in congestive heart failure. A proposal based on evidence
Juan Manuel Sénior Sánchez, MD1
1. Cardiólogo intensivista, Coordinador del postgrado en Cardiología Clínica, Universidad de Antioquia, Jefe de la Clínica de Falla Cardíaca y Trasplante, Universidad de Antioquia y Hospital Universitario San Vicente de Paúl, Medellín, Colombia.
RESUMEN
El objetivo de este artículo es presentar recomendaciones para la utilización clínica de la prueba de esfuerzo cardiopulmonar en el síndrome de falla cardíaca con énfasis en la medicina basada en la evidencia mediante una búsqueda sistemática de la literatura. La prueba de esfuerzo cardiopulmonar es una herramienta útil en la evaluación y seguimiento de los pacientes con falla cardíaca, pero es poco utilizada en la práctica diaria del internista general y el cardiólogo clínico. Permite establecer diagnósticos diferenciales en pacientes con disnea de causa inexplicada, evaluar la tolerancia al ejercicio, la capacidad funcional y el pronóstico, seleccionar los pacientes para trasplante cardíaco, proporcionar parámetros para la prescripción del ejercicio y monitorizar la respuesta al entrenamiento en programas de rehabilitación.
Palabras clave: Consumo de oxígeno pico, Falla cardíaca Prueba de esfuerzo, Prueba de esfuerzo cardiopulmonar
Summary
The purpose of this document is to present recommendations for the clinical utilization of the cardiopulmonary exercise testing in patients with congestive heart failure with special emphasis on the evidence–based medicine, by means of a systematic search of the literature.
The cardiopulmonary exercise testing is a useful tool in the evaluation and follow–up of patients with heart failure, but it is infrequently used in the daily practice of specialists in internal medicine and clinical cardiology. It allows differential diagnoses in patients with dyspnea of unexplained cause; to evaluate the tolerance to exercise, the functional capacity and prognosis; to select patients for heart transplantation; to provide parameters for the prescription of exercise, and to monitor the response to training in rehabilitation programs.
Key words: Cardiopulmonary exercise testing, Exercise testing, Heart failure, Peak oxygen uptake
INTRODUCCIÓN
Las manifestaciones clínicas de falla cardíaca son poco sensibles y no muy específicas para el diagnóstico. 1 Los síntomas sugestivos de falla cardíaca son: disnea de esfuerzo, disnea paroxística nocturna, ortopnea, edema vespertino de los miembros inferiores, disminución de la tolerancia al ejercicio, fatiga, alteración del estado mental en el anciano y síntomas abdominales asociados con ascitis o hepatomegalia, como náuseas y dolor abdominal.2
Aunque la aparición de estos síntomas sugiere la presencia de disfunción ventricular, muchos pacientes con disnea de esfuerzo tienen presiones de llenado ventricular normales, lo que sugiere un diagnóstico alternativo.3 Además, en el servicio de urgencias se evalúan pacientes con diagnóstico establecido por disnea de origen no cardíaco.4 La sintomatología no tiene una correlación directa con la función ventricular; hasta un 20% de los pacientes que tienen una fracción de expulsión menor del 40% no tienen criterios de falla cardíaca5 y solo el 42% de los pacientes con fracción de expulsión menor del 30% tienen disnea de esfuerzo.6
La etiología de la intolerancia al ejercicio es multifactorial y depende más de adaptaciones periféricas que de la función ventricular per se; sin embargo, se correlaciona en forma directa con la gravedad de la enfermedad y la disminución en la tasa de supervivencia7,8 (Tabla n.º 1).
Por lo anterior, la prueba de esfuerzo cardiopulmonar (PEC) se convierte en una herramienta útil en la evaluación y el seguimiento de los pacientes con falla cardíaca, porque permite establecer diagnósticos diferenciales en pacientes con disnea de causa inexplicada, evaluar la tolerancia al ejercicio, la capacidad funcional y el pronóstico y seleccionar los pacientes para trasplante cardíaco; además, proporciona parámetros para prescribir el ejercicio y para monitorizar la respuesta al entrenamiento en programas de rehabilitación.10,11
Consumo pico de oxígeno
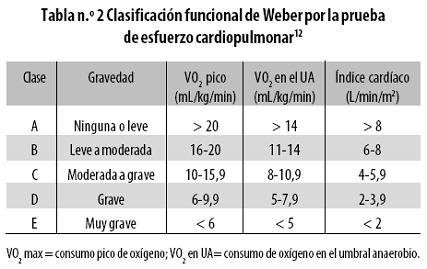
Desde 1986 Weber y colaboradores establecieron la correlación entre la capacidad funcional medida como el consumo pico de oxígeno durante la PEC con las medidas hemodinámicas invasivas, lo que dio origen a la 'Clasificación de Weber'12 (Tabla n.º 2).
Van den Broek y colaboradores informaron que el 88% de los pacientes en estado funcional II de la New York Heart Association (NYHA) estaban en las clases A y B de Weber, en contraposición al 73% de los pacientes en estado funcional III de la NYHA, los cuales estaban en las clases C y D de Weber.13
METODOLOGÍA
Se analizaron trabajos de investigación originales, revisiones, metanálisis y consensos en Medline, Google Scholarship y Cochrane con los siguientes términos: 'Cardiopulmonary exercise testing', 'Exercise test', 'Exercise testing' y 'Walking tests'. Se detectaron 5.300 registros, de los cuales se seleccionaron 390 al combinarlos con el término 'Congestive Heart Failure'. Luego de la revisión meticulosa del diseño metodológico de los artículos originales y de los metanálisis, y del análisis de la discusión académica de los consensos y revisiones se seleccionaron 33 documentos que, en opinión del autor, permiten establecer recomendaciones claras para utilizar la prueba de esfuerzo cardiopulmonar. Estas recomendaciones se incluyeron en las 'Guías Colombianas sobre Evaluación y Manejo de la Falla Cardíaca Crónica del Adulto', desarrolladas en 2007 por los miembros del Consejo Nacional de Falla Cardíaca de la Sociedad Colombiana de Cardiología y Cirugía Cardiovascular. 14 Dada la heterogeneidad de las publicaciones, no se hizo análisis estadístico, ni de los pacientes por enfermedad ni por subgrupos y se presenta solo la discusión académica de algunos de ellos que respaldan las recomendaciones finales.
RESULTADOS
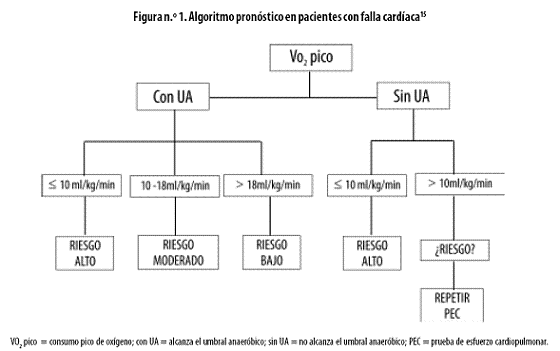
Está clara la importancia de la PEC en la estratificación del riesgo de los pacientes con falla cardíaca crónica. En el estudio de Mancini y colaboradores se incluyeron 116 pacientes con dicho diagnóstico, divididos en tres grupos de acuerdo con su consumo pico de oxígeno (VO2 pico), así: Grupo 1: pacientes con VO2 pico menor de 14 mL/kg/min aceptados para trasplante. Grupo 2: pacientes con VO2 pico =14 mL/kg/min en quienes se difiere el trasplante cardíaco. Grupo 3: pacientes con VO2 pico menor de 14 mL/kg/min en quienes está contraindicado el trasplante por la presencia de enfermedades concomitantes. Las tasas de supervivencia al año de seguimiento para los tres grupos fueron de 48%, 94% y 47%, respectivamente. Se debe hacer énfasis en que los pacientes con VO2 pico por debajo de 10 mL/kg/min tienen la menor tasa de supervivencia en el seguimiento.15 Los pacientes con VO2 pico menor de 14 mL/kg/min que fueron trasplantados tuvieron una tasa de supervivencia del 83% al año de seguimiento, bastante similar a la del grupo con tratamiento médico (Grupo 2).
Es difícil cuantificar la tolerancia al ejercicio en pacientes con falla cardíaca crónica porque depende, entre otros factores, del nivel de entrenamiento previo, la edad, el sexo, el peso, la motivación del paciente y la del examinador.16 La relación entre la producción de CO2 y el consumo de oxígeno o cociente respiratorio en la PEC mediante la relación de intercambio respiratorio (RER, del inglés: Respiratory Exchange Ratio) (VCO2/VO2) se conoce como el intercambio de gases o respiratorio. En condiciones basales, el RER se asimila al cociente respiratorio cuyo valor está determinado por los procesos metabólicos implicados en la generación de energía. 17 Puede ser utilizado para estimar el nivel de esfuerzo realizado; un RER mayor de 1,1 indica esfuerzo máximo y generalmente se obtiene cuando se ha alcanzado el umbral anaeróbico (UA).18 Mezanni y colaboradores demostraron, en 273 pacientes con falla cardíaca, que la mortalidad de los que tienen VO2 pico menor de 10 mL/kg/min y que no alcanzan un RER por encima de 1,15 es mayor que la de los que sí lo logran, pero similar a la de los pacientes con VO2 pico entre 10–14 mL/kg/min. Por lo anterior, los pacientes con falla cardíaca que tienen gravemente comprometida la tolerancia al ejercicio deben ser motivados para alcanzar un RER lo más cercano posible a 1,15, con el fin de conservar su poder pronóstico. 19 Se ha propuesto el umbral anaeróbico (UA) como un índice submáximo de capacidad de ejercicio, definido clásicamente como el punto de transición del metabolismo aerobio al anaerobio durante la actividad física, evidenciado por el aumento en la producción de lactato y más recientemente por otras técnicas en la PEC. Es frecuente que pacientes con falla cardíaca crónica no alcancen el UA, especialmente cuando su tolerancia al ejercicio está reducida. En el estudio de Opasich y colaboradores en 505 pacientes se demostró que el valor pronóstico del VO2 pico se mantiene en los pacientes que alcanzan el UA, a diferencia de los que no lo alcanzan en quienes el poder pronóstico es menor incluso en pacientes con VO2 pico menor de 10 mL/kg/min.20 Por lo anterior, el consenso de la Asociación Americana del Corazón y el Colegio Americano de Cardiología recomienda que luego de la optimización terapéutica se debe plantear el trasplante cardíaco en los pacientes con VO2 pico menor de 14 mL/kg/minuto; sin embargo, es importante demostrar que la prueba fue verdaderamente máxima con la documentación del alcance del UA aproximadamente al 50–70% del VO2 pico.21 En pacientes con VO2 pico mayor de 10 mL/kg/min que no alcanzan el UA, es útil repetir la prueba luego de optimizar el tratamiento, en el cual se incluyan recomendaciones de actividad física. Stevensson y colaboradores demostraron, en 68 pacientes con VO2 pico menor de 14 mL/kg/minuto, que el incremento de 2 o más mL/kg/min a un nivel por encima de 12 mL/kg/min del VO2 pico identifica un subgrupo de pacientes con menor riesgo, con supervivencia actuarial del 100% a los dos años de seguimiento. 22 De manera similar, la disminución menor del 10% en la PEC de control se correlaciona con un mejor pronóstico23 (Figura n.º 1).
Otros determinantes del riesgo en la PEC
Debido a las dificultades existentes en la evaluación del consumo pico de oxígeno, especialmente en mujeres y personas obesas, algunos autores han propuesto utilizar variables complementarias en la estratificación del riesgo. La corrección del VO2 pico por el peso magro es una de estas estrategias; la grasa corporal es metabólicamente inerte y por lo tanto no consume oxígeno.24 Osman y colaboradores demostraron que un consumo pico de oxígeno, ajustado por el peso magro, menor de 19 mL/kg/minuto es mejor predictor que el valor clásico del VO2 pico menor de 14 mL/kg/min.25 Stelken y colaboradores analizaron retrospectivamente 181 pacientes con falla cardíaca en cuanto al porcentaje esperado como normal del consumo pico de oxígeno; los pacientes que obtuvieron un 50% o menos del valor predicho tuvieron tasas de supervivencia de 74% y 43% al año y a los dos años de seguimiento, respectivamente, en comparación con el grupo que obtuvo más del 50% del valor predicho en el cual las tasas de supervivencia fueron de 98% y 90% al año y dos años, respectivamente. 26 Osada y colaboradores obtuvieron resultados similares; la presión sistólica máxima menor de 120 mm Hg y el VO2 pico menor del 50% del valor predicho fueron variables independientes de riesgo, en pacientes con VO2 pico menor de 14 mL/kg/min.27
Se debe tener en cuenta un nivel de consumo pico de oxígeno menor de 14 mL/kg/min para decidir si se hace trasplante cardíaco; sin embargo, la relación entre el consumo de oxígeno y la mortalidad en pacientes con falla cardíaca es una variable continua, por lo que no se puede proponer un nivel de corte absoluto.28 En términos de predicción del riesgo de muerte, un valor menor de 10 mL/kg/min define un grupo de alto riesgo, mientras que uno mayor de 18 mL/kg/min define un grupo de bajo riesgo.29
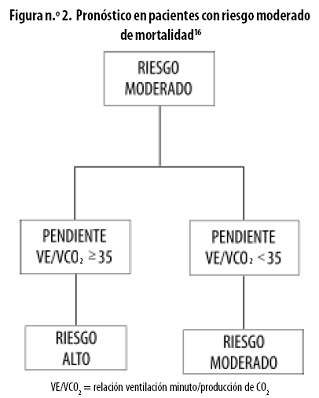
Existe un subgrupo con valores de 10–18 mL/kg/min en el cual se mezclan pacientes con diferentes niveles de riesgo, por lo que se constituye en una zona gris o indeterminada. En pacientes con falla cardíaca se altera el cociente entre la ventilación minuto y la génesis de CO2 (VE/VCO2), como resultado del ingreso de gases a los alvéolos situados en zonas con escaso flujo sanguíneo por el bajo gasto cardiaco, fenómeno denominado discordancia V/Q, y el incremento en la producción de CO2 con respecto al consumo de oxígeno, resultado del metabolismo anaeróbico.30 Chua y colaboradores reportaron que la relación VE/VCO2, expresada como su pendiente, de 35 o mayor se asoció con mal pronóstico;31 este hallazgo ha sido confirmado en otros estudios 32–35 (Figura n.º 2).
Evaluación de la respuesta al tratamiento
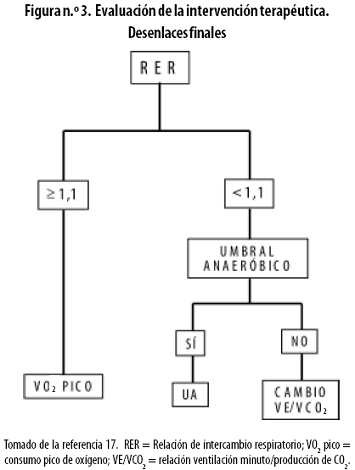
Actualmente se utiliza el VO2 pico en diferentes estudios clínicos como desenlace final (end point), especialmente en pacientes con falla cardíaca. Aunque está clara su importancia pronóstica, las dificultades para medirlo no permiten que sea siempre un adecuado desenlace final, específicamente cuando se evalúan intervenciones terapéuticas, por lo que se deben tener en cuenta en algunos casos el UA, el RER y el cambio en la relación VE/VCO2 24,36,37 (Figura n.º 3), especialmente en pacientes en tratamiento con betabloqueadores.38–41
Disnea de causa desconocida
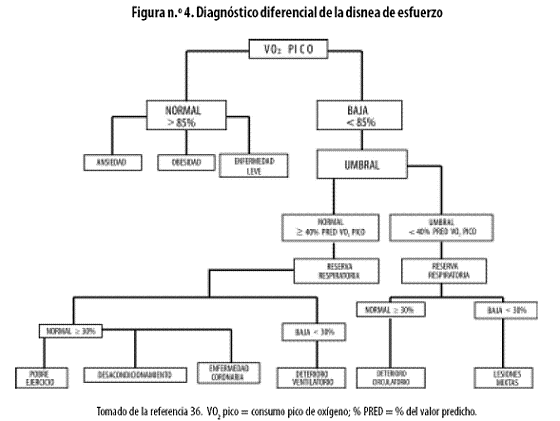
En pacientes evaluados por disnea de causa desconocida, cuyos exámenes iniciales no aclaren el diagnostico etiológico, existe evidencia suficiente para utilizar la PEC como una herramienta útil para definir si se trata de una enfermedad cardíaca o pulmonar, una miopatía, factores psicológicos o desacondicionamiento físico 24,42,43 (Figura n.º 4).
Resincronización cardíaca
En algunos estudios con terapia de resincronización cardíaca (PATH CHF– PATH CHF II), se utilizaron los resultados de la prueba de esfuerzo cardiopulmonar como criterios de inclusión o como desenlaces primarios y secundarios.44 Diferentes estudios han demostrado que la terapia de resincronización produce un incremento promedio de 1,5 mL/kg/min en el VO2 pico, el cual se correlaciona directamente con el grado de disincronía, por lo que la Sociedad Alemana de Cardiología incluye un valor menor de 14 mL/kg/min como criterio para indicarla.45
Puntaje de supervivencia en falla cardíaca (Heart Failure Survival Score, HFSS). Existe un número significativo de variables que son consideradas como marcadores pronósticos no relacionados con el ejercicio; utilizando estas variables en combinación con los datos obtenidos durante la prueba de esfuerzo cardiopulmonar se pudo diseñar un puntaje, que incluye siete variables, con excelente capacidad para predecir la supervivencia.46 Estos hallazgos fueron corroborados en el registro COCPIT (Comparative Outcome and Clinical Profiles in Transplantation Study Group), donde se demostró disminución del riesgo relativo de muerte luego del trasplante cardíaco solo en los pacientes clasificados como de alto riesgo.47 El puntaje utiliza la siguiente fórmula de regresión:

CONCLUSIONES
La prueba de esfuerzo cardiopulmonar proporciona información muy valiosa en el diagnóstico de pacientes con disnea de origen desconocido, con desacondicionamiento físico, con enfermedad cardiovascular, específicamente con síndrome de falla cardíaca y en pacientes con enfermedad pulmonar y deterioro de la ventilación. Aunque el costo inicial puede ser elevado y se requiere un personal altamente entrenado para llevarla a cabo, es relativamente barata en comparación con otras pruebas no invasivas en cardiología y su información permite estratificar el riesgo a largo plazo, identificar los pacientes candidatos para trasplante, establecer protocolos para la prescripción del ejercicio y determinar el mecanismo fisiopatológico de la intolerancia al ejercicio.48–50
RECOMENDACIONES
Las siguientes recomendaciones están basadas en los niveles de evidencia y grados de recomendación sugeridos por Lozano y Cuervo.51
Niveles de información y evidencia:
I. Al menos un experimento aleatorizado o un metanálisis de alta calidad.
II. Al menos un experimento aleatorizado o un metanálisis de alta calidad, pero con gran probabilidad de resultados falsos o falsos negativos.
III. 1. Estudios experimentales no aleatorizados, pero adecuados en otros aspectos.
2. Estudios observacionales, ojalá múltiples y de diversos centros.
3. Estudios con controles históricos, múltiples series de tiempo, series de casos.
IV. Opinión de autoridades respetadas, basada en la experiencia clínica no cuantificada, en informes de grupos de expertos o en ambos.
Grados de recomendación:
A. Hay buena evidencia que apoya incluir la intervención o la prueba en el cuidado de los pacientes.
B. Hay evidencia regular que apoya incluir la intervención o la prueba en el cuidado de los pacientes.
C. Hay evidencia pobre para emitir una recomendación.
D. Hay evidencia regular que apoya no incluir la intervención o la prueba en el cuidado de los pacientes.
E. Hay evidencia buena que apoya no incluir la intervención o la prueba en el cuidado de los pacientes.
1. La prueba de esfuerzo cardiopulmonar (PEC) está indicada en la evaluación de la tolerancia al ejercicio en pacientes con falla cardíaca. Nivel de evidencia I, Grado de recomendación A.
2. La PEC está indicada en la evaluación de la capacidad funcional de los pacientes con falla cardíaca. Nivel de evidencia III, Grado de recomendación B.
3. La PEC está indicada para establecer el pronóstico de los pacientes con falla cardíaca. Nivel de evidencia I, Grado de recomendación A.
4. Los pacientes que en la PEC obtengan un consumo pico de oxígeno (VO2) de 10 mL/kg/minuto o menos se diagnostican como de alto riesgo y deben ser considerados como candidatos a trasplante cardíaco. Nivel de evidencia I, Grado de recomendación A.
5. Los pacientes que en la PEC obtengan un consumo pico de oxígeno menor de 14 mL/kg/minuto se considerarán como posibles candidatos a trasplante, luego de optimizar el tratamiento, siempre que se alcance el máximo esfuerzo demostrado por un RER mayor de 1,15 o el UA al 50–70% del consumo de oxígeno pico. Nivel de evidencia II, Grado de recomendación B.
6. Los pacientes que en la PEC obtengan un consumo pico de oxígeno de 10–18 mL/kg/minuto se consideraran como de riesgo moderado. Nivel de evidencia III, Grado de recomendación B.
7. Los pacientes clasificados como de riesgo moderado serán considerados como posibles candidatos a trasplante, luego de optimizar el tratamiento, si durante la prueba la presión sistólica máxima obtenida fue menor de 120 mmHg, la pendiente VE/VCO2 fue de 35 o mayor o se alcanzó menos del 50% del VO2 pico predicho. Nivel de evidencia III, Grado de recomendación B.
8. Los pacientes que en la PEC obtengan un consumo pico de oxígeno mayor de 18 mL/kg/min serán como considerados como de bajo riesgo. Nivel de evidencia I, Grado de recomendación A.
9. Los pacientes que en la PEC se clasifiquen como de bajo riesgo no serán considerados para trasplante cardíaco. Nivel de evidencia I, Grado de recomendación E.
10. A los pacientes que en la PEC obtengan un consumo pico de oxígeno mayor de 10 mL/kg/minuto, pero que no alcancen el UA al 50–70% del VO2 pico o un RER mayor de 1,5, se les realizará una prueba de control, luego de optimizar el tratamiento, en un período no menor de un mes. Nivel de evidencia III, Grado de recomendación B.
11. Los parámetros de la PEC, específicamente el VO2 pico, pueden ser utilizados como desenlaces finales en la evaluación de intervenciones terapéuticas en estudios clínicos que involucren pacientes con falla cardíaca. Nivel de evidencia III, Grado de recomendación B.
12. La PEC es útil en la evaluación de los pacientes con disnea de esfuerzo de causa no clara. Nivel de evidencia III, Grado de recomendación B.
13. Los pacientes que en la PEC obtengan un consumo pico de oxígeno menor de 14 mLkg/minuto, en quienes se demuestre disincronía serán considerados para terapia de resincronización. Nivel de evidencia III, Grado de recomendación B.
14. Los pacientes clasificados como de alto riesgo por el puntaje de supervivencia de falla cardíaca (HFSS) deben ser considerados como candidatos a trasplante cardíaco. Nivel de evidencia III, Grado de recomendación B.
15. En los pacientes clasificados como de riesgo moderado por el puntaje de supervivencia de falla cardíaca (HFSS) se debe individualizar la consideración de trasplante cardíaco, si no hay mejoría clínica luego de optimizar el tratamiento. Nivel de evidencia III, Grado de recomendación C.
16. Los pacientes clasificados como de bajo riesgo por el puntaje de supervivencia de falla cardíaca (HFSS) no serán considerados para trasplante cardíaco. Nivel de evidencia III, Grado de recomendación D.
17. La PEC es útil en los programas de rehabilitación cardíaca para la prescripción del ejercicio y para evaluar la respuesta al entrenamiento en pacientes con falla cardíaca. Nivel de evidencia II, Grado de recomendación B.
REFERENCIAS BIBLIOGRÁFICAS
1. Cleland JGF. Diagnosis of heart failure. Heart 1998; 79: SP10–S16. [ Links ]
2. Senior JM. Falla Cardíaca. En: Manual de Normas y Procedimientos en Cardiología. Medellín: Editorial Universidad de Antioquia, Colección Yuluka, 2000. pp. 116–122. [ Links ]
3. Konstam MA, Dracup K, Baker DW, Bottorff MB, Brooks NH, Dacey RA, et al. Clinical Practice Guideline. Heart Failure: Evaluation and Care of Patients with Left–Ventricular Systolic Dysfunction. US Department of Health and Human Services. Public Health Service. Agency for Health Care Policy and Research; 1994, pp. 1–115. [ Links ]
4. Maisel AS, Krishnaswamy P, Nowak RM, McCord J, Hollander JE, Duc P, et al. Rapid measurement of B–type natriuretic peptide in the emergency diagnosis of heart failure. N Engl J Med 2002; 347: 161–167. [ Links ]
5. Marantz PR, Tobin JN, Wassertheil–Smoller S, Steingart RM, Wexlet JP, Budner N, et al. The relationship between left–ventricular systolic function and congestive heart failure diagnosed by clinical criteria. Circulation 1988; 77: 607–612. [ Links ]
6. Mattleman SJ, Hakki A, Iskandrian AS, Segal BL, Kane SA. Reliability of bedside evaluation in determining leftventricular function: correlation with left–ventricular ejection fraction determined by radionuclide ventriculography. J Am Coll Cardiol 1983; 1: 417–420. [ Links ]
7. Wilson JR, Rayos G, Yeoh TK, Gothard P, Bak K. Dissociation between exertional symptoms and circulatory function in patients with heart failure. Circulation 1995; 92: 47–53. [ Links ]
8. Ortega J. Capacidad de ejercicio y consumo de oxígeno en falla cardíaca. Rev Colomb Cardiol 2000; 3: 95–102. [ Links ]
9. Working Group on Cardiac Rehabilitation & Exercise Physiology and Working Group on Heart Failure of the European Society of Cardiology. Recommendations for exercise testing in chronic heart failure patients. Eur Heart J 2001; 22: 37–45. [ Links ]
10. Working Group on Cardiac Rehabilitation & Exercise Physiology and Working Group on Heart Failure of the European Society of Cardiology. Recommendations for exercise training in chronic heart failure patients. Eur Heart J 2001; 22: 125–135. [ Links ]
11. American Thoracic Society/American College of Chest Physicians. ATS/ACCP Statement on Cardiopulmonary Exercise Testing. Am J Respir Crit Care Med 2003; 167: 211–277. [ Links ]
12. Weber K, Janicki J. Cardiopulmonary exercise testing: physiologic principles and clinical applications. Philadelphia: WB Saunders; 1986, pp 238–243. [ Links ]
13. Van den Broek SAJ, van Veldhuisen DJ, de Graeff PA, Landsman MLJ, Hillege H, Lie KI. Comparison between New York Heart Association classification and peak oxygen consumption in the assessment of functional status and prognosis in patients with mild to moderate congestive heart failure secondary to ischemic or idiopathic dilated cardiomyopathy. Am J Cardiol 1992; 70: 359–363. [ Links ]
14. Consejo Nacional de Falla Cardiaca de la Sociedad Colombiana de Cardiología. 'Guías Colombianas sobre Evaluación y Manejo de la Falla Cardíaca Crónica del Adulto'. Revista Colombiana de Cardiología 2007; 5: (suplemento) 5–41. [ Links ]
15. Mancini DM, Eisen H, Kussmaul W, Mull R, Edmunds LH Jr, Wilson JR. Value of peak oxygen consumption for optimal timing of cardiac transplantation in ambulatory patients with heart failure. Circulation 1991; 83: 778–786. [ Links ]
16. Corrá U, Mezzani A, Bosimini E, Giannuzzi P. Cardiopulmonary exercise testing and prognosis in chronic heart failure. Chest 2004; 126: 942–950. [ Links ]
17. Wasserman K, Beaver WL, Whipp BJ. Gas exchange theory and the lactic acidosis threshold. Circulation 1990; 81: II14–II30. [ Links ]
18. Piña I. Cardiopulmonary exercise testing. En: Pashkow FJ, Dafeo WA, eds. Clinical Cardiac Rehabilitation. A cardiologist’s guide. Baltimore: Williams & Wilkins; 1999, pp. 102–123. [ Links ]
19. Mezanni A, Corra U, Bosimini E, Giordano A, Giannuzzi P. Contribution of peak respiratory exchange ratio to peak VO2 prognostic reliability in patients with chronic heart failure and severely reduced exercise capacity. Am Heart J 2003; 145: 1102–1107. [ Links ]
20. Opasich C, Pinna GD, Bobbio M, Sisti M, Demichelis B, Febo O, et al. Peak oxygen consumption in chronic heart failure: toward efficient use in the individual patient. J Am Coll Cardiol 1998; 31: 766–775. [ Links ]
21. Costanzo MR, Augustine S, Bourge R, Bristow M, O'Connell JB, Driscoll D, et al. Selection and treatment of candidates for heart transplantation. Circulation 1995; 92: 3595–3612. [ Links ]
22. Stevenson LW, Steimle AE, Fonarow G, Kermani M, Kermani D, Hamilton MA, et al. Improvement in exercise capacity of candidates awaiting heart transplantation. J Am Coll Cardiol 1995; 25: 163–170. [ Links ]
23. Grigioni F, Barbieri A. Magnani G, Potena L, Coccolo F, Boriani G, et al. Serial versus isolated assessment of clinical and instrumental parameters in heart failure: prognostic and therapeutic implications. Am Heart J 2003; 146: 298–303. [ Links ]
24. Milani R, Lavie C, Mehra MR. Cardiopulmonary exercise testing. How to differentiate the cause of dyspnea? Circulation 2004; 110: e27–e31. [ Links ]
25. Osman AF, Mehra MR, Lavie CJ, Nunez E, Milani RV. The incremental prognostic importance of body fat adjusted peak oxygen consumption in chronic heart failure. J Am Coll Cardiol 2000; 36: 2126–2131. [ Links ]
26. Stelken AM, Younis LT, Jennison SH, Miller DD, Miller LW, Shaw LJ, et al. Prognostic value of cardiopulmonary exercise testing using percent achieved of predicted peak oxygen uptake for patients with ischemic and dilated cardiomyopathy. J Am Coll Cardiol 1996; 27: 345–352. [ Links ]
27. Osada N, Chaitman BR, Miller LW, Yip D, Cishek MB, Wolford TL, et al. Cardiopulmonary exercise testing identifies low risk patients with heart failure and severely impaired exercise capacity considered for heart transplantation. J Am Coll Cardiol 1998; 31: 577–582. [ Links ]
28. Kleber FX, Waurick P, Winterhalter M. CPET in heart failure. Eur Heart J 2004; 6: D1–D4. [ Links ]
29. Lainchbury JG, Richards AM. Exercise testing in the assessment of chronic congestive heart failure. Heart 2002; 88: 538–543. [ Links ]
30. Corra U, Giordano A, Bosimini, Mezzani A, Piepoli M, Coats AJS, et al. Oscillatory ventilation during exercise in patients with chronic heart failure: clinical correlates and prognostic implications. Chest 2002; 121: 1572–1580. [ Links ]
31. Chua TP, Ponikowski P, Harrington D, Ankers SD, Webb–Peploe K, Clark AL, et al. Clinical correlates and prognostic significance of the ventilatory response to exercise in CHF. J Am Coll Cardiol 1997; 29: 1585–1590. [ Links ]
32. Kleber FX, Vietzke G, Wernecke KD, Bauer U, Opitz C, Wensel R, et al. Impairment of ventilatory efficiency in heart failure: prognostic impact. Circulation 2000; 101: 2803–2809. [ Links ]
33. Francis DP, Shamin W, Ceri Davies L, Piepoli MF, Ponikowski P, Anker SD, et al. Cardiopulmonary exercise testing for prognosis in chronic heart failure: continuous and independent prognostic value from VE/VCO2 slope and peak VO2. Eur Heart J 2000; 21: 154–161. [ Links ]
34. MacGowan GA, Janosko K, Cecchetti A, Murali S. Exercise related ventilatory abnormalities and survival in congestive heart failure. Am J Cardiol 1997; 79: 1264–1266. [ Links ]
35. Robbins M, Francis G, Pashkow FJ, Snader CE, Hoercher K, Young JB, et al. Ventilatory and heart rate response to exercise: better predictors of heart failure mortality than peak oxygen consumption. Circulation 1999; 100: 2411–2417. [ Links ]
36. Piña I, Karalis DG. Comparison of four exercise protocols using anaerobic threshold measurement of functional capacity in congestive heart failure. Am J Cardiol 1990; 65: 1269–1271. [ Links ]
37. Gitt AK, Wasserman K, Kilkowski C, Anselm K, Kleemann T, Kilkowski A, et al. Exercise anaerobic threshold and ventilatory efficiency identify heart failure patients for high risk of early death. Circulation 2002; 106: 3079–3084. [ Links ]
38. Wolk R, Johnson BD, Somers VK, Allison TG, Squires R, Gau GT, et al. Effects of betablocker therapy on ventilator responses to exercise in patients with heart failure. J Card Fail 2005; 11: 333–339. [ Links ]
39. Australia/New Zealand Heart Failure Research Collaborative Group randomised, placebo–controlled trial of carvedilol in patients with congestive heart failure due to ischaemic heart disease. Lancet 1997; 349: 375–380. [ Links ]
40. Guazzi M, Agostoni P, Matturri M, Pontone G, Guazzi MD. Pulmonary function, cardiac function, and exercise capacity in a follow–up of patients with congestive heart failure treated with carvedilol. Am Heart J 1999; 138: 460–467. [ Links ]
41. Witte KKA, Thackray SDR, Nikitin NP, Cleland JGF, Clark AL. The effects of a– and b–blockade on ventilator responses to exercise in chronic heart failure. Heart 2003; 89: 1169–1173. [ Links ]
42. Wasserman KT, Hansen J, Sue D, Casaburi R, Whipp B. Principles of exercise testing and interpretation. Philadelphia: Lea & Febiger; 1999, pp 112–131. [ Links ]
43. Piepoli M, Corra U, Agostoni PG, Bellardinelli L, Cohen–Solal A, Hambrecht R, et al. Statement on Cardiopulmonary Exercise Testing in Chronic Heart Failure due to Left Ventricular Dysfunction. Recommendations for Performance and Interpretation. Part I: Definition of cardiopulmonary exercise testing parameters for appropriate use in chronic heart failure. Eur J Cardiovasc Prev Rehabil 2006; 13: 150–164. [ Links ]
44. Lamp B, Vogt J, Schmidt H, Horstkotte D. Impact of cardiopulmonary exercise testing on patient selection for cardiac resynchronisation therapy. Eur Heart J 2004; 6: D5–D9. [ Links ]
45. Stellbrink C, Auricchio A, Lemke B, von Scheidt W, Vogt J. Positionspapier zur kardialen Resynchronisationsationstherapie. Z Kardiol 2003; 92: 96–103. [ Links ]
46. Aaronson K, Schwartz JS, Chen T–M, WongK–L, Goin JE, Mancini DM. Development and prospective validation of a clinical index to predict survival in ambulatory patients referred for cardiac transplant evaluation. Circulation 1997; 95: 2660–2667. [ Links ]
47. Deng MC, De Meester JMJ, Smits JMA, Heinecke J, Scheld HH. Effect of receiving a heart transplant: analysis of a national cohort entered on to a waiting list, stratified by heart failure severity. BMJ 2000; 321: 540–545. [ Links ]
48. Ingle L. Theoretical rationale and practical recommendations for cardiopulmonary exercise testing in patients with chronic heart failure. Heart Fail Rev 2007; 12: 12–22. [ Links ]
49. Lam CSP, Redfield MM. Heart Failure with Normal Ejection Fraction. En: Hosenpud JD, Greenberg BH, eds. Congestive Heart Failure, 3rd ed. Philadelphia: Lippincot Williams & Wilkins; 2007, pp. 97–127. [ Links ]
50. Ingle L, Witte K, Cleland JGF, Clark A. Combining the ventilatory response to exercise and peak oxigen consumption is no better than peak oxygen consumption alone in predicting mortality in chronic heart failure. Eur J Heart Fail 2008; 10: 85–88. [ Links ]
51. Lozano JM, Cuervo LG. Desarrollo de guías de práctica clínica basadas en la evidencia. En: Ruiz A, Gómez C, Londoño D, eds. Investigación Clínica: Epidemiologia clínica aplicada. Santa Fe de Bogotá: Centro Editorial Javeriano; 2001. pp. 379–410. [ Links ]
Recibido: julio 25 de 2007
Aceptado: diciembre 10 de 2007
Dirección para correspondencia: calle 64 x carrera 51D, No 62–29, Medellín, Colombia. Teléfono: Oficina: (574) 516–74–03 mmbt@une.net.co