Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.21 no.2 Medellín Apr./June 2008
ARTÍCULO DE REVISIÓN
Reanimación del paciente quemado
Resuscitation of burned patients
Andrés Felipe Palacio Sánchez1, Marco Antonio Hoyos Franco2
1. Residente, Medicina de Urgencias, Universidad de Antioquia, Medellín, Colombia.
2. Cirujano Plástico, Unidad de Quemados, Hospital Universitario San Vicente de Paúl, Medellín, Colombia.
RESUMEN
Las quemaduras extensas pueden generar gran morbilidad y altas tasas de mortalidad determinadas tanto por las lesiones mismas como por la calidad de la reanimación inicial. Si esta es adecuada, puede prevenir la evolución hacia una mayor profundidad de la lesión primaria y, por ende, mejorar el pronóstico del paciente. El objetivo de esta revisión fue recopilar información que permita optimizar la atención del paciente quemado, con miras a obtener una disminución de la mortalidad y de las secuelas y complicaciones derivadas de una inadecuada reanimación. Se hizo una búsqueda en Internet, utilizando la base de datos Pubmed. Se usaron las palabras clave 'Resuscitation' y 'Burn', y se limitó la búsqueda a los artículos publicados después del año 2000. Se incluyeron además algunos artículos considerados de importancia para la comprensión del tema, publicados con anterioridad a ese año.
Palabras clave: Quemaduras, Reanimación
Summary
Extensive burns can cause significant morbidity and high mortality, determined by both the injuries themselves and the quality of the initial resuscitation measures applied to the patient. If adequate, such measures can prevent the worsening of the burn and, consequently, they can improve the prognosis for the patient. The objective of this review was to compile information that may help resuscitation teams to improve the care of burned patients, looking for lower mortality and less frequent sequels and complications. The Pubmed database was reviewed searching for studies made on the subject from 2000 to 2007, using the key words 'Resuscitation' and 'Burn'. Some articles published before 2000 were also included because they were considered relevant for understanding this subject.
Key words: Burns, Resuscitation
EPIDEMIOLOGÍA
Las estadísticas mundiales sobre quemaduras son imprecisas; en Estados Unidos, dependiendo de la fuente, se queman entre uno y dos millones de personas por año, de las cuales entre 54.000 y 180.000 requieren hospitalización y de 5.000 a 6.500 mueren como resultado de la quemadura o por sus complicaciones.1–4 La incidencia de quemaduras en Europa es desconocida aunque se calcula que cada año 1.000.000 de europeos reciben atención médica por quemaduras, incluyendo a 120.000 españoles y a 250.000 ingleses.5,6 En varios países los casos de quemaduras vienen disminuyendo gracias a la normatividad implementada, principalmente sobre seguridad laboral, y a las campañas educativas, como lo reporta la American Burn Association; el registro canadiense informa una disminución de los ingresos hospitalarios por quemaduras desde 56,8 en 1966, hasta 22,5 pacientes por 100.000 habitantes/año en 1989.7,8 Aun así, las quemaduras siguen siendo una causa importante de ingresos hospitalarios y de mortalidad por trauma en especial en la población pediátrica. El pico máximo de presentación de las quemaduras está en los primeros años de vida con un segundo período de aumento de la incidencia entre los 20 y 29 años.1
En el Reino Unido se han encontrado diferencias en los agentes etiológicos de las quemaduras entre las poblaciones adulta y pediátrica, a saber: son más frecuentes las lesiones por llamas en la población adulta (aproximadamente 48%) y las debidas a contacto con líquidos calientes en la población infantil (aproximadamente 60%).5 En Colombia son pocos los datos disponibles. 9,10
En el Hospital Universitario San Vicente de Paúl, de Medellín, Colombia,11 principal centro de referencia para los pacientes quemados en su zona de influencia, se realizó un estudio para determinar el perfil epidemiológico de los pacientes que ingresan a la institución y se encontró que estas lesiones son dos veces más frecuentes en los hombres que en las mujeres; en cuanto a la edad, el riesgo es mayor en personas entre 15 y 59 años, seguidas por los niños de 1 a 4 años. Los agentes etiológicos más frecuentes son los líquidos calientes, seguidos por las llamas y las quemaduras eléctricas. Los líquidos calientes son el principal agente etiológico en los pacientes de 14 años o menos mientras que las lesiones por llamas predominan en los mayores de 15 años.
FISIOPATOLOGÍA
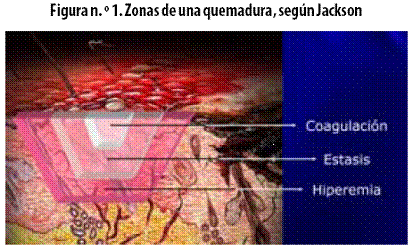
Para comprender la forma en que se pueden controlar los daños local y sistémico de los pacientes quemados con una adecuada reanimación, es necesario recordar algunos aspectos básicos de los cambios fisiopatológicos generados por las quemaduras: localmente se encuentran tres zonas que fueron descritas desde 1947 por Jackson, como lo cita Hettiaratchy12 (Figura n.° 1).
• Zona de coagulación: es el lugar donde se ha producido el daño directo, con una lesión de carácter irreversible, que no se modifica con la reanimación, debido a la coagulación de las proteínas constitutivas del tejido.
• Zona de estasis, isquémica o de congestión venosa: tiene la mayor importancia debido a que es en ella donde una reanimación adecuada puede tener mayor impacto. El tejido de esta zona es potencialmente recuperable porque en ella está disminuida la perfusión tisular, y el objetivo de la reanimación es incrementarla para evitar la progresión a un daño irreversible. Esta zona puede ser afectada adicionalmente por las condiciones que favorecen la hipoperfusión tisular tales como la hipotensión, los procesos infecciosos y el edema marcado, todo lo cual puede llevar a una pérdida tisular total.
• Zona de hiperemia: es la parte más externa de la lesión; en ella hay aumento de la perfusión tisular, y puede permanecer inalterada hasta finalizar el proceso de cicatrización.
Fisiopatología del edema
El edema es una de las principales características de las quemaduras, especialmente en los pacientes que han requerido reanimación con líquidos endovenosos. Demling13 hace una revisión extensa sobre su fisiopatología: se debe a la salida masiva de líquidos del espacio intravascular hacia el intersticio; si no se corrige apropiadamente puede llevar al paciente a un estado de hipovolemia, principalmente en las primeras horas posteriores a la lesión cuando el edema se forma más rápidamente. Además, en las lesiones circunferenciales, el edema favorece la hipoxia local asociada a un incremento de la presión tisular, que hará necesarias escarectomías y finalmente fasciotomías para aliviar la presión. El tratamiento intensivo con líquidos endovenosos puede mejorar el estado de hipovolemia, pero acentuar el proceso de edema. Aunque éste sea más intenso en las áreas comprometidas, es frecuente su aparición en tejidos no quemados (tejidos blandos, músculo, intestinos y pulmones).
La cantidad de líquido que pasa al espacio intersticial la determinan fuerzas físicas y las propiedades de los capilares y el intersticio, tal como lo describió Starling en 1896. La fuerza hidrostática en el espacio intravascular impulsa los fluidos desde los capilares hacia el intersticio, pero la presión oncótica producida por las proteínas plasmáticas los retiene en el espacio intravascular. De la misma forma, las fuerzas generadas en el espacio intersticial (oncótica e hidrostática) permiten el equilibrio de los líquidos entre el intersticio y el espacio intravascular para lo cual es fundamental preservar la integridad de la membrana capilar de modo que se mantenga su impermeabilidad a las proteínas plasmáticas conservando la presión oncótica del espacio intravascular.
Un marcado desequilibrio entre las fuerzas hidrostática y oncótica de Starling se observa en los pacientes quemados cuando ocurren los siguientes eventos:
• Aumento temprano de la resistencia vascular probablemente debido a la descarga del sistema nervioso simpático.
•Incremento en la distensibilidad (compliance) del espacio intersticial, por fragmentación del colágeno y del ácido hialurónico (componentes de la matriz extracelular), lo que permite la acumulación de líquido en este espacio.
•Aumento de la presión oncótica intersticial (por liberación de moléculas oncóticamente activas desde el tejido lesionado) generando un efecto de succión sobre el fluido que proviene del espacio intravascular.
•Incremento marcado y sostenido de la permeabilidad capilar a las proteínas plasmáticas en el tejido quemado que lleva a disminución de las mismas y de la presión oncótica plasmática, asociado a un incremento de las proteínas y la presión oncótica intersticiales.
•Incremento de la permeabilidad capilar del tejido no quemado generado por mediadores liberados desde el tejido quemado, especialmente oxidantes.
•Disminución de la presión oncótica plasmática que favorece la formación de edema en el tejido no quemado.
•Disminución del gradiente oncótico (presión oncótica plasmática – presión oncótica intersticial), lo que acentúa el edema por el desequilibrio de las fuerzas de Starling.13
A lo anterior se suman algunos eventos que favorecen la formación del edema:
•Después de quemaduras profundas ocurre oclusión de segmentos de los plexos dérmicos linfáticos superficial y profundo, que evita la reabsorción eficiente del líquido acumulado en el intersticio.
•Después de la quemadura se liberan grandes cantidades de radicales libres de oxígeno con lo que se supera la producción endógena de antioxidantes; son producidos principalmente por la reperfusión tisular y ocasionan daño endotelial que lleva a un incremento de la permeabilidad capilar y a fragmentación del ácido hialurónico y del colágeno, todo lo cual favorece el edema. La lesión por oxidantes se puede ver en la primera hora después de la quemadura que corresponde a la formación rápida del edema.14
•Presencia de células inflamatorias, principalmente de neutrófilos, que son otra fuente de liberación de oxidantes en el tejido quemado.
•Incremento del flujo sanguíneo local debido a la acción de la prostaciclina (PGI2), lo que acentúa la salida de líquido del espacio intravascular.13
•Liberación temprana de tromboxano (TxA2), que es un vasoconstrictor potente; se lo considera responsable, al menos en parte, de la disminución persistente del flujo sanguíneo en el tejido quemado (zona de isquemia).
•Liberación de bradiquininas por el tejido quemado, las cuales incrementan la permeabilidad vascular, principalmente en las vénulas.
•Inmediatamente después de la quemadura el tejido lesionado libera grandes cantidades de histamina, lo que favorece la permeabilidad de los capilares y vénulas a los fluidos y las proteínas.
El edema en el tejido no quemado, que se observa principalmente en pacientes con quemaduras mayores de 25% de la superficie corporal total, se debe al aumento de la conductividad hidráulica y de la permeabilidad capilar de dicho tejido, y a disminución de la presión oncótica plasmática.
Desde el punto de vista sistémico, una vez que la quemadura alcanza una extensión mayor de 25% de la superficie corporal total, la liberación de citoquinas y de otros mediadores inflamatorios desde el sitio de la lesión, puede generar cambios en diferentes órganos y sistemas;12,14,15 de ellos los más importantes son los siguientes:
•Cambios cardiovasculares: durante las primeras horas posteriores a la quemadura (con mayor intensidad durante las primeras 12 horas), la pérdida de líquidos y proteínas desde el espacio intravascular hacia el intersticio lleva a disminución progresiva de la presión arterial y a aumento de la frecuencia cardíaca. Además, en respuesta a estos cambios, se presenta una vasoconstricción esplácnica y periférica. Se cree que la liberación de factor de necrosis tumoral alfa genera una disminución de la contractilidad miocárdica, y una merma progresiva de la fracción de eyección y del gasto cardíaco, perpetuando el estado de hipotensión y de hipoperfusión tisular.
•Cambios metabólicos: en el paciente con quemaduras extensas se genera un aumento del metabolismo celular basal, hasta el triple de lo normal. El paciente desarrolla una acidosis metabólica secundaria al estado de hipoperfusión tisular.
•Cambios electrolíticos: aumento en la retención de sodio, agua y calcio dentro de las células, y pérdida de potasio de las mismas.
•Cambios respiratorios: constricción bronquial y síndrome de dificultad respiratoria aguda (SDRA).
•Cambios inmunológicos y hematológicos: se alteran la función de los macrófagos y la inmunidad celular y humoral, así como la coagulación.
EXTENSIÓN Y PROFUNDIDAD DE LA QUEMADURA
Para determinar cuándo un paciente quemado requiere reanimación es necesario evaluar adecuadamente la extensión y profundidad de sus lesiones.13,14
Extensión
La extensión de las quemaduras, evaluada primariamente por personal inexperto en cerca de 80% de los casos, es el principal determinante de la magnitud de la reanimación con líquidos endovenosos. La estimación de las áreas quemadas como porcentaje de la superficie corporal fue descrita inicialmente por Berkow en 1924, y actualmente existen varios métodos para calcularla; los más utilizados son la regla de los 9 y el método descrito por Lund y Browder.
– La regla de los 9, citada por Sheridan,16 es un método sencillo y ágil, que permite distinguir fácilmente los cambios de proporciones en la superficie corporal que se presentan en las diferentes edades de los pacientes, especialmente en los menores de 15 años en quienes se puede subestimar la superficie de la cabeza y sobrestimar la de las extremidades. Con este método usualmente se sobrestima la superficie corporal comprometida.
– El método de Lund y Browder17 permite determinar con mayor exactitud la superficie afectada, y tiene en cuenta los cambios en las proporciones según la edad de los pacientes. Sin embargo, su cálculo requiere mayor tiempo y disponer de las tablas para obtener los porcentajes de las áreas corporales según la edad del paciente.
– Superficie palmar:18–20 es otro método utilizado para calcular la superficie corporal afectada, especialmente en quemaduras de baja extensión. Se estima que la palma corresponde al 1% de la superficie corporal total. Sin embargo, esto es cierto solo en los niños, puesto que en los adultos tiene un valor cercano al 0,78% ± 0,08%, que puede variar con la edad, el índice de masa corporal y la población en la cual se aplica esta forma de medir; por ejemplo, los resultados pueden diferir entre los caucásicos y los chinos.21
Además de la edad, otros factores como la talla y el peso también modifican el cálculo de la superficie corporal quemada.16,21–28
La evaluación por personal inexperto de la superficie corporal afectada generalmente sobrestima la extensión de la quemadura, y solo es correcta en cerca de una tercera parte de los casos. Con los métodos comúnmente utilizados se ha encontrado que es frecuente sobrestimar las áreas afectadas pequeñas y subestimar las extensas.29 Infortunadamente una estimación inadecuada de la extensión de la quemadura lleva implícito un cálculo incorrecto de la cantidad de líquidos necesarios para la reanimación. Ashworth y colaboradores30 evaluaron retrospectivamente a 31 pacientes remitidos a las unidades especializadas en la atención de quemados en el Reino Unido. Encontraron que 14 habían sido sobrestimados (promedio de 9%, rango de 2–19%) y 13 subestimados (promedio de 7,5%, rango de 0,5–23%).
En un estudio llevado a cabo en el Hospital Universitario San Vicente de Paúl (HUSVP), de Medellín, en 2004, Hoyos y colaboradores31 compararon el diagnóstico de la extensión de la superficie corporal quemada hecho por el médico remitente, con los del médico del servicio de urgencias y el cirujano plástico de la unidad de quemados; incluyeron 329 pacientes y consideraron que el diagnóstico había estado errado cuando la estimación del médico remitente o del servicio de urgencias difería por exceso o defecto en más de 5% de la superficie corporal total (SCT) con respecto a la del cirujano plástico de la unidad de quemados. Se halló que el 18,8% de los pacientes remitidos con diagnóstico de quemadura no tenían cálculo de la superficie corporal afectada; el 31,8% habían tenido un diagnóstico con un promedio de 12,8% mayor que el real y en un 9% había habido infravaloración de la superficie quemada con un error promedio aproximado de 15%. En los pacientes que ingresaron directamente a la institución, se encontró que el servicio de urgencias había sobrevalorado la extensión de la quemadura en aproximadamente el 21% y la había infravalorado en el 6,7%.Este margen de error fue suficiente para que en la mayoría de esos pacientes mal valorados cambiara el grupo al cual pertenecía la quemadura (leve, moderada o grave).
En la actualidad se diseñan programas de computador que buscan simplificar la evaluación de la superficie quemada, incluso con modelos tridimensionales para lograr una mayor precisión.
Profundidad
Las quemaduras se clasifican en grados – primero, segundo y tercero – según su profundidad; a su vez, las de segundo grado se subdividen en superficiales y profundas. La clasificación de las quemaduras poco profundas y de las muy profundas no plantea, en general, mayores dificultades. El problema se presenta con las quemaduras de segundo grado, y la dificultad surge principalmente de la subjetividad del evaluador y de los cambios dinámicos presentes en el sitio de la quemadura durante las primeras 72 horas, influenciados por las condiciones de la reanimación (una cantidad suficiente de líquidos que permita recuperar la perfusión de la zona de estasis, pero que no sea excesiva como para ocasionar un edema tan intenso que haga disminuir la perfusión del tejido con isquemia secundaria); por lo tanto, la profundidad de las quemaduras puede aumentar por varios días más.14,15,32
FÓRMULAS PARA CALCULAR LOS LÍQUIDOS33
Las fórmulas mejor conocidas son las de Evans, Brooke, Brooke modificada, Parkland y Parkland modificada. Generalmente los cálculos se hacen según peso del paciente y la superficie corporal quemada.
Fórmula de Evans (1952)
• Primeras 24 horas: cristaloides 1 mL/kg/% de superfície corporal quemada, más coloides 1 mL/kg/% de superfície corporal quemada, más 2.000 mL de glucosa en agua.
•Luego de las primeras 24 horas: cristaloides 0,5 mL/kg/% de superficie corporal quemada, coloides 0,5 mL/kg/% de superficie corporal quemada, y la misma cantidad de glucosa en agua que en las primeras 24 horas.
Fórmula de Brooke
•Primeras 24 horas: lactato de Ringer (LR) 1,5 mL/kg/% de superficie corporal quemada, más coloides 0,5 mL/kg/% de superficie corporal quemada, más 2.000 mL de glucosa en agua.
•Luego de las primeras 24 horas: LR 0,5 mL/kg/% de superficie corporal quemada, más coloides 0,25 mL/kg/% de superficie corporal quemada y la misma cantidad de glucosa en agua de las primeras 24 horas.
Fórmula de Brooke modificada
•Primeras 24 horas: no se administran coloides. Cristaloides (LR) 2 mL/kg/% de superficie corporal quemada en el adulto y 3 mL/kg/% de superficie corporal quemada en niños.
•Luego de las primeras 24 horas: no se administran cristaloides. Coloides 0,3–0,5 mL/kg/% de superficie corporal quemada. Se adiciona la cantidad de glucosa en agua que sea necesaria para mantener un buen gasto urinario.
Fórmula de Parkland (la más ampliamente utilizada)
•Primeras 24 horas: no dar coloides. Lactato de Ringer 4 mL/kg/% de superficie corporal quemada en adultos y 3 mL/kg/% de superficie corporal quemada en niños. En estos últimos se adiciona lactato de Ringer para mantenimiento, según el peso, así: menos de10 kg: 4 mL/kg/hora; entre 10 y 20 kg, 40 mL/hora + 2 mL/kg/hora; por encima de 20 kg, 60 mL/hora + 1 mL/kg/hora.
•Después de las primeras 24 horas: coloides 20–60% del volumen plasmático calculado. No dar cristaloides. Se adiciona la cantidad de glucosa en agua que sea necesaria para mantener un buen gasto urinario: 0,5–1 mL/kg/hora en adultos y 1 mL/kg/hora en niños.
Fórmula de Parkland modificada
•Primeras 24 horas: lactato de Ringer 4 mL/kg/% de superficie corporal quemada en adultos.
•Luego de las primeras 24 horas: iniciar coloides en infusión con albúmina al 5%, 0,3–1 mL/kg/% de superficie corporal quemada.
REANIMACIÓN
Una vez que se han determinado la extensión y profundidad de la quemadura, se debe definir si el paciente requiere reanimación. La decisión de iniciarla con líquidos endovenosos depende de las circunstancias individuales: usualmente los adultos con quemaduras menores del 10% de la superficie corporal total (SCT) pueden no requerirla. Los que tienen quemaduras intermedias (11–20% de la SCT) necesitan alguna reanimación con líquidos, pero son fáciles de tratar. Por el contrario, los pacientes con quemaduras mayores del 20% de la SCT, y especialmente si superan el 40%, necesitan reanimación con líquidos endovenosos, idealmente utilizando monitorización hemodinámica invasiva.24 En los niños esta conducta es necesaria cuando la superficie afectada supera el 10%.5.El choque desencadenado por una quemadura extensa es de tipo distributivo, asociado a un estado de hipovolemia. El paciente con este tipo de lesiones requiere un tratamiento juicioso con líquidos endovenosos; al respecto ha habido por muchos años una gran controversia y se han hecho numerosos trabajos de investigación; como resultado hay diferentes corrientes, algunas de las cuales defienden el tratamiento intensivo con cristaloides y otra propone la utilización combinada de coloides y cristaloides; seguidamente se exponen los argumentos.
En el paciente quemado, como se describió previamente, se genera una pérdida dinámica de líquidos desde el espacio intravascular hacia un tercer espacio, lo que llevó al desarrollo de fórmulas para la reanimación según el cálculo de la superficie corporal afectada y el peso del paciente. Una de las fórmulas de mayor aceptación es la del Hospital de Parkland, descrita por Charles Baxter en 1968, basada en una serie de experimentos realizados en primates y perros quemados en los que se determinaba la cantidad de líquidos acumulada en los tejidos y posteriormente se calculaba el volumen requerido para la reanimación. Con este esquema de administración de líquidos se ha minimizado la ocurrencia del tradicionalmente llamado 'choque del quemado'.34 Sin embargo, diferentes estudios han demostrado que la reanimación con la fórmula de Parkland resulta insuficiente: Engrav y colaboradores, 35 en un estudio realizado en 28 centros de quemados, reportaron que en el 58% de los pacientes la reanimación con líquidos endovenosos excedió los 4 mL/kg /% de superficie corporal quemada que recomendaba Baxter.
La solución de lactato de Ringer (también conocida como solución de Hartmann) sigue siendo la de primera línea para reanimar al paciente quemado, pero su permanencia en el espacio intravascular es corta (solo 20–30% de los cristaloides permanecen dentro de este espacio),30 por lo que se requiere utilizar grandes volúmenes; con ellos disminuye la incidencia de falla renal, pero se facilitan complicaciones como el edema pulmonar agudo y las debidas al edema de los tejidos, entre ellas la hipertensión intrabdominal y el síndrome compartimental abdominal,36,37 con lo que aumentan la necesidad de soporte ventilatorio y de fasciotomías.37,38
Otro aspecto importante para la administración de los líquidos es la velocidad de infusión. Podría esperarse que en estos pacientes sea necesaria una administración intensiva de los mismos, pero los bolos rápidos de líquidos aumentan la presión hidrostática intravascular llevando a una mayor pérdida de líquido desde este espacio.15,39
Debido a las complicaciones antes mencionadas, secundarias a la utilización de grandes volúmenes de cristaloides, surgió la alternativa de utilizar solución salina hipertónica (NaCl al 7,5%), con el argumento de que permite restablecer rápidamente la presión arterial, el gasto cardíaco y la perfusión cerebral debido a su capacidad de expandir el volumen circulante por reabsorción de líquido desde el espacio intersticial; como resultado de ello se requiere infundir un volumen menor para reanimar al paciente y se evita el desarrollo de un edema tisular exagerado y de los problemas relacionados con él como el síndrome compartimental abdominal. Por más de 30 años se ha evaluado el uso de soluciones salinas hipertónicas en la reanimación de pacientes quemados. Sin embargo, los datos clínicos de su efectividad para prevenir el daño orgánico son contradictorios; en efecto, hay estudios en los que no se encontraron beneficios con su utilización, y sí un aumento en la presencia de falla renal e incluso de la tasa de mortalidad. Además, faltan estudios para demostrar realmente sus beneficios y estandarizar el volumen y el tiempo durante el cual deba ser utilizada. Por estas razones la solución salina hipertónica no se utiliza en la actualidad de forma rutinaria para la reanimación de pacientes quemados.34,37
Otra corriente defiende la utilización de coloides como la albúmina con el argumento de que al mejorar la presión oncótica intravascular mejora el volumen en este compartimiento y de esta forma disminuye la necesidad de administrar grandes volúmenes, se minimiza la ganancia temprana de peso en comparación con la del paciente reanimado con cristaloides, se mantiene el volumen urinario y se protege contra el síndrome compartimental abdominal; 38,40 infortunadamente los estudios han demostrado que la utilización de coloides en la fase temprana del tratamiento de las quemaduras puede hacer aumentar la tasa de mortalidad,15 por cuya razón se ha propuesto utilizar cristaloides en la fase temprana, y combinarlos posteriormente con coloides, de la siguiente manera: lactato de Ringer 2 mL/kg/% de superficie corporal quemada para administrar en las primeras 6 horas posquemadura; luego continuar con 1 mL/kg/% de superficie corporal quemada de cristaloides y 1 mL/kg/% de superficie corporal quemada de coloides administrados en las 18 horas siguientes.38
Una revisión sistemática de estudios clínicos aleatorizados que evaluaron la utilización de albúmina humana en pacientes críticamente enfermos fue publicada en Cochrane41 en 1998. En ella se incluyeron 30 ensayos clínicos, con un total de 1.419 pacientes en estado de hipovolemia, bien fueran quemados o con hipoalbuminemia, con el objetivo de comparar la tasa de mortalidad de los pacientes a quienes se les administraba albúmina con la de quienes recibían cristaloides. Se encontró que los pacientes tratados con albúmina presentaron mayor riesgo de muerte que los tratados con cristaloides. Específicamente en los pacientes quemados, de los cuales solo se incluyeron 3 trabajos con un total de 163 pacientes, solo en uno, que incluyó 14 pacientes, se halló tendencia favorable con la utilización de la albúmina (1 muerte entre los 7 pacientes en el grupo de intervención con albúmina, y dos muertes entre los 7 pacientes en el grupo de control, o sea, los que no recibieron albúmina), con un riesgo relativo de 0,50 (0,06 a 4,33); en los otros dos trabajos se vio una tendencia desfavorable con la utilización de albúmina: el primero de ellos incluyó 79 pacientes (con 11 muertes entre los 40 pacientes del grupo de intervención y 3 entre los 39 del grupo control) (riesgo relativo: 3,57; 1,08–11,85); el segundo incluyó 70 pacientes (con 7 muertes entre los 34 pacientes del grupo de intervención y 3 entre los 36 del grupo control) (riesgo relativo: 2,47; 0,69–8,79). El riesgo relativo de muerte para el total de pacientes quemados incluidos en esta revisión, después de utilizar albúmina fue de 2,40 (1,11–5,19). Por tanto, no hay evidencia de que la albúmina reduzca la tasa de mortalidad de los pacientes quemados en estado crítico, y por el contrario, es fuertemente sugestiva de que puede incrementar la mortalidad.41
Un metanálisis publicado en 200142 incluyó 55 investigaciones con un total de 3.504 pacientes, de las cuales solo 4 fueron ensayos clínicos con pacientes quemados. En este grupo, con un total de 197 pacientes se encontraron 24 muertes entre los 95 pacientes querecibieron terapia con albúmina, y 15 entre los 102 del grupo control (lactato de Ringer en 2 estudios, cristaloide hipertónico o Hartmann en otro y en el cuarto estudio albúmina para mantener un nivel sérico de la misma de 15 g/L, este último comparado con un régimen de albúmina que procura mantener el nivel de la misma entre 25–35 g/L generando un riesgo relativo de 1,76 (0,97–3,17).
En el estudio SAFE37 publicado en 2004, multicéntrico, con distribución aleatoria, doble ciego, se comparó el efecto de la reanimación con albúmina al 4% y con solución salina, evaluando como desenlace la mortalidad de los pacientes en 16 unidades de cuidado intensivo, durante los primeros 28 días. Se incluyeron 6.997 pacientes, de los cuales 3.497 fueron asignados a recibir albúmina y 3.500 a recibir suero salino. Los grupos tenían características de base similares. Hubo 726 muertes en el grupo tratado con albúmina y 729 en el grupo que recibió solución salina (con un riesgo relativo de muerte de 0.99; 95% de intervalo de confianza: 0,91–1,09; p = 0,87). La proporción de daño de órgano único o múltiple fue similar en los 2 grupos. Infortunadamente, los pacientes para el tratamiento de quemaduras fueron excluidos de esta investigación.
Cooper y colaboradores43 en un estudio multicéntrico publicado en 2006, en el que incluyeron 42 pacientes, compararon la reanimación con albúmina al 5% frente a lactato de Ringer en pacientes quemados; como efectos finales evaluaron la disfunción orgánica y la tasa de mortalidad y no encontraron diferencias significativas entre los dos grupos.
En un estudio de casos y controles, Cochran y colaboradores44 compararon un grupo de pacientes en quienes fue necesario administrar albúmina para la reanimación, debido a su alto requerimiento de líquidos, con otro grupo en el que no se utilizó albúmina; reportaron que los pacientes del primer grupo tenían en promedio un nivel inicial más alto de lactato sérico y requirieron más tiempo y mayor volumen de líquidos para la reanimación. En este estudio no se hallaron diferencias significativas entre los dos grupos en cuanto a la mortalidad.
La reanimación por vía enteral es una opción interesante para el tratamiento de los pacientes quemados, que ha sido evaluada en modelos animales pero a la que aún le faltan estudios en seres humanos. El proponerla se basa en que un porcentaje significativo de los pacientes quemados no tienen acceso temprano al tratamiento médico y a la terapia endovenosa. Parece que es un método seguro y efectivo que podría lograr beneficios adicionales como el mantenimiento de la integridad del intestino por mejoría de su flujo sanguíneo, evitando así el desarrollo de un proceso séptico y la falla orgánica múltiple secundaria. Falta optimizar un compuesto para la utilización por vía enteral y definir el volumen y la velocidad de utilización.
MONITORIZACIÓN
Se utiliza el término 'choque compensado' para describir las situaciones en que la perfusión tisular sigue siendo inadecuada a pesar de que se hayan normalizado la presión arterial, la frecuencia cardíaca y el gasto urinario; tal situación puede ser frecuente a raíz de traumatismos mayores. Tradicionalmente se han utilizado el gasto urinario y la presión arterial como variables para monitorizar la reanimación; sin embargo, en décadas recientes ha sido de mayor utilidad para ese propósito, en pacientes en estado crítico, medir las presiones de llenado cardíaco y la entrega de oxígeno.14
Las variables hemodinámicas recomendadas para orientar la reanimación del paciente quemado son las siguientes: signos vitales (presión arterial, frecuencia cardíaca, llenado capilar), gasto urinario, lactato sérico o déficit de base, presión venosa central o presión de cuña pulmonar y gasto cardíaco (con medición de la entrega y del consumo de oxígeno)45, algunos de estos utilizados como predictores de mortalidad 46.
En pacientes críticamente enfermos se ha utilizado la tonometría gástrica para evaluar el estado de la perfusión esplácnica, pues se trata de una manera adicional de determinar cuáles pacientes se encuentran en hipovolemia. Sin embargo, Holm y colaboradores47 no lograron demostrar que esta técnica diera información adicional a la suministrada por los parámetros utilizados para monitorizar el estado circulatorio del paciente en choque por quemadura, y concluyeron que la tonometría gástrica no mejora la capacidad para anticipar y revertir el metabolismo anaerobio regional durante el choque por quemadura y que no se recomienda su uso rutinario en estos pacientes.
En modelos animales se han evaluado otros métodos no invasivos como la ecografía doppler de alto poder y se ha observado una disminución significativa del flujo sanguíneo de la corteza renal en presencia de choque ocasionado por quemaduras extensas, así como mejoría del mismo después de la reanimación con líquidos; sin embargo, no se ha encontrado una adecuada correlación de estos cambios con el gasto urinario; es entonces un método promisorio para evaluar si está siendo adecuada la reanimación de pacientes en choque por quemaduras extensas.48
Considerando que gran cantidad de publicaciones recientes coinciden en afirmar que la utilización de las fórmulas para la reanimación con líquidos endovenosos puede ser insuficiente en pacientes con quemaduras extensas, Holm y colaboradores,49 en un estudio prospectivo de distribución aleatoria, compararon la reanimación con la terapia considerada estándar (utilizando el cálculo de los líquidos endovenosos con la fórmula de Parkland) y la llevada a cabo con líquidos endovenosos orientada por la monitorización invasiva, calculando el volumen sanguíneo intratorácico por la técnica de termodilución en pacientes en choque por quemadura. La infusión de líquidos durante las primeras 24 horas luego de la quemadura fue significativamente diferente entre los dos grupos: los del grupo control recibieron en promedio 16.232 mL (8.000–33.000) de líquidos, mientras que los reanimados bajo monitorización invasiva recibieron un promedio de 27.064 mL (12.000–44.000). La tasa de mortalidad fue de 40% en los primeros y de 32% en los segundos (p = 0,556); la incidencia de falla renal fue de 40% en el grupo control y de 32% en el grupo con monitorización hemodinámica (p = 0,771); la falla orgánica múltiple ocurrió en 40% en ambos grupos (p = 1,00).
Según lo anterior, es necesario investigar más para comprobar si es realmente benéfica la monitorización invasiva de los pacientes con quemaduras extensas.
COMPLICACIONES DE LA REANIMACIÓN CON CRISTALOIDES Y COLOIDES
Entre las complicaciones generadas por los grandes volúmenes que se administran cuando se utilizan cristaloides están el edema pulmonar agudo, la hipertensión abdominal y el síndrome compartimental abdominal; en cuanto a los coloides y las soluciones hipertónicas, la complicación más frecuente es la falla renal.39
El síndrome compartimental abdominal es una de las complicaciones de la reanimación cuando se administran grandes cantidades de líquidos; puede llegar a ser letal y consiste en el aumento de la presión en el interior del abdomen que es un espacio anatómico cerrado, lo cual favorece la hipoperfusión de los órganos intrabdominales afectando su función y viabilidad. Se manifiesta con aumento de la presión intrabdominal y de la presión inspiratoria pico (lo que genera mayores dificultades para la ventilación) y con oliguria. Algunos estudios han reportado que su frecuencia es cercana al 70% en pacientes con quemaduras extensas.50, 51
Oda y colaboradores52 compararon la reanimación con solución hipertónica y con lactato de Ringer en 36 pacientes adultos con quemaduras extensas; observaron que el grupo tratado con solución hipertónica requirió menor volumen que el calculado por la fórmula de Parkland (3,1 ± 0,9 mL/24 horas/kg/% de la superficie corporal quemada), mientras que los pacientes tratados con lactato de Ringer requirieron un volumen mayor que el calculado por dicha fórmula (5,2 ± 1,2 mL/24 horas/kg/% de superficie corporal quemada). Además, el 14% de los pacientes reanimados con solución hipertónica y el 50% de los reanimados con lactato de Ringer presentaron hipertensión abdominal. La presión inspiratoria pico fue marcadamente mayor en los pacientes que recibieron lactato de Ringer que en los tratados con solución hipertónica, lo que refleja una disminución de la distensibilidad (compliance) pulmonar en el primer grupo. Infortunadamente los autores no explicaron la metodología utilizada para el cálculo de la cantidad de los líquidos administrados ni los parámetros hemodinámicos y de disfunción orgánica que se tuvieron en cuenta en el estudio. Tampoco reportaron la tasa de mortalidad en los diferentes grupos, ni los datos de la osmolaridad sérica y de los electrólitos con los cuales se podría determinar la seguridad de la utilización de la solución hipertónica.
Cooper y colaboradores,43 en su estudio prospectivo aleatorizado, evaluaron la presión intrabdominal en pacientes con quemaduras mayores del 25% asociadas a afectación de la vía aérea por inhalación o con quemaduras mayores del 40%. Un grupo de pacientes fue reanimado con cristaloides utilizando la fórmula de Parkland y el segundo grupo recibió un régimen combinado de coloides (plasma) y cristaloides. Se encontró que el aumento de la presión intrabdominal fue mayor en el grupo reanimado con cristaloides, en el cual, además, se requirió un mayor volumen de líquidos; no se encontró diferencia en la tasa de mortalidad de los pacientes en los dos grupos; además, los autores no evaluaron el daño de órganos lo cual puede ser más importante que determinar solamente el aumento de la presión intrabdominal.
CONCLUSIONES
La reanimación aguda de los pacientes quemados es un factor crítico que tiene una marcada influencia en su morbilidad y mortalidad. La evaluación correcta de la extensión quemada es fundamental para el buen cálculo de los líquidos requeridos para la reanimación. Aunque se dispone de muchas fórmulas para dicho cálculo, la de Parkland es la más utilizada actualmente, aunque parece que se queda corta en garantizar un volumen adecuado de líquidos para la reanimación. A pesar de la gran cantidad de estudios dirigidos a la búsqueda del esquema ideal de reanimación, este aún no existe, y las fórmulas que se utilizan actualmente son solo un punto de partida para orientar la reanimación; en definitiva, estas fórmulas deberán ser complementadas con la información que brinda la respuesta del paciente a la administración de los líquidos; para ello son importantes sus constantes vitales, el gasto urinario y el apoyo del laboratorio en la medición de parámetros como los gases arteriales y el lactato sérico. Esto permitirá mantener un equilibrio en las cantidades de líquidos administrados recordando que si son muy bajas podrán persistir tejidos hipoperfundidos y si son exageradas favorecerán la presencia de edema con hipoxia en los tejidos edematizados lo que empeora el estado local de la quemadura y produce afectación sistémica. No hay evidencia clínica que sugiera que el uso de coloides mejore las tasas de morbilidad y mortalidad de los pacientes quemados y la literatura disponible no es clara en reconocer los beneficios de la reanimación con soluciones hipertónicas.
REFERENCIAS BIBLIOGRÁFICAS
1. Edlich RF, Martin ML, Long WB. Thermal Burns. En: Marx J, Hockberger R, Walls R, eds. Rosen's Emergency Medicine, 6ª ed. Philadelphia: Elsevier Mosby; 2006: 913–929. [ Links ]
2. Robson M, Burns B, Smith D. Acute management of the burned patient. Plast Reconstr Surg 1992; 89: 1155–1166. [ Links ]
3. Sheridan R. Burns. Crit Care Med 2002: 30 (Suppl.): S500–514. [ Links ]
4. Brigham PA, McLoughlin E. Burn incidence and medical care use in the United States. Estimates, trends, and data sources. J Burn Care Rehabil 1996; 17: 95–107. [ Links ]
5. Benson A, Dickson WA, Boyce DE. Burns. Brit Med J 2006; 332; 649–652. [ Links ]
6. Fernández E, Gálvez L, Fernández J, Gómez E, Salinas J. Epidemiology of burns in Málaga, Spain. Burns 1997; 23; 323–332. [ Links ]
7. Arturson G. Analysis of severe disasters. En: Massellis M, Gunn S, eds. The Management of Mass Burn Casualties and Fire Disasters: Proceedings of the First International Conference on Burns and Fire Disasters. Dordrecht/Boston/London: Kluwer Academic Publishers; 1992: 24–33. [ Links ]
8. Rose J, Herndon D. Advances in the treatment of burn patients. Burns 1997; 23 (Suppl. 1): S19–S26. [ Links ]
9. Berrocal M, Mendoza E, Patrón A. Análisis estadístico de pacientes con quemaduras, asistidos en la consulta de urgencias del Hospital Universitario de Cartagena (Colombia). Cir Plast Iberolatinamer 1998; 24: 403–407. [ Links ]
10. Polo J, Castaño A. Estudio retrospectivo de 425 pacientes quemados, Hospital Universitario San Vicente de Paúl, Medellín. En: Libro publicado con motivo de los 25 años de fundación del Servicio de Cirugía Plástica de dicho hospital. Medellín: Editec 1979: 97–102. [ Links ]
11. Hoyos M, Gonzales N, Díaz M, Pardo S, Ospina S. Epidemiological and clinical profile of burn victims, Hospital Universitario San Vicente de Paúl, Medellín, 1994–2004. Burns 2006; 32: 1044–1051. [ Links ]
12. Hettiaratchy S, Dziewulski P. Pathophysiology and types of burns. Brit Med J 2004; 328; 1427–1429. [ Links ]
13. Demling R. The burn edema process: Current concepts. J Burn Care Rehabil 2005; 26: 207–227. [ Links ]
14. Berger M, Bernath M, Chiolero R. Resuscitation, anaesthesia and analgesia of the burned patient. Curr Opin Anaesthesiol 2001; 14: 431–435. [ Links ]
15. Atiyeh B, Gunn W, Hayek S. State of the art in burn treatment. World J Surg 2005; 29: 131–148. [ Links ]
16. Sheridan R. Evaluating and managing burn wounds. Dermatol Nurs 2000; 12: 17–18, 21–28. [ Links ]
17. Lund C, Browder N. The estimation of areas of burns. Surg Gynecol Obstet 1944; 79: 352–358. [ Links ]
18. Amirsheybani HR, Crecelius GM, Tymothy NH, Pfeiffer M, Saggers GC, Manders EK. The natural history of the growth of the hand: I. Hand area as a percentage of body surface area. Plast Reconstr Surg 2001; 107: 726–733. [ Links ]
19. Nagel T, Schunk J. Using the hand to estimate the surface area of a burn in children. Pediatr Emerg Care 1997; 13: 254–255. [ Links ]
20. Berry M, Evison D, Roberts A. The influence of body mass index on burn surface area estimated from the area of the hand. Burns 2001; 27: 591–594. [ Links ]
21. Liao CY, Chen SL, Chou TD, Lee TP, Dai NT, Chen TM. Use of two–dimensional projection for estimating hand surface area of Chinese adults. Burns 2008; 34: 556–559. [ Links ]
23. Miller S, Finley R, Waltman M, Lincks J. Burn size estimate reliability: a study. J Burn Care Rehabil 1991; 12: 546–559. [ Links ]
24. Mertens D, Jenkins M, Warden G. Outpatient burn management. Nurs Clin N Am 1997; 32: 343–364. [ Links ]
25. Slattery DE, Schiller WR, Pollack CV Jr. A prospective comparison of burn size estimates by pre–hospital emergency medical personnel and burn surgeons to direct measurement. Presented at the 29th Annual Meeting of the American Burn Association, March 19–22, 1997, New York City, N.Y. Abstract; J. Burn Care and Rehabilitation 1997; 18: S93. [ Links ]
26. Nichter L, Williams J, Bryant C, Edlich R. Improving the accuracy of burn–surface estimation. Plast Reconstr Surg 1985; 76: 428–433. [ Links ]
27. Collins N, Smith G, Fenton O. Accuracy of burn size estimation and subsequent fluid resuscitation prior to arrival at the Yorkshire Regional Burns Unit. A three year retrospective study. Burns 1999; 25: 345–351. [ Links ]
28. Hammond J, Ward C. Transfers from emergency room to burn center: errors in burn size estimate. J Trauma 1987; 27: 1161–1165. [ Links ]
29. Freiburg C, Igneri P, Sartorelli K, Rogers F. Effects of differences in percent total body surface area estimation on fluid resuscitation of transferred burn patients. J Burn Care Res 2007; 28: 42–48. [ Links ]
30. Ashworth H, Cubison T, Gilbert M, Sim K. Treatment before transfer: the patient with burns. Emerg Med J 2001; 18; 349–351. [ Links ]
31. Hoyos M, Jaramillo N, Molina M, Valverde S, Posso C. Evaluación de la superficie corporal quemada en pacientes del Hospital Universitario San Vicente de Paúl, Medellín, 2004. Iatreia 2007; 20: 21–28. [ Links ]
32. Hettiaratchy S, Papini R. Initial management of a major burn: II. Assessment and resuscitation. Brit Med J 2004; 329; 101–103. [ Links ]
33. Fodor L, Fodor A, Ramon Y, Shoshani O, Rissin Y, Ullmann Y. Controversies in fluid resuscitation for burn management: Literature review and our experience. Injury 2006; 37: 374–379. [ Links ]
34. Ipaktchi K, Arbabi S. Advances in burn critical care. Crit Care Med 2006; 34 (Suppl.): S239–S244. [ Links ]
35. Engray LH, Colescott PL, Kemalvan N, Heimbach DM, Gibran NS, Solem LD, et al. A biopsy of the use of the Baxter formula to resuscitate burns or do we do it like Charlie did it? J Burn Care Rehabil 2000; 21: 91–95. [ Links ]
36. Pruitt B Jr. Does hypertonic burn resuscitation make a difference? Crit Care Med 2000; 28: 277–278. [ Links ]
37. The SAFE Study Investigators. A comparison of albumin and saline for fluid resuscitation in the intensive care unit. New Engl J Med 2004; 350: 2247–2256. [ Links ]
38. Gueugniaud P, Carsin H, Bertin–Maghit M. Current advances in the initial management of major thermal burns. Intensive Care Med 2000; 26: 848–856. [ Links ]
39. Monafo W. Initial management of burns. New Engl J Med 1996; 335; 1582–1586. [ Links ]
40. O'Mara M, Slater H, Goldfarb W, Caushaj P. A prospective, randomized evaluation of intra–abdominal pressures with crystalloid and colloid resuscitation in burn patients. J Trauma–Injury Infection & Critical Care 2005; 58: 1011–1018. [ Links ]
41. Cochrane Injuries Group Albumin Reviewers. Human albumin administration in critically ill patients: systematic review of randomised controlled trials. Brit Med J 1998; 317: 235–240. [ Links ]
42. Wilkes M, Navickis R. Patient survival after human albumin administration. Ann Intern Med 2001; 135: 149–164. [ Links ]
43. Cooper A, Cohn S, Zhang H, Hanna K, Stewart T, Slutsky A, and the ALBUR Investigators. Five percent albumin for adult burn shock resuscitation: lack of effect on daily multiple organ dysfunction score. Transfusion 2006; 46: 80–89. [ Links ]
44. Cochran A, Morris S, Edelman L, Saffle J. Burn patient characteristics and outcomes following resuscitation with albumin. Burns 2007; 33: 25–30. [ Links ]
45. Ansermino M, Hemsley C. Intensive care management and control of infection. Brit Med J 2004; 329: 220–223. [ Links ]
46. Andel D, Kamolz L, Roka J, Schramm W, Zimpfer M, Frey M, et al. Base deficit and lactate: Early predictors of morbidity and mortality in patients with burns. Burns 2007; 33: 973–978. [ Links ]
47. Holm CH, Horbrand F, Mayr M, Henckel G, Muhlbauer W. Assessment of splanchnic perfusion by gastric tonometry in patients with acute hypovolemic burn shock. Burns 2006; 32: 689–694. [ Links ]
48. Kuwa T, Jordan B, Cancio L. Use of power Doppler ultrasound to monitor renal perfusion during burn shock. Burns 2006; 32: 706–713. [ Links ]
49. Holm C, Mayr M, Tegeler J, Horbrand F, Henckel G, Muhlbauer W, et al. A clinical randomized study on the effects of invasive monitoring on burn shock resuscitation. Burns 2004; 30: 798–807. [ Links ]
50. Ivy ME, Atweh NA, Palmer J, Possenti PP, Pineau M, D'Aiuto M. Intra–abdominal hypertension and abdominal compartment syndrome in burn patients. J Trauma 2000; 49: 387–391. [ Links ]
51. Greenhalgh DG, Warden GD. The importance of intraabdominal pressure measurements in burned children. J Trauma 1994; 36: 685–690. [ Links ]
52. Oda J, Ueyama M, Yamashita K, Inoue T, Noborio M, Ode Y, et al. Hypertonic lactated saline resuscitation reduces the risk of abdominal compartment syndrome in severely burned patients. J Trauma 2006; 60: 64–71. [ Links ]
Recibido: agosto 10 de 2007
Aceptado: septiembre 03 de 2007