Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.21 no.2 Medellín Apr./June 2008
ARTÍCULO DE REVISIÓN
Nefropatía inducida por medios de contraste radiológico yodados
Contrast–induced nephropathy
Jon Kepa Balparda Arias1, María Elizabeth Gaviria Barrera2
1. Estudiante de Medicina, monitor editorial de la Escuela de Ciencias de la Salud, traductor de la Revista Medicina UPB, miembro del Semillero de Investigaciones, SIFAM, Universidad Pontificia Bolivariana, Medellín, Colombia. jonbalparda@une.net.co
2. Estudiante de Medicina, miembro del Semillero de Investigaciones, SIFAM, Universidad Pontificia Bolivariana, Medellín, Colombia. elizapmp@gmail.com
RESUMEN
La nefropatía inducida por medios de contraste radiológico yodados (NIACR) es una causa relativamente común de insuficiencia renal aguda en el medio hospitalario, asociada a un aumento considerable en la morbilidad y la mortalidad secundarias. La comprensión de su fisiopatología multifactorial, es aún incipiente, por lo que se carece de agentes profilácticos específicos y efectivos. La única medida preventiva aceptada mundialmente es la hidratación con solución salina pero se están estudiando para ese propósito otros compuestos. En este artículo se revisan la epidemiología y patogénesis de la NIACR, así como los factores de riesgo y las estrategias de prevención.
Palabras clave: Falla renal, Insuficiencia renal aguda, Nefropatía por medios de contraste radiológico yodados
Summary
Contrast–induced nephropathy (CIN) is a relatively common cause of acute renal insufficiency in the hospital milieu. It has been associated with a considerable increase in morbidity and mortality, as well as in the length of hospital stay. Clearly, many factors are involved in the pathophisiology of this complication, whose understanding is far from complete; therefore, there is still a lack of specific and effective prophylactic agents. In this article we review the epidemiology and pathogenesis of CIN, as well as the risk factors and preventive strategies.
Key words: Nephropathy due to iodinated radiological contrast media, Renal failure, Renal insufficiency
La nefropatía inducida por medios de contraste radiológico yodados (NIACR) es una forma relativamente común de insuficiencia renal aguda (IRA),1 generada como complicación del uso de dichos medios de contraste, con fines diagnósticos o terapéuticos.2,3 Se trata de una enfermedad relativamente común, que se diagnostica como agente causal del 10–12% de los casos de IRA en pacientes hospitalizados.4
No se conocen con total certeza los mecanismos fisiopatológicos que desencadenan la NIACR; por eso, los enfoques preventivos y terapéuticos son aún incipientes, 5 y no se ha demostrado, con ningún medicamento o medida, protección suficiente contra este tipo de daño renal;6–10 la única excepción es la hidratación profiláctica con solución salina al 0,9% (SSN). Los factores de riesgo propuestos y estudiados para el desarrollo de la NIACR incluyen, entre otros, diabetes mellitus, enfermedad renal crónica (ERC) establecida, hipertensión arterial (HTA), insuficiencia cardíaca congestiva (ICC), anemia, enfermedad vascular periférica, edad de 70 años o más y cirrosis.4,11–14
Se define la NIACR como una disminución de la función renal total, que ocurre de dos a siete días después de la exposición del paciente a medios de contraste radiológico yodados,15 sin ninguna otra causa identificable de falla renal aguda.4,16 El criterio para hablar de disminución de la función renal es un aumento absoluto (0,5 mg/dL) o relativo (25%) del nivel de creatinina sérica,15–17 al comparar los valores obtenidos en las evaluaciones previa y posterior al procedimiento imaginológico; los valores máximos se obtienen por lo general 3–5 días después de la administración del agente. Es importante mencionar que no existe ningún biomarcador específico para esta enfermedad,4 por lo que su diagnóstico requiere la exclusión de otros tipos más evidentes y comunes de IRA en el paciente hospitalizado,18 tales como hipovolemia, choque cardiogénico (IRA prerrenal) u obstrucción del árbol urinario (IRA posrenal).
EPIDEMIOLOGÍA
Los medios de contraste radiológico yodados se utilizan anualmente en más de diez millones de procedimientos en Estados Unidos,19y se estima que la probabilidad de desarrollar NIACR en una persona que tenga uno o más de los factores de riesgo antes mencionados es de 20,7–23,3%20; este riesgo es más de diez veces mayor que el de una persona sin ninguna enfermedad de base (1,5–2%). De lo anterior se infiere que tener una o más enfermedades de base genera un riesgo relativo (RR) promedio de 12,4 de sufrir esta complicación con respecto a los pacientes control.
La NIACR es una entidad muy importante desde los puntos de vista económico y de morbilidad y mortalidad, porque incrementa el tiempo de estancia hospitalaria, la probabilidad de necesitar terapia de reemplazo renal, la incidencia de eventos cardiovasculares adversos y de muerte.5,21 Levy22 y colaboradores demostraron que la tasa de mortalidad en los pacientes que desarrollan NIACR en el ambiente hospitalario es de 22–37%. McCullog21 y colaboradores informaron una tasa de mortalidad a dos años de 81,2% en los pacientes que desarrollaron NIACR y requirieron diálisis temporal o permanente. Por último, en una cohorte de 602 individuos, Buouzas–Mosquera1 y colaboradores observaron que quienes desarrollaban IRA en el ambiente hospitalario, secundaria a cateterización cardíaca, tenían 5,97 veces más probabilidad de morir por cualquier causa que los pacientes del grupo sin dicha complicación.
PATOGÉNESIS
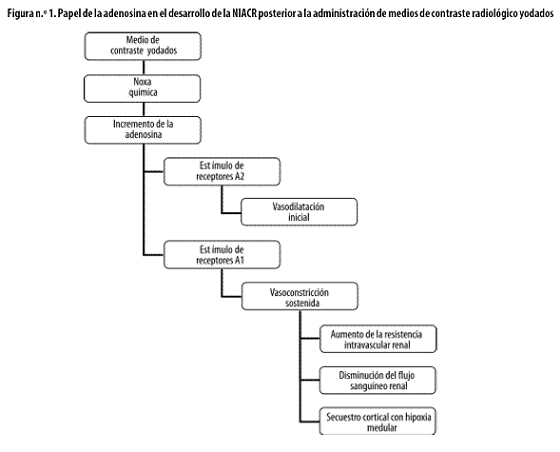
La patogénesis de esta complicación no está aún completamente entendida; el factor más frecuentemente imputado es, quizás, la alteración del flujo sanguíneo renal después de la administración del medio de contraste yodado5,12,23,24 Con respecto a su fisiopatología, parecen estar implicados varios mecanismos lesivos, pero los más claros son la vasoconstricción renal prolongada y el efecto tóxico directo sobre las células tubulares. Se ha encontrado que la respuesta renal frente a la administración de estos compuestos para contraste imaginológico es de naturaleza bifásica: primero se presenta una vasodilatación transitoria, que es seguida por una vasoconstricción prolongada.24 Lo anterior llevaría a tres procesos concomitantes esencialmente nocivos para la integridad celular de las nefronas: primero, un incremento marcado en la resistencia intravascular renal; segundo, una disminución del flujo sanguíneo renal total; por último, un 'secuestro' o derivación cortical de la poca sangre disponible; el resultado final es la hipoxia de la zona medular,5,24 que, debido a su fisiología basal, es muy sensible a las noxas que produzcan hipoxia.
Existen varias alteraciones intrarrenales y sistémicas a las que se les ha atribuido cierto papel en la fisiopatología de la IRA consecutiva a la administración de medios de contraste radiológico yodados. Quizás la más estudiada sea la fuerte elevación del nivel plasmático de adenosina,25,26 después de la administración de medios de contraste yodados, que estimula tanto receptores A2 (lo que induce vasodilatación inicial) como A1 (lo que lleva a vasoconstricción sostenida).24,26 Se considera que estos efectos antagónicos son los que inician la reacción bifásica inicial del riñón ante la noxa química (Figura n.º 1).
Otros estudios han reportado la génesis de radicales libres de oxígeno (peróxido de hidrógeno, anión superóxido y radicales hidroxilo) como un elemento importante de la fisiopatología en la NIACR,27 principalmente por mecanismos de daño directo a la membrana de la nefrona y de realcalinización citotóxica posisquémica.24 Esta teoría es la que ha llevado a proponer el uso de medicamentos antioxidantes, especialmente la N–acetilcisteína para la profilaxis de la NIACR; sin embargo, los resultados de los estudios y metanálisis han sido contradictorios.8,9,19,28–35
Un enfoque más profundo sobre la patogénesis de la NIACR se encuentra por fuera del alcance del presente escrito. Para el lector interesado en ahondar en el tema, es recomendable el artículo publicado en 2005 por Detrenis24 y colaboradores.
FACTORES DE RIESGO
Se han descrito varios factores de riesgo que aumentan la incidencia de la NIACR; los más importantes son la diabetes mellitus y la enfermedad renal crónica (ERC) de base.4,11–13 Parfrey y colaboradores36 describieron, en su artículo clásico de 1989, cómo en los pacientes que sufren concomitantemente de diabetes mellitus y ERC se cuadruplica el riesgo de desarrollar IRA después de la administración de medios de contraste yodados.
Los factores de riesgo descritos y comprobados hasta ahora en estudios bien controlados se encuentran en la tabla n.º 1.1,3–5,9,11,17,19,21,30,36–40
Se han hecho esfuerzos para diseñar protocolos que permitan identificar a los pacientes de más alto riesgo para desarrollar IRA secundaria a la administración de medios de contraste radiológico yodados de modo que se puedan iniciar terapias profilácticas más intensas. Bartholomew y colaboradores41 identificaron, en un estudio de 20.479 pacientes, ocho variables relacionadas estrechamente con el riesgo de desarrollar NIACR. La estratificación diseñada por este grupo de investigadores tenía en cuenta los siguientes elementos para calcular el riesgo de NIACR:
•Depuración de creatinina por debajo de 60 mL/min, estimada según la fórmula de Cockroft–Gault 42.
•Uso de balón intraórtico.
•Procedimiento cardíaco urgente.
•Diabetes mellitus.
•Insuficiencia cardíaca congestiva.
•Hipertensión arterial.
•Enfermedad vascular periférica.
•Volumen de líquido de contraste utilizado en el procedimiento.
En este grupo de estudio se encontró que el riesgo más alto de desarrollar NIACR era del 28%. Sin embargo, esta frecuencia está claramente subvalorada, puesto que en dicho estudio se utilizó como criterio para el diagnóstico de NIACR un aumento en la creatinina sérica de 1 mg/dL o más,41 es decir, el doble de lo que se acepta actualmente como valor normal.31
Seguidamente se presenta la ecuación de Cockcroft–Gault42 para estimar la depuración de creatinina de un paciente (dCr: depuración de creatinina; CrS: creatinina sérica; Kg: peso del paciente en kilogramos).
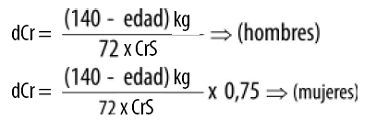
Es importante mencionar que, además de los factoresde riesgo relacionados con el paciente, se han descrito otros que tienen que ver con el tipo y la cantidad del medio de contraste yodado utilizado en el procedimiento imaginológico,5,37,38 principalmente la osmolaridad del mismo que implica un riesgo alto si es mayor de 1.200 mOsm/kg.19,38 Se han desarrollado compuestos de baja osmolaridad (300–500 mOsm/kg),5 pero, por su alto costo, no están disponibles en muchos centros asistenciales de baja y mediana complejidad. También se ha informado que la cantidad total de medio de contraste yodado administrada es un factor de riesgo para desarrollar NIACR. Bartolomew y colaboradores41 encontraron un riesgo relativo (RR) de 1,8 al administrar más de 240 mL en el mismo procedimiento, con respecto a pacientes que recibieron una cantidad por debajo de este límite. A pesar de que se ha estado trabajando desde hace casi dos décadas para encontrar una cantidad límite relacionada con el peso del paciente,43los datos experimentales para confirmarla son aún incipientes.
IDENTIFICACIÓN DE PACIENTES EN RIESGO
Aún no existen protocolos mundialmente aceptados para estratificar el riesgo de NIACR en distintos pacientes, 41,43 y no se considera que sea costo–efectiva la estrategia de hacer evaluación ni profilaxis extensas en todos los individuos que van a ser sometidos a procedimientos en los que se utilizan medios de contraste radiológico yodados.5
Las recomendaciones actuales incluyen hacer una anamnesis completa, con énfasis en los antecedentes patológicos personales y familiares, y un examen físico minucioso. Además de tener en cuenta la edad avanzada, si es del caso, se deben buscar principalmente la presencia de diabetes mellitus, ERC, HTA, ICC y deshidratación.19,28,44,45 A los pacientes con uno o más de estos factores de riesgo se les debe medir la creatinina sérica antes del estudio,5 con el fin de estimar su tasa de filtración glomerular (TFG).42 Si ésta se encuentra por debajo de 60 mL/min (ERC estadio 3 o más)46,47 se debe considerar que el paciente tiene un riesgo muy alto de desarrollar algún grado de IRA41 después de la administración del medio de contraste yodado, por lo que requiere un cuidadoso proceso profiláctico.5
PREVENCIÓN
Las medidas preventivas de la IRA secundaria a la administración de medios de contraste radiológico yodados se dividen en cuatro grupos principales, a saber: hidratación, vasodilatación, administración de antioxidantes y remoción extracorpórea del medio de contraste yodado.
Hidratación
Hasta la fecha, la hidratación del paciente es el único procedimiento profiláctico de aceptación general, a pesar de no haber sido evaluado en ningún tipo de ensayo clínico controlado.44 La recomendación inicial de hacerla se generó con base en teorías que planteaban que una ligera hipervolemia o por lo menos una euvolemia sostenida, ayudaría a aminorar algunos de los efectos hemodinámicos imputados en la fisiopatología de la NIACR, principalmente los que afectan el flujo tubular.5,24
Se ha propuesto la utilización de distintos compuestos, entre ellos la SSN, la solución salina hipotónica
(0,45%) y el bicarbonato de sodio.48–52 Sin embargo, aún no existe consenso acerca del tipo ideal de cristaloide que se debe utilizar, y la mayoría de los estudios aleatorizados no han demostrado que un compuesto u otro tenga mayor efecto preventivo de la NIACR. Solo dos estudios de tamaño considerable han demostrado algún grado de protección con datos extrapolables a la práctica clínica: Mueller y colaboradores,50 en un estudio de 1.620 pacientes, en el que se comparó la incidencia de IRA en un grupo hidratado con SSN frente a la de otro en el que se hizo un procedimiento profiláctico similar pero con solución salina hipotónica, encontraron porcentajes del 0,7 y el 2, respectivamente. Sin embargo, se ha cuestionado la validez de estos resultados,5 porque la incidencia de la complicación fue extremadamente baja en ambos grupos, y el índice de significancia estadística de los resultados (p = 0,04)50 estuvo en el límite de lo que se considera aceptable.
Se ha evaluado el uso de protocolos de hidratación por vía oral (VO) en vez de intravenosa (IV) y en ocasiones los resultados han sido contradictorios. Dos estudios (199853 y 200351), al comparar la hidratación con SSN por VO contra la IV, encontraron que la última era más eficiente que la primera en proteger al paciente contra la NIACR. Sin embargo, un estudio más reciente llevado a cabo en 2006 por Dussol y colaboradores54 contradijo estos resultados, al demostrar una incidencia muy similar de IRA tóxica en los grupos de hidratación oral (6,6%) y parenteral (5,2%).
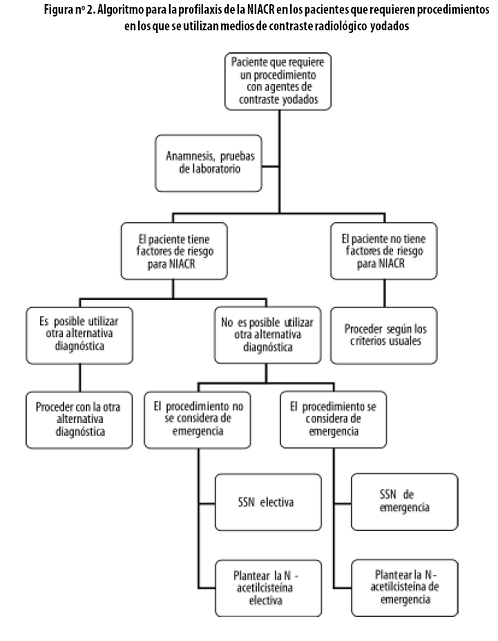
El protocolo actualmente aceptado para la hidratación profiláctica varía según que se trate de una intervención urgente o electiva, así:5
•Para una intervención urgente se inicia una hora antes del procedimiento con SSN a razón de 1 mL/kg/h, por vía parenteral, y se continúa a la misma dosis durante seis horas posintervención. Al finalizar, el paciente debe haber recibido un total de 7 mL de SSN por kilogramo de peso. La mayoría de los pacientes adultos reciben dosis totales entre 350 y 500 mL, a una tasa de 50 a 70 mL por hora ('SSN de emergencia', figura n.º 2).
•Si se trata de una intervención electiva, se debe comenzar seis a doce horas antes del procedimiento con SSN a la dosis de 3 mL/kg/h, por vía parenteral, y continuar por seis a doce horas, a la misma dosis, después de terminarlo. Al finalizar, el paciente debe haber recibido entre 36 y 72 mL de SSN por kilogramo de peso. Se deben vigilar los signos y síntomas de sobrecarga hídrica en pacientes con enfermedades graves de base. La tasa de infusión promedio para la mayoría de los pacientes adultos es de 150 a 200 mL por hora ('SSN electiva', figura n.º 2).
Vasodilatación
Se considera que la vasoconstricción, con la merma consecuente de la perfusión sanguínea renal, es uno de los elementos centrales de la fisiopatología de la NIACR.24 Por ello se ha propuesto la utilización de medicamentos vasodilatadores tales como la dopamina,55–58 el fenoldopam,59–62 y la teofilina.63–65 Sin embargo, ningún estudio ni metanálisis ha logrado demostrar un efecto protector valedero para ninguno de estos compuestos,5 por lo que no se recomienda usarlos. 44
Antioxidantes
La N–acetilcisteína (NAc) es el compuesto antioxidante más estudiado para prevenir la NIACR. Se desconoce su mecanismo protector, aunque se ha postulado su acción como 'barredor' de radicales libres,32 que evita el daño que estos producen sobre la fisiología renal.
Existen 26 estudios controlados y 12 metanálisis de los mismos, pero la interpretación de sus resultados ha sido difícil por la heterogeneidad de diseños metodológicos. Al–Ghonaim y Pannu5 informaron que su grupo encontró una disminución de la incidencia de NIACR con la administración de NAc, pero sin efectos sobre los riesgos de necesitar diálisis y de muerte. Los mismos autores sugirieron que la explicación para este fenómeno se podría extrapolar del estudio realizado por Hoffmann y colaboradores,66 en el cual se encontró que la administración oral de NAc reduce el nivel sérico de creatinina, pero no tiene ningún efecto sobre el de cistatina C, compuesto del que se ha demostrado que aumenta el riesgo de morbilidad del sistema cardiovascular. En la actualidad se utiliza en muchos centros clínicos el siguiente protocolo para la administración de NAc:5
•Para procedimientos de emergencia: NAc 150 mg/kg disueltos en 500 mL de SSN para perfundir antes de la intervención a una tasa de 1.000 mL/hora. Después del procedimiento se recomienda administrar 500 mg/kg en 500 mL de SSN a una tasa de perfusión de 125 mL/hora. ('Nacetilcisteína de emergencia', figura n.º 2).
•Para intervenciones electivas se prefiere utilizar la NAc por vía oral, 600–1.200 mg cada 12 horas, comenzando 24 horas antes del procedimiento y continuando hasta un total de cuatro dosis. En este caso cabe no olvidar la hidratación profiláctica para procedimientos electivos como se mencionó en el apartado correspondiente ('Nacetilcisteína electiva', figura n.º 2).
Sin embargo, aún falta más contundencia en los resultados de los estudios para que se pueda generar una recomendación clara con respecto a la utilización regular de este compuesto.44
RECOMENDACIONES
Otras recomendaciones que se han dado para prevenir la NIACR, incluyen:5
•Plantear, en pacientes de alto riesgo, opciones diagnósticas que no utilicen medios de contraste yodados.
•Asegurarse de que la medición más antigua de creatinina sérica del paciente no exceda de 7 días antes del procedimiento.
•De ser posible, descontinuar los medicamentos nefrotóxicos, tales como los antinflamatorios no esteroides y la metformina.
•Si están disponibles, utilizar medios de contraste yodados hiposmolares, tales como iodixanol (Visipaque®) o iotrolan (Isovist®). En caso contrario, administrar la menor cantidad posible de medios isosmolares.
AGRADECIMIENTOS
Los autores agradecen a la doctora María Margarita Agudelo Zuluaga, médica internista de la Clínica Universitaria Bolivariana, y al doctor John Mauricio Lopera, médico internista y nefrólogo del Hospital Pablo Tobón Uribe, por la concienzuda revisión del presente manuscrito. En memoria de N. B. H. (1988–2007).
REFERENCIAS BIBLIOGRÁFICAS
1. Bouzas A, Vásquez JM, Calvino R, Peteiro J, Florez X, Marzoa R, et al. Contrast–induced nephropathy and acute renal failure following emergent cardiac catheterization: incidence, risk factors, and prognosis. Rev Esp Cardiol 2007; 60: 1026–1034. [ Links ]
2. Ozcan EE, Gunen S, Akdeniz B, Akyildiz IZ, Senaslan O, Baris N, et al. Sodium bicarbonate, N–acetylcysteine and saline for prevention of radiocontrast–induced nephropathy; a comparison of 3 regimens for protecting contrast–induced nephropathy in patients undergoing coronary procedures. Am Heart J 2007; 154: 539–544. [ Links ]
3. Lawlor DK, Moist L, DeRose G, Harris KA, Lovell MB, Kribs SW, et al. Prevention of contrast–induced nephropathy in vascular surgery patients. Ann Vasc Surg 2007; 21: 593–597. [ Links ]
4. Lameire N, Van Biesen W, Vanholder R. The changing epidemiology of acute renal failure. Nat Clin Pract Nephrol 2006; 2: 364–377. [ Links ]
5. Al–Ghonaim M, Pannu N. Prevention and treatment of contrast–induced nephropathy. Tech Vasc Interv Radiol 2006; 9: 42–49. [ Links ]
6. Barreto R. Prevention of contrast–induced nephropathy: the rational use of sodium bicarbonate. Nephrol Nurs J 2007; 34: 417–421. [ Links ]
7. Masuda M, Yamada T, Mine T, Morita T, Yamaki S, Tsukamoto Y, et al. Comparison of usefulness of sodium bicarbonate versus sodium chloride to prevent contrastinduced nephropathy in patients undergoing an emergent coronary procedure. Am J Cardiol 2007; 100: 781–786. [ Links ]
8. Poletti PA, Saudan P, Platon A, Mermillod B, Sautter AM, Vermeulen B, et al. IV N–acetylcysteine and emergency CT: use of serum creatinine and cystatin C as markers of radiocontrast nephrotoxicity. Am J Roentgenol 2007; 189: 687–692. [ Links ]
9. Van Praet JT, DeVriesse AS. Prevention of contrastinduced nephropathy: a critical review. Curr Opin Nephrol Hypertens 2007; 16: 336–347. [ Links ]
10. Toprak O, Cirit M, Tanrisev M, Yazici C, Canoz O, Sipahioglu M, et al. Preventive effect of nebivolol on contrast–induced nephropathy in rats Nephrol Dial Transplant 2008; 23: 853 – 859. [ Links ]
11. Toprak O. Conflicting and new risk factors for contrastinduced nephropathy. J Urol 2007; 178: 2277–2283. [ Links ]
12. Wong GT, Irwin MG. Contrast–induced nephropathy. Br J Anaesth 2007; 99: 474–483. [ Links ]
13. Lameier NH. Contrast–induced nephropathy: prevention and risk reduction. Nephrol Dial Transplant 2006; 21: 11–23. [ Links ]
14. Mehran R, Nikolsky E. Contrast–induced nephropathy: definition, epidemiology, and patients at risk. Kidney Int Suppl 2006; 100: 11–15. [ Links ]
15. Kabalan SN, El–Imad BG, Geara AS. Contrast–induced nephropathy. J Med Liban 2007; 55: 29–38. [ Links ]
16. Solomon R. Contrast media nephropathy: how to diagnose and how to prevent? Nephrol Dial Transplant 2007; 22: 1812–1815. [ Links ]
17. Walsh SR, Tang T, Gaunt ME, Boyle HR. Contrast–induced nephropathy. J Endovasc Ther 2007; 14: 92–100. [ Links ]
18. Lameire N. The pathophysiology of acute renal failure. Crit Care Clin 2005; 21: 197–210. [ Links ]
19. Sanaei–Ardekani M, Movahed MR, Movafagh S, Ghahramani N. Contrast–induced nephropathy: a review. Cardiovasc Revasc Med 2005; 6: 82–88. [ Links ]
20. Webb JG, Pate GE, Humphries KH, Buller CE, Al Shamari A, Sutander A, et al. A randomized controlled trial of intravenous N–acetylcysteine for the prevention of contrast–induced nephropathy after cardiac catheterization: lack of effect. Am Heart J 2004; 148: 422–429. [ Links ]
21. McCullog PA, Wolyn R, Rocher LL, Levin RN, O'Neil WW. Acute renal failure after coronary intervention: incidence, risk factors and relationship to mortality. Am J Med 1997; 103: 368–375. [ Links ]
22. Levy EM, Viscoli CM, Horwitz RI. The effect of acute renal failure on mortality: a cohort analysis. JAMA 1996; 275: 1489–1494. [ Links ]
23. Porter GA. Contrast–associated nephropathy: Presentation, pathophisiology and management. Miner Electrolyte Metab 1994; 20: 232–243. [ Links ]
24. Detrenis S, Meschi M, Musini, Savazzi G. Lights and shadows on the pathogenesis of contrast–induced nephropathy: state of the art. Nephrol Dial Transplant 2005; 20: 1542–1550. [ Links ]
25. Arakawa K, Suzuki H, Naitho M, Matsumoto A, Hayashi K, Matsuda H, et al. Role of adenosine in the renal responses to contrast medium. Kidney Int 1996; 49: 1199–1206. [ Links ]
26. Oldroyd SD, Fang L, Haylor JL, Yates MS, El Nahas AM, Morcos SK. Effects of adenosine receptor antagonists on the responses to contrast media in the isolated rat kidney. Clin Sci 2000; 98: 303–311. [ Links ]
27. Tsao PS, Aoki N, Lefer DJ, Johnson G 3rd, Lefer AM. Time course of endothelial dysfunction and myocardial injury during myocardial ischemia and reperfusion in the cat. Circulation 1990; 82: 1402–1412. [ Links ]
28. Kohtz C, Thompson M. Preventing contrast mediuminduced nephropathy. Am J Nurs 2007; 107: 40–49. [ Links ]
29. Fishbane S. N–acetylcysteine in the prevention of contrast–induced nephropathy. Clin J Am Soc Nephrol 2008; 3: 281–287. [ Links ]
30. Coca SG, Perazella MA. Prevention of contrast–induced nephropathy in high risk patients with hemofiltration. Am J Med 2007; 120: e9. [ Links ]
31. Shah SJ, Hsu CY. Has acetylcysteine use changed the incidence of contrast nephropathy in hospitalized patients? A before–after study. Am J Med 2004; 117: 948–952. [ Links ]
32. Coyle LC, Rodriguez A, Jeschke RE, Simon–Lee A, Abbott KC, Taylor AJ. Acetylcysteine in diabetes (AID): a randomized study of acetylcysteine for the prevention of contrast nephropathy in diabetics. Am Heart J 2006; 151: 9–12. [ Links ]
33. Schmidt P, Pang D, Nykamp D, Knowlton G, Jia H. Acetylcysteine and sodium bicarbonate versus acetylcysteine and standard hydration for the prevention of radiocontrast–induced nephropathy following coronary angiography. Ann Pharmacother 2007; 41: 46–50. [ Links ]
34. Doung MH, MacKenzie TA, Malenka DJ. Acetylcysteine prophylaxis significantly reduces the risk of radiocontrast–induced nephropathy: comprehensive meta–analysis. Catheter Cardiovasc Interv 2005; 64: 471–479. [ Links ]
35. Tadros GM, Mouhayar EN, Akinwande AO, Campbell B, Word C, Balnkenship JA. Prevention of radiocontrastinduced nephropathy with N– acetylcysteine in patients undergoing coronary angiography. J Invasive Cardiol 2003; 15: 311–314. [ Links ]
36. Parfrey PS, Griffiths SM, Barrett BJ, Paul MD, Genge M, Withers J, et al. Contrast material–induced renal failure in patients with diabetes mellitus, renal insufficiency or both. A prospective controlled study. N Engl J Med 1989; 320: 143–149. [ Links ]
37. Kellum J, Leblanc M, Venkataraman R. Acute renal failure. Am Fam Physician 2007; 76: 418–422. [ Links ]
38. Detrenis S, Meschi M, del Mar J, Savazzi G. Contrast medium induced nephropathy in urological practice. J Urol 2007; 178: 1164–1170. [ Links ]
39. Blickle JF, Doucet J, Krummerl T, Hannedouch T. Diabetic nephropathy in the elderly. Diabetes Metab 2007; 33: 40–55. [ Links ]
40. Konen E, Konen O, Katz M, Levy Y, Rozenman J, Hertz M. Are referring clinicians aware of patients at risk from intravenous injection of iodinated contrast media? Clin Radiol 2002; 57: 132–135. [ Links ]
41. Bartholomew BA, Harjai KJ, Dukkipati S, Boura JA, Yerkey MW, Glazier S, et al. Impact of nephropathy after percutaneous coronary intervention and a method for risk stratification. Am J Cardiol 2004; 93: 1515–1519. [ Links ]
42. Pedone C, Corsonello A, Incalzi RA. Estimating renal function in older people: a comparison of three formulas. Age Ageing 2006; 35:121–126. [ Links ]
43. Cigarroa RG, Lange RA, Williams RH, Hillis LD. Dosing of contrast material to prevent contrast nephropathy in patients with renal disease. Am J Med 1989; 86: 649–652. [ Links ]
44. Thomsen HS. How to avoid CIN: guidelines from the European Society of Urogenital Radiology. Nephrol Dial Transplant 2005; 20: 18–22. [ Links ]
45. Stacul F. Reducing the risk factors for contrast–induced nephropathy. Cardiovasc Intervent Radiol 2005; 28: S12–18. [ Links ]
46. Eknoyan G. Chronic renal disease: definition and classification. Kidney Int 2007; 72: 1183–1185. [ Links ]
47. Kukla A, Adulla M, Pascual J, Samaniego M, Nanovic L, Becker BN, et al. CKD stage–to–stage progression in native and transplant kidney patients. Nephrol Dial Transplant 2008; 23: 693–700. [ Links ]
48. Bader BD, Berger ED, Heede MB, Silberbaur I, Duda S, Risler T, et al. What is the best hydration regimen to prevent contrast media–induced nephrotoxicity? Clin Nephrol 2004; 62: 1–7. [ Links ]
49. Merten GJ, Burgess WP, Gray LV, Holleman JH, Roush TS, Kowalchuk GJ, et al. Prevention of contrast–induced nephropathy with sodium bicarbonate: a randomized controlled trial. JAMA 2004; 291: 2328–2334. [ Links ]
50. Mueller C, Buerkle G, Buettner HJ, Petersen J, Perruchoud AP, Eriksson U, et al. Prevention of contrast mediainduced nephropathy: a randomized comparison of two hydration regimens in 1620 patients undergoing coronary angioplasty. Arch Intern Med 2002; 162: 329–236. [ Links ]
51. Trivedi HS, Moore H, Nasr S, Aggarwal K, Agrawal A, Goel P, et al. A randomized prospective trial to assess the role of saline hydration on the development of contrast nephrotoxicity. Nephron Clin Pract 2003; 93: C29–C34. [ Links ]
52. Stevens MA, McCullogh PA, Tobin KJ, Speck JP, Westveer DC, Guido–Allen DA, et al. PRINCE study: prevention of radiocontrast induced nephropathy. Clinical evaluation. J Am Coll Cardiol 1999; 33: 403–411. [ Links ]
53. Taylor AJ, Hotchkiss D, Morse RW, McCabe J. PREPARED: preparations for angiography in renal dysfunction. Chest 1998; 114: 1570–1574. [ Links ]
54. Dussol B, Morange S, Loundoun A, Auquier P, Berland Y. A randomized trial of saline hydration to prevent contrast nephropathy in chronic renal failure patients. Nephrol Dial Transplant 2006; 21: 2120–2126. [ Links ]
55. Gare M, Haviv YS, Ben–Yehuda A, Rubinger D, Bdolah–Abram T, Fuchs S, et al. The renal effect of low–dose dopamine in high–risk patients undergoing coronary angiography. J Am Coll Cardiol 1999; 34: 1682–1688. [ Links ]
56. Hans SS, Hans BA, Dhillon R, Dmuchowski C, Glover J. Effect of dopamine on renal function after arteriography in patients with preexisting renal insufficiency. Am Surg 1998; 64: 432–436. [ Links ]
57. Abizaid AS, Clark CE, Mintz GS, Dosa S, Popma JJ, Pichard AD, et al. Effects of dopamine and aminophylline on contrast–induced acute renal failure after coronary angioplasty in patients with preexisting renal insufficiency. Am J Cardiol 1999; 83: 260–263. [ Links ]
58. Bakris GL, Lass NA, Glock D. Renal haemodynamics in radiocontrast medium–induced renal dysfunction: a role for dopamine–L receptors. Kidney Int 1999; 56: 206–210. [ Links ]
59. Tumlin JA, Wang A, Murray PT, Samuels J, Cotsonis G, Shaw AD. Fenoldopam mesylate blocks reductions in renal plasma flow after radiocontrast dye infusion: a pilot trial for the prevention of contrast nephropathy. Am Heart J 2002; 143: 894–903. [ Links ]
60. Stone GW, McCullogh PA, Tumlin JA, Lepor NE, Madyoon H, Murray P, et al. Fenoldopam mesylate for the prevention of contrast–induced nephropathy: a randomized controlled trial. JAMA 2003; 290: 2284–2291. [ Links ]
61. Briguori C, Colombo A, Airoldi F, Violante A, Castelli A, Balestrieri P, et al. N–acetylcysteine and fenoldopam mesylate to prevent contrast agent–associated nephrotoxicity. J Am Coll Cardiol 2006; 109: 322–328. [ Links ]
62. Ng TM, Shurmur SW, Silver M, Nissen LR, O'Leary EL, Ringmaiden RS, et al. Comparison of N–acetylcysteine and fenoldopam for preventing contrast–induced nephropathy (CAFCIN). Int J Cardiol 2006; 44: 762–765. [ Links ]
63. Ix JH, McCullogh CE, Chertow GM. Theophylline for the prevention of radiocontrast nephropathy: a metaanalysis. Nephrol Dial Transplant 2004; 19: 2747–2753. [ Links ]
64. Erley CM, Duda SH, Schlepckow S, Koehler J, Huppert PE, Strohmaier WL, et al. Adenosine antagonist theophylline prevents the reduction of glomerular filtration rate after contrast media application. Kidney Int 1994; 45: 1425–1431. [ Links ]
65. Gandhi MR, Brown P, Romanowski CA, Morcos SK, Campbell S, El Nahas AM, et al. The use of theophylline, an adenosine antagonist, in the prevention of contrast media induced nephropathy. Br J Radiol 1992; 65: 838. [ Links ]
66. Hoffmann U, Fischereder M, Krüger B, Drobnik W, Krämer BK. The value of N–acetylcysteine in the prevention of radiocontrast agent–induced nephropathy seems questionable. J Am Soc Nephrol 2004; 15: 407–410. [ Links ]
Recibido: noviembre 27 de 2007
Aceptado: diciembre 10 de 2007