Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.21 no.3 Medellín July/Sept. 2008
ARTÍCULO DE INVESTIGACIÓN
Correlación entre los niveles plasmáticos de hormona luteinizante (LH) y hormona folículo–estimulante (FSH) y el estadio de maduración esquelética en un grupo de niños de Medellín, Colombia
Correlation between plasma levels of luteinizing (LH) and folliclestimulating hormones (FSH) and the state of skeletal maturation in a group of children from Medellin, Colombia.
Juan Manuel Alfaro Velásquez 1; Mónica Giraldo Fernández 2; Óscar Zapata Noreña2; Hilda Nora Jaramillo Londoño3
1. Médico Pediatra Endocrinólogo, Profesor Asociado de la Universidad de Antioquia y la Universidad CES, Medellín, Colombia.
2. Especialista en Odontología Integral del Niño, Profesor Asistente de la Facultad de Odontología, Universidad de Antioquia, Medellín, Colombia.
3. Médica, Magíster en Fisiología, Profesora Titular, Facultad de Medicina Universidad de Antioquia, Medellín, Colombia.
Correspondencia: JM Alfaro: alfarojm@yahoo.com
Carrera 42 n.º 60 sur 60. Casa 231. Sabaneta (Antioquia). Teléfono (4)2889797
RESUMEN
Con el fin de evaluar la asociación entre la madurez ósea y los cambios en los niveles de las gonadotrofinas durante las etapas iniciales de la pubertad, se correlacionaron los niveles séricos de las hormonas luteinizante (LH) y folículo–estimulante (FSH) con el estado de maduración esquelética (evaluado por el método de Greulich y Pyle), la edad, el peso, la talla y la madurez sexual (según la clasificación de Tanner y con el empleo del orquidómetro de Prader) en una población sana de la ciudad de Medellín, Colombia.
El estudio de tipo prospectivo observacional, conformado por 16 varones y 15 niñas, entre 8 y 12 años de edad, evaluó seis veces a la misma cohorte durante un período de 30 meses empleando muestras sanguíneas para los niveles hormonales y radiografías de las estructuras óseas carpofalángicas; se incluyeron quienes completaron seis muestras sanguíneas y seis estudios radiológicos.
Una vez registradas las diferencias clínicas de los estados Tanner de madurez sexual, los varones con ganancia progresiva de peso mostraron tendencia hacia mayores concentraciones de FSH y discreto avance de la edad esquelética, en tanto que, para los dos sexos, el cambio en los valores de LH se correlacionó mejor con la progresión de la edad esquelética independientemente de otras variables.
Palabras clave: Greulich–Pyle, Hormona luteinizante, Hormona folículo–estimulante, Maduración esquelética
SUMMARY
In order to analyze the association between skeletal maturation and the changes in the levels of gonadotrophins during the initial stages of puberty, serum levels of luteinizing (LH) and follicle–stimulating hormones (FSH) were correlated with the state of skeletal maturation (determined by the method of Greulich and Pyle), and with the age, weight, height and sexual maturity (according to the classification of Tanner and using Prader's orchidometer) in a healthy population of Medellin, Colombia.
Our report includes 16 boys and 15 girls, ranging in age from 8 to 12 years, who completed a total of six blood specimens for hormone levels determination, and six radiographic studies of the carpo–phalangeal bone structures. The study lasted 30 months.
Boys with progressive weight gain showed a trend towards higher concentrations of FSH and a discrete advance in skeletal age. On the other hand, in both girls and boys, changes in the LH values were better associated with the progression of skeletal age with no influence of other variables.
Key words: Greulich–Pyle, Follicle–stimulating hormone, Luteinizing hormone, Skeletal maturity
INTRODUCCIÓN
Por décadas se ha buscado un indicador de la maduración biológica diferente de la edad cronológica y de los caracteres sexuales secundarios; se ha encontrado que la maduración esquelética es un enfoque válido para lograr este objetivo comparando los tejidos óseo y cartilaginoso del niño con patrones de referencia.1–4 En la tabla n.º 1 se presentan algunos métodos para evaluar la edad esquelética.
La maduración esquelética al comienzo de la pubertad está influida por las bajas cantidades de esteroides gonadales y por hormonas dependientes de la adrenarquia funcional; una vez en curso, los cambios de la pubertad dependen de los incrementos en las gonadotrofinas y cuando el desarrollo puberal está avanzado, termina el proceso de dicha maduración asociado al declive de la velocidad de crecimiento posterior al estirón puberal de la talla.
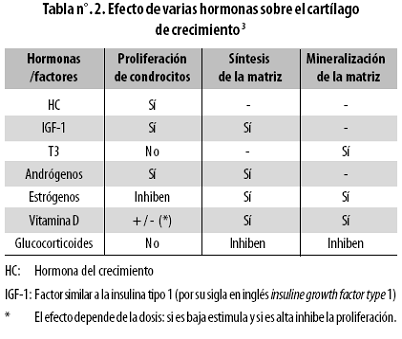
Teniendo en cuenta que el máximo dinamismo de la maduración esquelética ocurre durante el desarrollo puberal y que está influido por condiciones ambientales, genéticas, nutricionales y hormonales (Tabla nº. 2),18 se evaluó la relación de estas últimas con las características radiológicas; si se demuestra una correlación entre la maduración esquelética y los cambios en los niveles séricos de LH y FSH durante la transición de la prepubertad a la pubertad, serviría como punto de partida para nuevas investigaciones y para aplicaciones clínicas.
Los objetivos del estudio fueron los siguientes:
1. Reconocer clínicamente el momento puberal de los niños de una cohorte, que asistían a un servicio de tratamiento y control en una unidad universitaria de atención odontológica de la ciudad de Medellín.
2. Precisar la dinámica de las gonadotrofinas y su relación con los cambios radiológicos empleando la técnica imaginológica de Greulich–Pyle.
MATERIALES Y MÉTODOS
La muestra estuvo conformada por individuos impúberes de uno y otro sexo que asistían como pacientes a las Clínicas de Atención Integral del niño, de la Facultad de Odontología de la Universidad de Antioquia (Medellín, Colombia) durante los años 2000–2002. Se hizo un estudio prospectivo descriptivo, observacional y longitudinal, de una cohorte, con evaluaciones repetidas semestralmente durante 30 meses; el estudio incluyó lo siguiente:
1. Toma de muestras de sangre de una vena antecubital, entre las 7:00 y 8:00 a. m., en los módulos de consulta externa de las Clínicas de Atención Integral del Niño de la Facultad de Odontología de la Universidad de Antioquia, con todas las garantías de procesamiento y almacenamiento; en los sueros obtenidos de dichas muestras se cuantificaron los niveles de LH y FSH en UI/L empleando quimioluminiscencia y un equipo INMULITE DPC según los estándares de la casa fabricante. Se incluyeron para el análisis los niños en quienes se lograron seis tomas.
2. Evaluación del crecimiento y de la madurez genital por el pediatra endocrinólogo inmediatamente después de obtener las muestras de sangre; se emplearon para ello una balanza mecánica de precisión DETECTOKILOS® debidamente calibrada, un estadiómetro Genetech®, dos orquidómetros del diseño Zachmann–Prader y cartas de referencia para peso, talla y caracteres sexuales secundarios (NCHS–2000 y Tanner–1962 respectivamente) 19; a cada paciente se le hicieron las mediciones en seis oportunidades.
3. Tres a ocho días después de cada una de las anteriores mediciones a cada niño se le tomaron radiografías para estudiar la madurez esquelética; su lectura la hicieron separadamente dos pediatras endocrinólogos experimentados; en caso de discrepancia se solicitó el concepto de un tercer observador, pediatra efebólogo, que desconocía los resultados de las lecturas previas.
El pediatra endocrinólogo evaluó a cada paciente con los siguientes parámetros:
1. Estatura: en posición vertical y descalzo, preferiblemente a la misma hora de la mañana, en inspiración profunda; se hicieron tres tomas por paciente en cada evaluación y se seleccionó el mayor valor.
2. Se pesó a cada niño en kilogramos más fracciones adicionales de 0,25 kg.
3. Parámetros de maduración apocrina (adrenarquia), a saber:
a). Inspección de cada fosa axilar para calificar la presencia de vellos y de sudor con características apocrinas; se asignó una calificación numérica subjetiva entre cero (0) y tres (3).
b). Inspección de la característica y disposición del vello púbico acorde con la clasificación Tanner (1 a 5).
4. Parámetros de madurez genital; fueron los siguientes:
a). En las niñas, el Tanner genital (1 a 5) se determinó a la luz de las características de desarrollo de la glándula mamaria; se hicieron 12 calificaciones por paciente porque en cada oportunidad se evaluaron ambas glándulas mamarias; se adoptó la más alta como la característica determinante.
b). En los niños, el Tanner genital (1 a 5) se determinó de acuerdo con el volumen en mL alcanzado por el mayor de los testículos: 1 (inferior a 4), 2 (de 4 a 7), 3 (de 8 a 12), 4 (de 15 a 20), 5 (superior a 20). Se hicieron 12 calificaciones por paciente porque en cada oportunidad se evaluaron ambos testículos; se adoptó el volumen más alto como el determinante. Para definir la edad equelética se utilizó como estándar el Atlas de Greulich–Pyle.20–22
Todos los procedimientos cumplieron con los parámetros establecidos por el Tribunal de Ética Médica de Antioquia.
Para el análisis estadístico se utilizó el paquete Stat Graphix. Se estableció la normalidad de los datos y se hicieron los análisis aplicando el método descriptivo de variables múltiples, la correlación Pearson, la comparación de residuales y la prueba de independencia para chi al cuadrado. Se analizaron los resultados de las pruebas estadísticas empleando un nivel de confianza del 95%.
RESULTADOS
Completaron el estudio 16 varones y 15 niñas.
Varones
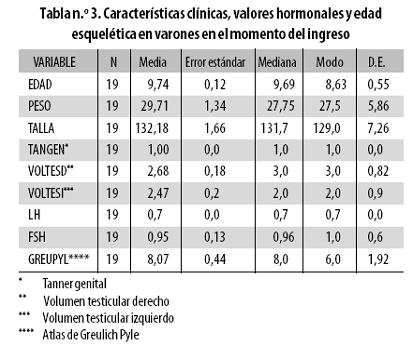
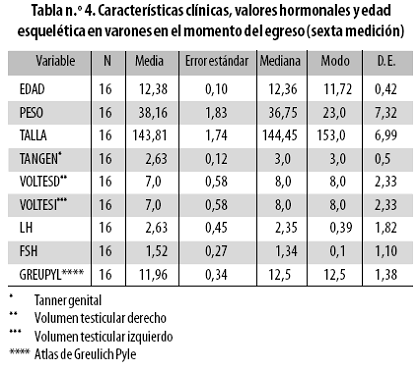
Diez y nueve varones ingresaron al estudio a una edad promedio de 9,74 años (DE: 0,55; tabla n.º 3); 16 de ellos completaron las seis muestras a los 12,38 años de edad en promedio (DE: 0,42 años); egresaron con madurez genital 2–3 (Tabla n.º 4), ganaron en promedio 8,46 kg y el máximo volumen testicular fue de 10 mL (DE: 2,33 mL).
Al cierre del estudio la LH había subido 3,75 veces sobre su valor inicial, incremento mayor que el de la FSH que fue de 1,6 veces (relación entre el incremento de la LH y el de la FSH = 2,3) y la madurez esquelética pasó de 8 a 11,96 años. La madurez esquelética en Tanner 1 (impactada previamente por la adrenarquia) cambió proporcionalmente con la edad (p = 0,037), tuvo una discreta asociación inicial con el alza de la FSH y al final del estudio se relacionó con la dinámica de la LH.
Niñas
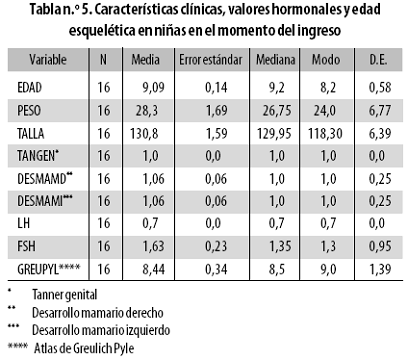
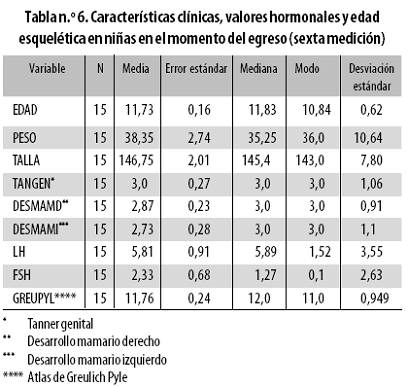
Diez y seis niñas ingresaron al estudio a una edad promedio de 9,09 años (Tabla n.º 5); quince completaron las 6 muestras a una edad promedio de 11,73 años con Tanner genital entre 1 y 4 (Tabla n.º 6).
Durante la transición de Tanner 1 a Tanner 4, los niveles de LH aumentaron 8,3 veces en tanto que los de FSH solo subieron 1,42 veces; la madurez esquelética mantuvo un incremento homogéneo desde 8,44 años al ingreso hasta 11,76 años al egreso, sin cambios significativos durante la tercera y cuarta evaluaciones, momento en el que la muestra hizo la transición de Tanner mamario 2 a 3.
Si bien la tercera medición (efectuada en la mitad del estudio) se asoció con los primeros incrementos del nivel de LH acompañando a las variaciones de peso y talla (p –0,046 y –0,047, respectivamente), aquellos fueron independientes del estado Tanner, se consolidaron en la cuarta medición (Tanner 2) y no generaron cambios significativos en la progresión radiológica de la madurez esquelética.
DISCUSIÓN
La determinación clínica del inicio de la pubertad ocurre en las niñas cuando tienen Tanner mamario 2 y en los varones cuando alcanzan un volumen testicular de 4 mL medido por el método de Zachmann–Prader, 23–26 antecedidos por un moderado incremento de la talla dependiente de la adrenarquia y completado por el eje hormona de crecimiento–somatomedina C.18,24,27,28
La adrenarquia, que precede en 1 a 2 años al inicio clínico de la pubertad, 27,28 genera no solo el primer cambio de la madurez esquelética al influir sobre el cartílago de crecimiento aumentando su grosor, la síntesis de tejido conjuntivo y la de colágeno, 18,26–28 sino al anticipar la activación del eje gonadal (madurez esquelética de 10,5 a 11 años en las niñas y de 11,5 a 12 años en los varones), evento progresivo que se consolida cuando la liberación de gonadotropinas se torna pulsátil y cíclica y culmina meses más tarde con el cierre definitivo de la placa de crecimiento (madurez esquelética final).
Una vez consolidada dicha forma de liberación de las gonadotrofinas y en vías de modificar definitivamente la madurez esquelética,27 se produce el final del estirón puberal de la talla (en las niñas transición Tanner 2–3 y en los varones transición Tanner 3–4). 4,21,22,28,29
A la luz de las anteriores observaciones fisiológicas y conocida la relación entre las modificaciones de las gonadotrofinas y los cambios en la madurez esquelética, se proponen, con base en nuestros hallazgos, las siguientes asociaciones, con la advertencia de que el estudio solo llegó hasta Tanner genital 3 en varones y 4 en las niñas.
En los varones
1. La evolución de la madurez esquelética, que se inició a los 8 años y culminó a los 11,96 años, mostró una progresión paulatina sin dispersión significativa (DE 1,92 vs. DE 1,38; tablas n.º 3 y 4) y no se acompañó de modificaciones de los niveles de gonadotrofinas durante la transición de Tanner 1 a Tanner 3. Dicha madurez en Tanner 1, que había sido impactada previamente por la adrenarquia, cambió proporcionalmente con la edad, tuvo una discreta asociación inicial con el alza de la FSH, y se relacionó con la dinámica de la LH al final del estudio.
2. Los cambios antropométricos, la evolución Tanner y la dinámica de la madurez esquelética de la cuarta y quinta mediciones no mostraron relación directa con el cambio en las gonadotrofinas; solo se observó una pequeña relación entre la sexta medición y los valores de LH (Tanner 3).
En las niñas
1. Aunque ingresaron en Tanner 1 con valores de FSH más elevados (1,635 vs. 0,95) y más precoces (9,09 años vs. 9,74 años) que los observados en los varones, esas diferencias no fueron significativas según el sexo sobre la madurez esquelética. Aunque la tercera medición se asoció con los primeros incrementos del nivel de LH acompañando a las variaciones de peso y talla, dichos incrementos fueron independientes del estado Tanner, se consolidaron en la cuarta medición (Tanner 2) y no generaron cambios significativos en la evolución de la madurez esquelética.
2. Para los estados Tanner 2 y 3 (mediciones 5 y 6 respectivamente) la evaluación de la madurez esquelética no tuvo ventajas sobre la valoración clínica a pesar de la elevación constante de los niveles de LH.
En conjunto, establecer una relación dinámica entre la edad esquelética y los niveles de gonadotrofinas fue particularmente difícil en nuestra población que no superó el estado Tanner 4 de desarrollo genital (30 meses de seguimiento); destacamos en primer lugar que los valores de FSH son consecuentes con el estado Tanner 1, con el peso y con la talla al ingreso, tanto en niños como en niñas, pero no son útiles prospectivamente; en segundo lugar, desapareció toda influencia de esta gonadotrofina – más tempranamente en las niñas – permitiendo que en ellas se preserve una relación anticipada y más fuerte con la LH sin implicar cambios sobre la madurez esquelética.
A pesar del predominio de los valores de LH durante la segunda mitad del estudio, estos no influyeron sobre la madurez esquelética porque esta gonadotrofina no tiene una acción directa sobre las estructuras óseas en crecimiento, como sí la tienen los estrógenos (tabla n.º 2): en el grupo estudiado el método de evaluación radiológica empleado (Greulich–Pyle) no tuvo ventajas sobre la valoración clínica ni se asoció con la dinámica cambiante de las gonadotrofinas antes del estado Tanner 3–4 de madurez genital.
CONCLUSIONES
Considerando el sexo y dada la heterogeneidad de lo observado, no encontramos durante la transición de prepúber a púber una relación causal entre los niveles cambiantes de gonadotrofinas y las modificaciones de la madurez esquelética estudiadas por el método Greulich–Pyle.
En varones, y de manera indirecta, los niveles de FSH al inicio de la pubertad pueden influenciar cambios en la madurez esquelética si el joven acusa incremento de peso; considerar siempre que este cambio puede depender más de los andrógenos adrenales que de la FSH.
En las niñas es útil suponer una relación directa entre los niveles de LH y la madurez esquelética una vez que se supera el Tanner genital 2, resultando innecesaria en la evaluación de la transición prepúberpúber. Se debe considerar la acción de otros mensajeros en futuras evaluaciones al analizar la relación entre LH/FSH y la madurez esquelética según el método Greulich–Pyle.
Tanto en varones como en mujeres se deben hacer estudios prospectivos para definir el papel de la LH, particularmente cuando el Tanner genital oscile entre los estadios 3 y 4.
AGRADECIMIENTO
Este trabajo fue financiado por el Comité para el Desarrollo de la Investigación (CODI) de la Universidad de Antioquia.
REFERENCIAS BIBLIOGRÁFICAS
1. Styne DM. Crecimiento. En: Greenspan FS, Strewler GJ, eds. Endocrinología básica y clínica, 4ª ed. México: Manual Moderno; 1997: 181–219. [ Links ]
2. Hernández–Rodríguez M. El patrón de crecimiento humano y su evaluación. En: Pombo M, ed. Tratado de Endocrinología Pediátrica, 3ª ed. Madrid: McGraw–Hill Interamericana; 2002: 244–274. [ Links ]
3. Bull RK, Edwards PD, Kemp PM, Fry S, Hughes IA. Bone age assessment: a large scale comparison of the Greulich and Pyle, and Tanner and Whitehouse (TW2) methods. Arch Dis Child 1999; 81: 172–173. [ Links ]
4. Sobradillo–Ruiz B. Evaluación de la maduración ósea y pronóstico de talla final (tema 2). En: Sociedad Española de Endocrinología Pediátrica. Sección de la Asociación Española de Pediatría. Hipocrecimiento. 5º Curso de Formación de Postgrado, 1ª ed. Palma de Mallorca, 1999. pp. 11– 22. [ Links ]
5. Greulich WW, Pyle SI. Radiographic Atlas of Skeletal Development of the Hand and Wrist, 2ª ed. Stanford: Stanford University Press;1959. [ Links ]
6. Tanner JM, Whitehouse RH, Marshall WA, Healy MJR, Goldstein H. Assessment of skeletal maturity and prediction of adult height (TW2 method), 2.ª ed. Londres: Academic Press; 1983. [ Links ]
7. Roche AF, Chumlea WM, Thissen D. Assessing the skeletal maturity of the hand–wrist: Felsmethod. Springfield: Charles C. Thomas; 1988. [ Links ]
8. Tanner JM, Gibbons RD. A computerized image analysis system for estimating Tanner–Whitehouse 2 bone age. Horm Res 1994; 42: 282–287. [ Links ]
9. Sinclair RJG, Kitchin AH, Turner RWD. The Marfan syndrome. Q J Med 1960; 29:19–46. [ Links ]
10. Sauvegrain J, Nahum H, Bronstein H. Étude de la maturation osseuse du coude. Ann Radiol 1962; 5: 542–550. [ Links ]
11. Pyle SJ, Hoerr NL. Radiographic atlas of skeletal development of the knee. Springfield:Charles C. Thomas;1955. [ Links ]
12. Roche AF, Wainer H, Thissen D. Skeletal maturity. The knee joint as a biological indicator. Nueva York: Plenum Press; 1975. [ Links ]
13. Schunk K, Kraus W, Boor R. The sonographic examination of the distal femoral epiphysis as a method of determining maturity of the newborn. Fortschr Röntgenstr 1987; 146: 623–627. [ Links ]
14. Hoerr NL, Pyle SJ, Francis CC. Radiographic atlas of skeletal development of the foot and ankle. Springfield: Charles C. Thomas; 1962. [ Links ]
15. Erasmie V, Ringertz H. A method for assessment of skeletal maturity in children below one year of age. Pediatr Radiol 1980; 9: 225–228. [ Links ]
16. Hernández M, Sánchez E, Sobradillo B, Rincón JM, Narvaiza JL. A new method for assessment of skeletal maturity in the first 2 years of life. Pediatr Radiol 1988; 18: 484–489. [ Links ]
17. Argemí J, Badía J. A new computerised method for assessment of skeletal maturity in the newborn infant. Pediatr Radiol 1997; 27: 309–314. [ Links ]
18. Catanni A, Reyes ML. La pubertad normal y patológica. En: Rodríguez–Portales JA, ed. Endocrinología Clínica, 1ª ed. Santiago de Chile: Editorial Mediterráneo; 2000: 313–323. [ Links ]
19. Tanner J. Auxology. En: Kappy MS, Blizzard R, Migeon C, eds. The diagnosis and treatment of endocrine disorders in childhood and adolescence, 4ª ed. Springfield: Charles C. Thomas; 1994: 137–192. [ Links ]
20. Berst MJ, Bogdanowicz MM, Stevens MA, Chow S, Brandser EA. Effect of knowledge of chronologic age on the variability of pediatric bone age determined using the Greulich and Pyle standards. AJR 2001; 176: 507–510. [ Links ]
21. Mora S, Boechat MI, Pietka E, Huang HK, Gilsanz V. Skeletal age determinations in children of european and african descent: Applicability of the Greulich and Pyle standards. Pediatr Res 2001; 50: 624–628. [ Links ]
22. Bilgili Y, Selda H, Simay–Altan K, Cihat S, Haydar–Hüseyin E, Deniz A. Accuracy of skeletal age assessment in children from birth to 6 years of age with the ultrasonographic version of the Greulich–Pyle Atlas. J Ultrasound Med 2003; 22: 683–690. [ Links ]
23. Antoniazzi F, Zamboni G. Central precocius puberty. Current treatment options. Pediatric Drugs 2004; 6: 211–231. [ Links ]
24. Albiach–Mesado VJ. Regulación del crecimiento posnatal. En: Pombo M, ed. Tratado de Endocrinología Pediátrica, 3ª ed. Madrid: McGraw–Hill Interamericana; 2002: 233–243. [ Links ]
25. Styne DM. Pubertad. En: Greenspan FS, Strewler GJ, eds. Endocrinología básica y clínica, 4ª ed. México: Manual Moderno; 1997: 593–622. [ Links ]
26. Ballabriga A. Morphological and physiological changes during growth: an update. Eur J Clin Nutr 2000; 54 (Suppl. 1): S1–S6. [ Links ]
27. Flor–Cisneros A, Leschek EW, Merke DP, Barnes KM, Coco M, Cutler JR, et al. In boys with abnormal developmental tempo, maturation of the skeleton and the hypothalamicpituitary–gonadal axis remains synchronous. J Clin Endocrinol Metab 2004; 89: 236–241. [ Links ]
28. Palmert MR, Hayden DL, Mansfield J, Crigler JF, Crowley WF, Chandler DW, et al. The longitudinal study of adrenal maturation during gonadal suppression: Evidence that adrenarche is a gradual process. J Clin Endocrinol Metab 2001; 86: 4536–4542. [ Links ]
29. Wierman ME, Beardsworth DE, Crawford JD, Crigler JF, Jr., Mansfield MJ, Bode HH, et al. Adrenarche and skeletal maturation during luteinizing hormone releasing hormone analogue supression of gonadarche. J Clin Invest 1986; 77: 121–26. [ Links ]
Recibido: julio 13 de 2007
Aceptado: abril 15 de 2008