Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.21 no.3 Medellín July/Sept. 2008
ARTÍCULO DE INVESTIGACIÓN
Evolución temporal del hemograma en niños con malaria
Temporal evolution of hemogram in children with malaria
Jaime Carmona–Fonseca1
1. Grupo Salud y Comunidad, Universidad de Antioquia, Calle 62 n.º 52–59, laboratorio 610. Medellín, Colombia.
Correspondencia: jaimecarmonaf@hotmail.com
RESUMEN
Introducción: los estudios colombianos sobre las relaciones entre paludismo, parásitos intestinales, desnutrición y comportamiento del hemograma son muy escasos.
Objetivos: conocer los cambios del hemograma en niños de 4 a 10 años de edad, con malaria, seguidos durante 30 días.
Metodología: el estudio es parte de un macroproyecto (estudio clínico controlado, grupos paralelos, no ciego).
Resultados: se evaluaron 93 niños. Los riesgos de desnutrición fueron: crónica 52%, global 47%, 15% aguda. Se hallaron parásitos intestinales en 88%, que fueron patógenos en 80%; 35% estaban poliparasitados.
Hemograma: hemoglobina (promedio): 10,3 g/dL a los días 1 y 8; al día 30: 11,8 g/dL. La desnutrición crónica y la parasitosis intestinal no influyeron significativamente en la hemoglobina en los días 1 y 30. Tuvo más influencia (sin ser estadísticamente significativa) la desnutrición que la parasitosis. Durante el episodio malárico el recuento leucocitario fue normal y pasó en los 30 días siguientes hacia muy leve leucocitosis. El análisis de los leucocitos mostró disminución de los neutrófilos y basófilos, aumento de los eosinófilos, linfocitosis leve y monocitopenia marcada, ambas estables. La linfocitosis y la monocitopenia no coinciden con lo informado por otros autores.
Conclusiones: estos niños con malaria (90% por P. vivax), parasitosis intestinal y desnutrición crónica, tuvieron antes del tratamiento anemia homogénea normocítica, de grado leve, que se recuperó en 30 días a partir del tratamiento antimalárico; 80% también tuvieron trombocitopenia; el leucograma mostró, al día 1, neutropenia y basopenia, con eosinofilia, junto con linfocitos normales y monocitopenia marcada. Los niños de nuestras zonas palúdicas están afectados simultáneamente por desnutrición, parasitosis intestinales y malaria. Se requiere tratar al tiempo todas estas enfermedades para mejorar notoriamente el estado de salud.
Palabras clave: Anemia, Recuento de Leucocitos, Malaria, Paludismo, Desnutrición, parásitos, Niños, Colombia
SUMMARY
Introduction: There are few Colombian studies about the relations between malaria, intestinal parasites, malnutrition and the hemogram.
Objectives: To know the temporal evolution of hemogram in children with malaria (aged 4–10 years) followed during 30 days.
Methodology: This study is part of a larger project, which has a non–blinded balanced experimental design.
Results: 93 children were evaluated. Malnutrition risks were as follows: 52% chronic, 47% global, 15% acute. 88% had intestinal parasites (80% of them were pathogens) and 35% were polyparasitized. Hemoglobin (average in g/dL) at days 1 and 8: 10.3 and at day 30: 11.8. Chronic malnutrition and intestinal parasites did not significantly influence hemoglobin levels at days 1 and 30. Apparently, malnutrition had more influence (although not statistically significant) than intestinal parasites. During the acute episode of malaria, the leukocyte count was normal and it changed to very mild leukocytosis within the next 30 days. Leukocyte analysis revealed decreased neutrophils and basophils, increased eosinophils, mild lymphocytosis and marked monocytopenia, both of them stable. Lymphocytosis and monocytopenia were in contrast with the findings of other studies.
Conclusions: These children with malaria (90% P. vivax), intestinal parasites and chronic malnutrition, had anemia (mild, homogeneous, normocytic) before therapy, but they recovered from it in 30 days after effective antimalarial treatment; 80% also suffered from thrombocytopenia; at day 1, they showed neutropenia, basopenia, and eosinophilia, along with normal lymphocytes and severe monocytopenia. It is necessary to treat simultaneously these diseases in order to improve the health status of these children.
Key words: Anemia, Leukocyte count, Malaria, Malnutrition, Parasites, Children, Colombia
INTRODUCCIÓN
En los pacientes con malaria no complicada suceden varias anormalidades que incluyen anemia normocítica normocrómica, trombocitopenia, leucocitosis o leucopenia, hipoglicemia, hiponatremia, valores altos de las pruebas hepáticas y renales, proteinuria, datos de coagulación intravascular diseminada (aunque el sangrado clínicamente importante es raro). No se observa eosinofilia. Los pacientes con paludismo complicado a veces muestran hemólisis intravascular masiva con hemoglobinemia y hemoglobinuria.1
La existencia de anemia se establece cuando hay un valor menor que el fisiológico en al menos una de estas tres variables: número de eritrocitos/µL de sangre, gramos de hemoglobina/dL de sangre, volumen de eritrocitos/dL de sangre.2 Una clasificación integral de la anemia incluye la evaluación de muchos otros parámetros hematológicos, además de los tres ya referidos.3
No se conoce completamente la fisiopatología de la anemia hallada en el paludismo, pero se acepta que es producida por múltiples mecanismos que incluyen la destrucción de eritrocitos infectados y no infectados, la eritrofagocitosis y un freno potencial de la eritropoyesis. Los factores involucrados en la anemia malárica son los siguientes:4
1. Factores relacionados con el parásito, como la endemicidad de la malaria, la especie de parásito presente, el retardo en el diagnóstico y la resistencia a los antimaláricos.
2. Factores del hospedero: algunas condiciones genéticas (como el rasgo falciforme o la talasemia, que lo protegen) o de otra índole, como edad, embarazo, infecciones parasitarias, bacterianas o virales asociadas.
3. Factores nutricionales, como las deficiencias previas de hierro y micronutrientes.
La carencia de hierro en el organismo es la deficiencia alimentaria más frecuente en el mundo y conduce a la anemia. En las zonas maláricas coexisten la malaria, la desnutrición (que incluye la anemia ferropénica) y los parásitos intestinales;5–11 estos producen anemia ferropénica y agravan la derivada de la desnutrición y la malaria. Los efectos de los nemátodos intestinales sobre el estado nutricional son claros.12–17
La trombocitopenia (menos de 150.000 plaquetas/µL)18 es frecuente durante esta enfermedad y tanto P. falciparum como P. vivax se asocian a ella.19 Como causas de la trombocitopenia malárica (TM) se proponen la destrucción mediada por anticuerpos antiplaquetarios20–25 pero pueden estar ausentes en presencia de TM.26 En la malaria se forman complejos circulantes de antígenos de Plasmodium e inmunoglobulinas séricas contra las plaquetas;27 por tales complejos, estas se activan y sufren cambios estructurales y bioquímicos que disminuyen sus funciones y, en consecuencia, el bazo las reconoce y fagocita ya que los macrófagos esplénicos están hiperactivos durante la malaria. La agregación es una función plaquetaria alterada luego de esta activación, por lo que el paciente malárico es más propenso a sangrados.22,27,28
Según Ladhani y colaboradores, en 2002, 'poco se conoce sobre los cambios de los leucocitos y plaquetas en los niños con malaria falciparum en las áreas endémicas'.29 Estos autores hallaron, en niños de Kenia, que los afectados por paludismo falcíparum tenían más leucocitos, más linfocitos y menos monocitos que los controles comunitarios y que la leucocitosis se asociaba con la gravedad y la mortalidad de los niños palúdicos. Con elevada frecuencia esos niños también tenían trombocitopenia, pero ella no se asociaba con un desenlace adverso.29 En enfermos ghaneses con malaria por P. falciparum, se demostró leucocitosis en 21% y leucopenia en 3%;30 el déficit leucocitario también fue informado en 24% de 37 franceses con 'malaria importada'.31
Contrario al dato de Ladhani y colaboradores sobre la existencia de linfocitosis en esos niños palúdicos, lo que más se informa en malaria es la linfopenia. Quizás el momento en que se hace el estudio (tiempo de evolución de la enfermedad) explique la divergencia. La linfopenia es un aspecto bien conocido de la malaria por P. falciparum pero es reemplazada por linfocitosis en cuestión de pocos días después de iniciada la farmacoterapia, antes de la normalización gradual que sucede al cabo de un par de semanas.32
La notoria disminución en el número de linfocitos circulantes, particularmente de células T, en la malaria aguda ha estimulado la investigación para explicar tal hallazgo.33 Sobre la base de estudios previos en Ghana, Hviid y colaboradores propusieron un modelo para explicar la alteración del número de células T periféricas luego de la infección con Plasmodium; según esa hipótesis, los eventos apoptóticos suceden tan pronto como se hace el tratamiento y ocurre la curación.32 La linfopenia durante la parasitemia previa al tratamiento se explica por reubicación de linfocitos en sitios de inflamación. En individuos no inmunes hay reducción inicial de los linfocitos y después del tratamiento específico hay incremento de 2–3 veces en unos 7 días, lo cual apoya la hipótesis de la reemergencia y redistribución de estas células.33 La reubicación y la apoptosis suceden en forma paralela. Para alcanzar la homeostasis linfocitaria durante el paludismo humano puede suponerse un balance entre los mecanismos proapoptóticos y los antiapoptóticos, comparable a la situación en otras infecciones, como la del virus de la inmunodeficiencia humana,34 según Kern y Wellinghausen.33
La apoptosis inducida por Fas (fatty acid synthase, llamada también CD95) juega un papel importante en la linfopenia de la malaria por Plasmodium falciparum.35 Es difícil imaginar cómo puede suceder el cambio de linfopenia a linfocitosis si la primera es el resultado de apoptosis generalizada. Hviid y Kemp proponen que la linfopenia inicial refleja la reubicación de células T inducida por la enfermedad a los sitios de inflamación, seguida por la reemergencia de tales células después de la curación.32 Hasta que existan pruebas, esos autores creen que la reubicación/reemergencia permanece como la más plausible explicación de la linfopenia observada en la malaria. Muchos estudios independientes apoyan esta hipótesis y, más recientemente, también la apoya una investigación sobre cambios celulares esplénicos y periféricos en ratones infectados con P. chabaudi,36 según estos investigadores.37
No hay pruebas directas de la expresión de Fas inducida por la malaria sobre las células T y el aumento del nivel sérico del ligando soluble de Fas (sFasL) en el modelo en macacos.37,38 Sin embargo, algunos consideran probable que la apoptosis de células T mediada por Fas esté involucrada en la linfopenia durante la infección malárica.38 Se ha visto que la linfopenia T en la malaria tiene múltiples y diversas causas debido a que la infección palúdica induce una amplia variedad de reacciones del hospedero en cada sistema hospedero–parásito.38 Matsumoto y colaboradores 38 creen que la causa principal de la linfopenia T malárica cambia durante la infección incluso en el mismo hospedero. En la fase inicial, la linfopenia T se debe principalmente a reubicación de células T activadas, pero con el progreso de la enfermedad juega un papel de importancia creciente la apoptosis mediada por Fas. Esta hipótesis concuerda con el hecho de que el grado de linfopenia T se correlaciona con la gravedad de la enfermedad 37 y que las células apoptóticas son difíciles de detectar excepto en pacientes moribundos.37 La linfopenia T parece jugar un papel crucial en la patogénesis de la malaria pero eso aún no está bien caracterizado.38
Son escasos los estudios colombianos sobre las relaciones entre paludismo, parasitosis intestinales y desnutrición y más lo son los que se refieren a las relaciones de esos tres procesos con la anemia. En menores de 15 años y en adultos de El Bagre (Bajo Cauca antioqueño), se halló anemia en 30% de los niños con malaria no complicada y en 10% de los niños sin paludismo, así como en 25% y 20% de los adultos con y sin paludismo, en ese orden.39
En Turbo (Urabá antioqueño), hallamos anemia en 39% de las mujeres y en 51% de los hombres con malaria no complicada.40 En pacientes de la costa Pacífica de Colombia, afectados con paludismo no complicado, se informó que 50% tuvieron anemia leve.41
El presente informe da cuenta del comportamiento temporal de un grupo de variables hematológicas en niños de 4 a 10 años de edad afectados por malaria, evaluados antes del tratamiento antipalúdico y una semana después del mismo, cuando ya estaban curados del paludismo.
MATERIALES Y MÉTODOS
Clase de estudio y diseño muestral
Este estudio forma parte de un proyecto mayor, con diseño experimental, balanceado, con grupos paralelos y asignación aleatoria al grupo, con determinación no ciega del efecto (la respuesta terapéutica). Participaron 93 pacientes con paludismo por P. falciparum (n = 11) o por P. vivax (n = 82). La unidad de análisis fue cada niño con malaria no complicada, según los criterios de la Organización Mundial de la Salud en el año 2000, y sometido a tratamiento antipalúdico.
En 2000–2003, en Turbo y en El Bagre, los niños de 5–14 años con malaria fueron 3.182 por año, con base en los cuales se calculó la muestra.42
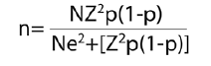
En donde:
n: tamaño de muestra.
N: población de origen, o sea 3.182 niños con malaria con edad de 4–10 años.
Z: unidades Z correspondientes a un intervalo de confianza del 95%, es decir Z = 1,96.
e: error de muestreo, definido en 10% en este trabajo.
p: proporción del 'fenómeno', definida en 50%, para forzar una muestra de máximo tamaño.
1–p:complemento de p.
El fenómeno de interés en el macroproyecto era múltiple y la prevalencia de cada uno variaba, lo que llevó a muestras de diferentes tamaños, así: prevalencia de falla del tratamiento antimalárico (estimada en 0,1 que llevó a n = 34), de parásitos intestinales (estimada en 0,8; n = 60), de desnutrición crónica (0,65; n = 85), de pobreza económica (0,6; n = 90), de todos los cuatro anteriores (0,0312; n = 2); para 'p' con valor 0,5 se obtuvo el mayor tamaño de muestra (n = 93). Se escogió n = 93 para garantizar que la muestra fuese apropiada para todos los fenómenos y se aproximó a 100, de los cuales 50 se estudiaron en El Bagre y 50 en Turbo.
Los pacientes maláricos se captaron según el orden de llegada a los puestos urbanos de malaria en cada municipio. La captación se hizo entre julio de 2004 y julio de 2005. Los niños se captaron si satisfacían los criterios de inclusión y sus acudientes daban el consentimiento por escrito.
Criterios de inclusión
Los pacientes con malaria se admitieron si cumplían todos estos requisitos:
• Tener malaria.
• Tener parasitemia entre 1.000 y 50.000 parásitos asexuales/µL.
• Residir en El Bagre o en Turbo, bien fuera en áreas rurales o en la urbana.
• Tener entre 4 y 10 años de edad.
• Acudir voluntariamente al puesto de diagnóstico de malaria.
• No tener enfermedad aparente distinta de la malaria.
• No tener malaria complicada según los criterios de la Organización Mundial de la Salud.43
• Aceptar la participación en el estudio mediante consentimiento informado y escrito, firmado por el acudiente.
• No haber tenido malaria en los 30 días previos.
Criterios de exclusión
• Presentar alguna otra enfermedad, trauma, accidente o envenenamiento.
• No cumplir con las citas para evaluación los días 1, 2, 3, 7–8, 14–15 y 28–31.
Diagnóstico y tratamiento de la malaria; medición de la respuesta terapéutica
El diagnóstico parasitológico de malaria se hizo según las recomendaciones de la Organización Mundial de la Salud.44 Los medicamentos antimaláricos se obtuvieron en la Dirección Seccional de Salud de Antioquia (DSSA) y se aplicaron, acompañados con agua, según los esquemas de dicha institución y del Ministerio de Protección Social de Colombia. Se aplicaron los tratamientos oficiales vigentes, con supervisión directa por los investigadores. La respuesta al tratamiento se midió con criterios clínicos (desaparición de los síntomas y los signos hallados en la evaluación de ingreso) y parasitarios (eliminación de la parasitemia, según la gota gruesa y el extendido de sangre periférica), de conformidad con los protocolos de la OMS.45–47
Análisis hematológico
En Turbo, las mediciones hemáticas se hicieron con equipo automático Celltac Auto Nihon Khodan® MEK 8118 (Nihon Khodan Co, Tokio, Japan), operado por profesionales. En El Bagre el examen hematológico se hizo en forma manual, por personal profesional y cubrió menos variables que en Turbo. En ambos municipios los exámenes se hicieron en laboratorios locales (Turbo: Hospital Francisco Valderrama y laboratorio particular Unilab; El Bagre: laboratorio particular Medicauca).
La hemoglobina se analizó mediante cianometahemoglobina. Se definió la anemia como el estado en que la hemoglobina está por debajo del valor 'normal' de referencia. La OMS define como anemia las siguientes concentraciones de hemoglobina, según la edad y sexo:48 menos de 11 g/dL entre 6 meses y 6 años; menos de 12 g/dL entre 7 y 14 años; menos de 13 g/dL en hombres; menos de 12 g/dL en mujeres no embarazadas; menos de 11 g/dL en mujeres embarazadas.
La altura media sobre el nivel del mar de ambos municipios es de 50 m, por lo que no se requiere corregir el valor de hemoglobina según esta variable.
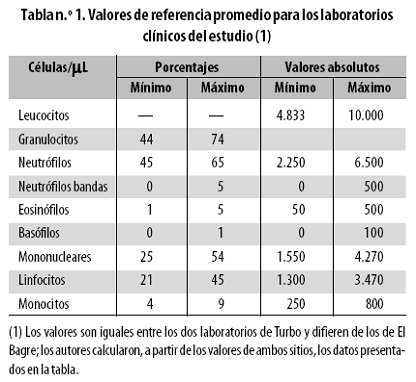
La clasificación morfológica de la anemia se basó en los datos que relacionan el volumen corpuscular medio (VCM) con el ancho de distribución de los eritrocitos (ADE). El VCM es el volumen promedio de los eritrocitos y el ADE es el coeficiente de variación (desviación estándar/promedio) del tamaño eritrocitario, que mide la heterogeneidad de ellos y equivale a la anisocitosis.49 Para menores de 15 años estos son los límites del VCM (fL): 72–92 (valor normal): eritrocitos de tamaño normal (normocitos); menos de 72 (valor menor que el normal): eritrocitos de tamaño disminuido o microcitos; más de 92 (valor aumentado): eritrocitos de tamaño mayor o macrocitos. Los valores del ADE (%) son: ≤ 15,1 (valor normal) indica poca variación en el VCM y las células son homogéneas; > 15,1 (valor aumentado) indica alta variación en el VCM y las células son heterogéneas. Con estos tres valores del VCM y los dos del ADE, resultan seis tipos morfológicos de anemia. Los valores de referencia del leucograma dados por los laboratorios donde se hizo el examen no fueron iguales en Turbo y El Bagre y nosotros promediamos los datos para obtener los resultados de la tabla n.º 1. Esto se pudo hacer porque las variables hemáticas no mostraron diferencias significativas de uno a otro municipio.
Se consideró que había trombocitopenia cuando el recuento era menor de 150.000 plaquetas/µL.18 Con la medición de las plaquetas hubo problemas operativos y, al final, solo se tuvieron los datos de Turbo.
La determinación de ferritina sérica se hizo mediante inmunoensayo enzimático de micropartículas (MEIA). Se usó estuche Abbott AxSYM® System (referencia 7A58–20 B7A583 56–4324/R12, Abbott Laboratorios, USA). Las determinaciones se hicieron en el laboratorio clínico de la IPS de la Universidad de Antioquia. Los valores de referencia para definir como bajos los depósitos de hierro fueron 12 µg/dL en ausencia de infección y 30 µg/dL en presencia de ésta.
Consideraciones éticas
Cada acudiente recibió una explicación detallada del proyecto y firmó el consentimiento informado. El estudio fue avalado por el Comité de Ética del Centro de Investigaciones Médicas de la Universidad de Antioquia.
Análisis estadístico
Para el análisis de los datos se usaron los programas EpiInfo 6.00 y SPSS versión 10. El análisis fundamental consistió en describir las variables con sus medidas de tendencia central y dispersión, básicamente promedio aritmético y desviación estándar.
Se usaron estas expresiones: DE desviación estándar, gl grados de libertad, IC 95% intervalo de confianza de 95% para el promedio o media aritméticos, M–H Mantel y Haenszel, n tamaño del grupo, p probabilidad, X2 chi (ji) cuadrada.
RESULTADOS
En Turbo se evaluó el 52% de los pacientes y en El Bagre, el 48%. P. vivax fue el agente de 88% de las infecciones y de los once casos por P. falciparum, nueve eran de El Bagre. Los hombres representaron 64% de los pacientes. La edad de los niños fue 7,0 ± 1,9 años (mediana 7,0; 4 a 10 años).
Entre 90 niños, 52% mostraron riesgo de desnutrición crónica (talla/edad), 47% de desnutrición global (peso/edad) y 15% de desnutrición aguda. Se hallaron parásitos intestinales en 88% de los niños y eran patógenos en 80%; además, 35% estaban poliparasitados.
La parasitemia previa al tratamiento osciló entre 80 y 40.040 parásitos/µL, con valores medios de 9.812 ± 8.377 para P. vivax y variables entre 200 y 39.200 parásitos/µL, con valores medios de 9.648 ± 11.414 para P. falciparum.
Todos los pacientes se curaron con el tratamiento estándar recibido, excepto dos niños con P. vivax: al día 28–30 se logró captar a 78 de los 82 niños con ese tipo de paludismo y se encontraron parásitos y fiebre en dos de ellos (2,6%: 2/78), es decir que hubo 2 fallas (2,6%) y fueron tardías. Un paciente tenía 32 y el otro 13.640 parásitos/µL; ambos fueron evaluados al día 30. Uno era de Turbo y el otro de El Bagre; sus parasitemias iniciales habían sido 13.470 y 5.800 parásitos/µL, en ese orden.
La fiebre y los parásitos habían desaparecido en todos los niños a las 24 horas de finalizar el tratamiento con cloroquina (malaria por P. vivax) o con amodiaquina (malaria por P. falciparum). Poco después (día 8 del seguimiento), el estado inflamatorio medido con el nivel de proteína C reactiva era de 7 ± 12 mg/L, que es normal, pues el valor de referencia es 8 mg/L. Al contrario, en el momento del ingreso, antes de los tratamientos, la proteína C reactiva era de 75 ± 63 mg/L (P. vivax 76 ± 63; P. falciparum 71 ± 66).
Las variables del hemograma se comportaron igual según la especie de Plasmodium, excepto porque la hemoglobina (K–W = 5,501; gl = 1; p = 0,019010) y el hematocrito (K–W = 5,178; gl = 1; p = 0,022876) difirieron en forma significativa pero únicamente al día 8. Ese día, los valores de hemoglobina fueron 10,4 ± 1,6 g/dL en pacientes con P. vivax y 9,4 ± 0,8 en los que tenían P. falciparum. Por esta razón, en adelante los resultados se presentan para el conjunto de los 93 niños, sin discriminar por especie.
Las variables del hemograma también se comportaron igual según el grupo de tratamiento en dosis única (vitamina A, antiparasitarios, vitamina A + antiparasitarios, ninguno de los anteriores) y por ello en los resultados no se vuelve a referir esta variable.
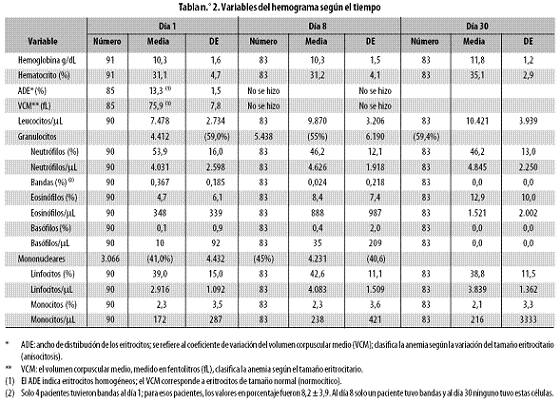
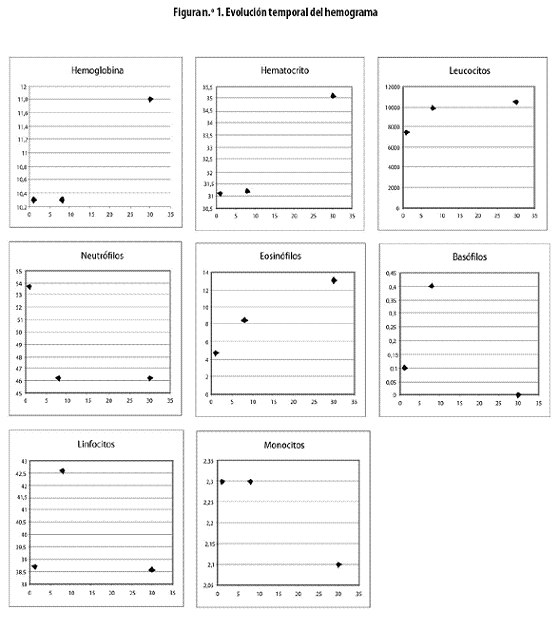
Los valores de las variables del hemograma durante el mes de seguimiento se resumen en la tabla n.º 2 y en la figura n.º 1.
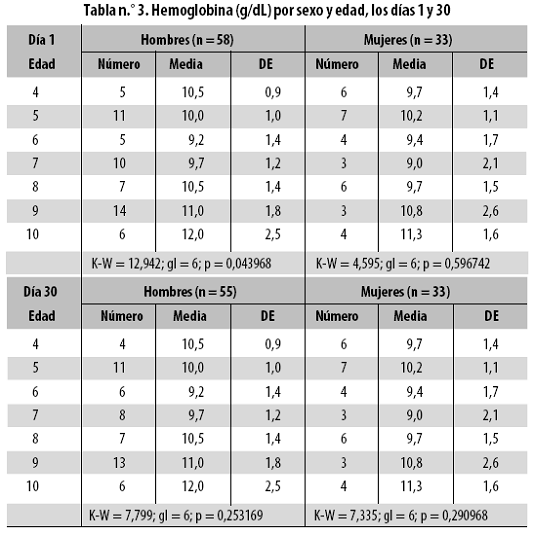
En esa tabla y en cualquier otro lugar, la expresión 'día 1' corresponde al momento previo al tratamiento. El promedio de hemoglobina (10,3 g/dL) indica que al día 1 había anemia y que la situación persistía al día 8, mientras que al día 30 el problema estaba casi superado, pues el promedio había alcanzado 11,8 g/dL, es decir que en tres semanas (día 8 a día 30) se ganaron 1,5 g/dL de hemoglobina. Según el ADE y el VCM, los eritrocitos del día 1 son de tipo homogéneo y normocítico, es decir, la anemia del día 1 era homogénea normocítica. Antes del tratamiento, la hemoglobina fue estadísticamente similar en niños y niñas (10,4 ± 1,7; 10,0 ± 1,6 g/dL, respectivamente) (p = 0,257760), pero por edad (7 grupos) sí hubo diferencia (p = 0,014984), que desapareció en las mujeres y se mantuvo en los hombres al controlar, mediante estratificación, la influencia del sexo (hombres: p = 0,043968; mujeres: p = 0,596742) (Tabla n.º 3).
Al día 30, la hemoglobina fue estadísticamente similar en niños y niñas (11,7 ± 1,1; 11,8 ± 1,3 g/dL, respectivamente) (p = 0,635240) y hubo diferencia por edad (p = 0,040437), que desapareció al controlar por sexo. Conviene decir que el promedio de la hemoglobina en los niños de 4 a 6 años fue bajo al día 1 (10,9 g/dL frente al valor de referencia 11 g/dL) pero fue normal al día 30, con 12,1 g/dL, mientras que en los niños de 7 a 10 años siempre hubo anemia (referencia: 12 g/dL): 9,8 al día 1 y 11,5 al día 30.
Como dato complementario para el estudio de la anemia hallada, se anota que la ferritina del día 1 fue 213 ± 203 µg/dL y la del día 30 fue 32 ± 30 µg/dL (n = 93), es decir que, según los valores de referencia del laboratorio que hizo el análisis, en ninguna de las dos mediciones hubo bajos depósitos de hierro, pues el límite es de 30 µg/dL de ferritina en presencia de infección (estos niños tenían malaria y parasitosis intestinales).
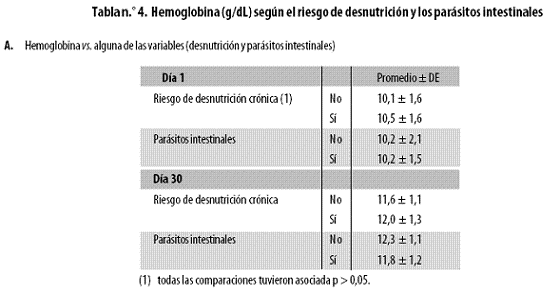
La desnutrición crónica medida con el indicador talla/edad, y la parasitosis intestinal no influyeron significativamente en los niveles de hemoglobina en los días 1 y 30 (Tabla n.º 4, parte A).
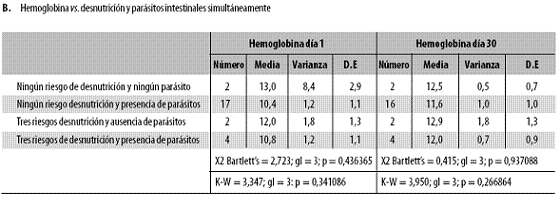
Al reunir los niños según la presencia simultánea de parásitos y desnutrición tampoco se vieron diferencias significativas en ninguno de los dos días, pero sí fue claro que hubo diferencias importantes (Tabla n.º 4, parte B).
Hay que anotar que en ese análisis la presencia/ausencia de parásitos se refiere a que tanto al día 1 como al 30 estaban ausentes o presentes. Igual sucedió con la desnutrición, que además en esa parte B de la tabla n.º 4 se refiere a la presencia/ausencia simultánea de los tres tipos de desnutrición (crónica, aguda, global).
Los niños sin ninguno de los dos problemas tenían niveles de hemoglobina normales en ambos días (día 1: 13,0 ± 2,9 g/dL; día 30: 12,5 ± 0,7 g/dL) y, en el otro extremo, aquellos con ambos riesgos (desnutrición y parásitos) presentaban anemia al día 1 (10,8 ± 1,1) pero no al día 30 (12,0 ± 0,9). Al parecer, tuvo más influencia aunque no estadísticamente significativa la desnutrición que los parásitos, como podría deducirse de los hallazgos en los grupos que tuvieron uno de los riesgos (parásitos o desnutrición) pero no ambos (grupos 'Tres riesgos de desnutrición y presencia de parásitos' y 'Ningún riesgo desnutrición y presencia de parásitos'), donde el primero de los anotados presentó, al día 1, hemoglobina de 10,4 ± 1,1 y el segundo mostró 12,0 ± 1,3, valores con notoria diferencia desde el punto de vista clínico, pues el uno implica anemia y el otro no y, además, la diferencia es importante, pues se trata de 1,6 g/dL de hemoglobina. Al día 30 ambos grupos mostraron mejoría notoria y siempre fue más bajo el nivel de hemoglobina en el primero (11,6 ± 1,0 versus 12,9 ± 1,3).
La fórmula leucocitaria o leucograma tuvo este comportamiento: al día 1 (antes del tratamiento), los niños mostraron 7.478 ± 2.734 leucocitos por µL, valor que es normal; al día 8, luego de curada la malaria, la cuenta subió a 9.870 ± 3.206/µL (en el límite superior normal) y al día 30 llegó a 10.421 ± 3.939/µL, que supera levemente el límite normal de 10.000/µL (hay muy leve leucocitosis). Los granulocitos representaron 59% del total al día 1, 55% al día 8 y 59% al día 30, todos ellos valores dentro del intervalo normal (44–76%, según la referencia) y concordantes con el punto medio de ese intervalo (60%). Lo anterior lleva a decir que, entonces, los mononucleares (linfocitos y monocitos) también tuvieron el porcentaje normal.
En resumen, en el ataque agudo malárico en estos niños con parasitismo intestinal y la mitad con desnutrición crónica leve, hubo una cantidad normal de leucocitos y después de los tratamientos antipalúdico y antiparasitarios, cuando cedía el proceso inflamatorio agudo, hubo tendencia a la leucocitosis.
El recuento diferencial de granulocitos mostró que los neutrófilos bajaron de 54% antes del tratamiento a 46% a los días 8 y 30, todos esos valores en el intervalo normal (45–65%). Por su parte, los eosinófilos subieron fuertemente, al pasar de 4,7% antes del tratamiento a 8,4% al día 8 y 13,0% al día 30. En consecuencia, a partir del día 8 hubo eosinofilia, pues el valor de referencia es 1–5%. Los basófilos representaron 0,1% antes del tratamiento, 0,4% al día 8 y cero al día 30, todos ellos porcentajes normales (referencia: 0–1%).
La fórmula de mononucleares mostró que los linfocitos estuvieron relativamente estables en las tres mediciones, entre 38,7% y 42,6%, e igual sucedió con los monocitos, que estuvieron alrededor de 2,2%. Todos los valores de linfocitos fueron altos (más de 23%, con referencia 23 a 41%) y todos los de monocitos fueron bastante bajos (intervalo de referencia: 3,5–9%), lo que indica linfocitosis y monocitopenia.
En síntesis, durante el episodio agudo malárico el recuento leucocitario fue normal y se pasó, en los 30 días siguientes, hacia una muy leve leucocitosis, con aumento del recuento en 39%, pero sin sobrepasar en forma fuerte el límite superior normal. La fórmula leucocitaria se caracterizó por la disminución de los neutrófilos y basófilos, con aumento de los eosinófilos, asociado esto a linfocitosis leve y monocitopenia marcada, ambas estables (es decir, sin cambio en los 30 días).
El estudio de las plaquetas se pudo hacer solo en Turbo (n = 37) y en el primer día. El mínimo recuento plaquetario fue de 45.000 /µL, el máximo de 517.000, el percentil 25 fue 68.500, la mediana 98.500, el percentil 75 fue 130.300, el promedio 122.000 y la desviación estándar 84.000/µL; es decir, lo típico es la trombocitopenia (menos de 150.000 plaquetas/µL); 80,5% de los niños tuvieron menos de 150.000 plaquetas/µL.
DISCUSIÓN
¿Qué se esperaba desde el punto de vista hematológico en este grupo de niños? Como punto de partida del debate, conviene recordar que el grupo estudiado no lo constituían niños sanos a quienes les dio paludismo y, entonces, se estudiaron antes del tratamiento antimalárico del ataque agudo y durante los 30 días siguientes. Se trató de un grupo que no era sano antes del paludismo, pues lo formaban niños (64% hombres) de 4 a 10 años, con desnutrición crónica en 52% de los casos y desnutrición aguda en 15%; 88% tenían parásitos intestinales (80% de ellos patógenos) y 35% estaban poliparasitados. Salvo dos excepciones, los pacientes se curaron rápida y completamente de su malaria con el tratamiento estándar recibido y las variables del hemograma se comportaron igual según el tratamiento adicional recibido en dosis única (vitamina A, antiparasitario, ambos, ninguno). Así, al día 1 los niños tenían paludismo y a los días 8 y 30 estaban curados del ataque palúdico agudo. En consecuencia, los cambios hemáticos del día 1 y de los días 8 y 30 están afectados tanto por la malaria aguda, en proceso de curación o ya curada, como por los parásitos intestinales y la desnutrición de larga data.
La anemia presente antes del tratamiento, según el nivel de hemoglobina, fue leve (10,3 g/dL frente a un valor esperado de 11 o más g/dL en niños de 6 meses a 6 años y de 12 o más g/dL en los de 7–14 años). Muy importante fue la recuperación del nivel de hemoglobina observada en 20 días de seguimiento (días 8 a 30), pues los niños anémicos casi lograron niveles normales. Según los datos presentados, parece más importante el papel del estado nutricional que el de las parasitosis, y parece que la anemia es más importante en los niños escolares (7–10 años) que en los preescolares (4–6 años). No fue claro el papel jugado en esto por el tratamiento antiparasitario y el suplemento de vitamina A. El tamaño pequeño de los grupos impide profundizar en este análisis.
La ferritina es la principal forma de almacenamiento de hierro en el organismo y los tejidos con mayor cantidad son el hígado y la médula ósea, que contienen dos tercios de la ferritina disponible; solo una pequeña cantidad está en circulación. Se calcula que 1 ng de ferritina sérica por mL equivale a 8–10 mg de hierro en los depósitos. Si el nivel plasmático de hierro disminuye, la ferritina almacenada libera fácilmente el hierro.50 El valor de ferritina hallado al día 30 (32 ± 30 µg/dL) es normal en presencia de infección, como la de estos niños (muchos de ellos con parásitos intestinales ese día), pero es claro que ese valor está muy cercano al límite inferior normal (30 µg/dL), lo que es compatible con el estado de desnutrición crónica que afectaba a 52% de los pacientes y revela, entonces, escasos depósitos de hierro en el organismo. El elevado valor de ferritina del día 1 (213 ± 203 µg/dL) se explica por la reacción inflamatoria de fase aguda existente en ese momento, debida a la parasitosis intestinal y, sobre todo, a la malaria, que provoca una intensa modificación de las proteínas de fase aguda, entre ellas la ferritina, que se eleva fuertemente en esta enfermedad.51 Algunas proteínas plasmáticas viscerales o de transporte (como la proteína de unión de retinol, la proteína de unión de tiroxina, la albúmina y la transferrina) son reactantes negativos de la respuesta de fase aguda, es decir, que su nivel se reduce en forma notoria durante este período, contrario a lo que sucede con los reactantes positivos, que se incrementan, como acontece con la ceruloplasmina, la haptoglobina, la hemopepsina, la proteína C reactiva, la alfa–1 glucoproteína ácida y la alfa–1 quimotripsina, entre otras.
Como se dijo, durante el episodio agudo malárico el recuento leucocitario fue normal y se pasó, en los 30 días siguientes, a una muy leve leucocitosis, con aumento del recuento en 39%, pero sin sobrepasar en forma fuerte el límite superior normal. La fórmula leucocitaria se caracterizó por la disminución de los neutrófilos y basófilos, con aumento de los eosinófilos, asociado esto a linfocitos normales y monocitopenia marcada, ambas estables (es decir, sin cambio en los 30 días). Estos hallazgos no coinciden con lo referido por otros autores, sobre 'la notoria disminución en el número de linfocitos circulantes'.33
Otros han dicho que la linfopenia es típica de la malaria por P. falciparum y que es seguida por linfocitosis en cuestión de pocos días después de iniciada la farmacoterapia, y antes de la normalización gradual que sucede durante un par de semanas.32
Tampoco fue este nuestro hallazgo, pues la cuenta de linfocitos fue siempre normal, tanto antes como después del tratamiento.
Hay informes de que la trombocitopenia (menos de 150.000 plaquetas/µL)18 ocurre con alta frecuencia en el paludismo y tanto Plasmodium falciparum como P. vivax se asocian con trombocitopenia malárica.19 Nuestros datos señalan que hubo trombocitopenia en 80,5% de los niños, cuando llegaron al estudio. En Turbo, en adultos con malaria por P, vivax no complicada, hallamos 8% con plaquetopenia40 y en otros con malaria falciparum o vivax no complicada encontramos 71% con esta alteración, sin diferencia por especie plasmodial y estadísticamente más frecuente en hombres.19 Como causa de la trombocitopenia malárica algunos proponen la destrucción mediada por anticuerpos antiplaquetarios, y otros, el exagerado proceso de secuestro esplénico, aunque informes recientes indican que el secuestro plaquetario, en pacientes con malaria no complicada, no se limita al bazo ni al hígado sino que tal fenómeno ocurre en muchos sitios.19
En conclusión, estos niños de 4 a 10 años de edad, con malaria (90% por P. vivax), parásitos intestinales y desnutrición crónica, tuvieron anemia de grado leve antes del tratamiento, que se recuperó en 30 días a partir del tratamiento antimalárico; 80% padecieron también trombocitopenia; el leucograma mostró, al día 1, neutropenia y basopenia, con eosinofilia, junto con linfocitos normales y monocitopenia marcada.
Declaración de conflictos
Ninguno para manifestar.
Financiación
Este proyecto fue financiado por la Dirección Seccional de Salud de Antioquia y la Universidad de Antioquia.
AGRADECIMIENTOS
A los directivos, empleados y pacientes de los hospitales locales de Turbo y El Bagre por su colaboración y participación en la investigación. Al personal del Grupo Malaria–Universidad de Antioquia por su trabajo en el campo (captación, seguimiento y evaluación de los pacientes).
REFERENCIAS BIBLIOGRÁFICAS
1. Baron S. Medical Microbiology. 4th ed. Galveston: University of Texas, Medical Branch, 1996. [ Links ]
2. López–Álvarez XL, Pérez–Lorenzo N. Estudio de una anemia. http://www.fisterra.com/guias2/anemia.asp. Consulta: 7 diciembre 2007 [ Links ]
3. MSD. Merck Sharp & Dohme de España S.A. http://coli.usal.es/Web/educativo/biblioteca/cursosonline.alu/manual12/www.msd.es/manual12/oct59.html. Consulta: 7 diciembre 2007 [ Links ]
4. Llanos C, Flórez MH, Arévalo–Herrera M, Herrera S. Mecanismos de generación de anemia en malaria. Colombia Médica 2004; 35: 205–214. [ Links ]
5. Blair S, Álvarez G, Villa A, Carmona–Fonseca J, Ríos L. Estado nutricional y niveles de inmunoglobulinas y citocinas en niños con malaria. An Pediatr (España) 2003; 58: 418–424. [ Links ]
6. Blair S, Carmona J, Correa A. Malaria en niños: relaciones entre nutrición e inmunidad. Rev Panam Salud Pública 2002; 11: 5–14. [ Links ]
7. Carmona–Fonseca J. Malaria, desnutrición y parasitosis intestinal en los niños colombianos: interrelaciones. Iatreia 2004; 17: 354–369. [ Links ]
8. Carmona–Fonseca J, Correa–Botero A, Alcaraz–López G. Población, alimentación y estado nutricional entre los tules (kunas) del resguardo Caimán Nuevo (Turbo y Necoclí; Antioquia, Colombia), 2003–2004. Iatreia 2005; 18: 259–278. [ Links ]
9. Correa AM, Carmona–Fonseca J, Alcaraz GM. Malaria entre la población Tule (Kuna) del resguardo Caimán Nuevo (Turbo y Necoclí; Antioquia, Colombia), 2003–2004. Invest Educ Enfermería (Medellín) 2005; 23: 17–33. [ Links ]
10. Correa A, Guzmán V, Carmona–Fonseca J, Blair S, Morales D. Alimentación y malaria: una aproximación biosocial. Invest Educ Enfermería (Medellín) 2002; 20: 30–47. [ Links ]
11. Guzmán V, Correa A, Carmona–Fonseca J, Blair S. Seguridad alimentaria y nutricional en un espacio de riesgo para malaria. Arch Latinoam Nutrición 2003; 53: 227–237. [ Links ]
12. Lunn PG, Northrop CA, Waineright M. Hypoalbuminemia in energy–malnourished rats infected with Nippostrongylus brasiliensis (Nematoda). J Nutr 1988; 118: 121–127. [ Links ]
13. Lunn PG, Northrop–Clewes CA. The impact of gastrointestinal parasites on protein–energy malnutrition in man. Proc Nutr Soc 1993; 52: 101–111. [ Links ]
14. Solomons N. Pathways to the impairment of human nutritional status by gastrointestinal pathogens. Parasitology 1993; 107 (Suppl.): 19–35. [ Links ]
15. Solomons NW, Scott ME. Nutritional status of host populations influences parasitic infections. En: Scott M, Smith G, eds. Parasitic and Infectious Diseases. Epidemiology and Ecology. San Diego: Academic Press, 1994. p. 101–114. [ Links ]
16. Stephenson LS. The impact of helminth infections on human nutrition. London: Taylor and Francis, 1987. [ Links ]
17. Van Houtert MFJ, Sykes AR. Implications of nutrition for the ability of ruminants to withstand gastrointestinal nematode infections. Int J Parasitol 1996; 26: 1151–1168. [ Links ]
18. Greer JP, Foerster J, Lukens JN, Rogers GM, Paraskevas F, Glader BE. Wintrobe's Clinical Hematology. 11ª ed. Philadelphia: Lippincott Williams Wilkins, 2003. [ Links ]
19. Ríos–Orrego A, Álvarez–Castillo T, Carmona–Fonseca J, Blair–Trujillo S. Evolución temporal de las plaquetas y los anticuerpos antiplaquetarios en pacientes de área endémica con malaria no complicada. An Med Interna (Madrid) 2005; 22: 561–568. [ Links ]
20. Kakar A, Bhoi S, Prakash V, Kakar S. Profund thrombocytopenia in Plasmodium vivax malaria. Diagn Microbiol Infect Dis 1999; 35: 243–244. [ Links ]
21. Kelton JG. Inmune–mediated thrombocytopenia of malaria. J Clin Inv 1983; 71: 832–836. [ Links ]
22. Mohanty D, Marwaha N, Ghosh K, Sharma S, Garewal G, Shah S, et al. Functional and ultrastructural changes of platelets in malaria infection. Trans R Trop Med Hyg 1988; 82: 369–375. [ Links ]
23. Ohtaka M, Ohyashiki K, Iwa Buchi H, Iwaabuchi A, Lin KY, Toyama K. A case of vivax malaria with thrombocytopenia suggesting immunology mechanism. Rinsho Ketsueki (resumen) 1993; 34: 490–92. [ Links ]
24. Touze JE, Mercier P, Rogier C. Platelet activity in malaria thrombocytopenia. Phatol Biol 1990; 38: 678–681. [ Links ]
25. Yamaguchi S, Kubota T, Yamagishi T. Severe thrombocytopenia suggesting immunological mechanism in two cases of vivax malaria. Am J Hematol 1997; 56: 183–186. [ Links ]
26. Karanika G, Zedwitz–Liebenstein K, Eidherr H, Schuetz M, Sauerman R, Dudczak R, et al. Platelet kinetics and scintigraphic imaging in thrombocytopenic malaria patients. Thromb Haemost 2004; 91: 553–557. [ Links ]
27. Srichaikul T. Hematologic changes in human malaria. J Med Assoc Thai 1973; 56: 658–663. [ Links ]
28. Essien E, Ebhota M. Platelet secretory activities in acute malaria (Plasmodium falciparum) infection. Acta Haematologica 1983; 70: 183–188. [ Links ]
29. Ladhani S. Lowe B, Cole AO, Kowuondo K, Newton CR. Changes in white blood cells and platelets in children with falciparum malaria: relationship to disease outcome. Br J Haematol 2002; 119: 839–847. [ Links ]
30. Khan AS, Malik SA. Haematological changes in falciparum malaria and tumor necrosis factor. J Pak Med Assoc 1996; 46: 198–201. [ Links ]
31. Fialon P, Macaigne F, Becker M, Boisseau MR, Cazenave J, Ripert C. Hematologic features in imported malaria. Value for the diagnosis of forms with low parasitemia. Pathol Biol (Paris) 1991; 39: 122–125. [ Links ]
32. Hviid L, Kurtzhals JAL, Goka BQ, Oliver–Commey JO, Nkrumah FK, Theander TG. Rapid reemergence of T cells into peripheral circulation following treatment of severe and uncomplicated Plasmodium falciparum malaria. Infect Immun 1997; 65: 4090–4093. [ Links ]
33. Kern P, Wellinghausen N. What is the cause of lymphopenia in malaria? Reply. Infect Immun 2000; 68: 6087–6088. [ Links ]
34. Cossarizza A, Stent G, Mussini C, Paganelli R, Borghi V, Nuzzo C, et al. Deregulation of the CD95/CD95L system in lymphocytes from patients with primary acute HIV infection. AIDS 2000; 14: 345–355. [ Links ]
35. Kern P, Dietrich M, Hemmer C, Wellinghausen N. Increased levels of soluble Fas ligand in serum in Plasmodium falciparum malaria. Infect Immun 2000; 68: 3061–3063. [ Links ]
36. Helmby H, Johnsson G, Troye–Blomberg M. Cellular changes and apoptosis in the spleens and peripheral blood of mice infected with bloodstage Plasmodium chabaudi chabaudi AS. Infect Immun 2000; 68: 1485–1490. [ Links ]
37. Hviid L, Kemp K. What is the cause of lymphopenia in malaria? Infect Immun 2000; 68: 6087. [ Links ]
38. Matsumoto JS, Kawai K, Terao MK, Yasutomi Y, Aikawa M, Matsuda H. What is the cause of lymphopenia in malaria? Reply. Infect Immun 2000; 68: 6088–6089. [ Links ]
39. Blair S, Álvarez G, Campuzano G. Relación entre anemia y malaria en una población rural de Colombia. Bol Dir Malariol y San Amb (Venezuela) 1997; 37: 7–13. [ Links ]
40. Echeverri M, Tobon A, Alvarez G, Carmona J, Blair S. Clinical and laboratory findings of Plasmodium vivax malaria in Colombia, 2001. Rev Inst Med Trop Sao Paulo 2003; 45: 29–34. [ Links ]
41. Zamora F, Ramírez O, Vergara J, Arevalo–Herrera M, Herrera S. Hemoglobin levels related to days of illness, race, and Plasmodium species in Colombian patients with uncomplicated malaria. Am J Trop Med Hyg 2005; 73 (Suppl. 5): 50–54. [ Links ]
42. Martínez–Bencardino C. Muestreo. Bogotá: Ecoe, 1984. [ Links ]
43. World Health Organization WHO. Severe falciparum malaria. Severe and complicated malaria. 3th ed. Trans R Soc Trop Med Hyg 2000; 94 (Suppl. 1): S1–S88. [ Links ]
44. López–Antuñano FJ. Diagnóstico microscópico de los parásitos de la malaria en la sangre. En: López–Antuñano FJ, Schmunis G, eds. Diagnóstico de malaria. Washington: OPS–OMS; 1988: 39–50. [ Links ]
45. Organización Mundial de la Salud OMS, Organización Panamericana de la Salud OPS. Evaluación de la eficacia terapéutica de los medicamentos para el tratamiento del paludismo por Plasmodium falciparum sin complicaciones en las Américas. Documento OPS/HCP/HCT/113/98. Washington: OMS–OPS, 1998. [ Links ]
46. World Health Organization WHO. A general guide for the assessment of therapeutic efficacy of chloroquine for vivax malaria (working draft). Version 3. 07–05–2001. Geneva: WHO, 2001. [ Links ]
47. World Health Organization WHO. Assessment and monitoring of antimalarial drug efficacy for the treatment of uncomplicated falciparum malaria. Documento WHO/CDS/CSR/RMB. Geneva: WHO, 2003. [ Links ]
48. Organización Panamericana de la Salud OPS. Anemia: hematología para un diagnóstico básico. Washington DC: OMS–OPS; 1986. Serie Paltex, n.º 14. [ Links ]
49. Campuzano–Maya G. Aproximación al diagnóstico etiológico del paciente con anemia. Laboratorio al día (Medellín) 1995; 5: 195–204. [ Links ]
50. Campuzano G. Ferritina. Laboratorio al día (Medellín) 1997; 7: 527–532. [ Links ]
51. Seyrek A, Kocyigit A, Erel O. Essential trace elements selenium, zinc, cooper, and iron concentrations and their related acute–phase proteins in patients with vivax malaria. Biol Trace Elem Res 2005; 106: 107–115. [ Links ]
Recibido: diciembre 12 de 2008
Aceptado: marzo 22 de 2008