Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.21 no.4 Medellín Oct./Dec. 2008
ARTÍCULO DE REVISIÓN
Enfermedad renal crónica asociada a diacetilmorfina (heroína)
Heroin–associated chronic kidney disease
Jon Kepa Balparda Arias1
1 Estudiante de Medicina, monitor editorial de la Escuela de Ciencias de la Salud, traductor inglés español de la Revista Medicina UPB, miembro avanzado del Semillero de Investigación SIFAM, Universidad Pontificia Bolivariana, Medellín, Colombia.
Dirección de contacto: jonbalparda@gmail.com
Resumen
El abuso de sustancias sicoactivas es un problema mundial de grandes proporciones, y no es infrecuente que se asocie a daño renal crónico. Los principales cuadros patológicos renales asociados al uso de heroína son: el síndrome nefrótico, la amiloidosis, la nefritis intersticial y la glomerulonefritis aguda. El cuadro clínico y el tratamiento son los mismos de la enfermedad renal crónica en general, sea primaria o secundaria, según el estadio en que se encuentre. Se presenta en este artículo una revisión de la nefropatía asociada al consumo de heroína; se incluyen aspectos químicos y biológicos de la heroína, así como la epidemiología y la fisiopatología de la enfermedad.
Palabras clave: Dependencia a la heroína, Enfermedad renal crónica, Insuficiencia renal
Summary
Abuse of psychoactive substances is a huge worldwide problem, and its association with chronic renal damage is not an uncommon complication. The main pathologic syndromes which have been associated with heroin abuse include: nephrotic syndrome, amyloidosis, interstitial nephritis and acute glomerulonephritis. From the clinical and therapeutic points of view, the chronic renal damage associated with heroin abuse does not differ from the chronic kidney disease in general, regardless of its etiology. In this article a review is presented on chemical and biological aspects of heroin, as well as on the epidemiology and physiopathology of the heroin–associated nephropathy.
Key words: Chronic kidney disease, Heroin dependence, Renal insufficiency
INTRODUCCIÓN
El abuso de sustancias psicoactivas es un problema mundial común e importante;1–3 estudios recientes demuestran que hasta el 46% de las personas se expondrán a ellas por lo menos una vez en la vida, y que 19 millones de estadounidenses mayores de 12 años han usado algún tipo de alucinógeno en el último mes.4 En Colombia hay datos similares: Martínez y colaboradores5 demostraron que las frecuencias de uso de marihuana y tranquilizantes en adolescentes son de 4,4% y 3,1%, respectivamente. No es raro el daño renal crónico en pacientes abusadores de sustancias alucinógenas:6 se ha demostrado una relación importante entre el uso a largo plazo de heroína y la posterior aparición de síndrome nefrótico, amiloidosis, nefritis intersticial y glomerulonefritis aguda.7–13
Heroína, aspectos químicos y biológicos
La heroína (diacetilmorfina) es un opiáceo semisintético14,15 derivado de la morfina, una sustancia natural extraída de la Papaver somniferum, planta común en Europa y Asia.4 Con un tiempo de vida media de 3,3 minutos, la concentración sérica máxima se obtiene después de 1 minuto de haberla administrado por inhalación, según lo informado por Jenkins y colaboradores.16 Se han obtenido datos similares con estudios sobre la administración parenteral del mismo compuesto:16 es importante mencionar que la droga administrada por vía intravenosa genera efectos euforizantes4 hasta cuatro veces más potentes que la misma dosis por vía intranasal.17 Una vez absorbido por cualquiera de las rutas, este compuesto cruza rápidamente la barrera hematoencefálica para transformarse en su metabolito activo, la morfina, y activar los receptores del sistema opioide para ejercer su acción a nivel central.4
El sistema opioide contiene tres subtipos de receptores cerebrales: mu (μ), kappa (κ) y delta (δ).18 Se ha postulado que los principales en la génesis de la adicción a estos compuestos son los del subtipo mu, por cuanto ratones transgénicos (knockout) cuyo sistema nervioso central carece de ellos no muestran ningún efecto de recompensa o refuerzo frente a la administración de morfina.19 Igualmente, estudios de neuroimaginología y genética han demostrado que alteraciones en el nivel de receptores mu son factores predisponentes fundamentales en la adicción a la heroína y a compuestos opiáceos similares.20–24 También es evidente el rol de los receptores kappa y delta: los kappa reducen la función dopaminérgica en el núcleo accumbens,25,26 (característica de la que carecen los mu) lo que parece estar implicado en las reacciones de disforia características del ictus en el consumo de heroína. En cuanto a los receptores delta, están implicados en reacciones disfóricas intensas y pueden participar en el cuadro clínico del paciente agudamente intoxicado por opiáceos.
Un análisis profundo acerca del mecanismo de acción neuronal de la heroína y de los procesos que regulan su efecto de recompensa se encuentra claramente por fuera de los alcances de este manuscrito. Para el lector interesado en el tema, es recomendable el artículo de Lingford–Hughes y Nutt,18 publicado en 2003 en el British Journal of Psychiatry.
EPIDEMIOLOGÍA
A pesar del marcado aumento mundial en el consumo y abuso de heroína,27 la incidencia de nefropatía asociada a ella (NAH) ha disminuido, paradójicamente, desde 1992 por razones aún desconocidas.4
Resulta de interés mencionar las importantes diferencias raciales y de sexo informadas en el abuso de esta droga y en la nefropatía crónica asociada a ella. Lebeau–Craven28 y colaboradores reportaron que, en Estados Unidos, los adolescentes blancos no hispánicos son más propensos que los de otras razas al uso de cocaína, heroína y otros alucinógenos. Un estudio adicional halló que, en un determinado momento, hay tres veces más blancos que negros adictos a la heroína.4 Por otra parte, en un estudio llevado a cabo en Massachussets29 se halló que los adolescentes blancos no hispánicos eran 4,5 veces más dados que los blancos de ascendencia latina a comportamientos de alta peligrosidad con el uso de drogas IV, tales como compartir agujas.
En cuanto a la diferencia por sexos en la población abusadora de heroína, Soza–Zapata30 y colaboradores encontraron, en una cohorte de 412 abusadores de esta droga en forma no inyectada, que solo el 18% eran mujeres. Es de destacar que, en esta cohorte, el 26% de las mujeres y solo el 3% de los hombres tenían antecedentes de infecciones de transmisión sexual.30 Investigadores en Israel31 y Estados Unidos32 han informado resultados similares en cuanto a las diferencias por sexo en el abuso y el manejo de esta droga. Sin embargo, se ha encontrado que las mujeres tienden a utilizar dosis mucho más altas (hasta el doble) de opiáceos que los hombres.33
A pesar de los datos expuestos, es de notar que los índices de NAH son considerablemente más altos en los negros que en los otros grupos raciales.34,35 En 1983, un estudio hecho por Cunningham y colaboradores34 reportó que el 93,9% de los pacientes con NAH eran de raza negra. En un estudio similar que evaluó la etiología de la insuficiencia renal crónica (IRC) en minorías de Estados Unidos35 se encontró igualmente que la NAH era de 'gran importancia en los jóvenes negros'. La NAH es más común en hombres: en efecto, solo el 24,5% de los casos reportados de esta complicación se presentan en mujeres.4
Desde 1980 se ha considerado que la NAH es una causa relativamente importante de insuficiencia renal crónica en hombres jóvenes de raza negra;8,34–37 en la actualidad se estima que una persona consumidora de esta droga tiene 19,1 veces más probabilidad de desarrollar IRC u otro tipo de nefropatía crónica que una no consumidora.38 Sin embargo, se carece de datos específicos acerca de su incidencia y prevalencia reales.
FISIOPATOLOGÍA
Los primeros informes de cambios renales secundarios al uso parenteral crónico de heroína, cocaína y anfetaminas aparecieron a finales de la década de 1960 y principios de la de 1970.12,39–46 Desde entonces, se ha visto un aumento exponencial en el número de investigaciones centradas en este fenómeno, lo que concuerda con un marcado crecimiento mundial del abuso de estas sustancias.1,3
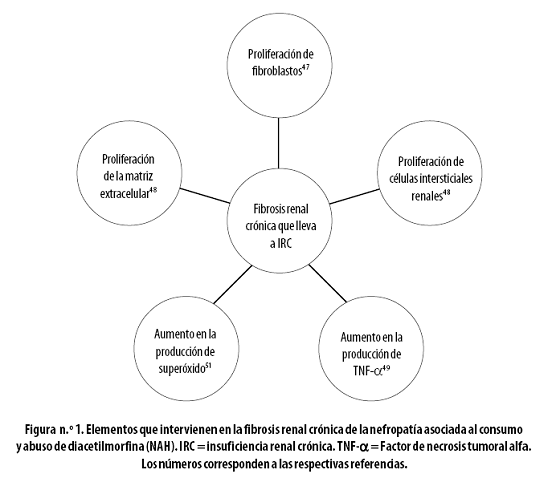
Aún no existe un modelo in vivo de la NAH, pero ha habido estudios in vitro que han dado alguna información acerca de la fisiopatología de este síndrome.47–49 En dichos modelos experimentales se ha encontrado una interacción directa de la morfina (metabolito activo de la diacetilmorfina) con las células intersticiales del riñón provocando, especialmente, una proliferación de los fibroblastos renales por medio de la activación patológicamente temprana de genes de crecimiento celular.47 Este elemento celular puede ser importante, dado que la fibrosis intersticial es uno de los componentes esenciales que se observan en la biopsia renal en pacientes con IRC.50
En otro estudio in vitro, publicado en 1997,48 se buscó evaluar el efecto de la morfina en la proliferación de células intersticiales renales y de la matriz extracelular en células renales derivadas de ratas. Se encontró que el opiáceo en cuestión aumentaba la proliferación de las células intersticiales renales con respecto al control por medio de un efecto dependiente de la dosis y del tiempo (p < 0,001). La administración de morfina causó también la acumulación de colágeno de los tipos I y III en la matriz extracelular, dando lugar a una extensa fibrosis dependiente de la dosis.48 Estos hallazgos sustentan aún más la noción de que la fibrosis y la glomeruloesclerosis secundarias pueden ser elementos fundamentales en la fisiopatología de la NAH.47,51
La lesión de las células mesangiales también parece desempeñar un papel en el desarrollo del daño renal secundario a opiáceos: Shingal y colaboradores51 demostraron que la morfina induce la producción de superóxido por las células mesangiales, lo que provoca un daño celular importante, con una reacción de estrés oxidativo; se sabe que esto lleva a una reacción inflamatoria y al ulterior reclutamiento de fibroblastos.52
Se ha demostrado que en las células glomerulares epiteliales la heroína tiene un doble efecto dependiente de la dosis: si es baja, estimula la proliferación mientras que si es más alta, induce la apoptosis.53 En este mismo estudio se halló que el uso de antioxidantes hacía disminuir estos efectos de la heroína sobre las células glomerulares epiteliales, lo que sugiere que el estrés oxidativo tiene una función importante en este punto.53
En resumen, los estudios in vitro señalan al menos dos procesos clave en la patogenia de la NAH: el aumento de células y compuestos inflamatorios47–49 y el estrés oxidativo crónico;51,53 ambos llevan a un final común que es la fibrosis renal crónica, con la subsiguiente merma de la función renal global del paciente,4 (Figura n.º 1) lo que acarrea, en último término, los cambios fisiológicos clásicos de la insuficiencia renal crónica.50
CUADRO CLÍNICO
La presentación clínica del paciente con nefropatía crónica asociada al uso de diacetilmorfina (NAH) es similar a la de quien sufre de una enfermedad renal crónica (ERC) de cualquier otra etiología,32 y depende esencialmente del estadio de la enfermedad.54 Por ello es pertinente mencionar algunos elementos generales de la ERC y la IRC como estados finales comunes de un sinnúmero de elementos que pueden atacar el riñón.55,56
Se define la enfermedad renal crónica como la pérdida progresiva e irreversible de la función renal, que puede ser secundaria a muchas causas; se expresa inicialmente como un aumento en los niveles séricos de creatinina y nitrógeno ureico (BUN).54 Para que se pueda establecer el diagnóstico, se debe encontrar un daño renal que date, al menos, de tres meses, demostrado por histopatología o por marcadores de dicho daño con o sin disminución de la tasa de filtración glomerular (TFG).50 También se puede hacer el diagnóstico de enfermedad renal crónica si se encuentra una disminución de la TFG por un período de tres meses o más, incluso si no se cuenta con otros marcadores de daño renal como el histopatológico.50
Los pacientes con ERC pueden no presentar ningún síntoma o signo clínico que la haga sospechar,57 pero en los estadios más avanzados se pueden desarrollar, entre otras, las siguientes complicaciones: hipertensión arterial,57 azoemia,58,59 hiperkalemia,60–62 anemia,50,63,64 sobrecarga de volumen,58 edema pulmonar,58,65,66 acidosis metabólica67,68 y muerte.50,69–71 Por lo anterior, es de importancia tener en cuenta los factores individuales de riesgo y tamizar adecuadamente por medio de pruebas de laboratorio costo–efectivas con el fin de hacer el diagnóstico lo más tempranamente posible.60
La estratificación de los pacientes con ERC se lleva a cabo midiendo la tasa de filtración glomerular72,73 en la muestra de orina de 24 horas;50 también es posible hacerla de manera rápida por medio de la fórmula de Cockroft–Gault,54,74 como se muestra en la figura n.º 2.
Los distintos estadios de la enfermedad renal crónica con base en la tasa de filtración glomerular se muestran en la tabla n.º 1;74 se debe tener en cuenta que un paciente con ERC en estadio 4 se considera en riesgo inminente de requerir tratamiento de reemplazo renal, por lo que es obligatoria su pronta remisión a un nefrólogo para evaluación y tratamiento prediálisis.75
El paciente en estadio 5 se considera en falla renal y requiere terapia permanente de reemplazo renal (hemodiálisis o diálisis peritoneal).50
Para el lector interesado en ahondar más en el tema de la ERC se recomiendan las guías publicadas por el Colegio Real de Médicos (Royal College of Physicians) y el Colegio Real de Médicos Generales (Royal College of General Practitioners) en la página web de la Asociación Renal (Renal Association).76
TRATAMIENTO
El tratamiento de la NAH es el mismo de la enfermedad renal crónica de cualquier otra etiología.4 Al respecto, resulta ineludible que el paciente suspenda el uso de la heroína;6 se ha recomendado, igualmente, la suspensión del uso del tabaco si el individuo es fumador.76,77 Johnson y colaboradores6 aconsejan también la pérdida de peso si el paciente se encuentra por encima del ideal. Las guías británicas76 recomiendan incentivar el ejercicio aeróbico y disminuir el consumo de bebidas alcohólicas.
Es importante tratar adecuadamente las enfermedades concomitantes, tales como la diabetes mellitus78–80 y la hipertensión arterial.80,81 Cabe mencionar que algunos antihipertensivos, especialmente los inhibidores de la enzima convertidora de angiotensina (IECA) y los antagonistas del receptor de angiotensina II (ARAII) poseen 'una acción de protección orgánica independiente del efecto [...] hipotensor', al reducir esencialmente la presión intraglomerular.82
Se ha demostrado desde hace décadas83–86 que la estricción de proteínas en la dieta es una medida válida para retrasar la tasa de pérdida de la función renal.83 Al respecto, según D'Achiardi y Ariza,82 'una dieta con aporte proteico de 0,58 g/kg/día en pacientes con insuficiencia renal crónica avanzada, retarda la pérdida de la tasa de filtración glomerular'.
Sin embargo, recientemente se ha puesto en tela de juicio la verdadera efectividad de esta restricción dietética, especialmente en pacientes con cuadros renales leves a moderados82,87,88 y en niños.89
El tratamiento inicial de la anemia secundaria a la enfermedad renal crónica se hace con suplemento oral o parenteral de hierro.82 Si el enfoque inicial no da los resultados que se esperan, se puede recurrir a la eritropoyetina administrada por vía subcutánea o intravenosa90 a la dosis de 50 a 150 UI/kg/semana.84
Con el fin de corregir la osteodistrofia renal, se requiere normalizar los niveles séricos de paratohormona, calcio y fósforo,91,92 principalmente en quienes se encuentran en un estadio avanzado de la enfermedad.84 Se recomienda la administración de calcio oral a las dosis usuales y el uso de quelantes de fósforo, además de la administración de vitamina D3 y calcitriol en pulsos orales.84 Schlosser y colaboradores92 recomiendan la paratiroidectomía en pacientes con cuadros clínicos refractarios, 'en vista del riesgo de calcificaciones vasculares potencialmente letales que se desarrollan en la mayoría de los adultos que desarrollaron enfermedad renal crónica en la infancia'.
CONCLUSIÓN
Es común el daño renal secundario al abuso de sustancias psicoactivas, incluyendo la diacetilmorfina,6 y representa una carga social y económica en vista de su relación con el desarrollo de enfermedad renal crónica avanzada.13 El médico debe estar atento a las posibles complicaciones derivadas del abuso de estas sustancias, y hacer evaluaciones seriadas de los marcadores de daño renal,11 especialmente de los niveles séricos de creatinina y nitrógeno ureico (BUN) por su facilidad y confiabilidad.50
No existe un tratamiento específico para la nefropatía asociada a la heroína,4 diferente del cese en el uso de la droga.6 Se debe enfocar al paciente como a cualquier otro individuo con ERC según las guías internacionales disponibles,76 y remitirlo prontamente al médico especialista en caso de que se encuentre en estadio prediálisis.84
AGRADECIMIENTOS
El autor agradece la asesoría y apoyo oportunos e incondicionales de las siguientes personas: doctores John Mauricio Lopera, Margarita María Agudelo y Mónica Uribe; bacterióloga especialista Lina María Martínez Sánchez; estudiante de medicina María Elizabeth Gaviria Barrera.
REFERENCIAS BIBLIOGRÁFICAS
1. Fields B. Patients with substance abuse problems: Effective identification, diagnosis and treatment. Issues Ment Health Nurs 2007; 8: 1345–1346. [ Links ]
2. Clatts MC, Giang le M, Goldsamt LA, Yi H. Novel heroin injection practices: Implications for transmission of HIV and other bloodborne pathogens. Am J Prev Med 2007; 32: S226–233. [ Links ]
3. Dong Y, Winslow M, Chan YH, Subramaniam M, Whelan G. Benzodiazepine dependance in Singapore. Subst Use Misuse 2007; 42: 1345–1352. [ Links ]
4. Jaffe JA, Kimmel PL. Chronic nephropaties of cocaine and heroin abusers. A critical review. Clin J Am Soc Nephrol 2006; 1: 655–667. [ Links ]
5. Martínez JA, Amaya W, Campillo HA, Rueda GE, Campo A, Diaz LA. Abuso de sustancias entre adolescentes, Bucaramanga, Colombia, 1996–2004. Rev Salud Pública (Bogotá) 2007; 9: 215–229. [ Links ]
6. Barbiano G, Genderini A, Scorza D, Landriani N. Renal damage in drug abusers. Contrib Nephrol 1990; 77: 142–156. [ Links ]
7. Campistol JM, Montoliu J, Soler–Amigó J, Darnell A, Revert L. Renal amyloidosis with nephrotic syndrome in a Spanish subcutaneous heroin abuser. Nephrol Dial Transplant 1988; 3: 471–473. [ Links ]
8. Cunningham EE, Brentjens JR, Zielezny MA, Andres GA, Venuto RC. Heroin nephropathy: A clinicopathologic and epidemiologic study. Am J Med 1980; 68: 47–53. [ Links ]
9. Llach F, Descoeudres C, Massry SG. Heroin associated nephropathy: Clinical and histological studies in 19 patients. Clin Nephrol 1979; 11: 7–12. [ Links ]
10. Grishman E, Churg J, Porush JG. Glomerular morphology in nephrotic heroin addicts. Lab Invest 1976; 35: 415–424. [ Links ]
11. Gupta K, Weber ML. Renal effects of opioid exposure: Considerations for therapeutic use. J Opioid Manag 2006; 2: 236–240. [ Links ]
12. Dettmeyer RB, Preuss J, Wollersen H, Madea B. Heroinassociated nephropathy. Expert Opin Drug Saf 2005; 4: 19–28. [ Links ]
13. Do Sameiro M, Sampaio S, Faria V, Carvalho E. Nephropathy associated with heroin abuse in Caucasian patients. Nephrol Dial Transplant 2003; 18: 2308–2313. [ Links ]
14. International Narcotics Control Board. List of Narcotic Drugs Under International Control, 46th ed. December 2004. Consultado en diciembre 08 de 2007 en la dirección web www.incb.org/pdf/e/list/46thedition.pdf. [ Links ]
15. Furunes H, Spigset O, Slørdal L. Heroin: A useful analgesic? Tidsskr Nor Laegeforen 2003; 23: 3512–3514. [ Links ]
16. Jenkins AJ, Keenan RM, Henningfield JE, Cone EJ. Pharmacokinetics and pharmacodynamics of smoked heroin. J Anal Toxicol 1994; 18: 317–330. [ Links ]
17. Comer SD, Collins ED, MacArthur RB, Fischman MW. Comparison of intravenous and intranasal heroin selfadministration by morphine–mantained humans. Psychopharmacology (Berl) 1999; 143: 327–338. [ Links ]
18. Lingford–Hughes A, Nutt D. Neurobiology of addiction and implications for treatment. Br J Psychiatry 2003; 182: 97–100. [ Links ]
19. Kieffer BL. Opioids: First lessons from knockout mice. Trends Pharmacol Sci 1999; 20: 19–26. [ Links ]
20. Tan EC, Tan CH, Karupathivan U, Yap EP. Mu opioid receptor gene polymorphisms and heroin dependence in Asian populations. Neuroreport 2003; 14: 569–572. [ Links ]
21. Szeto CY, Tang NL, Lee DT, Stadlin A. Association between mu opioid receptor gene polymorphisms and Chinese heroin addicts. Neuroreport 2001; 12: 1103–1106. [ Links ]
22. Shi J, Hui L, Xu Y, Wang F, Huang W, Hu G. Sequence variations in the mu–opioid receptor gene (OPRM1) associated with human addiction to heroin. Hum Mutat 2002; 19: 459–460. [ Links ]
23. Lötsch J, Geisslinger G. Relevance of frequent mu–opioid receptor polymorphisms for opioid activity in healthy volunteers. Pharmacogenomics J 2006; 6: 200–210. [ Links ]
24. Bond C, LaForge KS, Tian M, Melia D, Zhang S, Borg L, et al. Single–nucleotide polymorphisms in the human mu opioid receptor gene alters beta–endorphin binding activity: Possible implications for opiate addiction. Proc Natl Acad Sci USA 1998; 95: 9608–9613. [ Links ]
25. Chefer CI, Czyzyk T, Bolan EA, Moron J, Pintar JE, Shippenberg TS. Endogenous kappa–opioid receptor systems regulate mesoaccumbal dopamine dynamics and vulnerability to cocaine. J Neurosci 2005; 18: 5029–5037. [ Links ]
26. Svingos AL, Chavkin C, Colago EE, Pickel VM. Major coexpression of kappa–opioid receptors and the dopamine transporter in nucleus accumbens axonal profiles. Synapse 2001; 42: 785–792. [ Links ]
27. Maag V. Estimated trends in the prevalence of heroin addiction in Switzerland: A multiple–indicator approach. Eur Addict Res 2003; 9: 176–181. [ Links ]
28. Lebeau–Craven R, Stein L, Barnett N, Colby SM, Smith JL, Canto AL. Prevalence of alcohol and drug use in an adolescent training facility. Subst Use Misuse 2003; 38: 825–834. [ Links ]
29. Koblin BA, McCusker J, Lewis BF, Sullivan JL. Racial/ethnic differences in HIV–1 seroprevalence and risky behaviors among intravenous drug users in a multisite study. Am J Epidemiol 1990; 132: 837–846. [ Links ]
30. Soza–Zapata I, Colón HM, Robles RR, Cabassa M. Gender differences in drug use and sexual risk behaviors among non–injecting heroin users in Puerto Rico. PR Health Sci J 2007; 26: 205–211. [ Links ]
31. Isralowitz R, Rawson R. Gender differences in prevalence of drug use among high risk adolescents in Israel. Addict Behav 2006; 31: 355–358. [ Links ]
32. Davis WR, Johnson BD, Randolph D, Liberty HJ. Gender differences in the distribution of cocaine and heroin in central Harlem. Drug Alcohol Depend 2005; 77: 115–127. [ Links ]
33. Cicero TJ, Aylward SC, Meyer ER. Gender differences in the intravenous self–administration of mu opiate agonists. Pharmacol Biochem Behav 2003; 74: 541–549. [ Links ]
34. Cunningham EE, Zielezny MA, Venuto RC. Heroinassociated nephropathy: A nationwide problem. JAMA 1983; 250: 2935–2936. [ Links ]
35. Cruz IA, Hosten AO. End stage renal disease in minorities. J Natl Med Assoc 1991; 83: 309–312. [ Links ]
36. Zielezny MA, Cunningham EE, Venuto RC. The impact of heroin abuse on a regional end–stage renal disease program. Am J Public Health 1980; 70: 829–831. [ Links ]
37. Haskell LP, Glicklich D, Senitzer D. HLA associations in heroin–associated nephropathy. Am J Kidney Dis 1988; 12: 45–50. [ Links ]
38. Perneger TV, Klang MJ, Whelton PK. Recreational drug use: A neglected risk factor for end–stage renal disease. Am J Kidney Dis 2001; 38: 49–56. [ Links ]
39. Klock JC, Sexton MJ. Rhabdomyolysis and acute myoglobinuric renal failure following heroin use. Calif Med 1973; 119: 5–8. [ Links ]
40. Richter RW, Challenor YB, Pearson J, Kagen LJ, Hamilton LL, Ramsey WH. Acute myoglobinuria associated with heroin addiction. JAMA 1971; 216: 1172–1176. [ Links ]
41. Kilcoyne MM, Gocke DJ, Meltzer JL, Daly JJ, Thomson GE, Hsu KC, et al. Nephrotic syndrome in heroin addicts. Lancet 1972; 1: 356–363. [ Links ]
42. Miller AB, Diamant M. Muscle damage and acute renal failure associated with heroin use. Med Ann Dist Columbia 1972; 41: 571–574. [ Links ]
43. Savin V, Siegel L, Schreiner GE. Nephropathy in heroin addicts with staphylococcal septicemia. Perspect Nephrol Hpertens 1973; 1: 397–408. [ Links ]
44. Friedman EA, Rac TK, Nicastri AD. Heroin–associated nephropathy. Nephron 1974; 13: 421–426. [ Links ]
45. Treser G, Cherubin C, Longergan ET, Yoshizawa N, Viswanathan V, Tannernberg AM, et al. Renal lessions in narcotic addicts. Am J Med 1974; 57: 678–694. [ Links ]
46. Rifkin SI. Amphetamine–induced angiitis leading to renal failure. South Med J 1977; 70: 108–109. [ Links ]
47. Shinghal PC, Sharma P, Sanwal V, Prasad A, Kapasi A, Ranjan R, et al. Morphine modulates proliferation of kidney fibroblasts. Kidney Int 1998; 53: 350–357. [ Links ]
48. Shingal PC, Sharma P, Gibbons N, Franki N, Kapasi A, Wagner JD. Effect of morphine on renomedullary interstitial cell proliferation and matrix accumulation. Nephron 1997; 77: 225–234. [ Links ]
49. Kapasi AA, Gibbons N, Mattana J, Singhal PC. Morphine stimulates mesangial cell TNF–alpha and nitrite production. Inflammation 2000; 24: 463–476. [ Links ]
50. Alarcón JC, Lopera JM, Montejo JD, Henao JD, Rendón GJ. Enfermedad e insuficiencia renal crónicas: segunda parte. Medicina UPB 2005: 25; 25–45. [ Links ]
51. Shingal PC, Pamarthi M, Shah R, Chandra D, Gibbons N. Morphine stimulated superoxide formation by glomerular mesangial cells. Inflammation 1994; 18: 293–299. [ Links ]
52. Mastruzzo C, Crimi N, Vancheri C. Role of oxidative stress in pulmonary fibrosis. Monaldi Arch Chest Dis 2002; 57: 173–176. [ Links ]
53. Patel J, Manjappa N, Bhat R, Mehrotra P, Bhaskaran, Singhal PC. Role of oxidative stress and heme oxygenase activity in morphine–induced glomerular epithelial cell growth. Am J Physiol Renal Physiol 2003; 285: 861–869. [ Links ]
54. Coresh J, Stevens LA. Kidney function estimating equations: Where do we stand? Curr Opin Nephrol Hypertens 2006; 15: 276–284. [ Links ]
55. Lucove J, Vupputuri S, Heiss G, North K, Russell M. Metabolic syndrome and the development of CKD in American indians: The Strong Heart Study. Am J Kidney Dis 2008; 51: 21–28. [ Links ]
56. Cheunsuchon B, Rungkaew P, Chawanasuntorapoj R, Pattaragam A, Parichatikanond P. Prevalence and clinicopathologic findings of antiphospholipid syndrome nephropathy in Thai systemic lupus eritematosus patients who underwent renal biopsies. Nephrology (Carlton) 2007; 12: 474–480. [ Links ]
57. Salako BL. The relationship between kidney and hypertension: A review. Afr J Med Sci 2005; 34: 335–340. [ Links ]
58. Talwar VK, Gupta HL, Shashinarayan. Clinicohematological profile in chronic renal failure. J Assoc Physicians India 2002; 50: 228–233. [ Links ]
59. O'Loughlin JA, Bruder JM, Lysaght MJ. Degradation of low molecular weight uremic solutes by oral delivery of encapsulated enzymes. ASAIO J 2004; 50: 253–260. [ Links ]
60. Putcha N, Allon M. Management of hyperkalemia in dyalisis patients. Semin Dial 2007; 20: 431–439. [ Links ]
61. Musso CG. Potassium metabolism in patients with chronic kidney disease (CKD), Part I: Patients not on dyalisis (Stages 3–4). Int Urol Nephrol 2004; 36: 465–468. [ Links ]
62. Musso CG. Potassium metabolism in patients with chronic kidney disease (CKD), Part II: Patients on dyalisis (Stage 5). Int Urol Nephrol 2004; 36: 469–472. [ Links ]
63. Dowling TC. Prevalence, etiology and consequences of anemia and clinical and economic benefits of anemia correction in patients with chronic kidney disease: An overview. Am J Health Syst Pharm 2007; 64: 3–7. [ Links ]
64. Fishbane S. Iron management in nondyalisis–dependent CKD. Am J Kidney Dis 2007; 49: 736–743. [ Links ]
65. Headley CM, Wall BM. Flash pulmonary edema in patients with chronic kidney disease and end stage renal disease. Nephrol Nurs J 2007; 34: 15–26. [ Links ]
66. Rocker GM, Morgan AG, Shale DJ. Pulmonary edema and renal failure. Nephrol Dial Transplant 1988; 3: 244–246. [ Links ]
67. Kraut JA, Kurtz I. Metabolic acidosis of CKD: Diagnosis, clinical characteristics, and treatment. Am J Kidney Dis 2005; 45: 978–993. [ Links ]
68. Mehrotra R, Kopple JD, Wolfson M. Metabolic acidosis in maintenance dyalisis patients: Clinical considerations. Kidney Int Suppl 2003; 88: 13–25. [ Links ]
69. Kopyt N. Management and treatment of chronic kidney disease. Nurse Pract 2007; 32: 14–23. [ Links ]
70. Herzog CA. Can we prevent sudden cardiac death in dyalisis patients? Clin J Am Soc Nephrol 2007; 2: 410–412. [ Links ]
71. O'Seaghdha CM, Foley RN. Septicemia, abcess, cardiovascular disease and death in dyalisis patients. Perit Dial Int 2005; 25: 534–540. [ Links ]
72. St Peter WL. Introduction: Chronic kidney disease: A burgeoning epidemic. J Manag Care Pharm 2007; 13: 2–5. [ Links ]
73. Correa–Rotter R, Cusumano AM. Present, prevention and management of chronic kidney disease in Latin America. Blood Purif 2008; 26: 90–94. [ Links ]
74. Balparda JK, Gaviria ME. Nefropatía inducida por medios de contraste radiológico yodados. Iatreia 2008; 21: 166–176. [ Links ]
75. Stevens LA, Coresh J, Greene T, Levey AS. Assesing kidney function: measured and estimated glomerular filtration rate. N Engl J Med 2006; 354: 2473–2483. [ Links ]
76. The Royal College of Physicians, the Royal College of General Practitioners, the Renal Associations. Chronic Kidney Disease in Adults: UK Guidelines for Identification, Management and Referral. Disponible en www.renal.org, Consultado en marzo 01 de 2008. [ Links ]
77. Johnson DW, Usherwood T. Chronic kidney disease: Management update. Aust Fam Physician 2005; 34: 915–923. [ Links ]
78. Eknoyan G. Obesity, diabetes and chronic kidney disease. Curr Diab Rep 2007; 7: 449–453. [ Links ]
79. Schrijvers BF, De Vriese AS. Novel insights in the treatment of diabetic nephropathy. Acta Clin Belg 2007; 62: 278–290. [ Links ]
80. Rasu RS, Crawford T, Manley HJ, Balkrishnan R. Treatment of hypertension and diabetes mellitus in patients with chronic kidney disease: A review. Expert Opin Pharmacother 2007; 8: 2543–2551. [ Links ]
81. Foley RN, Agarwal R. Hypertension is harmful to dyalisis patients and should be controlled. Semin Dial 2007; 20: 518–522. [ Links ]
82. D'Achiardi R, Ariza M. Insuficiencia renal crónica. En: Nefrología. 4ª ed. Medelín: Corporación para Investigaciones Biológicas –CIB–; 2004. p. 728–738. [ Links ]
83. Weir MR. Is it the low–protein diet or simply the salt restriction? Kidney Int 2007; 71: 188–190. [ Links ]
84. Mandayam S, Mitch WE. Dietary protein restriction benefits patients with chronic kidney disease. Nephrology (Carlton) 2006; 11: 53–57. [ Links ]
85. Maschio G, Oldrizzi L, Tessitore N, D'Angelo A, Valvo E, Lupo A. Effects of dietary protein and phosphorus restriction on the progression of early renal failure. Kidney Int 1982; 22: 371–376. [ Links ]
86. Berger M. Dietary management of children with uremia. J Am Diet Assoc 1977; 70: 498–505. [ Links ]
87. Pecoits–Filho R. Dietary protein intake and kidney disease in western diet. Contrib Nephrol 2007; 155: 102–112. [ Links ]
88. Levey AS, Geene T, Sarnak MJ, Wang X, Beck GJ, Kusek JW, et al. Effect of dietary protein restriction on the progression of kidney disease: Long–term follow–up on the Modification Diet in Renal Disease (MDRD) Study. Am J Kidney Dis 2006; 48: 879–888. [ Links ]
89. Chatuvedi S, Jones C. Protein restriction for children with chronic renal failure. Cochrane Database Syst Rev 2007; (4): CD006863. [ Links ]
90. Pussel BA, Walker R. Dose of Epoetin alfa used in haemodialysis patients when switching from subcutaneous to intravenous administration. Nephrology (Carlton) 2007; 12: 120–125. [ Links ]
91. Wesswling K, Bakkaloglu S, Salusky I. Chronic kidney disease mineral and bone disorder in children. Pediatr Nephrol 2008; 23: 195–207. [ Links ]
92. Schlosser K, Schmitt CP, Bartholomeus JE, Suchan KL, Buchler MW, Rothmnd M, et al. Parathyroidectomy for renal hyperparathyroidism in children and adolescents. World J Surg 2008; 32: 801–806. [ Links ]
Recibido: mayo 24 de 2008
Aceptado: julio 16 de 2008