Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.22 no.1 Medellín Jan./Mar. 2009
INVESTIGACIÓN ORIGINAL
Parasitosis intestinal en niños de zonas palúdicas de Antioquia (Colombia)
Intestinal parasitoses in children living in malarious zones of Colombia
Jaime Carmona–Fonseca1; Rosa M. Uscátegui Peñuela2; Adriana María Correa Botero1
1 Grupo Salud y Comunidad, Universidad de Antioquia, Medellín, Colombia. Carrera 51D n.º 62–29, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. Teléfono (574) 219 60 50
2 Grupo Alimentación y Nutrición Humanas, Universidad de Antioquia, Medellín, Colombia.
Correspondencia: jaimecarmonaf@hotmail.com
Resumen
Introducción: malaria, parasitosis intestinales y desnutrición coexisten e interactúan en los habitantes de las zonas palúdicas; se requiere conocer la magnitud de cada una de esas enfermedades.
Objetivo: identificar la prevalencia de parásitos intestinales en niños (4–10 años) de Urabá y Bajo Cauca (Antioquia, Colombia) y conocer el cambio postratamiento antiparasitario intestinal específico.
Metodología: en niños con paludismo, se hicieron encuestas parasitarias intestinales antes y 8 y 30 días postratamiento (albendazol + secnidazol). Se usaron coprológicos directo y por concentración, en muestra única.
Resultados: el día–1, 80% mostraron algún helminto patógeno y 39%, algún protozoo patógeno; hubo helmintos y protozoos patógenos en 35%. Las prevalencias específicas el día 1 fueron: Ascaris lumbricoides 43,5%, Trichuris trichiura 68,2%, Necator americanus 37,6%, Entamoeba histolytica 15,3%, Giardia lamblia 21,2%. La intensidad parasitaria protozoaria fue siempre baja (1–2 cruces) y por helmintos fue moderada–intensa en 84% para A. lumbricoides, 83% para T. trichiura y 50% para N. americanus. Medida el día 8, la 'reducción neta de la prevalencia protozoaria', atribuible al tratamiento, fue: E. histolytica 50%, G. lamblia 71% (p < 0,05). Medida el día 8, la 'reducción neta de la intensidad de helmintos', atribuible al tratamiento, fue significativa para A. limbricoides y N. americanus. La reducción neta por el albendazol medida al día 8 fue: A. lumbricoides 91%, N. americanus 87%, T. trichiura 27%; siempre fue significativa la reducción de la cantidad de huevos (p < 0,05).
Conclusión: las parasitosis intestinales en Turbo y El Bagre, en niños maláricos de 4–10 años, tienen muy alta prevalencia y constituyen un grave problema de salud pública.
Palabras clave: Ascaris, Entamoeba, Giardia, Necator, Strongyloides, Trichocephalus, Colombia, Malaria, Niños
Summary
Introduction: Malaria, intestinal parasitoses and malnutrition coexist and interact in people of malarious areas; it is required to know the magnitude of these diseases.
Objective: to identify the prevalence of intestinal parasites in children (aged 4–10 years) of malarious areas of Antioquia (northwestern Colombia), and to know the changes of parasites at days 8 and 30 after specific treatment.
Methodology: intestinal parasites surveys were applied before treatment (albendazole + secnidazole) and at days 8 and 30 after treatment. Examination of stools (direct and concentration) were used in single samples.
Results: at day 1, 80% of the children showed some pathogenic helminth, 39% had some pathogenic protozoan, and 35% had both helminths and protozoa. Specific prevalences at day 1 were as follows: Ascaris lumbricoides 43.5%, Trichuris trichiura 68.2%, Necator americanus 37.6%, Entamoeba histolytica, 15.3%, Giardia lamblia 21.2%. The intensity of infection was slight (1–2 crosses) for protozoan parasites and it was moderateintense for helminth parasites, namely: 84% for A. lumbricoides, 83% for T. trichiura and 50% for N. americanus. The 'net effect on protozoan prevalence' attributable to treatment, measured at day 8, was E. histolytica 50% and G. lamblia 71% (p < 0.05). The 'net effect on helminth burden' (NEHB) attributable to treatment (between days 1 and 8) was significant for A. lumbricoides and N. americanus. The NEHB of albendazole, measured at day 8, was 91% for A. lumbricoides, 27% for T. trichiura and 87% for N. americanus. Egg reduction was always significant (p < 0.05).
Conclusion: Prevalence rates of intestinal parasites in Turbo and El Bagre, in children with malaria, aged 4–10 years, are still high and constitute a severe public health problem.
Key words: Ascaris, Entamoeba, Giardia, Necator, Strongyloides, Trichocephalus, Colombia, Children, Malaria
INTRODUCCIÓN
Las parasitosis intestinales humanas reflejan el desarrollo socioeconómico de una comunidad1–8 y sus agentes pertenecen a un grupo de alrededor de 370 especies (300 de helmintos y 70 de protozoos), de las cuales unas 90 (24%) son frecuentes y de esas 90 unas pocas causan algunas de las más importantes enfermedades.9
En el mundo hay 3.500 millones de personas infectadas por parásitos intestinales (prevalencia mundial: 52% = 3.500/6.700 millones), de los cuales 450 millones están enfermos,10 pero en los países que llaman 'en vías de desarrollo' la prevalencia de parásitos intestinales es muy superior, así como la morbilidad y mortalidad asociadas. En 1999 se estimaba que había 1.472 millones de personas parasitadas por Ascaris lumbricoides, 1.298 millones por uncinarias (Ancylostoma duodenalis, Necator americanus), 1.049 millones por Trichuris trichiura, 70 millones por Strongyloides stercoralis, 77 millones por Taenia saginata y 10 millones por Taenia solium.11 Las infecciones por helmintos intestinales se comportan de manera tal que muchos hospederos humanos albergan pocos parásitos y unos pocos hospedan muchos parásitos.12 En los barrios populares (tugurios, favelas, villas–miseria, barrios bajos o marginales) de las medianas y grandes ciudades de los países 'en desarrollo' existen las condiciones apropiadas para que se conserve o intensifique la transmisión de geohelmintos y de protozoos como giardias y amibas,3,6 que no se limitan, entonces, a las 'zonas rurales', 'al campo'.
La Organización Mundial de la Salud (OMS) impulsa programas antiparasitarios para reducir la prevalencia, la deficiencia de hierro, la anemia y la morbilidad;7,13 ese tratamiento debe ser masivo (se aplica a todos los miembros de una comunidad, sin examen previo de materia fecal), repetido periódicamente, usando antihelmínticos de amplio espectro (como albendazol y mebendazol) y aplicado en áreas donde la prevalencia de geohelmintos exceda el 50% de la población en edad escolar; también recomienda tratamiento con una sola dosis de albendazol o mebendazol a niños desnutridos y anémicos entre 2 y 5 años, en áreas de alta transmisión de uncinarias y tricocéfalos.7,13–15
Hace 40 años (en 1965–1966), en Colombia, el 80% de toda la población estaba infestado con parásitos intestinales patógenos; en niños de 1–4 años esa frecuencia era de 83% y en los de 5–14 años, de 90%16,17–26 (Tabla n.º 1); los cinco parásitos patógenos más frecuentes en la población general eran áscaris (54%), tricocéfalos (50%), uncinarias (23%), amibas (24%) y giardias (12%).16
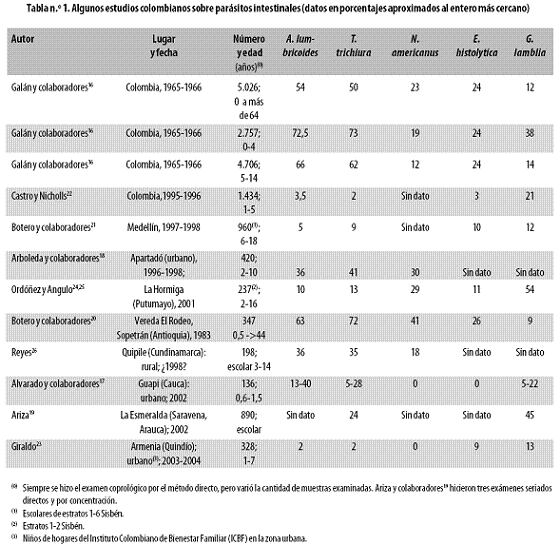
También en Colombia, treinta años más tarde, en 1995–1996, los parásitos intestinales estaban presentes en 43% de los niños de 12 a 59 meses, incluyendo Giardia lamblia (G. duodenalis o G. intestinalis) (21%), Entamoeba histolytica (E. dispar) (3%), A. lumbricoides (3,5%) y Trichuris trichiura (2%).22 En la zona urbana de Medellín, en 1997–1998, en niños y adolescentes estudiantes (6–18 años), 51% presentaron parásitos intestinales patógenos.21 Hacia otro extremo de esa escala oficial de medir pobreza y bienestar se encuentran Apartadó (Antioquia) y Valle del Guamuez –popularmente conocido como La Hormiga– en Putumayo; la primera es un mediano centro políticoeconómico de la zona bananera y ganadera de Urabá, con 103.000 habitantes en 2005 –86.000 urbanos (datos obtenidos en junio de 2007 en la página de internet del Dane) –, con malaria endémica: índice parasitario anual por mil (IPA) 2001 de 7,1 para todo el municipio y 40,6 para la zona rural (datos del Ministerio de Protección Social); la otra es una pequeña población de 39.000 habitantes en 2005 –29.000 rurales (datos de junio de 2007 en la página de internet del Dane) –, en el pie de monte de la cordillera Oriental del selvático Putumayo y con malaria endémica: IPA 1998 de 14,0 (datos suministrados por el Plan de Atención Básica del Putumayo). En Apartadó, en 1996–1998, en niños de 2–10 años de la zona urbana, la prevalencia de áscaris fue 36%, la de tricocéfalos 41% y la de uncinarias 30%;18 en La Hormiga, en 2001, los valores fueron 10%, 13% y 29%, respectivamente, en niños de 2–16 años.24,25
La tríada parásitos intestinales–malaria–desnutrición se encuentra, inseparable y en interacción, en las zonas colombianas donde el paludismo es endémico.27–29 A pesar de esa cotidianidad, es muy poca la información que se tiene en el país sobre la magnitud e intensidad de las parasitosis intestinales que afectan a los niños de las zonas maláricas. ¿Cuánto del estado inflamatorio que se halla en nuestros niños con paludismo30,31 se debe a la concomitante infección parasitaria intestinal? ¿Cuál es la influencia de la inflamación en la respuesta terapéutica al tratamiento antimalárico? ¿Puede mejorarse la respuesta terapéutica a dicho tratamiento con la simultánea aplicación de tratamiento antiparasitario intestinal? Esas son algunas preguntas importantes al abordar el tratamiento del niño malárico y para responderlas es necesario empezar a conocer cuáles son la frecuencia y gravedad de las parasitosis intestinales que lo afectan.
Se diseñó una investigación para conocer la prevalencia de los parásitos intestinales en niños con malaria, residentes en dos zonas endémicas de paludismo en el departamento de Antioquia. Adicionalmente se quiso conocer la eficacia del tratamiento antiparasitario intestinal no masivo, sino selectivo grupal (dado a un grupo de sujetos, pero no a sus convivientes familiares y escolares), para reducir la carga parasitaria a corto plazo (8 y 30 días). Este escrito informa sobre esos dos objetivos y se anota que el tratamiento antiparasitario intestinal específico se aplicó simultáneamente con el tratamiento antipalúdico.
MATERIALES Y MÉTODOS
Clase de estudio y diseño muestral
Se trató de un diseño descriptivo y prospectivo con el que se midió la prevalencia parasitaria intestinal pretratamiento; se evaluó luego a los pacientes en los días 8 y 30 para medir de nuevo la clase y cantidad de parásitos intestinales. El tamaño muestral se calculó así:32
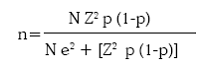
Donde:
n: tamaño de muestra
N: población de niños (5–14 años) con malaria: 3.182, promedio anual, en 2000–2003, en Turbo y El Bagre.
Z: unidades Z correspondientes a un intervalo de confianza del 95%, es decir Z = 1,96.
e: error de muestreo, definido en 10% en este trabajo. p: proporción del 'fenómeno', definida en 50%, para forzar una muestra de máximo tamaño. 1–p: complemento de p.
Esto llevó a un tamaño muestral de 93 niños, que se aproximó a 100 y se decidió estudiar 50 en El Bagre y 50 en Turbo.
Los pacientes palúdicos se captaron según el orden de llegada a los puestos urbanos de malaria en cada municipio, a los que acudieron por su iniciativa. Se incluyeron si satisfacían los criterios fijados y sus acudientes daban el consentimiento informado escrito. La captación se hizo a partir del mes de julio de 2004 y duró hasta julio de 2005. Se siguió a cada niño durante 30 días, con dos evaluaciones en ese lapso (días 8 y 30).
El primer día del estudio, cuando tenían paludismo y se les hizo el primer examen clínico y de laboratorio, todos los niños recibieron el tratamiento antimalárico oficial; además, 50% recibieron antiparasitarios intestinales (albendazol y secnidazol) y el otro 50% no los recibieron.
Población de referencia
La población de referencia la integran niños, de uno y otro sexo, residentes en las zonas urbana o rural de los municipios de El Bagre y Turbo, que consulten al puesto de diagnóstico de malaria de cada lugar por presentar un síndrome febril y a quienes se les demuestre, mediante examen de gota gruesa, que presentan infección con Plasmodium falciparum o P. vivax, excluyendo las infecciones mixtas.
Criterios de inclusión en el estudio
Los pacientes con malaria se admitieron al estudio si cumplían con todos estos requisitos:
a) Residir en El Bagre o en Turbo, bien fuera en área rural o urbana.
b) Tener entre 4 y 10 años de edad.
c) Acudir voluntariamente al puesto de diagnóstico de malaria.
d) No tener enfermedad aparente distinta del paludismo.
e) No tener malaria complicada según los criterios de la OMS.
f) Aceptar participar mediante la firma por el acudiente del consentimiento informado.
Criterios de exclusión del estudio
a) Presentar un nuevo episodio de malaria.
b) Presentar alguna otra enfermedad, trauma, accidente o envenenamiento.
c) No cumplir con la cita para evaluación el día 30.
Evaluación clínica y diagnóstico y tratamiento de la malaria
A cada uno de los participantes se le hicieron tres evaluaciones clínicas generales: al ingresar (pretratamiento), y a los días 8 y 30.
El diagnóstico parasitológico de malaria se hizo según las recomendaciones de la OPS/OMS. Los medicamentos antimaláricos se obtuvieron en la Dirección Seccional de Salud de Antioquia (DSSA) y se aplicaron según los esquemas del Ministerio de Protección Social de Colombia y la DSSA, acompañados con agua.
Tratamiento antiparasitario
Estos medicamentos se administraron por vía oral, cada uno en dosis única, igual para cada niño, cualquiera que fuese su edad (4–10 años); cada uno recibió sendos frascos de los siguientes preparados: albenzadol en suspensión al 4% en frasco de 10 mL (400 mg) de laboratorios MK (Colombia); secnidazol en suspensión al 3,33% en frasco de 15 mL (500 mg) de laboratorios Biogen (Genéricos Medicalex) (Colombia).
Solo los niños del estudio recibieron el tratamiento antiparasitario, de tal manera que sus convivientes hogareños y escolares no lo recibieron; no se trató, en consecuencia, de una desparasitación masiva y repetida. Tanto el tratamiento antipalúdico como el antiparasitario intestinal se dieron con supervisión directa por los investigadores. Se observó al paciente durante la primera media hora; en caso de vómito, se administró nuevamente la dosis completa y se repitió la observación por 30 minutos; si el paciente vomitaba de nuevo se lo excluía y remitía al hospital municipal.
Coprológico
El examen de materias fecales se hizo al inicio del estudio (antes del tratamiento), al día 8 (siete días después de tomar los antiparasitarios) y al día 30 (al finalizar el seguimiento, que corresponde a 29 días después de tomar los antiparasitarios). Se estableció la presencia de helmintos y protozoos, y se cuantificaron sus huevos, larvas, trofozoítos y quistes. Se tomó una muestra única (no se estudiaron muestras seriadas). A aproximadamente 3 g de materias fecales se les adicionó formol al 10% hasta cubrir la muestra, que se guardó por 4–7 días, mientras se la sometía a 'examen directo'; si este no revelaba ningún parásito, se pasaba al 'examen por concentración'.
Con el tratamiento con formol al 10% se conservan bien los huevos de helmintos y los quistes de protozoos.33 El examen coprológico directo con solución salina–lugol y el examen por concentración con formol–éter según Ritchie se hicieron según el procedimiento usual;33 solo cuando la segunda evaluación fue negativa se declaró como tal a la muestra. Los análisis coprológicos fueron llevados a cabo por personal profesional del Laboratorio de Parásitos Intestinales de la Facultad de Medicina de la Universidad de Antioquia. Los helmintos adultos por persona según el número de huevos por gramo de materias fecales se calcularon con el supuesto de que un gusano adulto equivale a los siguientes huevos/g, según Maldonado 34: áscaris 1.000, tricocéfalos 200 y uncinarias 17,5.
Consideraciones éticas
El acudiente de cada niño recibió una explicación detallada del proyecto y firmó el consentimiento informado. El estudio fue avalado por el Comité de Ética del Centro de Investigaciones Médicas de la Universidad de Antioquia.
Análisis estadístico
Para el análisis de los datos se usaron los programas EpiInfo 6.00 y SPSS 10.
El factor de exposición o tratamiento (tratamiento antiparasitario intestinal) fue una variable cualitativa con dos valores (sí, no); el efecto 'respuesta al tratamiento antiparasitario' se trabajó como una variable cualitativa (parásitos presentes o ausentes) y como cuantitativa (cantidad de huevos, de quistes, o de gusanos). El análisis fundamental consistió en comparar:
- En cada tratamiento antiparasitario (sí, no), la prevalencia de cada parásito entre cada par de días (1 vs. 8 y 1 vs. 30), mediante tablas de frecuencias, analizadas con la prueba no paramétrica de McNemar para muestras pareadas.
- En cada día, la prevalencia de cada parásito entre dos grupos de tratamiento antiparasitario (sí, no), mediante tablas de frecuencias, analizadas con una prueba chi cuadrada de Mantel y Haenzsel o la prueba chi cuadrada exacta de Fisher, ambas para muestras independientes.
- En cada tratamiento antiparasitario (sí, no), la densidad de cada parásito entre los días 1 vs. 8 y 1 vs. 30, mediante la prueba no paramétrica de Friedman para dos grupos pareados.
- En cada día, la densidad (cantidad) de cada parásito entre dos grupos de tratamiento antiparasitario (sí, no), mediante la prueba no paramétrica de Kruskall & Wallis para muestras independientes.
Además, se analizó la variación de la prevalencia entre días mediante lo que aquí llamaremos la 'Reducción Neta de la Prevalencia Parasitaria' (RNPP) que es una medición de la eficacia del tratamiento antiparasitario y se define aritméticamente así, para dos grupos pareados, según la prueba de McNemar:
RNPP = [(pares niños que sí tenían parásitos el día–1 y no los tenían el día 8 o el 30) – (pares niños que no tenían parásitos el día–1 y si los tenían el día 8 o el 30) – 1)]2 / (pares niños que sí tenían parásitos el día–1 y no los tenían el día 8 o el 30) + (pares niños que no tenían parásitos el día–1 y si los tenían el día 8 o el 30).
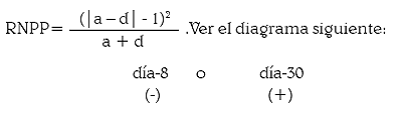
día–1
(+) a b Solo interesan los pares que cambiaron: 'a' y 'd'.
(–) c d 'a' pasó de (+) a (–) y 'd' cambió de (–) a (+).
La comparación estadística se hizo con la prueba de McNemar para datos pareados, con 1 grado de libertad. La prueba se considera de 1 cola porque la hipótesis plantea que al día 8 o al día 30 debe haber menos positivos que en el día 1. Con 1 gl y p = 0,025 (1 cola), McNemar (teórico) = 3,84; entonces, todo valor McNemar (calculado) mayor de 3,84 será significativo.
También se midió la variación de la densidad o intensidad parasitaria entre días mediante lo que llamaremos la 'Reducción Neta de la Intensidad o Carga Parasitaria' (RNIP), definida aritméticamente así, para grupos pareados:7

donde '∑' indica sumatoria, 'n' es el total de sujetos, 'i' indica los valores en cada sujeto en los días 1 y 8 (o día 30). Se basa en el recuento de huevos por gramo de materia fecal. Es otra medición de la eficacia del tratamiento antiparasitario.
Todas las decisiones sobre significación estadística se tomaron con base en un valor de probabilidad (p) menor de 0,05. En el texto, los valores decimales se omitirán para facilitar la lectura, lo que hará que puedan existir algunas diferencias menores con relación a los valores consignados en las tablas, donde se expresan hasta con un decimal.
Se usan estas expresiones: X promedio, DE desviación estándar, IC95% intervalo de confianza de 95%.
RESULTADOS
Se captaron 97 niños y pudo hacerse el seguimiento de 30 días a 93 de ellos, número que corresponde al tamaño mínimo muestral. Se logró obtener muestra de materias fecales de 85, 87 y 82 niños en los días 1, 8 y 30, respectivamente; setenta niños tuvieron coprológico en los tres momentos y de ellos 34 recibieron tratamiento antiparasitario y 36 estuvieron en el grupo sin él. El grupo de 85 niños con coprológico el día 1 se usó para describir la prevalencia parasitaria antes del tratamiento, así como las relaciones entre las especies parasitarias. El grupo de 70 niños con los tres exámenes sirvió para medir el efecto del tratamiento antiparasitario, basado en la comparación de la prevalencia y la densidad de parásitos en los diferentes días.
En El Bagre se examinaron 48 niños y en Turbo 45. En la zona 'rural' (fuera de la cabecera municipal) vivía el 68% de los pacientes y en la urbana residía el 32%. En Turbo, 76% de los niños estaban en el área rural, contra 56% de El Bagre (p = 0,07475203).
Los 70 niños con examen en las tres oportunidades fueron 49 hombres (70%) y 21 mujeres (30%), con edades entre 4 y 10 años cumplidos: 10% (n = 7) con 4 años, 20% (n = 14) con 5, 10% (n = 7) con 6, 17% (n = 12) con 7, 13% (n = 9) con 8, 17% (n = 12) con 9 y 13 (n= 9) con 10 años.
La curación del ataque agudo de paludismo se logró en el 100% de los niños con el tratamiento prescrito (para malaria falciparum: amodiaquina 3 días más sulfadoxinapirimetamina en dosis única más primaquina en dosis única; para paludismo vivax: cloroquina 3 días más primaquina 14 días).
La clase y frecuencia de los eventos adversos posiblemente asociados a los tratamientos antipalúdico y antiparasitario intestinal fueron indistinguibles de los síntomas maláricos, no se pudieron diferenciar entre uno y otro tratamiento, fueron leves, de corta duración y no dejaron secuelas. Nunca hubo que dar tratamiento o atención adicional para tales eventos.
Prevalencia de parásitos
El día 1 el resultado del coprológico se basó en el examen directo en 81% de los pacientes y en 13 de los 16 niños con examen por concentración el resultado persistió negativo (81%). Ese día 1, la prevalencia de parásitos fue 97% (38/39) en Turbo y 74% (34/46) en El Bagre (p = 0,00283842). La prevalencia de protozoos patógenos fue mayor en Turbo (51% = 20/39) que en El Bagre (28% = 13/46) (p = 0,03097870) e igual sucedió con la de helmintos patógenos: 95% (37/39) contra 67% (31/46) (p = 0,00170342).
Sin importar si se tienen los tres exámenes, los resultados de la coproscopia (datos basados siempre en quistes y en huevos, excepto cuando se indique algo diferente) según el día de evaluación están en la parte A de la tabla n.º 2; en resumen, 83,5% (71/85) de los niños presentaron parásitos intestinales antes del tratamiento; ese valor fue 68% el día 8 y 78% el día 30. Cuando se consideran únicamente los 70 niños con los tres exámenes, los resultados fueron muy similares: 81%, 67% y 79% de positividad los días 1, 8 y 30, en su orden.
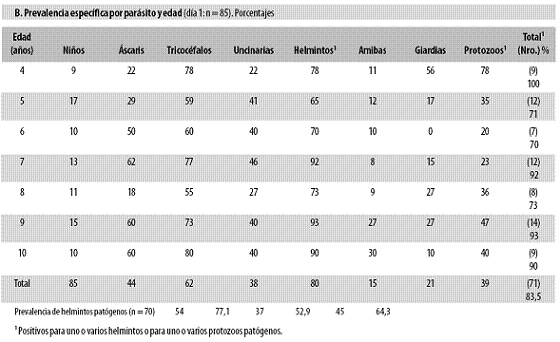
El día 1 la prevalencia de A. lumbricoides fue 44%, la de T. trichiura, 62%, la de N. americanus, 38%, la de E. histolytica, 15% y la de G. lamblia, 21%. La prevalencia global de helmintos fue 30% y la de protozoos patógenos, 39%. Ese día 1, la prevalencia parasitaria fue como sigue: a) según el sexo 86% (48/56) en hombres y 79% (23/29) en mujeres (Fisher exacta 2 colas p = 0,5406321); b) según la edad fue similar entre los grupos (p = 0,22465612); c) según la edad, la proporción específica por parásito también fue estadísticamente similar (Tabla n.º 2, parte B); d) según la patogenicidad, hubo protozoos intestinales en 49%, protozoos patógenos en 39% y helmintos en 80% (siempre los helmintos informados en el examen fueron patógenos); d) según se hubiera recibido o no tratamiento antiparasitario, la prevalencia fue similar en los dos grupos.
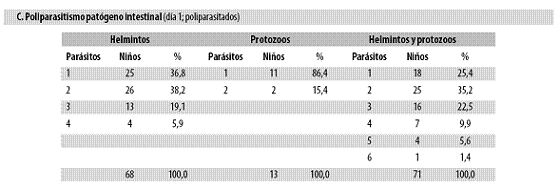
El día 1 se encontraron las poliparasitosis registradas en la tabla n.º 2, parte C: 68 niños presentaron helmintos y de ellos 63% tenían 2 a 4 de esos agentes; 13 niños mostraron protozoos patógenos y de ellos 15% tenían 2 agentes, y 71 niños presentaron helmintos y protozoos y entre ellos 75% tenían 2 a 6 parásitos. En resumen, entre las helmintiasis predominaron ampliamente las poliparasitosis y entre los protozoos lo dominante fue el monoparasitismo.
La tabla n.º 3, parte A presenta las asociaciones entre especies parasitarias: 35% (30/85) tenían helmintos y protozoos patógenos (p = 0,04645456), 35% áscaris y tricocéfalos (p = 0,02640119) y 21% áscaris y uncinarias (p = 0,06767271), mientras que 33% estaban parasitados por uncinarias y tricocéfalos (p = 0,00321000) y 2% albergaban amibas y giardias (p = 0,7260913).
Diecisiete de los 85 (20%) tenían los tres helmintos y, de esos 17, cuatro (23,5%) portaban además E. histolytica (el resto, 76,5% no tenía esta amiba). De igual manera, entre esos 17 niños con tres helmintos, 4 (23,5%) mostraban Giardia lamblia (76,5% sin ella). Solo 2% (2/85) tenían los dos protozoos patógenos. Un solo niño estaba parasitado por los tres helmintos y los dos protozoos patógenos. El resultado cambia poco si el anterior análisis de poliparasitismo se restringe a los 70 niños con coprológico en los tres días.
El cuanto a la cantidad de helmintos adultos por persona (Tabla n.º 3, parte B), los niños tenían, en promedio, 23 áscaris, 22 tricocéfalos y 69 uncinarias.
Intensidad de la infección parasitaria
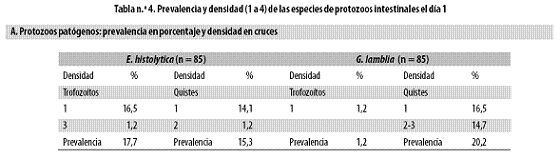
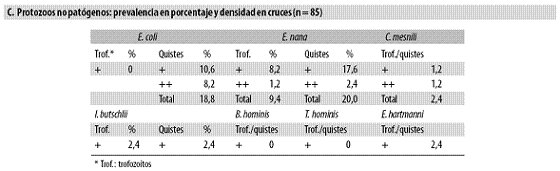
La prevalencia y la densidad (1 a 4 cruces en el examen) de las especies protozoarias el día 1 (pretratamiento) se resumen en la tabla n.º 4, parte A.
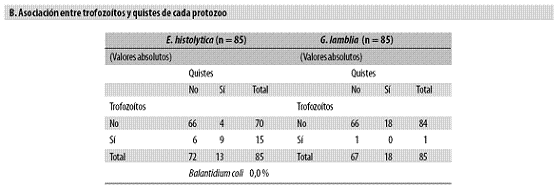
En 18% había trofozoítos de E. histolytica y en 15% se hallaron sus quistes; 20% presentaban quistes de G. lamblia y solo en un niño había trofozoítos de este protozoo; ninguno estaba infestado por Balantidum coli. La amiba se diagnosticó con similar frecuencia con base en los trofozoítos y en los quistes, pero en el caso de G. lamblia sucedió algo muy diferente, pues apenas se halló un niño con trofozoítos (Tabla n.º 4, parte B).
En 19% se observaron los quistes de E. coli, en 20% los de Endolimax nana y en 2% cada uno de los siguientes: Iodameba butschlii, Entamoeba hartmanni y Chilomastix mesnili; en ninguno había Blastocystis hominis ni Trichomonas hominis. En ninguna especie (patógena o no patógena) la densidad de los parásitos superó las dos cruces y esto ocurrió en pocos niños, razón por la cual no se hará ninguna evaluación adicional de los protozoos en términos cuantitativos (promedios, regresiones, etc.) (Tabla n.º 4, parte C).
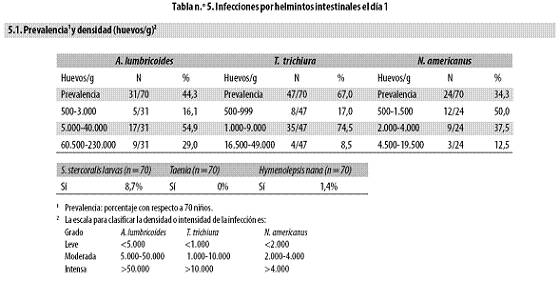
En el día 1, los huevos de helmintos se hallaron con las siguientes frecuencias: 67% T. trichiura, 44% A. lumbricoides y 34% N. americanus. Únicamente 9% tenían larvas de S. stercoralis y nadie mostró Taenia. En un niño se halló Hymenolepis nana (Tabla n.º 5, parte 5.1).
En cuanto a la densidad de los parásitos se halló lo siguiente: para T. trichiura fue leve en 17%, moderada en 75% e intensa en 8%. En el caso de A. lumbricoides fue leve en 16%, moderada en 55% e intensa en 29%. En el de N. americanus fue leve en 50%, moderada en 38% e intensa en 12%.
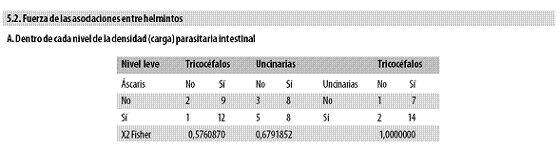
Antes se registraron las asociaciones entre parásitos independientemente del nivel de la parasitación; ahora se anota que la fuerza de tales asociaciones entre helmintos poco cambia en función de la intensidad de la infección, es decir, de la densidad parasitaria (Tabla n.º 5, parte 5.2), de tal forma que la frecuencia de la asociación no aumentó con el incremento de la carga parasitaria.
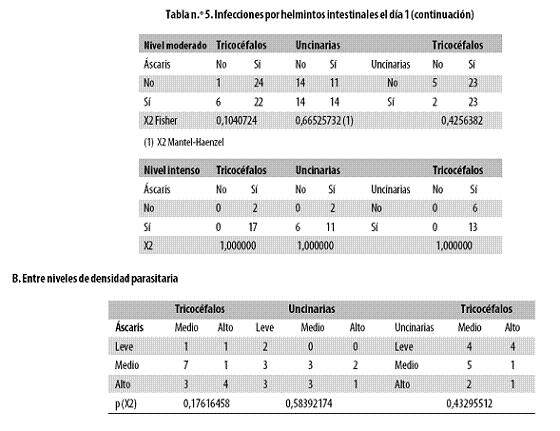
Tampoco hubo ninguna asociación significativa al comparar entre sí los niveles de carga parasitaria para cada par de helmintos.
Eficacia del tratamiento antiprotozoario (secnidazol)
El día 1, la frecuencia de protozoos patógenos en los 70 niños fue 32% en el grupo con tratamiento antiparasitario y 50% en el grupo sin ese tratamiento (p = 0,13694). El día 8 (7 días después del tratamiento con albendazolsecnidazol), la frecuencia de esos protozoos fue 9% en el grupo tratado y 39% en el no tratado (p = 0,00360451) y el día 30 las prevalencias fueron 23% y 44%, respectivamente (p = 0,06735195). El efecto antiprotozoario del secnidazol fue, en consecuencia, leve y apreciable a muy corto plazo (día 8), pero no a mediano plazo (día 30).
Al discriminar por especie de protozoario se encontró lo siguiente en el grupo tratado (Tabla n.º 6): a) E. histolytica presentó prevalencia (quistes) de 12% el día 1, mientras que el día 8 fue 6% y el día 30 fue 9%; b) G. lamblia exhibió prevalencia (quistes) de 11% el día 1, 11% el día 8 y 15% el día 30.
La información sobre la 'Reducción neta de la prevalencia parasitaria' (RNPP) ejercida por el secnidazol sobre las amibas y las giardias medida en los días 8 y 30 indica que la reducción amibiana el día 8 comparada con la prevalencia existente el día 1 fue de 50% y el día 30 la RNPP fue 25%. Para las giardias, este efecto fue 'negativo': 71% el día 8 y 29% el día 30. Según la prueba de McNemar para comparar proporciones entre dos grupos pareados, ninguna comparación del cambio de prevalencia (día 1 vs. día 8; día 1 vs. día 30) fue significativa para amibas ni para giardias.
Eficacia del tratamiento antihelmíntico (albendazol)
En cuanto a los helmintos, el día 1 las proporciones de niños con y sin áscaris fueron similares, pero en los días 8 y 30 esas dos proporciones sí cambiaron (Tabla n.º 7, parte A). Ese mismo día 1, las proporciones de niños con y sin uncinarias no difirieron significativamente, pero en los días 8 y 30 sí fueron muy distintas. Las proporciones de niños con y sin tricocéfalos fueron similares en cada uno de los tres días.
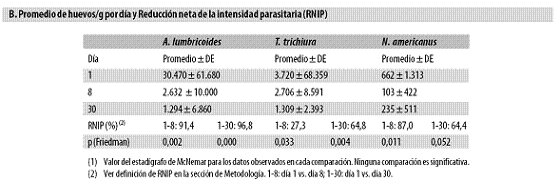
Se comparó la proporción de niños con determinado helminto el día 1 con la existente el día 8 o el día 30, es decir se midió la RNIP de helmintos; según la prueba de McNemar; la comparación del cambio de prevalencia (día 1 vs. día 8; día 1 vs. día 30) fue significativa únicamente para áscaris entre el día 1 y el día 8 y entre el día 1 y el día 30, y para uncinarias entre el día 1 y el día 8. Entre quienes recibieron albendazol, el día 1 el promedio de huevos de áscaris/g fue 30.470, el de tricocéfalos, 3.720 y el de uncinarias, 662. El día 8 los promedios fueron, respectivamente, 2.632, 2.706 y 103; el día 30, los promedios fueron 1.294 para áscaris, 1.309 para tricocéfalos y 235 para uncinarias (Tabla N.º 7, parte B.).
La 'reducción neta en la intensidad parasitaria' (RNIP) de la infección helmíntica indica que el promedio de huevos de áscaris se redujo 91% entre los días 1 y 8 (Friedman para dos muestras pareadas: p = 0,002), y 97% entre el día 1 y el 30 (p = 0,000); el de uncinarias se redujo 87% en la medición del día 8 (p Friedman = 0,011) y 64% (p Friedman = 0,052) en la del día 30, mientras que el de tricocéfalos disminuyó 27% (p Friedman = 0,033) el día 8 y 65% el día 30 (p Friedman = 0,004). Resulta claro que el albendazol produjo una reducción intensa (más de 86%) de la cantidad de huevos de áscaris y uncinarias detectable el día 8, que se acentuó hasta 97% el día 30 para A. lumbricoides pero se redujo para N. americanus; en cambio la eficacia sobre T. trichiura fue muy baja el día 8 pero se hizo moderada el día 30.
Se exploró, por parejas de gusanos, la correlaciónregresión entre la cantidad de huevos de áscaris, tricocéfalos y uncinarias antes del tratamiento y no se halló ninguna asociación significativa; lo mismo sucedió en los días 8 y 30 con esta excepción para el día 30: existió una elevada asociación entre la cantidad de huevos de tricocéfalosydeuncinarias: r = 0,79, con r2 = 62% (46% a 75%).
Entre quienes recibieron tratamiento antiparasitario, tampoco hubo correlaciones significativas entre la cantidad de huevos de las especies de helmintos con esta excepción: el día 8, el coeficiente r fue 0,66, con r2 = 44% (IC95% 12 a 68%) para áscaris y uncinarias. De igual forma, entre quienes no recibieron tratamiento antiparasitario no hubo correlaciones significativas excepto por la hallada el día 30 entre huevos de tricocéfalos y uncinarias (r = 0,91; r2 = 83% con IC95% 68% a 91%).
DISCUSIÓN
Clase y magnitud del grupo estudiado
Se trató de 93 niños con malaria, de 4 a 10 años de edad, captados en el orden de llegada al puesto de diagnóstico de paludismo en Turbo o en El Bagre, a quienes se les hizo examen coprológico. El tamaño del grupo se definió mediante un procedimiento que tuvo en cuenta la población de niños de 5–14 años con malaria en 2000–2003 en esas dos poblaciones y la proporción de frecuencia del fenómeno para estudiar. Este procedimiento apuntaba a comparar la proporción de mejoría en ese grupo con la de otro que recibió antiparasitarios (albendazol y secnidazol), además del tratamiento antipalúdico. Hay que insistir en que este grupo estudiado representa a la población de niños con paludismo que acude por sus propios medios a buscar diagnóstico y tratamiento en el puesto que para ese fin opera en la cabecera municipal, a donde llegaron niños de las zonas urbana y rural. Ese grupo no se diseñó como representante de la población general de niños de 4–10 años, sino de aquellos de 4–10 años y con paludismo y, además, no se restringió a los escolares.
Técnicas usadas para el examen de parásitos intestinales
Muestra única vs. muestras seriadas
Se tomó una muestra única y no tres seriadas como se recomienda cuando se hace un examen directo, con el fin de aumentar la probabilidad de detectar los parásitos. Esta decisión tuvo que ver con los costos económicos y con las dificultades operativas que implica el desplazamiento de los pacientes desde zonas rurales hasta el casco urbano a traer las muestras.
Cantidad de placas por muestra
Examinamos una placa única a partir de la muestra de materias fecales, mientras que otros autores han analizado dos o tres placas por muestra diaria, lo cual incrementa notoriamente la posibilidad de hallar los parásitos.
Examen directo vs. examen por concentración
El examen por concentración con formol–éter según Ritchie es la técnica más usada para concentrar quistes, huevos y larvas33 y la aplicamos únicamente para las muestras que dieron negativas en el examen directo. Un informe colombiano indica que, hacia 1993, se estudiaron 487 muestras para comparar el examen directo con la concentración formol–éter; 'La comparación de los valores de sensibilidad y especificidad obtenidos de la evaluación del examen directo y el método de concentración formol–éter mostró una mayor detección de parásitos con el método de concentración. Sin embargo, por la superposición de los valores del límite superior de la sensibilidad del primero (directo) con los del límite inferior de la sensibilidad del segundo (concentración), no pudo establecerse la existencia de esta ventaja'.35
En consecuencia, la prevalencia real de parásitos intestinales en estos niños se incrementaría si se aplicara el procedimiento de una muestra diaria durante tres días consecutivos, si se examinara más de una placa por muestra y si se usara la técnica de Ritchie en todas las muestras y no solo en las que fueron negativas con el examen directo. Nuestros datos representan, entonces, la prevalencia mínima.
Muestras frescas vs. muestras formolizadas
Las muestras evaluadas estuvieron 4–7 días en formol al 10%; esta preparación conserva bien los huevos y quistes pero se dice que no preserva los trofozoítos, lo que no sucedió en nuestro caso para E. histolytica pero sí para G. lamblia.
Recuento de huevos de helmintos: Beaver vs. Kato–Katz
El procedimiento de Beaver es el más simple pero menos exacto para cuantificar los huevos de helmintos;33 ese recuento de huevos por gramo de material fecal en una micromuestra 'es sumamente variable, fuere cual fuere la exactitud con que la muestra se mida y los huevos se cuenten';36 además, la técnica es relativamente precisa para medir el grado de parasitación por uncinarias y áscaris y menos exacta para tricocéfalos.37 El método de recuento de huevos de Kato–Katz es más preciso y se considera que tiene mayor sensibilidad para contar huevos de geohelmintos,38,39 como sucedió en Bucaramanga (Colombia), cuando se compararon los dos métodos para recuento de huevos de T. trichiura, A. lumbricoides y uncinaria en 1.005 muestras de una población con edades entre cero y 60 o más años; 'Significativamente mayor número de muestras fueron positivas por el método de Kato–Katz (98,1%) que por el método de Beaver (43,1%)'.40
Medición de la intensidad de la infección helmíntica
Hay que anotar que la clasificación aplicada por nosotros es la misma que recomienda la Organización Panamericana de la Salud (OPS),39,40 utilizada por Arboleda y colaboradores, en su estudio en Apartadó,18 pero diferente de la usada en la 'Investigación Nacional de Morbilidad, Colombia, 1965–1966'.16
Medición de la cantidad de helmintos adultos a partir del recuento de sus huevos
El criterio de Maldonado para deducir la cantidad de gusanos adultos por niño depende del recuento de huevos por gramo de materia fecal (un helminto adulto por cada 1.000 huevos/g para áscaris, 200 para tricocéfalos y 17,5 para uncinarias);34 si, además, la cuenta de huevos es poco exacta con el método usado de Beaver36
y es relativamente precisa para áscaris y uncinarias e imprecisa para tricocéfalos,37 hay que concluir que lo mismo sucederá con la cantidad de helmintos adultos que se mida.
Comparación de nuestros resultados con los de otros autores
En general, esta comparación tendrá como punto de referencia los datos de las tablas n.º 1 y 2–B.
Prevalencias protozoarias
La frecuencia de amibas (quistes) hallada por nosotros en niños de 4–10 años es un tercio menor que la encontrada en la población general colombiana en 1965–1966,16 mientras que la de giardias es casi el doble. Comparados con los datos para niños de Colombia menores de 5 años, en 1995–1996,22 nuestros valores son más de cuatro veces los de ellos para las amibas y son iguales para las giardias. Nuestros datos restringidos a los niños de 4 años son tres veces los del estudio nacional 1995–1996 en menores de 5 años:22 amibas 11% vs. 3% y giardias 56% vs. 21%.
Los datos del presente informe duplican los anotados para escolares de 6–18 años de la zona urbana de Medellín, en 1997–1998, tanto para amibas como para giardias.21 En niños de 2–16 años de La Hormiga (Valle de Guamuez), un lugar más parecido a Turbo y El Bagre que Medellín o que toda Colombia, la frecuencia de amibas fue un tercio de la nuestra pero la de giardias fue 2,5 veces más alta.25 Cabe anotar que esa prevalencia de giardias de 54%25 es la más alta de la tabla 1.
Los datos de los dos estudios nacionales16,22 cuando se comparan los niños menores de 5 años, indican una gran reducción de las amibas y giardias en el lapso de 30 años que los separan: las primeras rebajan 7 veces y las segundas caen a la mitad. Pero eso no sucede en los niños de la zona palúdica de Antioquia, pues allí, en los de 4 y 5 años, los valores son más próximos a los hallados hace 40 años en Colombia, según los datos de 1965–1966.16
Prevalencias helmínticas
Se considera que las geohelmintiasis reflejan mejor que las protozoosis la contaminación fecal ambiental. Los datos de la prevalencia de helmintos en niños colombianos menores de 5 años se han reducido 20–35 veces, según las frecuencias de áscaris y tricocéfalos, entre 1965–196616 y 1995–1996,22 pero, otra vez, las zonas maláricas antioqueñas siguen como hace cuatro decenios, pues las prevalencias de esos dos agentes son similares a las de esa remota época del primer estudio nacional.16 Llama la atención que mientras la prevalencia de áscaris y tricocéfalos que ahora informamos para niños de 4–5 años es alrededor de 47%, la de 1965–1966 en niños de 0–4 años era aproximadamente 72% (reducción: 35%), y la de uncinarias aumentó 68% (pasó de 19% a 32%). Por otra parte, nuestros datos son 20% mayores que los encontrados para esos tres helmintos en niños de 2–10 años de Apartadó, en 1996–199818 y son casi el triple de los correspondientes a los escolares de La Hormiga en 2000.25
Otros dos estudios en niños, en dos lugares y dos épocas muy diferentes, muestran lo siguiente. En Caucasia (zona palúdica del Bajo Cauca, Antioquia), en 1980, 96% de los estudiantes de 5 a 20 años presentaban parásitos intestinales.41 En Pereira (Risaralda), área urbana y sin malaria, en 2004, 68% de los escolares de 2 a 7 años presentaban parásitos intestinales; G. lamblia fue el más frecuente de los patógenos (19,5%), seguida por E. histolytica (14,8%), A. lumbricoides (11,5%) y T. trichiura (2,9%).42 Estos datos ratifican que el parasitismo intestinal está disperso en Colombia, en áreas urbanas y rurales, palúdicas y sin esa endemia, hace muchos años y ahora.
La mejoría del problema parasitario intestinal no es uniforme en el país y es necesario definir con claridad y precisión las poblaciones que se van a comparar, tanto en cuanto a la geografía y a la época, como en relación con edad, condiciones socioeconómicas, clase de grupo (escolares, población general, población captada en centros de atención sanitaria, etc.).
En Apartadó, en 1996–1998, 26% tenían un parásito, 37% tenían dos y 37% tenían más de dos parásitos.18 Nuestros datos sobre poliparasitismo son diferentes de esos, pues solo 25% tenían un parásito y 75% presentaban al menos dos agentes patógenos (un helminto y un protozoo). En La Hormiga, en niños de 2 a 16 años, hubo poliparasitismo (2 o más agentes patógenos) en 46% de los preescolares (2–4 años), 51% de los escolares (5–11,5 años) y 66% de los adolescentes (11,6–16 años).25
Con la misma escala de clasificación, la intensidad de la infección por helmintos en los niños de 2–10 años de Apartadó, 1996–1998,18 y en los nuestros fue muy diferente para cada una de las tres especies, aunque las prevalencias globales fueron iguales para tricocéfalos y uncinarias y diferentes para áscaris: nosotros hallamos infecciones moderadas–intensas en 84% de las veces en áscaris, contra 58% de los otros autores, 83% contra 49% las de tricocéfalos y 50% contra 25% las de N. americanus. Con los datos reales, correspondientes a dos poblaciones diferentes, separadas por 40 años en la historia colombiana, la frecuencia de helmintiasis moderadasintensas informada por la Investigación Nacional 1965–1966 fue siempre mucho menor que la hallada por nosotros ahora: áscaris 33% vs. 84%, tricocéfalos 52% vs. 83% y uncinarias 10% vs. 50%. El estudio de Quipile (Cundinamarca), hacia 1998, en escolares de 3–14 años, halló una carga moderada–intensa de helmintos de 44% para áscaris, 9% para tricocéfalos y cero para uncinarias.26
El criterio de Maldonado34 fue aplicado en la 'Investigación Nacional de Morbilidad, Colombia, 1965–1966' para calcular el número de gusanos adultos/persona y halló 6 áscaris (nosotros encontramos cuatro veces ese valor: 23), 9 tricocéfalos adultos (nosotros obtuvimos 2,5 veces tal valor: 22) y 64 uncinarias adultas (nosotros hallamos el mismo valor: 69).16 Esto ratifica que las zonas palúdicas antioqueñas presentan una situación peor que la nacional de hace 40 años.
Sin considerar la magnitud de la helmintiasis (densidad), la frecuencia de la asociación entre pares de helmintos mostró significación estadística para áscaris–tricocéfalos (p = 0,02640119) y uncinarias–tricocéfalos (p = 0,00321000), pero no para áscaris–uncinarias (p = 0,06767271), pero cuando se hizo este mismo análisis dentro de cada nivel de carga parasitaria (huevos/g de materias fecales), no se halló ninguna asociación en ninguno de los tres niveles. Tampoco hubo asociación significativa cuando se compararon entre sí los niveles de carga parasitaria para cada par de helmintos, lo cual no concuerda con lo sugerido por Howard y colaboradores, quienes hallaron que la fuerza de la asociación entre áscaris y tricocéfalos aumenta con la intensidad de la parasitosis, de tal manera que aquellos con infección más intensa por una especie de helminto probablemente albergarán una infección intensa con la otra especie.43
El estudio colombiano de 1965–1966 halló que la prevalencia de parásitos intestinales patógenos aumenta con la edad hasta los 14 años y pasa de 38% en menores de 1 año a 83% en los de 1–4 años y 90% en los de 5–14 años (escolares); entre 15 y 44 años la frecuencia es estable, alrededor de 75%; no hubo diferencias por sexo, pero sí por zona de residencia: rural 86% y urbana 68%. En la Hormiga se encontró una prevalencia de parásitos patógenos de 81% en preescolares (2–4 años), 88% en escolares (5–11,5 años) y 85% en adolescentes (11,6–16 años), pero por especie de parásito solamente tricocéfalos y uncinarias mostraron incremento en función de la edad, pero no áscaris, amibas ni giardias; T. trichiura pasó de 4% en niños de 2–4 años a 11% en los de 5–11,5 y a 24% en los de 11,6–16 años; por su parte, las uncinarias aumentaron de 23% a 28% y luego a 34%, respectivamente.25 Nuestros datos de prevalencia no mostraron ninguna asociación significativa en función de la edad, con ninguno de los cinco parásitos, aunque con áscaris hubo un claro crecimiento entre los 4 y 7 años, con valores relativamente estables entre los 7 y 10 años.
Las larvas de S. stercoralis aparecieron en 9% de nuestros niños, frente a 47% de los de La Hormiga (31% en preescolares, 49% en escolares y adolescentes).25 Muy probablemente la forma de recolección, conservación y análisis de nuestras muestras explique una buena parte de la baja prevalencia.
Coprológico vs. métodos 'modernos'
Los métodos diagnósticos basados en procedimientos inmunológicos no necesariamente son superiores al coprológico para diagnosticar los parásitos, como se halló en Quipile (Cundinamarca), en 278 muestras de niños de la zona rural: allí se encontró G. lamblia en 17,5% mediante el coprológico y el antígeno se detectó en 96% mediante ELISA; muy posiblemente, según los autores, ese elevado porcentaje incluyó antígeno derivado de infecciones anteriores.44
Efecto del tratamiento antiparasitario
Según un informe de la OMS sobre quimioterapia antihelmíntica para uso frecuente y masivo, el albendazol tiene una eficacia terapéutica similar a la del mebendazol contra áscaris (por encima de 90%), pero mejor contra uncinarias (60–89% vs. 20–89%) y mucho mejor contra tricocéfalos (20–89% vs. 0–19%).7 Así mismo, debe tenerse presente que el albendazol, usualmente formulado como antihelmíntico, tiene también actividad antigiardiásica,45–48 pero no antiamibiana,46 parte de la cual debe explicar la RNPP observada sobre G. lamblia, la cual fue alta el día 8 (RNPP: 71% días 1 vs. 8), aunque no estadísticamente significativa.
Entre los niños parasitados, el estudio en Apartadó encontró una eficacia del mebendazol aplicado en forma masiva (dosis única de 600 mg, cada 6 meses y por cuatro veces) de 94% para áscaris, 45% para tricocéfalos y 66% para uncinarias.24 En nuestro trabajo no se aplicó tratamiento masivo y repetido, que implica tratar periódicamente a todo un grupo (por ejemplo: a todos los escolares, o a toda una comunidad como serían los habitantes de una vereda); ni siquiera todos nuestros pacientes recibieron antiparasitarios, sino solamente la mitad, sin que los hermanos, padres y demás convivientes de quienes fueron tratados hubiesen recibido también el medicamento. Seguramente ahí está la mayor explicación del escaso efecto antiparasitario observado en nuestros niños sometidos a tratamiento con albendazol + secnidazol. El efecto neto en la prevalencia parasitaria medido el día 8 (o sea, 7 días postratamiento) fue 50% para amibas y 46% para giardias y el día 30 los valores cayeron a 25% y 29%, respectivamente. Estos datos sugieren que debe aumentarse la dosis/kg peso corporal del secnidazol o, más probablemente, aumentar las aplicaciones (en vez de una sola dar dos o tres dosis, en días consecutivos), para mejorar la eficacia del tratamiento antiprotozoario.
Para los helmintos, ese efecto neto en la prevalencia, medido el día 8, fue 91% para áscaris, 84% para uncinarias y apenas 27% para tricocéfalos, cifras totalmente ajustadas a la escala de la OMS para tratamiento masivo y reiterado, mientras que los valores del día 30 fueron, en el mismo orden, de 95%, 64% y 65%, es decir que se conservaron los mismos del día 8 para A. lumbricoides y se redujeron moderadamente los de uncinarias y tricocéfalos. Estos valores, derivados de una situación que no fue de tratamiento masivo y reiterado, sugieren que dicha quimioterapia sería útil en las poblaciones estudiadas, pues la reducción parasitaria fue aceptable a pesar de la forma como se aplicó.
Finalmente, cabe recordar que se conoce el desarrollo de resistencia a los antihelmínticos, incluido el albendazol, por los nemátodos de algunos animales (ovejas, cabras, bovinos, caballos) y se sospecha que exista en los de otros animales y de humanos.49–52 También se sabe de la resistencia de protozoos, como G. lamblia, a los medicamentos de elección.53,54
Se concluye que:
- A pesar de investigar solo una muestra de materia fecal, la prevalencia de parásitos intestinales en los niños con malaria de las dos zonas palúdicas antioqueñas fue muy elevada 85% (74 a 97%), lo que constituye un grave problema de salud pública. Urge que las autoridades sanitarias emprendan acciones para reducir este problema.
- En ninguna especie protozoaria intestinal la intensidad de la infección superó las dos cruces, en T. trichiura la densidad de parásitos fue moderada–intensa en 83%, en A. lumbricoides la densidad de la infección fue moderada–intensa en 84%, en N. americanus la densidad de parásitos fue moderada–intensa en 50%. Se requiere investigar cuál es la influencia de estas cargas parasitarias en fenómenos como la inflamación, las deficiencias nutricionales, los estados mórbidos, entre otros.
- El efecto antiprotozoario del secnidazol fue leve y apreciable el día 8. La 'reducción neta en la intensidad parasitaria' (RNIP) de la infección helmíntica mostró que, entre los días 1 y 8, el promedio de huevos de áscaris se redujo 91%, el de uncinarias, 87% y el de tricocéfalos, 27%. El tratamiento antiparasitario aplicado a los pacientes redujo la prevalencia a 67% el día 8. Esta reducción es apenas leve y ello puede deberse a que no se trató al grupo total de convivientes hogareños y escolares, como es lo recomendado.
Financiación
Dirección Seccional de Salud de Antioquia DSSA y Universidad de Antioquia.
Declaración de conflicto de intereses
Ninguno para declarar.
Agradecimientos
A los integrantes del Laboratorio de Parasitología Intestinal de la Facultad de Medicina de la Universidad de Antioquia por hacer los coprológicos. Al personal de campo en Turbo y El Bagre por la evaluación clínica y la toma de muestras para exámenes de laboratorio.
REFERENCIAS BIBLIOGRÁFICAS
1. Belo S, Rompao H, Goncalves L, Gracio M. Prevalence, behavioural and social factors associated with Schistosoma intercalatum and geohelminth infections in Sao Tome and Principe. Parassitologia 2005; 47: 227–231. [ Links ]
2. Botero D. Epidemiology and public health importance of intestinal nematode infections in Latin America. Prog Drug Res 1975; 19: 28–43. [ Links ]
3. Crompton D, Savioli L. Intestinal parasitic infections and urbanization. Bull World Health Org 1993; 71: 1–7. [ Links ]
4. Gamboa M, Basualdo J, Cordoba M, Pezzani B, Minvielle M, Lahitte H. Distribution of intestinal parasitoses in relation to environmental and sociocultural parameters in La Plata, Argentina. J Helminthol 2003; 77: 15–20. [ Links ]
5. Maco–Flores V, Marcos–Raymundo L, Terashima–Iwashita A, Samalvides–Cuba F, Gotuzzo–Herencia E. Distribución de la enteroparasitosis en el altiplano Peruano: Estudio en 6 comunidades rurales del Departamento de Puno, Perú. Rev Gastroenterol Peru 2002; 22: 304–309. [ Links ]
6. Mott K, Desjeux A, Moncayo A, Ranque P, de Raadt P. Parasitic diseases and urban development. Bull World Health Org 1990; 68: 691–698. [ Links ]
7. OMS. Organización Mundial de la Salud. El uso de quimioterapia para el control de la morbilidad debida a nemátodos transmitidos por el suelo en humanos. Informe de una reunión de consulta; 29 abril–1 mayo 1996. Vol. HCT/AIEPI–19.E. Washington; 1999. [ Links ]
8. Rinne S, Rodas E, Galer–Unti R, Glickman N, Glickman L. Prevalence and risk factors for protozoan and nematode infections among children in an Ecuadorian highland community. Trans R Soc Trop Med Hyg 2005; 99: 585–592. [ Links ]
9. Cox F. History of human Parasitology. Clin Microbiol Rev 2002; 15: 595–612. [ Links ]
10. OMS. Organización Mundial de la Salud. Suplementos de vitamina A (2ª ed.). Ginebra: OMS; 1998. [ Links ]
11. Crompton D. How much human helminthiasis is there in the world? J Parasitol 1999; 85: 397–403. [ Links ]
12. Northrop–Clewes CA, Shaw C. Parasites. Br Med Bull 2000; 56: 193–208. [ Links ]
13. OMS. Organización Mundial de la Salud. Uncinariasis y anemia en niñas y mujeres. Informe de una reunión de consulta; 5–7 diciembre 1994. Vol. HCT/AIEPI–18.E. Washington: OPS; 1999. [ Links ]
14. Beltramino D, Lurá M, Carrera E. El tratamiento antihelmíntico selectivo frente al tratamiento masivo. Experiencia en dos comunidades hiperendémicas. Rev Panam Salud Pública 2003; 13: 10–18. [ Links ]
15. WHO. World Health Organization. Prevention and control of intestinal parasitic infections. Report of WHO Expert Committee. Vol. 749. Ginebra, Suiza: OMS; 1987. [ Links ]
16. Galán R, Agualimpia C, Corredor A, Cáceres E. Investigación Nacional de Morbilidad. Parasitismo intestinal. Bogotá, Colombia: Ministerio de Salud Pública, Ascofame; 1969. [ Links ]
17. Alvarado B, Vásquez L. Determinantes sociales, prácticas de alimentación y consecuencias nutricionales del parasitismo intestinal en niños de 7 a 18 meses de edad en Guapi, Cauca. Biomédica 2006; 26: 82–94. [ Links ]
18. Arboleda M, Lopera T, Restrepo M, Botero D, Lotero M, Ríos P. Efectos de la desparasitación comunitaria en la población infantil del área urbana de Apartadó, Colombia. Revista CES Medicina 2004; 18: 51–59. [ Links ]
19. Ariza Y, Sánchez C, González A, Ayala J, Peñaranda M, Castro J, et al. Estado de las parasitosis intestinales en la población escolar de La Esmeralda, Arauquita, Colombia en junio de 2002. Biomédica 2003; 23 (Supl. 1): 94. [ Links ]
20. Botero C, Cálad G, Cardona E, Correa D, González C. Epidemiología de las helmintiasis intestinales en una zona rural de Antioquia, Colombia. Medicina UPB 1984; 3: 66–78. [ Links ]
21. Botero J, Castaño A, Montoya MN, Hurtado M, Ocampo NE, Agudelo GM. Anemia por deficiencia de hierro y su asociación con los parásitos intestinales en escolares y adolescentes matriculados en instituciones oficiales y privadas de Medellín, 1997–1998. Acta Med Col 2002; 27: 7–14. [ Links ]
22. Castro L, Nicholls S. Deficiencia de hierro, vitamina A y prevalencia de parasitismo intestinal en la población infantil y anemia nutricional en mujeres en edad fértil, Colombia, 1995–1996. Bogotá: Ministerio de Salud e Instituto Nacional de Salud; 1998. [ Links ]
23. Giraldo–Gómez J, Lora F, Henao L, Mejía S, Gómez–Marín J. Prevalencia de giardiasis y parásitos intestinales en preescolares de hogares atendidos en un programa estatal en Armenia, Colombia. Rev Salud Pública (Bogotá) 2005; 7: 327–338. [ Links ]
24. Ordóñez L, Angulo E. Desnutrición y su relación con el parasitismo intestinal en niños de una población de la Amazonia colombiana. Biomédica 2002; 22: 486–498. [ Links ]
25. Ordóñez LE, Angulo ES. Parasitismo intestinal en el valle del Guamuez y San Miguel, Putumayo, Colombia. Medicina & Laboratorio (Medellín) 2000; 9: 565–574. [ Links ]
26. Reyes P, Agudelo C, Moncada L, Cáceres E, López C, Corredor A, et al. Desparasitación masiva, estado nutricional y capacidad de aprendizaje de una comunidad rural. Salud Publ (Bogotá) 1999; 1: 255–264. [ Links ]
27. Carmona–Fonseca J. La malaria en Colombia, Antioquia y las zonas de Urabá y Bajo Cauca: panorama para interpretar la respuesta terapéutica antimalárica. Parte 1. Iatreia 2003; 16: 299–318. [ Links ]
28. Carmona–Fonseca J. La malaria en Colombia, Antioquia y las zonas de Urabá y Bajo Cauca: panorama para interpretar la respuesta terapéutica antimalárica. Parte 2. Iatreia 2004; 17: 34–53. [ Links ]
29. Carmona–Fonseca J. Malaria, desnutrición y parasitosis intestinal en los niños colombianos: interrelaciones. Iatreia 2004; 17: 354–369. [ Links ]
30. Blair S, Álvarez G, Villa A, Carmona–Fonseca J, Ríos L. Estado nutricional y niveles de inmunoglobulinas y citoquinas en niños con malaria. An Pediatr (Barcelona, España) 2003; 58: 418–424. [ Links ]
31. Blair S, Carmona J, Correa A. Malaria en niños: relaciones entre nutrición e inmunidad. Rev Panam Salud Pública 2002; 11: 5–14. [ Links ]
32. Martínez–Bencardino C. Muestreo. Bogotá: Ecoe; 1984. [ Links ]
33. Botero D, Restrepo M. Parasitosis humanas (4ª ed.). Medellín: Corporación para Investigaciones Biológicas; 2003. [ Links ]
34. Maldonado J. Helmintiasis del hombre en América. Madrid: Editorial Científico–Médica; 1965. [ Links ]
35. Duque S, Guerrero R, Nicholls R, López M. Examen coproparasitológico en niños: comparación de resultados obtenidos por dos métodos en dos instituciones de Santafé de Bogotá, D.C. Biomédica 1994; 14: 39–47. [ Links ]
36. Beaver C. Control de los helmintos transmitidos por el suelo. Bol Of San Panam 1963; 54: 30–53. [ Links ]
37. Faust E, Russell P, Jung R. Parasitología clínica de Craig y Faust. México: Salvat; 1974. [ Links ]
38. Idris M, Al–Jabri A. Usefulness of Kato–Katz and trichrome staining as diagnostic methods for parasitic infections in clinical laboratories. SQU J Scient Res Med Sci 2001; 3: 65–68. [ Links ]
39. Montresor A, Crompton DWT, Hall A, Bundy DAP, Savioli L. Lineamientos para la evaluación de las geohelmintiasis y las esquistosomiasis a nivel de la comunidad. Guía para el manejo de los programas de control. Washington: OPS; 1998. [ Links ]
40. Tarazona Z, Torres A, Valencia M. Estudio evaluativo del método de Kato–Katz frente a otras técnicas de diagnóstico de parásitos intestinales. Rev Univ Ind Santander Salud 1989; 17: 7–18. [ Links ]
41. Montoya F, Londoño A, Saldarriaga A, Pérez H. Prevalencia de parasitosis en escolares de 14 municipios en Antioquia, 1980. Boletín Epidemiológico Antioquia 1981; 6: 28–30. [ Links ]
42. Lora F, Cuervo L, Henao L, Agualimpia D, Machado J, Gómez J. Parasitismo intestinal en niños de Pereira. Revista Epidemiológica Risaralda 2005; 9: 1–7. [ Links ]
43. Howard S, Donnelly C, Kabatereine N, Ratard R, Brooker S. Spatial and intensity–dependent variations in associations between multiple species helminth infections. Acta Tropica 2002; 83: 141–149. [ Links ]
44. Chávez M, Reyes P, Duque S, Echeverry J, Nicholls R, Arévalo A, et al. Concordancia entre la observación microscópica de Giardia duodenalis en heces y la detección del antígeno en eluidos de materia fecal mediante ELISA en una población menor de 15 años de Quipile, Cundinamarca. Biomédica 2003; 23 (Supl. 1): 94–95. [ Links ]
45. Cedillo–Rivera R, Munoz O. In–vitro susceptibility of Giardia lamblia to albendazole, mebendazole and other chemotherapeutic agents. J Med Microbiol 1992; 37: 221–224. [ Links ]
46. Chávez B, Espinosa–Cantellano M, Cedillo–Rivera R, Ramirez A, Martinez–Palomo A. Effects of albendazole on Entamoeba histolytica and Giardia lamblia trophozoites. Arch Med Res 1992; 23: 63–67. [ Links ]
47. Edlind T, Hang T, Chakraborty P. Activity of the anthelmintic benzimidazoles against Giardia lamblia in vitro. J Infect Dis 1990; 162: 1408–1411. [ Links ]
48. Oxberry M, Thompson R, Reynoldson J. Evaluation of the effects of albendazole and metronidazole on the ultrastructure of Giardia duodenalis, Trichomonas vaginalis and Spironucleus muris using transmission electron microscopy. Int J Parasitol 1994; 24: 695–703. [ Links ]
49. Albonico Q, Bickle M, Ramsan A, Montresor L, Savioli L, Taylor M. Efficacy of mebendazole and levamisole alone or in combination against intestinal nematode infections after repeated targeted mebendazole treatment in Zanzibar. Bull World Health Organ 2003; 81: 343–352. [ Links ]
50. Cernanska D, Varady M, Corba J. A survey on antihelmintic resistance in nematode parasites of sheep in the Slovak Republic. Vet Parasitol 2006; 135: 39–45. [ Links ]
51. Harder A. Chemotherapeutic approaches to nematodes: current knowledge and outlook. Parasitol Res 2002; 88: 272–277. [ Links ]
52. Schwab A, Boakye D, Kyelem D, Prichard R. Detection of benzimidazole resistance–associated mutations in the filarial nematode Wuchereria bancrofti and evidence for selection by albendazole and ivermectin combination treatment. Am J Trop Med Hyg 2005; 73: 234–238. [ Links ]
53. Dupouy–Camet J. [New drugs for the treatment of human parasitic protozoa] [en francés]. Parassitologia 2004; 46: 81–84. [ Links ]
54. Harris J, Plummer S, Lloyd D. Antigiardial drugs. Appl Microbiol Biotechnol 2001; 57: 614–619. [ Links ]
Recibido: julio 14 de 2008
Aceptado: octubre 10 de 2008