Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.22 no.2 Medellín Apr./June 2009
INVESTIGACIÓN ORIGINAL
Influencia de la ingesta de bebidas con diferente osmolaridad, sobre el tipo de deshidratación y las concentraciones de electrolitos, plasmáticos y urinarios, durante una actividad física de alta intensidad y larga duración
Effect of beverage osmolarity on dehydration type and plasmatic and urinary electrolytic concentrations during a high–intensity, long–lasting physical activity
Jaime Alberto Pérez Giraldo1; Juan Carlos Aristizábal Rivera2; Álvaro Ortiz Uribe3; Hilda Norha Jaramillo Londoño4
1 MD, Especialista en Medicina Deportiva, profesor asociado de la Facultad de Medicina, Universidad de Antioquia.
2 ND, MSc en Fisiología del Ejercicio, profesor asistente de la Escuela de Nutrición y Dietética, Universidad de Antioquia.
3 MD, Especialista en Medicina Deportiva.
4 MD, MSc en Fisiología, profesora titular de la Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
Dirección: Jaime Alberto Pérez Giraldo, Departamento de Fisiología y Bioquímica, Facultad de Medicina, Universidad de Antioquia. AA. 1226. Medellín. Teléfonos: (094) 2196030, (094) 2196037; fax: 263 02 53. jaimepg5@hotmail.com; perezja@medicina.udea.edu.co
Resumen
Objetivo: establecer los efectos sobre la osmolalidad y las concentraciones electrolíticas, plasmáticas y urinarias, del consumo de tres bebidas con diferente osmolaridad después de una actividad física de alta intensidad y larga duración.
Métodos: nueve corredores de fondo realizaron 88 minutos de carrera en banda rodante (con una pendiente del 1% y al 80% de la frecuencia cardíaca de la reserva), seguidos de 90 minutos de recuperación; inicialmente, sin reposición hídrica –procedimiento deshidratado– (DH); posteriormente, tres procedimientos secuenciales y aleatorios ingiriendo un volumen similar de una de tres bebidas, isoosmolar, hipoosmolar o hiperosmolar –procedimientos con hidratación (RH)–. Los electrolitos, plasmáticos y urinarios, la osmolalidad plasmática y la osmolaridad urinaria se midieron antes y después de la carrera y al final de la recuperación.
Resultados: en DH, al final del ejercicio, se observó una deshidratación hipernatrémica e hiperclorémica (p < 0,05); durante todo el procedimiento hubo hipercaliemia (p < 0,011); al final de la recuperación hubo reducción del volumen urinario (p < 0,05) e hipercaliuria (p < 0,001). La reposición parcial de las pérdidas hídricas, con las bebidas de diferente osmolaridad, atenuó la deshidratación y los cambios plasmáticos del sodio y el cloro pero no los del potasio al final del ejercicio, ni los del potasio urinario al final de la recuperación. Todas las variables estudiadas, excepto la concentración urinaria de cloro, se asociaron con la duración de la actividad física (p< 0,03); solo la pérdida de peso presentó asociación tiempo–tratamiento (p < 0,001). Hubo correlaciones, con todos los tratamientos, durante todo el procedimiento, entre el sodio y el cloro plasmáticos (r: 0,85–0,96) y entre la osmolaridad y el sodio urinarios (r: 0,50–0,83).
Conclusiones: al final de la actividad física se observó en el grupo DH una deshidratación hipernatrémica, hiperclorémica e hipercaliémica; la reposición parcial de las pérdidas hídricas, en el límite inferior de lo recomendado, atenuó la deshidratación y los cambios de los electrolitos plasmáticos excepto los del potasio; tampoco modificó la hipercaliuria del final del procedimiento. Son pocas las investigaciones que emplean un modelo de mediciones secuenciales, doble ciego, como el utilizado en el presente trabajo.
Palabras clave: Actividad física de alta intensidad y larga duración, Bebidas hidratantes, Cloro, Deshidratación, Osmolalidad, Potasio, Sodio
SUMMARY
Objetive: To establish the effects on plasma osmolality and serum and urine electrolyte composition of the intake of three beverages with different osmolarities after a high intensity, long duration run in endurance athletes.
Methodology: Nine long–distance runners performed 88 minutes of running on a treadmill (1% of inclination at a speed equivalent to 80% of the reserve heart rate), followed by 90 minutes of recovery; at the beginning there was no fluid replacement –dehydrated treatment– (DH); later on three sequential and randomized procedures were used, drinking equal volumes of one of three beverages, namely: hyperosmolar (Hyper), hyposmolar (Hypo) and isosmolar (Iso). Plasmatic osmolality and urinary osmolarity were measured by means of standard laboratory techniques, before and after the running period.
Results: In DH, at the end of the exercise period, a hypernatremic and hyperchloremic dehydration was observed (p < 0.05); throughout the procedure there was hyperkaliemia (p < 0.011); at the end of the recovery period there were an urinary volume reduction (p< 0.05) and hyperkaliuria (p < 0.001). Partial replacement of the water loss, with beverages of different osmolarity, attenuated dehydration and the plasmatic changes of sodium and chloride, but not those of potassium at the end of the exercise period, or those of urinary potassium at the end of the recovery period. All studied variables, except for the urinary concentration of chlorine, were associated with the duration of the physical activity (p < 0.03); only the weight loss showed time–treatment association (p < 0.001). There were correlations with all treatments and during all procedures between plasmatic sodium and chloride (r: 0.85–0.96) and between urinary osmolarity and sodium (r: 0.50–0.83).
Conclusions: At the end of the physical activity there was, in the DH group, a hypernatremic, hyperchloremic and hyperkaliemic type of dehydration; partial replacement of the water loss, although in the lower level of the recommended volume, attenuated dehydration and the plasmatic electrolytic changes, except for those of the potassium; hyperkaliuria did not change either at the end of the procedure. Few investigations have used the double–blinded model of sequential measurements that was used in the present work.
Key words: Chlorine, Dehydration, High–intensity, long–duration physical activity, Hydrating beverages, Osmolality, Potassium, Sodium
INTRODUCCIÓN
Durante la realización de una actividad física se incrementa la velocidad de la hidrólisis del ATP que, además de brindar la energía necesaria para la contracción muscular, produce una cantidad de calor proporcional a la intensidad y a la duración de dicha actividad.1,2 Cuando la ejecución de la actividad física es de alta intensidad y larga duración la producción de calor aumenta considerablemente la temperatura corporal central y, cuando esto sucede, se desencadenan mecanismos fisiológicos que trabajan coordinadamente para regularla; entre ellos se destacan el incremento del flujo sanguíneo hacia la piel y los músculos, la vasodilatación periférica y la sudación.1,3 Si bien, y en términos generales, las actividades físicas de alta intensidad y larga duración, bajo condiciones ambientales neutras (19 a 25 ºC) generan, por sudor, una pérdida de líquidos entre 1,0 y 1,5 L/h, la ingesta líquida voluntaria, tendiente a reemplazar la pérdida, pocas veces supera el 0,5 L/h.4,5
El sudor es un líquido hipotónico con respecto al plasma, con una concentración promedio, en mEq/L, de 35 de sodio (rango entre 10 y 70), 30 de cloro (rango entre 5 y 60) y 5 de potasio (rango entre 3 y 15); su velocidad de secreción, al igual que su composición, pueden ser modificadas por otros factores tales como el nivel de entrenamiento y el grado de aclimatación;6,7 en consecuencia, las pérdidas hidroelectrolíticas ocasionadas por el sudor pueden generar una deshidratación hipertónica que desencadena, además, otros mecanismos homeostáticos tendientes a mantener la osmolalidad y el volumen plasmáticos; se destacan la liberación neurohipofisiaria de arginina–vasopresina (hormona antidiurética, HAD)– y la secreción adrenal de aldosterona (ALDO).8–15
Se acepta que el reemplazo adecuado de líquidos, durante la práctica de una actividad física, permite conservar el contenido de agua corporal y atenuar el grado de deshidratación en cantidad suficiente para mantener la tasa de sudación e incrementar la vasodilatación periférica y, en consecuencia, mantener los principales mecanismos de disipación del calor;16–18 sin embargo, no hay acuerdo en cuanto a la composición de los líquidos para suministrar ni sobre la cantidad y el momento de hacerlo.
Los resultados de los estudios son contradictorios pero la mayoría de los investigadores18–20 consideran que la eficiencia de las bebidas hidratantes, para reemplazar las pérdidas de líquidos y electrolitos por sudor depende, en parte, de la osmolaridad de la bebida, ya que esta afecta tanto la velocidad del vaciamiento gástrico como la de la absorción intestinal. Para algunos autores las soluciones hipotónicas promueven una absorción más rápida de agua que las isotónicas e hipertónicas; estasú ltimas generan inicialmente un eflujo de agua hacia la luz intestinal.21,22 Así pues, algunos autores recomiendan bebidas hidratantes hipotónicas, con una concentración de electrolitos similar a la del sudor; otros, por el contrario, consideran que las bebidas isotónicas son las más recomendables.
Diseñar un programa de hidratación que reponga los líquidos y electrolitos perdidos durante una actividad física es una tarea compleja dado que la cantidad por reponer va a estar determinada por una serie de circunstancias tales como la tasa individual de sudación, el tipo, la intensidad y la duración del ejercicio, las condiciones climáticas, el vestuario utilizado y las oportunidades para disponer de la bebida hidratante, además de las características organolépticas de la misma.
El Colegio Americano de Medicina Deportiva (ACSM) recomienda a los deportistas monitorear el peso corporal durante los entrenamientos y las competencias, con el fin de calcular las pérdidas hídricas por sudor, y de esta manera diseñar un esquema individualizado de hidratación que evite pérdidas hídricas mayores del 2% del peso corporal.7
Como pautas generales para la hidratación durante una actividad física de larga duración el ACSM sugiere una ingesta entre 400 y 800 mL/h con el objeto de evitar los problemas de deshidratación o sobrehidratación; los consumos más altos son para los individuos de mayor peso corporal y que corren en un ambiente caluroso, en tanto que los individuos de menor peso corporal y que compiten en un ambiente frío deberán tener los consumos más bajos. En cuanto a la composición de la bebida recomienda: 20 a 30 mEq/L de cloruro de sodio, 2 a 5 mEq/L de potasio y 5 a 8% de carbohidratos.7
En la presente investigación se elaboró una solución hidroelectrolítica, de composición similar al sudor, con miras a reponer las pérdidas ocasionadas por él. En consecuencia, la cantidad de electrolitos, similar para las tres bebidas, fue, en mEq/L, de 50 de sodio, 40 de cloro y 9 de potasio; la concentración de carbohidratos, responsable de la diferencia de la osmolaridad de las bebidas, varió entre 2 y 5%.
El propósito de la presente investigación fue establecer los efectos del consumo de estas bebidas sobre la osmolalidad plasmática y la osmolaridad urinaria y sobre la concentración de los principales electrolitos, tanto plasmáticos como urinarios, durante una actividad física de alta intensidad y larga duración, llevada a cabo bajo condiciones ambientales neutras.
MATERIALES Y MÉTODOS
Población
Se estudiaron nueve hombres deportistas con entrenamiento aeróbico, quienes se encontraban en el período de preparación física específica; después de ser informados del protocolo por seguir dieron su consentimiento por escrito.
Protocolo experimental
La investigación se realizó en el Laboratorio de Fisiología del Ejercicio de Indeportes Antioquia, situado en Medellín a 1.538 msnm, con una temperatura promedio de 24,2 ºC (error estándar de la media ± 0,1), una humedad relativa ambiental de 51,8% (error estándar de la media ± 1,4) y
una presión barométrica de 674 mm Hg.
Se siguió el protocolo descrito en el artículo Efectos de la ingesta ad libitum de bebidas hidratantes sobre el peso corporal, la frecuencia cardíaca y el volumen plasmático, durante una actividad física de alta intensidad y larga duración. Informe preliminar.23 En resumen: se utilizó un modelo de mediciones repetidas o secuenciales, doble ciego, en el cual una semana después de la determinación de la frecuencia cardíaca máxima (FCmáx) y de las frecuencias cardíacas de reserva, mediante la aplicación de una prueba máxima de carga ascendente, a cada uno de los nueve deportistas se lo sometió al tratamiento deshidratado (DH) el cual consistió en nueve minutos de calentamiento sobre la banda rodante, con una pendiente del 1% y a una velocidad equivalente al 50% de la reserva de la frecuencia cardíaca (RFC50); lo anterior fue seguido de 88 minutos de carrera, sobre la banda rodante, con igual pendiente y a una velocidad correspondiente al 80% de la RFC (RFC80); finalmente, 90 minutos de recuperación. Dos a tres semanas más tarde se repitió este mismo protocolo en tres ocasiones con cada deportista y en cada una de ellas se le suministró, aleatoriamente, un volumen similar, establecido luego del primer protocolo con hidratación, de una de las tres bebidas, a saber: isoosmolar –iso– (293 mOsm/L), hipoosmolar –hipo– (210 mOsm/L) e hiperosmolar– hiper– (376 mOsm/L).
Medición de variables
Se registraron la edad, el peso corporal (báscula Detecto), la estatura (tallímetro Andac), los pliegues cutáneos (adipómetro Harpenden) y se calculó el porcentaje de grasa corporal por el método de Yuhasz.24 Para este estudio se obtuvieron los datos de las variables al inicio del procedimiento (IP), al final del ejercicio (FE) y al final de la recuperación (FR); para la dosificación de la osmolalidad plasmática se empleó un osmómetro de presión (Wescor 5500) y para la osmolaridad urinaria, un nefelómetro; las concentraciones de sodio y potasio se obtuvieron con un espectrofotómetro (Corning 410C) y las de cloro mediante la técnica del ion selectivo (Electrolyte analizer Nova 10+).
Análisis estadístico
Todos los datos se procesaron mediante el paquete Statistica 6.0 (Stafsoft Inc.), se presentan como el promedio y el error estándar de la media. Se estableció la normalidad de los datos mediante la prueba de Shapiro Willks y se aplicó un ANOVA de mediciones repetidas y una evaluación post–hoc mediante la prueba de Newman–Keuls. La significancia estadística se fijó en p< 0,05. Para el análisis de la regresión lineal y del coeficiente de correlación se aplicó el método de Pearson.
RESULTADOS
Variables generales
El promedio de edad fue 25,1 ± 1,8 años; el de peso, 60,2 ± 2,1 kg; el de estatura, 168,2 ± 1,0 cm; el de porcentaje de grasa corporal, 7,0 ± 0,4%, y el índice de masa corporal, 21,3 ± 0,7 kg/m2.
Para la presentación de los resultados se analizó cada variable comparativamente: el inicio del procedimiento con el final del ejercicio y el final del ejercicio con el final de la recuperación.
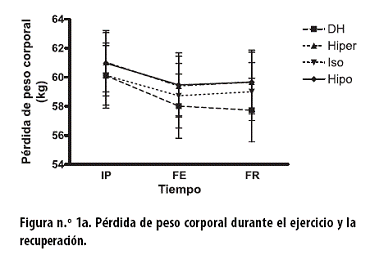
Al FE, con cada uno de los tratamientos, se observaron reducciones del peso corporal, en kg, estadísticamente no significativas: con el tratamiento DH de 2,2 ± 0,2; con el hiper de 1,6 ± 0,2; con el iso de 1,4 ± 0,3, y con el hipo de 1,5 ± 0,2 (Figura n.º 1a).
Al FR se observó reducción no significativa del peso corporal con el tratamiento DH de 0,3 ± 0,1 kg; por el contrario, se observaron aumentos no significativos con los tratamientos hiper (0,3 ± 0,1 kg), iso (0,3 ± 0,3 kg) e hipo (0,2 ± 0,1 kg). Al aplicar un ANOVA de dos vías a todo el procedimiento hubo asociación tiempo–tratamiento (p < 0,001). Como se informó previamente,23 la reducción porcentual de la pérdida de peso fue estadísticamente significativa, tanto al FE como al FR; en esta última fase, el tratamiento DH se diferenció de los tratamientos con hidratación.
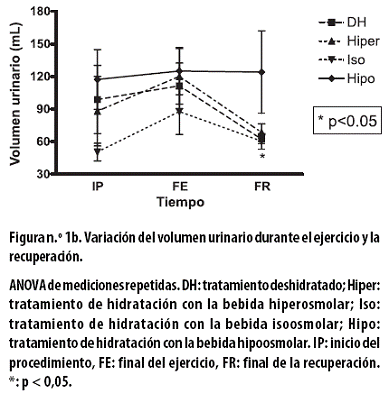
El volumen urinario, en mL, al FE y con cada uno de los tratamientos presentó incrementos no significativos: con el tratamiento DH de 12,6 ± 26,6; con el hiper de 32,0± 18,5; con el iso de 37,2 ± 21,1, y con el hipo de 7,7 ± 19,0 (Figura n.º 1b).
Al FR el volumen urinario presentó una reducción significativa con el tratamiento DH (56,0 ± 17,1; p < 0,05); con los otros tratamientos las reducciones no fueron significativas: con el hiper de 51,6 ± 24,1; con el iso de 27,2 ± 16,6, y con el hipo de 1,0 ± 31,1 (Figura n.º 1b). Al aplicar un ANOVA de dos vías a todo el procedimiento hubo asociación con el tiempo (p < 0,000).
Osmolalidad plasmática y osmolaridad urinaria
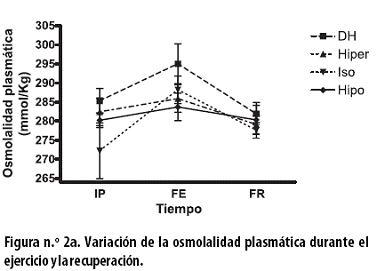
La osmolalidad plasmática, en mmol/kg, al FE y con cada uno de los tratamientos, presentó incrementos no significativos: con el tratamiento DH de 9,7 ± 7,6; con el hiper de 3,4 ± 4,8; con el iso de 16,0 ± 8,3 y con el hipo de 3,5 ± 4,1 (Figura n.º 2a).
Al FR, con cada uno de los tratamientos, se observó una reducción no significativa de la osmolalidad: con el tratamiento DH de 13,1 ± 6,8; con el hiper de 6,8 ± 3,9; con el iso de 10,6 ± 3,5 y con el hipo de 3,4 ± 3,9. Al aplicar un ANOVA de dos vías a todo el procedimiento hubo asociación con el tiempo (p< 0,01).
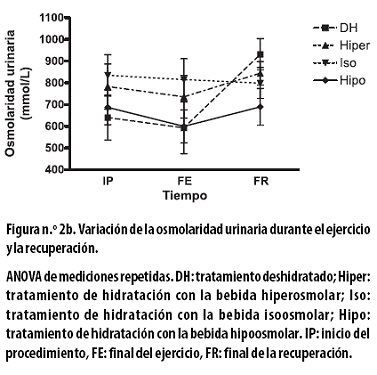
La osmolaridad urinaria, en mmol/L, al FE y con cada uno de los tratamientos presentó disminuciones no significativas: con el tratamiento DH de 47,2 ± 93,9; con el hiper de 47,2 ± 45,3; con el iso de 19,6 ± 59,9 y con el hipo de 87,3 ± 62,0 (Figura n.º 2b).
Al FR se observaron aumentos no significativos: con el tratamiento DH de 338,2 ± 82,9; con el hiper de 108,1 ± 64,8 y con el hipo de 89,6± 99,3; en tanto que con el tratamiento iso se observó una reducción no significativa de 15,9 ± 37,8. Al aplicar un ANOVA de dos vías a todo el procedimiento hubo asociación con el tiempo (p < 0,033).
Sodio plasmático y urinario
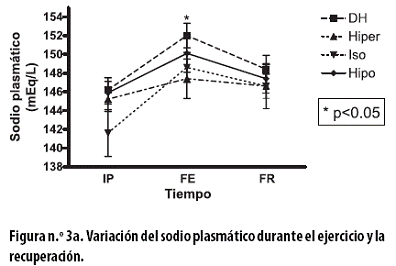
El sodio plasmático, en mEq/L, al FE del tratamiento DH presentó un incremento significativo de 5,8 ± 1,3 (p = 0,03); aumentos no significativos se presentaron con los tratamientos hiper (2,3 ± 2,4), iso (7,0 ± 3,0) e hipo (4,6± 1,5) (Figura n.º 3a).
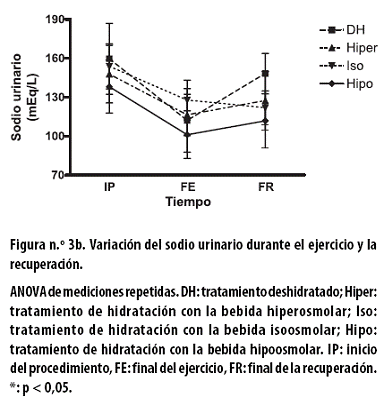
Al FR se observaron reducciones no significativas: con el tratamiento DH de 3,6 ± 2,0; con el hiper de 0,8 ± 2,9; con el iso de 2,1 ± 1,3 y con el hipo de 3,2 ± 2,0. Al aplicar un ANOVA de dos vías a todo el procedimiento hubo asociación con el tiempo (p < 0,01). El sodio urinario, en mEq/L, al FE presentó reducciones no significativas con todos los tratamientos: con el DH de 47,3 ± 7,9; con el hiper de 31,3 ± 18,0; con el iso de 26,0± 10,5 y con el hipo de 37,0 ± 12,8 (Figura n.º 3b).
Al FR se observaron incrementos no significativos: con el tratamiento DH de 36,2 ± 19,6; con el hiper de 10,0 ± 19,6; con el iso de 147,9 ± 19,2 y con el hipo de 10,6 ± 17,2. Al aplicar un ANOVA de dos vías a todo el procedimiento hubo asociación con el tiempo (p < 0,000).
Cloro plasmático y urinario
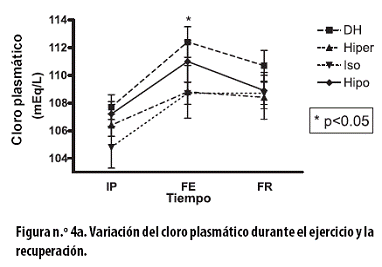
Un comportamiento similar al del sodio se observó con el cloro plasmático, el cual presentó un incremento significativo al FE del tratamiento DH de 4,7 ± 0,8 mEq/L (p < 0,02); incrementos no significativos (en mEq/L) se observaron con los tratamientos hiper (2,3 ±1,5), iso (3,9 ± 1,6) e hipo (3,7 ± 1,1) (Figura n.º 4a).
Al FR se observaron reducciones no significativas: con el tratamiento DH de 1,7 ± 1,3; con el hiper de 0,4 ± 1,9 y con el hipo de 2,0± 1,2; con el tratamiento iso no se presentó modificación de la concentración plasmática del cloro (0,0 ± 0,6). Al aplicar un ANOVA de dos vías a todo el procedimiento hubo asociación con el tiempo (p < 0,000).
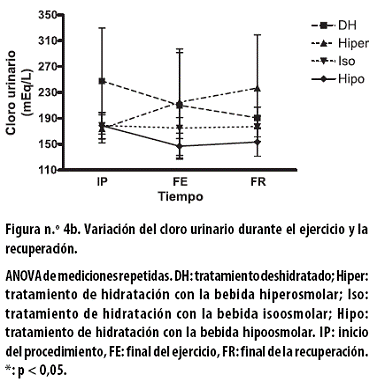
El cloro urinario, en mEq/L, al FE presentó reducciones no significativas con los tratamientos DH (37,4 ± 15,6); iso (4,0 ± 7,8) e hipo (31,7 ± 13,0), y un incremento no significativo con el tratamiento hiper de 41,1 ± 73,8 (Figura n.º 4b).
Al FR se observó una reducción no significativa con el tratamiento DH de 19,4 ± 75,0 y aumentos no significativos con los tratamientos hiper (21,8 ± 24,7), iso (2,3 ± 16,6) e hipo (6,4 ± 23,6). Al aplicar un ANOVA de dos vías a todo el procedimiento no se observó asociación con el tiempo ni con el tratamiento.
Potasio plasmático y urinario
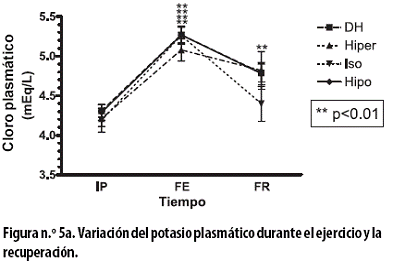
Por último, el potasio plasmático, en mEq/L, al FE, con todos los tratamientos, presentó un incremento significativo: con el DH de 0,96 ± 0,04 (p < 0,000); con el hiper de 0,87 ± 0,18 (p < 0,004); con el iso de 1,07 ± 0,17 (p< 0,001), y con el hipo de 0,98 ± 0,10 (p < 0,000) (Figura n.º 5a).
Mientras que al FR la reducción observada fue significativa con el tratamiento DH (0,48 ± 0,13; p < 0,011); se observaron reducciones no significativas con los tratamientos hiper (0,26 ± 0,27), iso (0,56 ± 0,23) e hipo (0,49 ± 0,13). Al aplicar un ANOVA de dos vías a todo el procedimiento hubo asociación con el tiempo (p < 0,000).
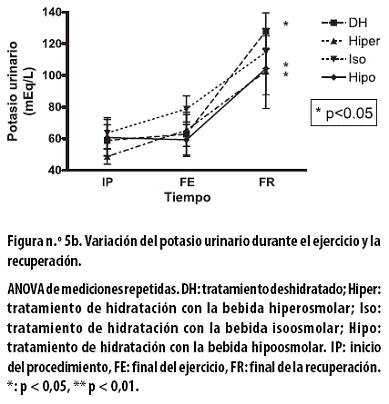
Al FE el potasio urinario, en mEq/L, presentó incrementos no significativos con el tratamiento DH (3,8 ± 7,5), con el hiper (16,7 ± 8,2) y con el iso (15,2 ± 4,6); por el contrario, se presentó una reducción no significativa con el tratamiento hipo de 1,4 ± 7,7 (Figura n.º 5b).
Al FR se observó un incremento significativo (p < 0,05) con los tratamientos DH (65,2 ± 10,2), hiper (37,1 ± 17,3) e hipo (45,1 ± 22,0); con el tratamiento iso el incremento (36,0 ± 14,0) no fue significativo. Al aplicar un ANOVA de dos vías a todo el procedimiento hubo asociación en el tiempo (p < 0,000).
Coeficientes de correlación
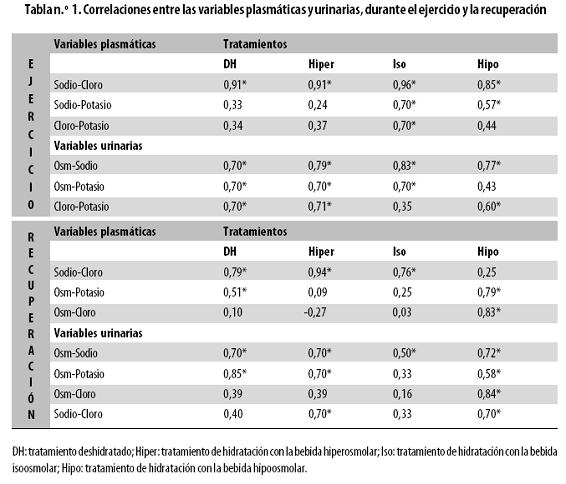
En la presente investigación las correlaciones entre las diferentes variables en estudio, tanto plasmáticas como urinarias, se observan en la tabla n.º 1; solo haremos referencia a aquellas cuyo coeficiente de correlación fue = 0,70.
Variables plasmáticas
Se observaron correlaciones estadísticamente significativas, con todos los tratamientos, entre el sodio y el cloro, al FE (r = 0,85–0,96) y al FR (r = 0,76–0,94); en estaú ltima fase no se observó correlación significativa con el tratamiento hipo. Con el tratamiento iso, al FE, se observaron correlaciones estadísticamente significativas del potasio con el sodio y con el cloro (r = 0,70). Mientras que con el tratamiento hipo, al FR, se observó correlación estadísticamente significativa de la osmolalidad con el potasio (r = 0,79) y con el cloro (r = 0,83).
Variables urinarias
Se observaron correlaciones estadísticamente significativas, con todos los tratamientos, entre la osmolaridad y el sodio, tanto al FE (r = 0,70–0,83) como al FR (r = 0,50–0,72). Entre la osmolaridad y el potasio, al FE (r = 0,70), con todos los tratamientos, excepto con el hipo; al FR (r = 0,58–0,85), en todos los tratamientos excepto con el iso. Solo al FE se observó correlación estadísticamente significativa entre el potasio y el cloro (r = 0,60–0,71) con todos los tratamientos, excepto con el iso. Al FR del tratamiento hipo aparecen correlaciones estadísticamente significativas entre el sodio y el cloro (r = 0,84) y entre la osmolaridad y el cloro (r = 0,70).
DISCUSIÓN
En investigaciones previas25–27 habíamos encontrado que cuando no hay reposición hídrica se desencadena una deshidratación hiperosmolar e hipernatrémica y que la hipercaliemia que se presenta es independiente del estado de hidratación. El propósito de la presente investigación, con un protocolo parecido, fue establecer: por un lado, los efectos de la deshidratación sobre la concentración plasmática y urinaria de cloro, que no habían sido estudiados previamente, y, por otro, los efectos del consumo de tres bebidas con diferente osmolaridad sobre la osmolalidad plasmática y la osmolaridad urinaria y sobre la concentración de los principales electrolitos, tanto plasmáticos como urinarios, durante una actividad física de alta intensidad y larga duración, efectuada bajo condiciones ambientales neutras.
Con respecto a la metodología de la presente investigación, recordemos que: 1) para cada deportista la intensidad de la actividad física, equivalente a la RFC80, se mantuvo constante durante los 88 minutos de la fase de ejercicio; 2) que luego del procedimiento DH el volumen hidroelectrolítico ingerido fue similar en los tres tratamientos con hidratación, y 3) que la osmolaridad de las bebidas fue dada, principalmente, por el contenido variable de carbohidratos ya que el de electrolitos fue similar.
Con respecto a los resultados de la presente investigación es importante señalar que: 1) todas las variables estudiadas, ya fueran plasmáticas o urinarias, excepto la concentración urinaria de cloro, mostraron asociación estadísticamente significativa con el tiempo, esto es, con la duración de la actividad física. Además, con la variable pérdida de peso se observó asociación con el tiempo y con el tratamiento; 2) las variables plasmáticas mostraron, durante todo el procedimiento, un comportamiento bifásico, esto es, el sentido de la variación observada al final del ejercicio fue opuesto al observado al final de la recuperación; y 3) un comportamiento similar al anterior se observó en las muestras urinarias con el volumen, la osmolaridad y el sodio; con el cloro y el potasio las variaciones al final del ejercicio se acentuaron al final de la recuperación.
Al final de todo el procedimiento y con cada uno de los tratamientos se observó una pérdida de peso estadísticamente no significativa; pero la reducción porcentual de la pérdida de peso (parámetro que se tiene en cuenta para establecer el grado de deshidratación) sí fue estadísticamente significativa, tanto al FE como al FR;23 en esta última fase, el tratamiento DH se diferenció de los tratamientos con hidratación a pesar del poco volumen ingerido durante todo el procedimiento (1.152 mL). La ingesta promedio, durante la fase de ejercicio, fue de 407 mL/h, cifra ubicada en el límite inferior de la recomendada por el ACSM para atletas de bajo peso corporal cuando realizan actividad física en ambientes con baja temperatura (menor de 15 °C) con el fin de atenuar los efectos adversos ocasionados por la deshidratación sobre el desempeño deportivo.6,7
Si bien el comportamiento de la osmolalidad plasmática con todos los tratamientos fue el esperado, en el procedimiento DH la magnitud del cambio observado no fue estadísticamente significativa, probablemente debido a la falta de sensibilidad del método empleado para su determinación (osmómetro de vapor); en un estudio previo,25 bajo condiciones similares, encontramos diferencias significativas con la técnica de punto de congelación –Osmette–. Argumentamos la falta de sensibilidad de la técnica empleada ya que la proporcionalidad establecida entre la osmolalidad y el sodio plasmáticos (Osm = 2[Na]) se observó en menos del 50% de las muestras.
El comportamiento plasmático del sodio fue el esperado;26,28,29 esto es, al FE del procedimiento DH su incremento fue estadísticamente significativo; aumentos no significativos se observaron en los procedimientos con hidratación; ahora bien, el poco volumen ingerido de las bebidas hidratantes podría explicar que la diferencia observada entre hidratados y no hidratados no fuera significativa. Tampoco hubo diferencias entre los tratamientos con hidratación, probablemente debido a que las bebidas ofrecidas tenían igual contenido de cloruro de sodio.
El comportamiento plasmático del cloro, que no había sido estudiado por nuestro grupo, fue también el esperado.28–30 Al igual que el sodio, al FE del procedimiento DH su incremento fue estadísticamente significativo; aumentos no significativos se observaron en los procedimientos con hidratación; como con el sodio, el bajo volumen ingerido de las bebidas hidratantes podría explicar que la diferencia observada entre hidratados y no hidratados no fuera significativa. Que no haya habido diferencias entre los varios procedimientos con hidratación probablemente se deba a que las bebidas ofrecidas tenían igual contenido de cloruro de sodio.
Igualmente, el comportamiento plasmático del potasio fue el esperado al FE de todos los procedimientos, esto es, una hipercaliemia independiente de la reposición de las pérdidas hídricas. De nuevo, el bajo volumen ingerido de las bebidas hidratantes podría explicar que la diferencia observada entre hidratados y no hidratados al FR no haya sido significativa.25,28,29,31
Con ninguno de los procedimientos, la magnitud de los cambios de las variables urinarias fue estadísticamente significativa, ni al FE ni al FR, excepto: la excreción urinaria de potasio, que aumentó significativamente al FR, con todos los tratamientos menos con el iso; y la disminución del volumen al FR con el tratamiento DH. Estos resultados son similares a los obtenidos previamente por nuestro grupo;26,27,32 en la publicación de ellos resaltábamos que: 1) la utilización de las variables urinarias como indicadoras del estado de hidratación, durante la ejecución de una actividad física, no ofrecía ventajas con respecto al uso de las variables plasmáticas, y 2) las respuestas renales ante la liberación hormonal, HAD y ALDO, no eran las esperadas y estaban temporalmente disgregadas.
Las correlaciones obtenidas en el presente estudio fueron las esperadas, esto es, entre sodio y cloro, durante todo el procedimiento y con todos los tratamientos. La ingesta de la bebida hidratante de tipo isoosmolar durante la fase del ejercicio, aun en cantidades menores que las recomendadas, modifica el balance electrolítico (aparición de la correlación del potasio con el sodio y con el cloro).
La existencia de la correlación esperada entre la osmolaridad urinaria (empleando un nefelómetro) y la concentración urinaria de sodio, con todos los tratamientos y durante todo el procedimiento, respalda nuestra afirmación de que el método empleado para la medición de la osmolalidad plasmática (utilizando el osmómetro de vapor) es poco sensible. De nuevo, la ingesta de una bebida isoosmolar modifica al final del procedimiento la relación existente entre la osmolaridad urinaria y el contenido urinario de potasio.
En conclusión, en el presente trabajo observamos que al final de una actividad física de alta intensidad y larga duración, por corredores de fondo, bajo condiciones ambientales neutras, cuando no se hace reposición hídrica, se presenta una deshidratación hipernatrémica, hiperclorémica e hipercaliémica, y al final de la recuperación una reducción del volumen urinario acompañada de hipercaliuria. La reposición parcial de las pérdidas hidroelectrolíticas con bebidas de diferente osmolaridad, aun en el límite inferior de lo recomendado por el Colegio Americano de Medicina Deportiva, atenúa la deshidratación, la hipernatremia y la hipercloremia pero no la hipercaliemia ni la hipercaliuria.
Infortunadamente, y tal vez debido a la baja ingesta de las bebidas hidratantes, no se pudieron establecer los efectos de cada una de ellas sobre las variables en estudio por lo que se hacen necesarios estudios posteriores. Son pocas las investigaciones que emplean un modelo de mediciones secuenciales, doble ciego, como el utilizado en el presente trabajo.
AGRADECIMIENTOS
La presente investigación fue realizada con el auspicio del Comité para el Desarrollo de la Investigación de la Universidad de Antioquia (CODI) e Indeportes Antioquia. A Laboratorios Mineralín por la preparación y el suministro de las bebidas hidratantes; a la bacterióloga Rubiela Flórez por su ayuda técnica, a la doctora Diana Patricia Díaz y al licenciado Luis Hernando Valbuena por su ayuda durante la realización del proyecto. A los
deportistas y entrenadores por su valiosa colaboración.
REFERENCIAS BIBLIOGRÁFICAS
1. Sawka M. Physiological consequence of hipohydration: exercise performance and thermoregulation. Med Sci Sports Exerc 1992; 24: 657–670. [ Links ]
2. Sawka M, Convertino V, Eichner E, Schneider S, Yung A. Blood volume: importance and adaptations to exercise training. Environmental stresses and trauma/sickness. Med Sci Sports Exerc 2000; 32: 332–348. [ Links ]
3. Gisolfi CV, Duchman SM. Guidelines for optimal replacement beverages for different athletic events. Med Sci Sports Exerc 1992; 24: 678–687. [ Links ]
4. Noakes TD. Fluid replacement during exercise. Exerc Sport Sci Rev 1993; 21: 297–330. [ Links ]
5. Passe DH, Horn M, Murray R. Impact of beverage acceptability on fluid intake during exercise. Appetite 2000; 35: 219–229. [ Links ]
6. American College of Sports Medicine Position Stand. Exercise and fluid replacement. Med Sci Sports Exerc 1996; 28: 1–7. [ Links ]
7. American College of Sports Medicine Position Stand. Exercise and fluid replacement. Med Sci Sports Exerc 2007; 39: 377–390. [ Links ]
8. Jaramillo HN, Díaz DP, Calderón JC. Líquidos y Electrolitos. Medellín: Universidad de Antioquia, 2004, 68 pp. [ Links ]
9. Eaton D, Pooler J. Fisiología Renal de Vander, 6ª ed. México: McGraw–Hill, Inc. 2006: 97–133. [ Links ]
10. Borrero RJ, Constaín FA, Restrepo CJ. Manual de Líquidos y Electrolitos. Corporación para Investigaciones Biológicas, Medellín Colombia, 2006, 330 pp. [ Links ]
11. Sawka M. Body fluid responses and hypohydration during exercise–heat stress. En: Pandolf KB, Sawka M, Gonzalez RR, eds. Human performance physiology and enviromental medicine at terrestrial extremes, 1ª ed. Carmel: Cooper Publishing Group; 1986: 227–266. [ Links ]
12. Schrier RW, Regal EM. Influence of aldosterone on sodium, water and potassium metabolism in chronic renal disease. Kidney Int 1972; 1: 156–168. [ Links ]
13. Karvonen J, Vuorima T. Heart rate and exercise intensity during sports activities Practical application. Sports Med 1988; 5: 303–311. [ Links ]
14. Mullins RJ. Shock, Electrolitos y Líquidos. En: Townsend CM, Beauchamp RD, Evers BM, Mattox KL, eds. Sabiston Tratado de Cirugía: Fundamentos biológicos de la práctica quirúrgica moderna, 17ª ed. Madrid: Elsevier; 2005: 67–112. [ Links ]
15. Kozar RA, Moore FA. Cuidado de líquidos y electrolitos en el paciente quirúrgico. En: Brunicardi FC, Andersen DC, Billiar TR, Dunn DL, Hunter JG, Pollock RE, eds. Schwartz Principios de Cirugía, 8ª ed. México: McGraw– Hill Interamericana; 2006: 43–59. [ Links ]
16. Montain SJ, Coyle EF. Influence of graded dehydration on hyperthermia and cardiovascular drift during exercise. J Appl Physiol 1992; 73: 1340–1350. [ Links ]
17. Gonzalez AJ, Mora JR, Below PR, Coyle EF. Dehydration reduces cardiac output and increases systemic and cutaneous vascular resistance during exercise. J Appl Physiol 1995; 79: 1487–1496. [ Links ]
18. Backhouse SH, Ali A, Biddle SJ, Williams C. Carbohydrate ingestion during prolonged high–intensity intermittent exercise: impact on affect and perceived exertion. Scand J Med Sci Sports 2007; Published online: 20–Feb–2007. doi: 10.1111/j.1600–0838.2006.00613.x [ Links ]
19. Coombes JS, Hamilton KL. The effectiveness of commercially available sport drinks. Sports Med 2000; 29: 181–209. [ Links ]
20. Gisolfi CV, Summers RW, Lambert GP, Xia T. Effect of beverage osmolality on intestinal fluid absorption during exercise. J Appl Physiol 1998; 85: 1941–1948. [ Links ]
21. Maughan RJ, Bethell LR, Leiper JB. Effects of ingested fluids on exercise capacity and on cardiovascular and metabolic responses to prolonged exercise in man. Experim Physiol 1996; 81: 847–859. [ Links ]
22. Maughan RJ, Leiper JB. Limitations to fluid replacement during exercise. Can J Appl Physiol 1999; 24: 173–187. [ Links ]
23. Aristizábal JC, Jaramillo HN, Díaz DP, Pérez JA, Flórez R. Efectos de la ingesta ad libitum de bebidas hidratantes sobre el peso corporal, la frecuencia cardíaca y el volumen plasmático durante una actividad física de alta intensidad y larga duración. Iatreia 2004; 17: 203–215. [ Links ]
24. Yuhasz MS. Physical fitness Manual, 1ª ed. London, Ontario: University of Western Canada, 1974. [ Links ]
25. Caldas ZR, Ortiz A, Jaramillo HN. Influencia del estado de hidratación sobre la capacidad física de trabajo y sobre la recuperación en atletas corredores de fondo. Acta Méd Colomb 1997; 22: 132–139. [ Links ]
26. Jaramillo HN, Caldas ZR, Díaz DP, Ortiz A. Índices urinarios y plasmáticos en la valoración del estado de hidratación en corredores de fondo sometidos a una actividad física intensa y de larga duración. Acta Méd Colomb 1998; 23: 69–76. [ Links ]
27. Caldas ZR, Díaz DP, Ortiz A, Jaramillo HN. Influencia del estado de hidratación sobe la capacidad física y las variables urinarias y plasmáticas en corredores de larga distancia. Rev Antioq Med Deport Cienc Apl Deport Act Fís 1999; 1: 16–26. [ Links ]
28. Daries HN, Noakes TD, Dennis SC. Effects of fluid intake volume on 2–h running performances in a 25 ºC environment. Med Sci Sports Exerc 2000; 10: 1783–1789. [ Links ]
29. Van Beaumont W, Strand JC, Petrofsky JS, Hipskind SG, Greenleaf JE. Changes in total plasma content of electrolytes and protein with maximal exercise. J Appl Physiol 1973; 34: 102–106. [ Links ]
30. Rocker L, Kirsch KA, Heyduck B, Alterkirtch U. Influence of prolonged physical exercise on plasma volume, plasma proteins, electrolytes and fluid regulation hormones. Int J Sport Med 1989; 10: 270–274. [ Links ]
31. McCoy M, Hergreaves M. Potassium and ventilation during incremental exercise in trained and untrained men. J Appl Physiol 1992; 73: 1287–1290. [ Links ]
32. Díaz DP, Jaramillo HN. Efecto de la deshidratación sobre la aldosterona durante una actividad física intensa y de larga duración. Acta Méd Colomb 1999; 24: 195–201. [ Links ]
Recibido: junio 17 de 2008
Aceptado: septiembre 10 de 2008