Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.22 no.3 Medellín July/Sept. 2009
INVESTIGACIÓN ORIGINAL
Estudio comparativo, cruzado, al azar, para la determinación de la bioequivalencia entre dos formulaciones de oxcarbazepina en tabletas
Bioequivalence comparison of two formulations of oxcarbazepine tablets: a two period, single dose, randomized, cross–over study
Gloria Shirley Ramírez Correa1, Piedad Restrepo Valencia2, Milena Pérez Guzmán3, Mauricio Pérez Flórez4, Eduar Echeverri García5
1 Química Farmacéutica. Asistente de Investigación, Unidad de Estudios Biofarmacéuticos, CIDEIM, Cali, Colombia. gloriashirley_ramirez@cideim.org.co
2 Química Farmacéutica, MSc en Farmacología. Investigadora Asociada, Unidad de Estudios Biofarmacéuticos, CIDEIM, Cali, Colombia. piedadrestrepo11@une.net.co
3 Química Farmacéutica. Coordinadora de la Unidad de Estudios Biofarmacéuticos, CIDEIM, Cali, Colombia. milena_perez@cideim.org.co
4 Estadístico. Unidad de Epidemiología y Bioestadística, CIDEIM, Cali, Colombia. mauricioperez@cideim.org.co
5 Médico Internista. Coordinador clínico de la Unidad de Estudios Biofarmacéuticos, CIDEIM, Cali, Colombia. dr_echeverri@hotmail.com
Resumen
Dos formulaciones de oxcarbazepina (Trileptal®, Novartis, y Oxcarbazepina®, Tecnoquímicas S. A.), previamente demostradas como equivalentes farmacéuticos, fueron evaluadas en cuanto a bioequivalencia por medio de un estudio aleatorizado, cruzado, en dos períodos, con dosis oral única de 1.200 mg, en 24 hombres adultos voluntarios sanos entre 18–35 años. Se evaluaron los siguientes parámetros farmacocinéticos: Área bajo la curva (AUC), Concentración máxima (Cmáx) y Tiempo para alcanzar la concentración máxima (Tmáx). Hubo un intervalo de lavado de siete días entre los dos períodos. Las concentraciones plasmáticas se evaluaron por HPLC/UV con el método de la adición estándar. No se encontraron diferencias significativas entre las dos preparaciones. Se concluyó que las dos preparaciones son equivalentes farmacéuticos y bioequivalentes y que, en consecuencia, son intercambiables para propósitos terapéuticos.
Palabras clave
Bioequivalencia, Oxcarbazepina en tabletas
SUMMARY
Two formulations of oxcarbazepine (Trileptal®, Novartis, y Oxcarbazepina®, Tecnoquímicas S. A.), previously shown to be pharmaceutical equivalents, were evaluated concerning their bioequivalence by means of a randomized, crossover, single oral dose (1.200 mg), two–period study in 24 healthy adult males. The following pharmacokinetic parameters were determined: Area under the curve (AUC), Maximal concentration (Cmax), and Time to reach maximal concentration (Tmax). There was a 206 wash–out interval of seven days between the two periods. Plasmatic concentrations of the drug were measured with HPLC/UV with standard addition. No significant differences were found between the two preparations. It was concluded that they are pharmaceutical equivalents as well as bioequivalent. Consequently, they are interchangeable for therapeutic purposes.
Key words(
Bioequivalence, Oxcarbazepine tablets
INTRODUCCIÓN
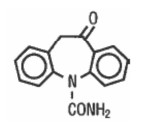
La oxcarbazepina es un fármaco anticonvulsivante cetoanálogo de la carbamazepina, activo por vía oral. Fue sintetizada en 19661 y aprobada para uso en Dinamarca en 1990 y en Colombia en 1998. En el organismo se convierte en varios metabolitos; uno de ellos, el derivado monohidroxilado de oxcarbazepina – MHD– (10,11–dihidro–10–hidroxicarbamazepina), es el principal en cuanto a actividad anticonvulsivante; finalmente este metabolito se conjuga con ácido glucurónico y se elimina por excreción renal. La denominación química de la oxcarbazepina es 10–11– dihidro–10–oxo–5H dibenz[b,f]azepina–5–carboxamida y la fórmula molecular es: C15H12N2O2. La masa molecular es de 252,268 g/mol. La fórmula estructural es la siguiente:
Tanto la oxcarbazepina como su metabolito activo (MHD) actúan por mecanismos similares a los descritos para la carbamazepina, relacionados con el bloqueo de los canales de sodio activados por voltaje, estabilizan las membranas neuronales hiperexcitadas, inhiben las descargas neuronales repetitivas y disminuyen la propagación de los impulsos sinápticos. También es parte de su mecanismo de acción anticonvulsiva el incremento de la conductancia del potasio y la modulación de los canales de calcio activados por voltaje alto.
El sitio de acción de la oxcarbazepina está en la biofase o superficie neuronal; por lo tanto, la concentración que allí se alcance, en contacto con el receptor, depende del equilibrio entre el fluido extracelular y el plasma sanguíneo. 2,3 Tal característica es la razón científica para que las valoraciones del principio activo en el plasma se correlacionen con las concentraciones en el sitio de acción y se fundamenten en ello la comparación de las biodisponibilidades de los medicamentos y el análisis de su bioequivalencia.
La oxcarbazepina administrada en tabletas se absorbe casi por completo (> 95%) y se metaboliza extensamente por enzimas citosólicas hepáticas a su monohidroxiderivado (MHD) activo farmacológicamente. Se calcula que en los pacientes la vida media plasmática es de dos horas (en adultos sanos es de 1 a 5 horas). La vida media aproximada del MHD es de 9 horas. En condiciones de ayuno se espera que el tiempo para alcanzar la concentración plasmática máxima sea aproximadamente de 4,4 horas (3 a 13 horas). Los alimentos no afectan la velocidad ni la cantidad de oxcarbazepina que se absorbe. La farmacocinética plasmática es lineal en dosis de 300 a 2.400 mg/día. El 76% se une a la albúmina del plasma. La depuración es de 67,4 mL/min/kg.
La demostración de bioequivalencia entre productos,4 previa a la declaración de su equivalencia terapéutica, se basa en estudios comparativos aplicando diferentes métodos in vitro e in vivo, en los que se considera como Referencia (R) al producto innovador con el cual se llevaron a cabo las investigaciones de eficacia y seguridad para el fármaco, y como producto de ensayo o Test (T) o producto multiorigen, al que pretende la intercambiabilidad. En los estudios de bioequivalencia, con base en la demostración de biodisponibilidad in vivo (sujetos humanos), el perfil de exposición sistémica se determina mediante ensayos clínicos en voluntarios sanos, para documentar la calidad del producto y concluir sobre el desempeño in vivo, en términos de biodisponibilidad/ bioequivalencia, como evidencia de seguridad y eficacia. 5 Los resultados se expresan como la velocidad de absorción y la cantidad absorbida hasta la circulación sistémica del ingrediente activo o de su metabolito o metabolitos activos. Se aplican diseños experimentales cruzados, en dos períodos, con asignación aleatoria del producto y el período.
Este artículo describe los resultados del estudio de bioequivalencia entre dos productos comercialmente disponibles en Colombia identificados como Oxcarbazepina MK, tabletas de 600 mg (Tecnoquímicas S. A.), como producto de prueba o Test(T), frente a Trileptal®, tabletas de 600 mg (Novartis) como producto de Referencia(R).
MATERIALES Y MÉTODOS
Voluntarios
El estudio farmacocinético se llevó a cabo en 24 hombres voluntarios sanos, con edades entre 18–35 años e índices de masa corporal (IMC) entre 20–29 kg/m2, cuyos exámenes médicos y de laboratorio clínico eran normales, y quienes aceptaron participar en el estudio y firmaron un formato de consentimiento aprobado por el Comité de Ética del CIDEIM, el que también revisó y aprobó el protocolo del estudio para cumplir los requerimientos de la Organización Mundial de la Salud y las normas colombianas.
Reactivos
El estándar de oxcarbazepina fue suministrado por Tecnoquímicas S. A. Se emplearon acetonitrilo (Fisher Scientific) y agua grado HPLC (high performance liquid chromatography). El ácido acético glacial (Panreac) y el acetato de sodio anhidro (Sigma), fueron de grado analítico.
Instrumentos y cromatografía
Los análisis se llevaron a cabo en un equipo de cromatografía líquida LaChrom Elite® (Merck–Hitachi) con detector ultravioleta con arreglo de diodos, columna Chromolith® Performance RP–18e 100–4.6 mm, 2µm (Merck), software EZChrom Elite® 3.1.3 (Merck), balanza analítica (Ohaus Adventurer®, agitador vórtex (Fisher Scientific), agitador magnético Multistation® (IKA), baño ultrasónico (Fisher Scientific), purificador de agua (Simplicity Millipore®), congelador –70° C (Revco®), congelador –45° C (Revco®), pH metro (WTW 740 Inolab®) y microcentrífuga (Eppendorf 5415C®).
Diseño y conducción del estudio
Se diseñó el estudio comparativo, cruzado, al azar para evaluar la bioequivalencia de los productos farmacéuticos identificados como Oxcarbazepina MK®/ Oxcarbazepina, en tabletas de 600 mg, elaborado por Tecnoquímicas S. A. y Trileptal®/Oxcarbazepina en tabletas de 600 mg, elaborado por Novartis, con base en las medidas farmacocinéticas de cantidad de fármaco absorbido y velocidad (en términos de tiempo requerido), con que la oxcarbazepina alcanza la circulación sistémica después de administrarla por vía oral en dosis de 1.200 mg de cada producto, en períodos de tratamiento asignados al azar y separados entre sí por un intervalo de siete días.
Equivalencia farmacéutica
En el Laboratorio Especializado de Análisis de la Universidad de Antioquia (Medellín, Colombia) se valoraron muestras de los productos en estudio para determinar el cumplimiento de las propiedades fisicoquímicas de acuerdo con la Farmacopea de los Estados Unidos (USP edición n.° 31). Los resultados de ambos productos permitieron concluir la conformidad con los métodos aplicados para las propiedades físicas, la identificación y valoración del principio activo, la prueba de disolución y la uniformidad de contenido. Tales resultados verificaron el cumplimiento de las especificaciones para ambos productos y permitieron definir su equivalencia farmacéutica.
Diseño experimental
Se hizo un estudio de bioequivalencia con base en la biodisponibilidad comparada de dosis únicas de 1.200 mg de oxcarbazepina en tabletas administradas por vía oral, en diseño cruzado al azar de dos vías para el producto de prueba Oxcarbazepina MK frente al estándar de referencia Trileptal ®, ambas en tabletas de 600 mg. Los productos se administraron por asignación aleatoria a 24 hombres voluntarios sanos. El diseño correspondió a un estudio comparativo de dos formulaciones, dos períodos, en dos secuencias cruzadas, no replicado, en sujetos con asignación al azar en los grupos y períodos de tratamiento. Lo anterior, con el fin de establecer la bioequivalencia de los productos en estudio por la estimación estadística de diferencias (significativas o no), en los parámetros farmacocinéticos de la AUC (área bajo la curva, por su sigla en inglés) y Cmáx (concentración máxima del fármaco alcanzada en el plasma sanguíneo tras administrar una dosis del medicamento que lo contiene), luego de la transformación logarítmica de los mismos. Para el análisis estadístico se aplicaron un nivel de significancia de 5% y un intervalo de confianza de 90% alrededor de la razón de la media geométrica dentro de los límites de bioequivalencia de 80–125% para los datos transformados logarítmicamente.
La Unidad de Epidemiología y Bioestadística del CIDEIM codificó los productos como A (Oxcarbazepina MK® de Tecnoquímicas) y B (Trileptal® de Novartis). A cada voluntario se le asignó un código con el fin de proteger su identidad durante y después del estudio.
Procedimientos clínicos
Los productos se administraron por asignación aleatoria; el día de la prueba, a las 7 horas, a cada uno de los sujetos se le extrajo una muestra de 10 mL de sangre (muestra cero); luego, cada uno recibió la dosis del producto de prueba o del de referencia (según el orden aleatorio asignado), con 240 mL de agua; a partir de ese momento, se le extrajeron a cada individuo 13 muestras de igual volumen que la cero, en los siguientes intervalos: 0.25, 0.50, 0.75, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5, 4.5, 6.5, 8.5 y 12.5 horas. El siguiente período de tratamiento estuvo separado del primero por un lapso de 7 días calendario, con el fin de asegurar la depuración suficiente del fármaco administrado.
Se envió al laboratorio el plasma obtenido de cada muestra de sangre para determinar la concentración de oxcarbazepina. Es de advertir que, por tratarse de concentraciones muy bajas, fue necesario mejorar la sensibilidad de la prueba en cuanto a límites de detección y cuantificación de oxcarbazepina, dentro de los parámetros estadísticos aceptados para selectividad, linealidad, precisión y exactitud, mediante el procedimiento de la adición estándar,6 consistente en agregar una cantidad constante en concentración y volumen de oxcarbazepina a cada una de las muestras, incluyendo las obtenidas antes de la administración del medicamento, lo cual afectó en igual proporción la concentración en todas ellas. Lo anterior explica los resultados positivos en las muestras obtenidas antes de la ingestión de cada producto.
Procedimiento analítico
La metodología analítica para la determinación de oxcarbazepina en plasma humano se validó y aplicó de acuerdo con procedimientos estandarizados. Se usó la técnica de cromatografía líquida de alta eficiencia (HPLC, por su sigla en inglés) con detección ultravioleta con arreglo de diodos.7 Se siguieron las guías para la industria, publicadas por la Food and Drug Administration (FDA).8, 13
La extracción del principio activo se hizo por el método de precipitación de proteínas empleando acetonitrilo. Se utilizó un cromatógrafo LaChrom Elite®. El analito se valoró con absorción ultravioleta a 231 nm, empleando una columna Chromolith® Performance RP–18e 100–4.6 mm, 2µm; como fase móvil se usó una mezcla de acetonitrilo y buffer acetato de sodio 7 mM pH 5,40, en una proporción de 30:70; el tiempo de retención de la oxcarbazepina fue de 2,8 minutos.
El método analítico fue lineal en el rango de 0,0 µg/mL a 35,0 µg/mL con un coeficiente de correlación promedio de 1. El límite de cuantificación fue de 0,171 µg/mL. El cálculo de la concentración de oxcarbazepina en cada muestra se llevó a cabo mediante la aplicación de la siguiente función matemática: Concentración de oxcarbazepina (µg/mL) = Área de la muestra Área del estándar x Concentración del estándar
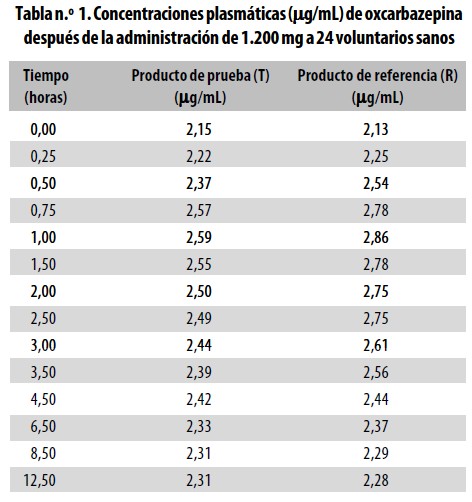
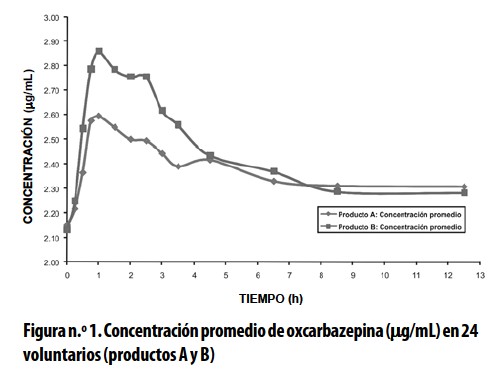
El incremento de la concentración por la adición referida, se observa en los resultados (Tabla n.° 1, Figura n.° 1).
Parámetros farmacocinéticos
La Concentración plasmática máxima (Cmáx) y el Tiempo máximo (Tmáx) se obtuvieron del gráfico de concentración plasmática de oxcarbazepina frente al tiempo. El Área bajo la curva (AUCo–t) se calculó por el método de los trapecios y el AUCt–inf se determinó a partir de la última concentración calculada y la pendiente de la fase de eliminación.
Evaluación estadística
La bioequivalencia se estableció aplicando el cálculo estadístico a la diferencia entre los valores promedio obtenidos para el producto Oxcarbazepina MK/ Oxcarbazepina (Tecnoquímicas S.A.), o T, codificado a ciego como A, y Trileptal®/Oxcarbazepina (Novartis), o R, codificado a ciego como B. El análisis se aplicó a las variaciones del área bajo la curva de concentración
Ver (Tabla1)
Ver (Figura1)
frente al tiempo (AUC) y de la concentración máxima (Cmáx) alcanzadas por cada formulación, después de la transformación logarítmica de los datos. Los valores antilogarítmicos de los límites de confianza constituyeron el intervalo de 90% para la razón de las medias geométricas entre los productos A y B, con aceptación de un nivel de confianza de mínimo 80% y no más de 125%, mediante dos test de hipótesis unilaterales, definidas como:
1. Ho: razón entre los promedios logarítmicos A/B menor que log (0,8) frente a Ha: razón entre los promedios logarítmicos A/B mayor que o igual a log (0,8).
2. Ho: razón entre los promedios logarítmicos A/B mayor que log (1,25) frente a Ha: razón entre los promedios logarítmicos A/B menor que o igual a log (1,25).
El propósito fue el de rechazar las hipótesis nulas y establecer la bioequivalencia de los productos, definida como la diferencia no significativa entre los valores promedio logarítmicos, comprendidos en el intervalo de 0,8 a 1,25 (80–125%), con 5% de significancia.
RESULTADOS
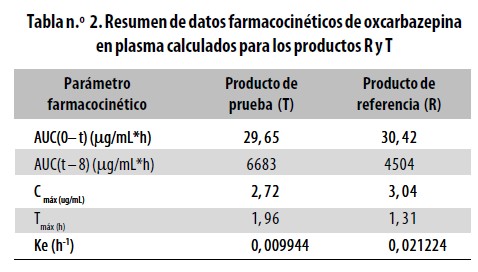
La comparación de las biodisponibilidades de los productos Test y Referencia se hizo con base en los valores de datos primarios de concentración de oxcarbazepina en el tiempo, y de los datos secundarios para el parámetro farmacocinético de Área bajo la curva de concentración plasmática entre los tiempos cero y t. (Tablas n.° 1 y 2. Figura n.°1).
Ver (Tabla2)
El análisis de dos pruebas de hipótesis unilaterales, para la razón de medias de las variables transformadas, demostró que no existen diferencias estadísticamente significativas entre los dos productos, para las variables farmacocinéticas AUC y Cmáx transformadas logarítmicamente, en el intervalo de confianza de 90%, con rangos de bioequivalencia comprendidos entre 0,80 y 1,25 [Logaritmo natural (Ln) AUC: 0,9481 (0,9193–0,9779) y Ln Cmáx: 0,9537 (0,9283–0,9798)]. En el intervalo de confianza de 95% con rangos de bioequivalencia comprendidos entre 0,80 y 1,25 [Ln AUC: 0,9134–0,9841 y Ln Cmáx: 0,9232–0,9853].
Con un nivel de confianza del 95% para la prueba de rangos con el test de Wilcoxon en la variable original Tmáx, se estableció que no existen diferencias estadísticamente significativas entre los dos productos (test y referencia) (p = 0,177). Tampoco se hallaron diferencias significativas en la cantidad de oxcarbazepina que alcanza la circulación sistémica durante doce horas y media después de administrar una dosis oral de 1.200 mg a individuos sanos."
DISCUSIÓN
Los medicamentos genéricos de origen diferente al producto innovador en el mercado, con el mismo principio activo, en igual concentración y en la misma forma farmacéutica, declaran su calidad con base en el cumplimiento de parámetros estándar, que se verifican mediante ensayos in vitro. Estos estándares están relacionados directamente con la identidad, concentración, pureza, uniformidad de contenido, velocidad y tiempo de desintegración y disolución. Sin embargo, mediante ensayos complementarios, es posible demostrar que la velocidad a la cual la sustancia activa alcanza la circulación sistémica y la cantidad que llega a dicha circulación no presentan diferencias significativas entre los productos genérico e innovador, lo que permite declarar su equivalencia terapéutica.
Con este estudio se demostró, mediante ensayos in vitro, la equivalencia farmacéutica de los productos Test y de Referencia, que contienen el mismo principio activo, en concentraciones similares, en igual forma de dosificación y para la misma vía de administración. Lo anterior, debido a que los resultados de las pruebas de valoración, desintegración, disolución y uniformidad de contenido cumplieron las especificaciones de la USP 31 y las establecidas por el financiador del estudio (Tecnoquímicas S. A.).
El estudio demostró la bioequivalencia de los productos Test (de Tecnoquímicas S. A.) y de Referencia (de Novartis), por la comparación y la razón entre el área bajo la curva de concentración de oxcarbazepina en el tiempo y de la concentración máxima obtenida con cada producto. Los resultados estuvieron dentro de los límites de aceptación (intervalos de confianza del 90% de la razón entre los dos productos, contenidos dentro del rango de bioequivalencia de 80–125% para los parámetros farmacocinéticos).
Los conceptos vigentes sobre biodisponibilidad, bioequivalencia, equivalencia farmacéutica e intercambiabilidad, descritos en publicaciones técnicas y legales, precisan la equivalencia terapéutica con base en la intercambiabilidad entre medicamentos.14, 18 Según lo establecido, se considera que un medicamento es el equivalente terapéutico de otro u otros, cuando se cumplen las siguientes condiciones:
1. Es equivalente farmacéutico, porque tiene el mismo principio activo aunque difiera en sus excipientes, cumple los requisitos en cuanto a potencia, calidad, pureza e identidad, está en la misma forma de dosificación y se administra del mismo modo y para las mismas indicaciones.
2. Es elaborado de acuerdo con buenas prácticas de manufactura (BPM).
3. Ha demostrado ser bioequivalente con el producto con que se pretende intercambiarlo.
El cumplimiento de estos requisitos permite que la autoridad sanitaria admita la declaración de sustitución e intercambiabilidad durante la dispensación para el uso terapéutico.19
CONCLUSIONES
Los resultados de este estudio demuestran estadísticamente la equivalencia farmacéutica y la bioequivalencia entre los productos Oxcarbazepina MK®/Oxcarbazepina, tabletas de 600 mg de Tecnoquímicas S. A. y Trileptal®/ Oxcarbazepina, tabletas de 600 mg de Novartis, para la velocidad de absorción y la cantidad de oxcarbazepina en el plasma de 24 hombres voluntarios sanos, después de administrarles una dosis única equimolar, de acuerdo con un diseño experimental cruzado con asignación al azar de los tratamientos y períodos. Los anteriores hallazgos permiten concluir que los dos productos son intercambiables para el uso terapéutico.
CONFLICTO DE INTERESES
Este estudio se llevó a cabo con financiación de Tecnoquímicas S. A. en cumplimiento del contrato CIDEIM–Tecnoquímicas–ICESI, firmado el 14 de marzo de 2008.
Los autores declaran no tener conocimiento de situaciones que los puedan involucrar en conflictos de intereses reales, potenciales o aparentes, y no haber encontrado incompatibilidades ni riesgos de influencia por parte de Tecnoquímicas S. A., sobre su objetividad, independencia, criterios científico, clínico y técnico para llevar a cabo este estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Wikipedia. U.S. Wikimedia Foundation, Inc; 2001. Oxcarbazepina. [Fecha de acceso 28 de julio de 2009]. Disponible en: http://en.wikipedia.org/wiki/Oxcarbazepine. [ Links ]
2. Eadie MJ. Therapeutic drug monitoring: antiepileptic drugs. Br J Clin Pharmacol 1998; 46: 185–193. [ Links ]
3. Eadie MJ. Therapeutic drug monitoring: antiepileptic drugs. Br J Clin Pharmacol 2001; 52 (Suppl. 1): S11–20. [ Links ]
4. U.S. Food and Drug Administration. Center for Drug Evaluation and Research. Guidance for Industry: Bioavailability and Bioequivalence Studies for Orally Administered Drug Products. General Considerations. 2003 March. [Fecha de accesso 28 de julio de 2009]. Disponible en:http://www.fda.gov/downloads/Drugs/ GuidanceComplianceRegulatoryInformation/Guidances/ucm070124.pdf [ Links ]
5. U.S. Food and Drug Administration. Center for Drug Evaluation and Research. Statistical Approaches to Establishing Bioequivalence. 2001 January. [Fecha de acceso 28 de julio de 2009]. Disponible en: http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/ucm070244.pdf [ Links ]
6. Skoog DA. Principios de Análisis Instrumental. 6ª ed. Cengage Learning Editores, 2008: 376. [Fecha de acceso 28 de julio de 2009]. Disponible en: http://books.google.com.co/books?id=7FOyZbb7q8UCpg=PA376dq=adicion+estandar [ Links ]
7. Levert H, Odou P, Robert H. LC determination of oxcarbazepine and its active metabolite in human serum. J Pharm Biomed Anal 2002; 28: 517–525. [ Links ]
8. Huber L. Validation of analytical methods. BioPharm 1999 March; 12: 64–66. Epub 1999 January. [Fecha de acceso 28 de julio de 2009]. Disponible en: http//www.geocities.com/HotSprings/Spa/6896/hplc.pdf [ Links ]
9. U.S. Food and Drug Administration. Center for Drug Evaluation and Research. Guidance for industry: Analytical Procedures and Methods validation. Draft Guidance. 2000 August. [Fecha de acceso 28 de julio de 2009].Disponible en: http://www.fda.gov/downloads/ Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM070489.pdf [ Links ]
10. U.S. Food and Drug Administration. Center for Drug Evaluation and Research. Guidance for Industry. Q2B Validation of Analytical Procedures: Methodology. International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH). 1996 November. [Fecha de acceso 28 de julio de 2009]. Disponible en: http://www.fda.gov/downloads/Regulator yInformation/Guidances/UCM128049.pdf [ Links ]
11. Shah VP, Midha KK , Findlay JW , Hill HM , Hulse JD, McGilveray IJ, et al. Bioanalytical method validation: a revisit with a decade of progress. Pharm Res 2000; 17: 1551–1557. [Fecha de acceso 28 de julio de 2009]. Disponible en: http://www.labmeeting.com/paper/23711244/bioanalytical–method–validation—a–revisitwith–a–decade–of–progress [ Links ]
12. Therapeutic Products Programme Health Canada. International Conference on Harmonisation of Technical Requirements for the Registration of Pharmaceuticals for Human Use. Validation of Analytical Procedures: Methodology. 1999 February 12. [Fecha de acceso 28 de julio de 2009]. Disponible en: http://www.hc–sc.gc.ca/dhpmps/alt_formats/hpfb–dgpsa/pdf/prodpharma/q2beng.pdf [ Links ]
13. The United States Pharmacopeia. The National Formulary (USP–NF). Validation of compendial methods. In: USP 27–NF 22, 2004. Rockville, MD: United States Pharmacopeial Convention Inc; 2003: 2622–2625. [ Links ]
14. U.S. Food and Drug Administration. Center for Drug Evaluation and Research Therapeutic Equivalence of Generic Drugs. Letter to Health Practitioners; 1998 January 28. [Fecha de acceso 28 de julio de 2009]. Disponible en: http://www.fda.gov/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/ApprovalApplications/Abbreviated NewDrugApplicationANDAGenerics/ucm073182.htm [ Links ]
15. Health Canada Health Products and Food Branch Guidance Document. Draft Guidance for Industry Preparation of Comparative Bioavailability Information for Drug Submissions in the CTD Format. 2004 May 12. [Fecha de acceso 28 de julio de 2009]. Disponible en:http://www.hc–sc.gc.ca/dhp–mps/alt_formats/hpfbdgpsa/pdf/prodpharma/draft_ebauche_ctdbe–eng.pdf [ Links ]
16. European Agency for the Evaluation of Medicinal Products. Evaluation of Medicines for Human Use. Committee for Proprietary Medicinal Products. ICH Topic E 9. Statistical Principles for Clinical Trials Step 5 Note for Guidance on Statistical Principles for Clinical Trials (CPMP/ICH/363/96). London, 1998 September. [Fecha de acceso 28 de julio de 2009]. Disponible en: http://www.emea.europa.eu/pdfs/human/ich/036396en.pdf [ Links ]
17. European Agency for the Evaluation of Medicinal Products. Evaluation of Medicines for Human Use. Committee for Proprietary Medicinal Products. Note for Guidance on The investigation of Bioavailability and Bioequivalence, CPMP/EWP/QWP/1401/98. London, 2001 July 26. [Fecha de acceso 28 de julio de 2009]. Disponible en: http://www.emea.europa.eu/pdfs/human/qwp/140198enfin.pdf [ Links ]
18. WHO. Marketing Authorization of Pharmaceutical Products with Special Reference to Multisource (generics) Products: A Manual for Drug Regulatory Authorities. WHO/DMP/RGS/98.5. Geneva, 1998. [Fecha de acceso 28 de julio de 2009]. Disponible en: http://www.who.int/medicinedocs/en/d/J2273e/1.html#Js2273e.1 [ Links ]
19. European Agency for the Evaluation of Medicinal Products. Evaluation of Medicines for Human Use. Committee for Proprietary Medicinal Products. Draft Guideline on the Investigation of Bioequivalence, Doc. Ref. CPMP/EWP/QWP/1401/98 Rev. 1. London, 2008 July 24. [Fecha de acceso 28 de julio de 2009]. Disponible en: http://www.emea.europa.eu/pdfs/human/qwp/140198enrev1.pdf [ Links ]
Recibido: marzo 16 de 2009
Aceptado: julio 27 de 2009