Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.22 no.3 Medellín July/Sept. 2009
Artículo de Revisión
Neutropenia febril en pacientes pediátricos: un enfoque diagnóstico y terapéutico
Febrile neutropenia in pediatric patients: a diagnostic and therapeutic approach
Carolina Jaramillo Arango1,3, Isabel Cristina Valencia Montoya 1,3, María Adelaida Aristizábal Gil2
1Residente de tercer aüo de Pediatría, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. crisvalmontoya@yahoo.es
2Pediatra hematóloga, profesora asociada, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. maristiz@une.net.co
3Grupo Pediaciencias, Universidad de Antioquia, Medellín, Colombia. cjaramilloarango@gmail.com
Resumen
Durante las últimas décadas ha habido un progreso muy notorio en el tratamiento de los pacientes con cáncer: se ha reducido significativamente la tasa de mortalidad gracias a los nuevos agentes quimioterapéuticos y a la puesta en práctica de modalidades modernas de tratamiento; sin embargo, la mayoría de los agentes usados producen una profunda depresión del sistema inmune aumentando la susceptibilidad a las infecciones. La neutropenia febril es la complicación más común en pacientes que reciben terapia contra el cáncer; hace cuarenta aüos se estableció por primera vez la asociación entre el recuento bajo de neutrófilos circulantes, la fiebre y el riesgo de infección y desde entonces la terapia antibiótica empírica se ha convertido en la piedra angular en el tratamiento de esta complicación; infortunadamente, las hospitalizaciones prolongadas que son necesarias para estos tratamientos, además de ser muy costosas, tienen un gran impacto psicológico en los niüos y sus familias. El desarrollo de modelos de estratificación del riesgo ha permitido identificar a qué pacientes se les pueden ofrecer otras opciones, como la terapia oral o la ambulatoria. En esta revisión se presentan conceptos actualizados sobre la neutropenia febril en pediatría.
Palabras clave
Cáncer, Fiebre, Neutropenia, Niüos
Summary
Febrile neutropenia in pediatric patients: a diagnostic and therapeutic approach Treatment of patients with neoplastic diseases has improved over the past several decades: a significant reduction in the mortality rate due to cancer has been achieved with the new chemotherapeutic agents and with modern treatment modalities. However, most of these agents produce a profound depression of the immune system thus increasing the susceptibility to infections. Febrile neutropenia is the most common complication in patients being treated for malignant diseases. Forty years ago the association was first established between low neutrophil count, fever and infection; since then, empiric antibiotic therapy has become the cornerstone in the management of this complication. Unfortunately, the long periods of hospital stay necessary for these treatments, besides being expensive, produce important psychological effects on patients and their families. The development of risk–stratification models has allowed the identification of low–risk patients to whom other options may be offered, such as the oral or ambulatory therapy. This review presents up to date concepts on febrile neutropenia in pediatric patients.
Key words
Cancer, Children, Fever, Neutropenia
INTRODUCCIÓN
La neutropenia, que puede ser congénita o adquirida, es una reducción del recuento absoluto de neutrófilos (RAN) en la sangre; en pacientes pediátricos se encuentra con frecuencia asociada a neoplasias malignas. Se la clasifica en moderada cuando el RAN está entre 200 y 500/µL y grave cuando es menor de 200/µL. Por otra parte, se define la fiebre como una temperatura central mayor de 38 °C en tres tomas en un período de 24 horas, o mayor de 38,5 °C en una sola toma.1,3 Actualmente se diagnostica la neutropenia febril en pacientes con un amplio espectro de enfermedades malignas que están recibiendo quimioterapia o radioterapia,1,4 y es la segunda causa de ingreso hospitalario de pacientes en oncología pediátrica después de las admisiones para quimioterapia; en un estudio en el que se observaron pacientes con neutropenia febril durante dos aüos y medio se reportó un promedio de 3,25 admisiones por paciente en dicho período, con duración promedio de trece días. La práctica usual de tratamiento de los pacientes con neutropenia febril incluye la evaluación clínica completa con el fin de clasificarlos según el riesgo de infección, y los estudios microbiológicos que permitan identificar un posible agente etiológico, lo cual es de gran valor en el momento de elegir la terapia antimicrobiana más adecuada; los algoritmos de tratamiento surgieron a partir de los aportes de Pizzo y colaboradores en 1970, citados por Bow6 y Talcott,7 pero a pesar de muchos estudios aún no existe un régimen adoptado en todo el mundo para el tratamiento de estos pacientes, posiblemente por el cambio continuo del espectro de patógenos que causan infección en pacientes neutropénicos con cáncer, y por el incremento en la resistencia de los mismos a los antibióticos. Los pacientes neutropénicos son un grupo heterogéneo en cuanto a los riesgos de desarrollar infecciones, presentar complicaciones graves y morir durante los episodios de neutropenia; la mayoría de los estudios concuerdan en cuanto a las causas predominantes de las infecciones y a la frecuencia de las complicaciones, pero las circunstancias de una población y la epidemiología microbiana propia de una institución no son totalmente aplicables a otras; por su importancia a la hora de definir las pautas para el tratamiento empírico, hay que procurar conocerlas.8,9
EVALUACIÓN DEL PACIENTE Y ESTRATIFICACIÓN DEL RIESGO
La evaluación inicial de los pacientes con neutropenia y fiebre no ha cambiado de manera significativa durante las décadas recientes. La historia clínica cuidadosa y el examen físico concienzudo siguen siendo los pilares fundamentales del enfoque inicial; cualquier signo o síntoma se debe considerar de importancia, puesto que esta condición cursa con disminución en la capacidad para manifestar una respuesta inflamatoria.10 El examen físico se debe repetir a diario mientras persistan los síntomas, con un énfasis especial en las áreas con mayor riesgo de infección, como son las siguientes: tracto respiratorio, regiones perioral y perianal, piel, sitios de inserción de catéteres o de toma de biopsias y la dentadura.
Las pruebas iniciales de laboratorio deben incluir: hemoleucograma completo con fórmula diferencial y recuento de plaquetas, creatinina sérica, nitrógeno ureico, pruebas de función hepática, radiografía de tórax y hemocultivos con muestras obtenidas de venas periféricas o de catéter; los cultivos de orina, materia fecal, piel y líquido cefalorraquídeo (LCR) se solicitan según la sospecha diagnóstica.11,12 Se han estudiado la sensibilidad y especificidad para detectar infecciones bacterianas de la procalcitonina, la interleuquina 8 y la proteína quimioatrayente de monocitos alfa 1; así, por ejemplo, la sensibilidad y especificidad de la procalcitonina como marcador de sepsis grave fueron,respectivamente, 83,3% y 100% en concentraciones por encima de 5 ng/mL;13,14 en algunos estudios se concluyó, incluso, que en estos pacientes la procalcitonina es un marcador de inflamación más útil que la proteína C reactiva (PCR).15,16
Klaassen y colaboradores desarrollaron y validaron una herramienta para clasificar según el riesgo a los pacientes pediátricos con neutropenia febril; clasificaron como de bajo riesgo a quienes al ingreso tenían un recuento total de monocitos mayor de 100/µL, radiografía de tórax normal y ninguna enfermedad asociada; además, encontraron que el RAN y la neutropenia prolongada (mayor de 7 días) eran malos predictores de infección bacteriana.17 Santolaya y colaboradores usaron un modelo de predicción en el que la PCR por encima de 90 mg/L, la hipotensión, la recaída de leucemia linfocítica aguda (LLA), las plaquetas por debajo de 50.000/µL y la quimioterapia reciente fueron predictores fuertes de infección bacteriana invasiva.18,19 La cantidad de factores de riesgo ya mencionados es directamente proporcional a la probabilidad de sufrir complicaciones, así: la probabilidad de infección bacteriana invasora (IBI) es 2% si al ingreso no hay ninguno de estos factores de riesgo; 17% si hay uno solo y 48–100% si hay dos o más. 10 En un estudio reciente, Paganini y colaboradores validaron una nueva escala de predicción de la mortalidad basada en los siguientes factores de riesgo: malignidad en estadio avanzado, presencia de enfermedades asociadas y bacteriemia; la sensibilidad fue del 100% y la especificidad, 84%.20
En la actualidad se aceptan como criterios de alto riesgo al ingreso los siguientes: PCR por encima de 90 mg/L, hipotensión arterial e inestabilidad clínica, estado general al ingreso entre regular y malo, episodios de origen intrahospitalario y recaídas de la neutropenia febril, leucemia en recaída, leucemia linfocítica aguda de alto riesgo, leucemia mieloide aguda, linfoma no hodgkin B y de células grandes, retinoblastoma en etapa IV y recaída de tumores sólidos. Se deben hallar dos o más de los anteriores criterios para clasificar al paciente como de alto riesgo. Los criterios de alto riesgo en la evaluación a las 48–72 horas son: hemocultivos positivos, aparición de signos de inestabilidad clínica, foco infeccioso no controlado, aparición de signos clínicos de foco infeccioso y persistencia de la fiebre. Los criterios de bajo riesgo al ingreso son: malignidad en remisión, duración de la neutropenia menor de siete días, temperatura menor de 39 °C, ausencia de dolor abdominal, apariencia no tóxica, estado neurológico normal, sitio del catéter no infectado, neutrófilos por encima de 100/µL, monocitos por encima de 100/ µL, normalidad en la radiografía de tórax y las pruebas de función hepática y renal. Los criterios de bajo riesgo en la evaluación a las 48–72 horas son: hemocultivos negativos, PCR de 40 mg/L o menos o en disminución comparada con la del ingreso, foco infeccioso controlado, ausencia de signos clínicos de inestabilidad y de fiebre.1,10,17
ETIOLOGÍA DE LAS INFECCIONES
En aüos recientes ha cambiado la etiología de las infecciones en los pacientes neutropénicos: los bacilos gramnegativos predominaron en la década de los aüos 70 y principios de los 80 y la frecuencia de las bacterias grampositivas aumentó marcadamente hasta convertirse en los patógenos predominantes en muchas instituciones en la década de los aüos 90;21,22 muchos factores están involucrados en estos cambios epidemiológicos: el aumento de la incidencia de infecciones por estafilococos coagulasa negativa y por otros cocos grampositivos se ha asociado con el uso de catéteres intravasculares; se ha atribuido la aparición de infecciones por estreptococos del grupo viridans a factores como la toxicidad sobre la mucosa oral de dosis altas de quimioterapia con citosina arabinósido, a la reactivación de infecciones por el virus Herpes simplex y al uso de fluoroquinolonas como profilaxis de las infecciones bacterianas.23,24
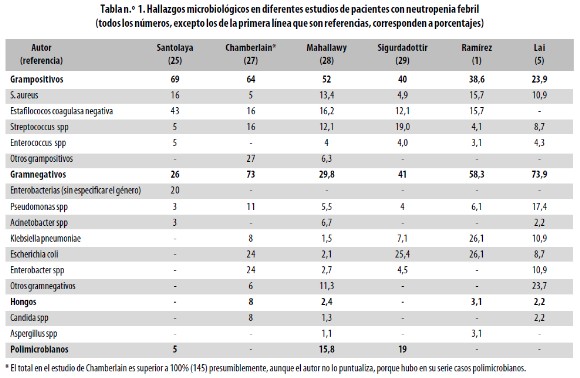
En general la tasa de confirmación microbiológica es baja: 20% para las infecciones bacterianas y 10% para las fúngicas.25,26 La tabla n.° 1 presenta un resumen de los hallazgos microbiológicos en diferentes estudios.
En el Servicio de Hematooncología del Hospital Universitario San Vicente de Paúl (Medellín, Colombia) se estudiaron varios aspectos de los 143 episodios de neutropenia febril en 84 niüos menores de 15 aüos, atendidos en 1999. No se identificó la causa de la fiebre en 46,9% de los casos. Los cuadros clínicos fueron: bronconeumonía (81,8%), celulitis (4,5%), enfermedad diarreica (4,5%) y otros (9%) entre ellos flebitis, sinusitis y coriorretinitis. Se encontraron como patógenos más comunes: Escherichia coli, Klebsiella pneumoniae, estafilococos coagulasa negativa, Staphylococcus aureus, estreptococos del grupo viridans, Pseudomonas aeruginosa, Enterococcus faecalis, Aeromonas hydrophila, Enterobacter cloacae, Geotrichum spp y Aspergillus flavus. En general los bacilos gramnegativos fueron sensibles a ciprofloxacina, meropenem e imipenem; se encontró gran resistencia a ceftazidime; todas las cepas de Staphylococcus aureus fueron sensibles a vancomicina y 50% de ellas, a oxacilina; una de las cepas de estreptococos del grupo viridans fue resistente a penicilina, pero todas fueron sensibles a vancomicina.1
Ver (Tabla1)
ESTRATEGIAS DE TRATAMIENTO
Las decisiones sobre la terapia antibacteriana empírica inicial en el paciente con episodios de neutropenia febril se deben basar en tres factores principales: categorización del episodio en cuanto a riesgo, manifestaciones clínicas que orienten hacia una determinada localización de la infección, y estadísticas microbiológicas de cada institución hospitalaria.
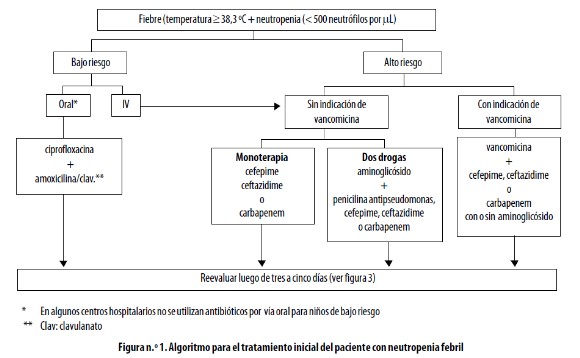
El paso inicial es decidir si el paciente es candidato a recibir tratamiento oral ambulatorio, o si por el contrario debe permanecer hospitalizado para tratamiento intravenoso; en general existen tres esquemas: monoterapia, dos antibióticos sin glicopéptido (vancomicina) y terapia con glicopéptido más uno o dos antibióticos.11 En la figura n.° 1 se presenta un algoritmo para el tratamiento inicial del paciente con neutropenia febril.
Pacientes de bajo riesgo
En un metaanálisis reciente en el que se incluyeron quince estudios, cuatro de ellos de niüos, se concluyó que según la evidencia actual se puede hacer tratamiento oral a niüos con neutropenia febril hemodinámicamente estables.30 En un estudio efectuado en Chile se comparó la utilización ambulatoria con la hospitalaria de ceftriaxona y teicoplanina y no se hallaron diferencias en cuanto a eficacia;31 en algunos centros de dicho país se utilizan para el tratamiento oral en niüos los siguientes antibióticos: amoxicilina/clavulanato, cefuroxime o ciprofloxacina.25
En casos no complicados se puede usar monoterapia pero aún no estó; clara la superioridad de una u otra droga; en una revisión sistemática de 47 ensayos clínicos, ocho de los cuales correspondían a pacientes pediátricos, se concluyó que la monoterapia de amplio espectro debe ser considerada como el tratamiento estándar en niüos.32
Ver (Figura1)
Debido a la reducción de la frecuencia de las bacterias gramnegativas como agentes etiológicos durante los aüos recientes, se ha planteado en algunos estudios la conveniencia de reevaluar si es necesario adicionar aminoglicósidos al tratamiento.33 Por otra parte, Mustafa y colaboradores compararon la eficacia de cefepime y ceftazidime en 68 pacientes; hallaron curación en 58% y 47%, respectivamente, sin muertes ni efectos adversos asociados.34 Otros estudios han llegado a la misma conclusión.35,36 De un metaanálisis en el que se compararon varios ß lactámicos y carbapenems se concluyó que el cefepime se asociaba con mayor frecuencia a mortalidad en la población adulta (RR 1,44; 95% IC 1,06-1,94; p = 0,02) mientras que se consideraron como agentes útiles para la monoterapia los siguientes: ceftazidime, piperacilina/tazobactam, meropenem e imipenem/cilastatina.37
En la terapia combinada se debe resaltar que cualquiera de los regímenes debe incluir antibióticos contra Pseudomonas. Entre las combinaciones estudiadas se encuentran: piperacilina/tazobactam + netilmicina con las que se encontró que la seguridad y la eficacia eran adecuadas;38 ciprofloxacina + piperacilina/tazobactam; gentamicina + piperacilina/tazobactam;39 cefepime y amikacina,40,41 todos ellos con resultados similares.
Pacientes de alto riesgo
Se aplican los mismos conceptos sobre monoterapia o terapia combinada intravenosa que para los pacientes de bajo riesgo. La adición de vancomicina al tratamiento inicial está indicada ante la presencia de microorganismos grampositivos (Stapylococcus aureus, estreptococos del grupo viridans y Enterococcus spp), infecciones asociadas a catéter o hipotensión; sin embargo, el uso indiscriminado de este antibiótico, y de cefalosporinas de amplio espectro, ha favorecido el incremento en esta población de la frecuencia de bacterias grampositivas y la aparición de Enterococcus resistentes.11 Datos recientes describen el uso rutinario de vancomicina en algunos hospitales, sin aplicar los criterios aceptados por la Sociedad Americana de Enfermedades Infecciosas (IDSA, por su sigla en inglés), a pesar de la sospecha de tener Enterococcus resistentes a ella en el respectivo hospital.42 En los pacientes que están recibiendo terapia nefrotóxica, como cisplatino o altas dosis de metotrexate, se debe evitar el uso de aminoglicósidos, o limitarlo a cinco días; en los que son alérgicos a penicilina se deben utilizar ciprofloxacina y teicoplanina; si por alguna razón recibieron ciprofloxacina profiláctica, se debe iniciar aztreonam, que por no tener actividad contra anaerobios hay que asociarlo con metronidazol, especialmente si hay ulceración grave de las mucosas.24
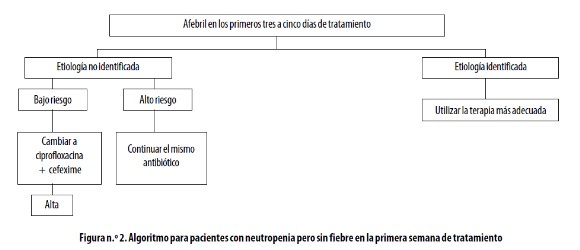
Cuando el paciente haya recibido por lo menos tres a cinco días de tratamiento se debe evaluar la eficacia del mismo; la continuación de la terapia dependerá de su condición clínica y de los hallazgos microbiológicos (Figuras n.° 2 y 3).
Ver (Figura2)
En algunos países se ha considerado que es seguro y efectivo el cambio a cefexime oral en niüos luego de la terapia intravenosa por 48 a 72 horas en las que no han tenido signos de sepsis ni mucositis al ingreso o durante el tratamiento y cuyos recuentos de neutrófilos sean mayores de 100/µL.43,44 Sin embargo, aunque el cefexime estuvo disponible hace algún tiempo en Colombia, actualmente no se cuenta en el país con ninguna cefalosporina de tercera generación en presentación para la vía oral.
En un estudio45 se hizo tratamiento por dos días con ceftriaxona + amikacina; luego se dividió el grupo en dos subgrupos: A y B. Los del subgrupo A recibieron cefexime oral por cuatro días y los del B continuaron con ceftriaxona + amikacina por siete días. En otro trabajo46 se estudiaron 177 episodios de neutropenia febril con el siguiente protocolo: dosis única intravenosa de ceftriaxona + amikacina; luego se subdividió el grupo aleatoriamente para recibir uno de estos dos tratamientos: ciprofloxacina oral o dos días mós de ceftriaxona intravenosa. Se concluyó en estos estudios que el tratamiento oral con ciprofloxacina luego de 24 horas de administrar ceftriaxona + amikacina es tan seguro y eficaz como continuar el tratamiento con ceftriaxona venosa. Sin embargo la ceftriaxona no se encuentra recomendada en las guías de la IDSA dado el riesgo de inducción de resistencia bacteriana.
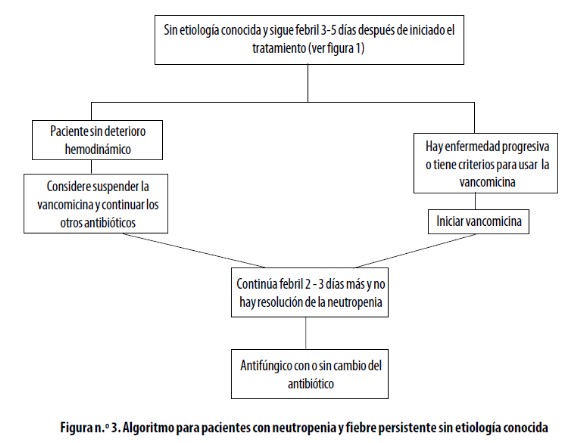
Si, por el contrario, el paciente permanece febril durante la primera semana de tratamiento con antibióticos, se lo debe reevaluar cuidadosamente buscando nuevos signos y síntomas que orienten hacia algún sitio de infección; los estudios diagnósticos incluyen hemocultivos y radiografías de tórax, abdomen y otros sitios según la sospecha clínica; si no se obtiene ninguna información adicional, hay tres opciones de tratamiento, que se presentan en la figura n.° 3).
Ver (Figura3)
OTROS TRATAMIENTOS
Factores estimulantes de colonias
Los factores estimulantes de colonias de granulocitos (GCSF, filgrastim) y de granulocitos–macrófagos (GM–CSF, sargramostim) aumentan la producción y la función de elementos mieloides maduros. En un metaanálisis reciente se encontró que estos agentes no afectan la mortalidad pero sí disminuyen el tiempo de estancia hospitalaria y el período de recuperación.47
La Sociedad Americana de Oncología Clínica establece niveles de evidencia I grado A y I grado C para la administración primaria de filgrastim y sargramostim, respectivamente, con las siguientes indicaciones: pacientes con cultivos positivos persistentes a pesar del tratamiento, neutropenia que persiste por diez o más días a pesar de estar recibiendo antibióticos, pacientes en mal estado general cuando comienza la fiebre, pacientes con complicaciones durante el tratamiento, como neumonía, hipotensión, celulitis grave, micosis sistémica y disfunción multiorgánica secundaria a sepsis.
Aunque las anteriores han sido recomendaciones para adultos, también se aplican a la población infantil, ante la poca información disponible para sustentar el uso de factores estimulantes de colonias en pediatría; las dosis son: 5 a 10 µg/kg/día para G–CSF y 500 a 750 µg/m2/día para GM–CSF.48
Se debe suspender la administración de estos factores cuando el recuento de neutrófilos se estabilice entre 500– 1.000/µL .49 La seguridad y eficacia de nuevos factores de crecimiento como el pegfilgrastim se deben comparar con las del filgrastim en niüos pequeüos.50
Agentes antivirales
Usualmente no estón indicados los agentes antivirales como terapia empírica inicial en pacientes con neutropenia febril sin evidencia de enfermedad viral; sin embargo, si el examen físico evidencia lesiones cutóneas o mucosas por Herpes simplex o Varicela zoster estó indicado el tratamiento con aciclovir, aun en pacientes afebriles y en los que estén febriles aunque la infección viral no sea la causa directa de la fiebre; las dosis empleadas son de 250 mg/m2/8 horas o 5 mg/kg/8 horas durante una semana en pacientes con enfermedad no complicada, que se pueden prolongar a 10 días en casos de enfermedad diseminada; cuando hay riesgo alto de infección del sistema nervioso central se utilizan dosis de 500 mg/m2/ 8 horas.51
La infección por citomegalovirus se trata con ganciclovir; la debida al virus respiratorio sincitial, usualmente, con ribavirina; y la producida por el virus de la influenza, con zanamavir, oseltamavir, rimantadina y amantadina.11
Aunque existen recomendaciones internacionales que deben tenerse en cuenta (IDSA), la decisión final sobre la terapia empírica inicial en pacientes con neutropenia febril se debe basar en el consenso del comité de vigilancia epidemiológica y los profesionales tratantes de cada institución, teniendo en cuenta los perfiles epidemiológico y de resistencia local a los antibióticos. Como recomendación general la terapia antibiótica debe cubrir la gran mayoría de gérmenes posibles con la mínima inducción de resistencia bacteriana.
MANEJO DE CATÉTERES VENOSOS CENTRALES (CVC), ARTERIALES Y PERIFÉRICOS
En 1973 se desarrollaron los dispositivos intravasculares invasivos de tipo Broviac y en 1979 fueron modificados; desde entonces se los ha utilizado ampliamente en pacientes con enfermedades malignas y se han obtenido con ellos muchos beneficios; sin embargo, no están libres de complicaciones y se ha reportado una tasa de infección relacionada con el catéter de 0,2 a 7,2 por 1.000 catéteres/ día.52
En condiciones ideales se deberían retirar los dispositivos para acceso vascular si se asocian a infección; sin embargo, dados el costo y el riesgo quirúrgico de un nuevo acceso, se han propuesto situaciones específicas en las cuales se puede intentar salvar el catéter con terapia antimicrobiana oral o parenteral y estrategias de terapia cerrada.11,53,54
La mayoría de las recomendaciones para tratar las infecciones asociadas a catéteres venosos centrales en adultos también son aplicables en niüos; sin embargo, no siempre es posible retirar el catéter, sobre todo en los pacientes más pequeüos.
Infección por estafilococos coagulasa negativa
Se puede dejar el catéter e iniciar un tratamiento antibiótico venoso por 7 días; se recomienda ademós la terapia cerrada por 10 a 14 días. Si existe deterioro clínico o recurrencia de la bacteriemia se debe retirar el catéter.
Infección por Staphylococcus aureus
En los casos de infección producida por S. aureus y asociada a un catéter en general se recomienda retirar este si ya ha habido un tratamiento antibiótico adecuado durante 14 días; solo en casos seleccionados se podrá hacer terapia cerrada durante 14 días para salvar el catéter.
Infección por bacilos gramnegativos
Son indicaciones para retirar el catéter todas las infecciones causadas por Pseudomonas spp, Burkholderia cepacia, Stenotrophomonas spp, Agrobacterium spp y Acinetobacter baumannii, así como las infecciones en catéteres no tunelizados; los pacientes sin deterioro clínico cuyos catéteres tunelizados no se puedan retirar se pueden tratar con antibióticos sistémicos y terapia cerrada por el catéter durante 14 días.
La demostración de fungemia asociada al catéter es indicación para retirarlo y hacer tratamiento venoso con antifúngicos apropiados durante 14 días.10,53
Las infecciones relacionadas con dispositivos intravasculares pueden ser locales (flebitis, celulitis, tromboflebitis supurada) o sistémicas (bacteriemia, fungemia, endocarditis); ante la sospecha de infección o la fiebre persistente sin foco, se toman simultáneamente cultivos del catéter y de vena periférica; si se retira el catéter se envía la punta (3–5 cm) para cultivo por las técnicas de Maki y Clero.54 Los resultados se interpretan de la siguiente manera:
Cultivo positivo cualitativo: hallazgo del mismo germen en el cultivo periférico y en el central.
Cultivo positivo cuantitativo: hallazgo de 15 o mós unidades formadoras de colonias (UFC) por la técnica de Maki o de 1.000 o mós UFC por la técnica de Clero.
Se puede definir que una bacteriemia estó asociada al catéter venoso central (CVC) en las siguientes dos circunstancias: 1. La UFC es 4–5 veces mayor en el cultivo del CVC que en el del periférico. 2. El resultado positivo del cultivo del CVC ocurre 120 minutos o más antes que el del cultivo del catéter periférico.
REFERENCIAS BIBLIOGRÁFICAS
1. Ramírez L, Blanco N, Hernández M, Sierra M, Aristizábal M, Peüa J, et al. Episodios de neutropenia febril en niüos con neoplasias malignas. Infectio 2003; 7: 137–146. [ Links ]
2. Anaissie EJ, Kiwan EN. Management in febrile neutropenia with hematological malignancies: an update. Hematology. New Orleans: American Society of Hematology Educational Book. 1999: 550–558. [ Links ]
3. Urabe A. Clinical features of the neutropenic host: definitions and initial evaluation. Clin Infect Dis 2004; 39 (Suppl. 1): S53–S55. [ Links ]
4. Klaassen RJ, Allen U, Doyle JJ. Randomized placebocontrolled trial of oral antibiotics in pediatric oncology patients at low–risk with fever and neutropenia. J Pediatr Hematol Oncol 2000; 22: 405–411. [ Links ]
5. Lai HP, Hsueh PR, Chen YC, Lee PI, Lu CY, Lu MY, et al. Bacteremia in hematological and oncological children with febrile neutropenia: experience in a tertiary medical center in Taiwan. J Microbiol Immunol Infect 2003; 36: 197–202. [ Links ]
6. Bow EJ. Management of the febrile neutropenic cancer patient: lessons from 40 years of study. Clin Microbiol Infect 2005; 11 (Suppl. 5): 24–29. [ Links ]
7. Talcott JA. Outpatient management of febrile neutropenia: should we change the standar of care? The Oncologist 1997; 2: 365–373. [ Links ]
8. Broglia N, Carranza L. Estudio descriptivo de episodios de neutropenia febril en pacientes con tumores sólidos en un centro privado de Córdoba. Oncología Clínica 2002; 8: 827–830. [ Links ]
9. Neth O, Bajaj M, Turner MW, Klein NJ. Susceptibility to infection in patients with neutropenia: the rol of the innate immune system. Br J Haematol 2005; 129: 713– 722. [ Links ]
10. Santolaya ME, Álvarez AM, Avilés C, Becker A, Cofré J, Payó E. Tratamiento selectivo de los episodios de neutropenia febril en niüos con cáncer. Rev Chilena Infectol 2004; 21: 213–222. [ Links ]
11. Hughes WT, Armstrong D, Bodey GP, Bow EJ, Brown AE, Calandra T, et al. 2002 guidelines for the use of antimicrobial agents in neutropenic patients with cancer. Clin Infect Dis 2002; 34: 730–751. [ Links ]
12. Lane S, Kohler J. The management of febrile neutropenia. Current Paediatrics 2005; 15: 400–405. [ Links ]
13. Giamarellou H, Giamarellos–Bourboulis EJ, Repoussis P, Galani L, Anagnostopoulos N, Grecka P, et al. Potential use of procalcitonin as a diagnostic criterion in febrile neutropenia: experience from a multicentre study. Clin Microbiol Infect 2004; 10: 628–633. [ Links ]
14. de Bont ES, Vellenga E, Swaanenburg J, Kamps W. Procalcitonin: a diagnostic marker of bacterial infection in neutropenic cancer patients with fever? Infection 2000; 28: 398–400. [ Links ]
15. El–Maghraby SM, Moneer MM, Ismail MM, Shalaby LM, El–Mahallawy HA. The diagnostic value of C–reactive protein, interleukin–8, and monocyte chemotactic protein in risk stratification of febrile neutropenic children with hematologic malignancies. J Pediatr Hematol Oncol 2007; 29: 131–136. [ Links ]
16. Secmeer G, Devrim I, Kara A, Ceyhan M, Cengiz B, Kutluk T, et al. Role of procalcitonin and CRP in differentiating a stable from a deteriorating clinical course in pediatric febrile neutropenia. J Pediatr Hematol Oncol 2007; 29: 107–111. [ Links ]
17. Klaassen RJ, Goodman TR, Pham B, Doyle JJ. "Low–risk" prediction rule for pediatric oncology patients presenting with fever and neutropenia. J Clin Oncol 2000; 18: 1012–1019. [ Links ]
18. Alexander SW, Wade KC, Hibberd PL, Parsons SK. Evaluation of risk prediction criteria for episodes of febrile neutropenia in children with cancer. J Pediatr Hematol Oncol 2002; 24: 38–42. [ Links ]
19. Santolaya ME, Alvarez AM, Aviles CL, Becker A, Cofré J, Enriquez N, et al. Prospective evaluation of a model of prediction of invasive bacterial infection risk among children with cancer, fever, and neutropenia. Clin Infect Dis 2002; 35: 678–683. [ Links ]
20. Paganini HR, Aguirre C, Puppa G, Garbini C, Javier RG, Ensinck G, et al. A prospective, multicentric scoring system to predict mortality in febrile neutropenic children with cancer. Cancer 2007; 109: 2572–2579. [ Links ]
21. Zinner SH. New pathogens in neutropenic patients with cancer: an update for the new millennium. Int J Antimicrob Agents 2000; 16: 97–101. [ Links ]
22. Gaytán J, Mateos E, Sánchez E, González J, Casanova LJ, Fuentes JL. Microbiological findings of febrile neutropenia. Arch Med Res 2000; 31: 388–392. [ Links ]
23. Ammann RA, Hirt A, Luthy AR, Aebi C. Predicting bacteremia in children with fever and chemotherapyinduced neutropenia. Pediatr Infect Dis J 2004; 23: 61– 67. [ Links ]
24. Laws HJ, Kobbe G, Dilloo D, Dettenkofer M, Meisel R, Geisel R, et al. Surveillance of nosocomial infections in paediatric recipients of bone marrow or peripheral blood stem cell transplantation during neutropenia, compared with adult recipients. J Hosp Infect 2006; 62: 80–88. [ Links ]
25. Santolaya ME, Rabagliati R, Bidart T, Payó E, Guzmán AM, Morales R, et al. Consenso nacional. Manejo racional del paciente con neutropenia febril. Rev Chilena Infectol 2005; 22 (Supl. 2): 79–107. [ Links ]
26. Sipsas NV, Bodey GP, Kontoyiannis D. Perspectives for managment of febrile neutropenic patients with cancer in the 21st century. Cancer 2005; 103: 1103–1113. [ Links ]
27. Chamberlain JD, Smibert E, Skeen J, Alvaro F. Prospective audit of treatment of paediatric febrile neutropenia in Australasia. J Paediatr Child Health 2005; 41: 598–603. [ Links ]
28. El–Mahallawy H, Sidhom I, El–Din NH, Zamzam M, El– Lamie MM. Clinical and microbiologic determinants of serious bloodstream infections in Egyptian pediatric cancer patients: a one–year study. Int J Infect Dis 2005; 9: 43–51. [ Links ]
29. Sigurdardottir K, Digranes A, Harthug S, Nesthus S, Tangen JM, Dybdahl B, et al. A multi–centre prospective study of febrile neutropenia in Norway: microbiological findings and antimicrobial susceptibility. Scand J Infect Dis 2005; 37: 455–464. [ Links ]
30. Vidal L, Paul M, Ben dor I, Soares K, Leibovici L. Oral versus intravenous antibiotic treatment for febrile neutropenia in cancer patients: a systematic review and meta–analisis of randomized trials. J Antimicrob Chemother 2004; 54: 29–37. [ Links ]
31. Santolaya ME, Alvarez AM, Aviles CL, Becker A, Cofré J, Cumsille MA, et al. Early hospital discharge followed by outpatient management versus continued hospitalization of children with cancer, fever, and neutropenia at low risk for invasive bacterial infection. J Clin Oncol 2004; 22: 3784–3789. [ Links ]
32. Paul M, Soares K, Leibovici L. B lactam monotherapy versus B lactam – aminoglicoside combination therapy for fever with neutropenia: systematic review an metaanalysis. Brit Med J 2003; 326: 1–9. [ Links ]
33. Kutluk T, Kurne O, Akyuz C, Ceyhan M, Kanra G, Büyükpamukçu, M et al. Cefepime vs. meropenem as empirical therapy for neutropenic fever in children with lymphoma and solid tumours. Pediatr Blood Cancer 2004; 42: 284–286. [ Links ]
34. Mustafa MM, Carlson L, Tkaczewski I, McCracken GH, Jr., Buchanan GR. Comparative study of cefepime versus ceftazidime in the empiric treatment of pediatric cancer patients with fever and neutropenia. Pediatr Infect Dis J 2001; 20: 362–369. [ Links ]
35. Chuang YY, Hung IJ, Yang CP, Jaing TH, Lin TY, Huang YC. Cefepime versus ceftazidime as empiric monotherapy for fever and neutropenia in children with cancer. Pediatr Infect Dis J 2002; 21: 203–209. [ Links ]
36. Kebudi R, Gorgun O, Ayan I, Gurler N, Akici F, Toreci K. Randomized comparison of cefepime versus ceftazidime monotherapy for fever and neutropenia in children with solid tumors. Med Pediatr Oncol 2001; 36: 434–441. [ Links ]
37. Paul M, Yahav D, Fraser A, Leibovici L. Empirical antibiotic monotherapy for febrile neutropenia: systematic review and meta–analysis of randomized controlled trials. J Antimicrob Chemother 2006; 57: 176– 189. [ Links ]
38. Le Guyader N, Auvrignon A, Vu–Thien H, Portier E, Tabone MD, Leverger G. Piperacillin–tazobactam and netilmicin as a safe and efficacious empirical treatment of febrile neutropenic children. Support Care Cancer 2004; 12: 720–724. [ Links ]
39. Fleischhack G, Schmidt–Niemann M, Wulff B, Havers W, Marklein G, Hasan C, et al. Piperacillin, beta–lactam inhibitor plus gentamicin as empirical therapy of a sequential regimen in febrile neutropenia of pediatric cancer patients. Support Care Cancer 2001; 9: 372–379. [ Links ]
40. Chastagner P, Plouvier E, Eyer D, Plesiat P, Lozniewski A, Sommelet D. Efficacy of cefepime and amikacin in the empiric treatment of febrile neutropenic children with cancer. Med Pediatr Oncol 2000; 34: 306–308. [ Links ]
41. Hamidah A, Lim YS, Zulkifli SZ, Zarina AL, Nordiah AJ, Jamal R. Cefepime plus amikacin as an initial empirical therapy of febrile neutropenia in paediatric cancer patients. Singapore Med J 2007; 48: 615–619. [ Links ]
42. Kline RM, Baorto EP. Treatment of pediatric febrile neutropenia in the era of vancomycin–resistant microbes. Pediatr Blood Cancer 2005; 44: 207–214. [ Links ]
43. Paganini HR, Sarkis CM, De Martino MG, Zubizarreta PA, Casimir L, Fernó;ndez C, et al. Oral administration of cefixime to lower risk febrile neutropenic children with cancer. Cancer 2000; 88: 2848–2852. [ Links ]
44. Shenep JL, Flynn PM, Baker DK, Hetherington SV, Hudson MM, Hughes WT, et al. Oral cefixime is similar to continued intravenous antibiotics in the empirical treatment of febrile neutropenic children with cancer. Clin Infect Dis 2001; 32: 36–43. [ Links ]
45. Paganini H, Rodriguez–Brieshcke T, Zubizarreta PA, Latella A, Firpo V, Casimir L, et al. Oral ciprofloxacin in the management of children with cancer with lower risk febrile neutropenia. Cancer 2001; 91: 1563–1567. [ Links ]
46. Paganini H, Gomez S, Ruvinsky S, Zubizarreta PA, Latella A, Fraquelli L, et al. Outpatient, sequential, parenteraloral antibiotic therapy for lower risk febrile neutropenia in children with malignant disease: a single–center, randomized, controlled trial in Argentina. Cancer 2003; 97: 1775–1780. [ Links ]
47. Clark OA, Lyman GH, Castro AA, Clark LG, Djulbegovic B. Colony–stimulating factors for chemotherapy–induced febrile neutropenia: a meta–analysis of randomized controlled trials. J Clin Oncol 2005; 23: 4198–4214. [ Links ]
48. Ammann RA, Aebi C, Hirt A, Ridolfi LA. Fever and neutropenia in children and adolescents: evolution over time of main characteristics in a single center, 1993–2001. Support Care Cancer 2004; 12: 826–832. [ Links ]
49. Gaur AH, Flynn PM, Shenep JL. Optimum management of pediatric patients with fever and neutropenia. Indian J Pediatr 2004; 71: 825–835. [ Links ]
50. Andre N, Kababri ME, Bertrand P, Rome A, Coze C, Gentet JC, et al. Safety and efficacy of pegfilgrastim in children with cancer receiving myelosuppressive chemotherapy. Anticancer Drugs 2007; 18: 277–281. [ Links ]
51. Alexander S, Walsh T. Infectious complications in pediatric cancer patients. In: Pizzo PA, Poplack DG, editors. Principles and Practice of Pediatric Oncology. 4th ed. Philadelphia: Lippincott Publishers, 2001. [ Links ]
52. Dannenberg C, Bierbach U, Rothe A, Beer J, Korholz D. Ethanol–lock technique in the treatment of bloodstream infections in pediatric oncology patients with broviac catheter. J Pediatr Hematol Oncol 2003; 25: 616–621. [ Links ]
53. Del Pont JM, PaganiniH, Debag R. Consenso nacional. Riesgo de infección en el paciente oncológico. Arch Argent Pediatr 2003; 101: 270–295. [ Links ]
54. Centers for Diseases Control and Prevention. Guidelines for the prevention of intravascular catheter related infection. MMWR 2002; 51 RR–10: 1–36. [ Links ]
Recibido: septiembre 30 de 200
Aceptado: octubre 22 de 2008