Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.22 no.4 Medellín Oct./Dec. 2009
ARTÍCULO DE REVISIÓN
Evaluación neurofuncional del tallo cerebral Parte I: reflejo del parpadeo
Functional neurological evaluation of the brainstem. Part I: the blink reflex
Fidias E. Leon–Sarmiento1, Claudia Gutiérrez2, Jaime Bayona–Prieto3
1Neurólogo clínico, Universidad Nacional, Bogotá, Colombia. feleones@gmail.com
2Optómetra, Mediciencias Research Group, Bogotá, Colombia. odclaudia06@gmail.com
3Especialista en Neurorrehabilitación, Universidad de Santander (UDES), Bucaramanga, Colombia.
RESUMEN
El reflejo de parpadeo es la respuesta neural que se obtiene en el músculo orbicular de los ojos, luego de estimular el nervio trigeminal, bien sea de manera simple o pareada, por medios eléctricos, mecánicos, acústicos, térmicos, químicos o magnéticos; cuando se estimula dicho nervio se obtienen tres respuestas llamadas R1, R2 y R3. R1 tiene latencia corta, viaja por fibras A beta y no se habitúa. R2 es de latencia mediana, viaja por fibras A beta o A delta, tiende a habituarse y la modulan estructuras suprasegmentales sensorimotoras. R3 es de latencia larga, se genera al estimular vías multisinápticas que involucran fibras tipo C, en una ruta compleja ponto–amígdalo–talámico–cerebelar. También se pueden registrar tres períodos silentes cuando el reflejo del parpadeo se obtiene mientras el individuo hace una contracción voluntaria muscular facial. El estudio funcional de este reflejo permite identificar con certeza si la lesión está en las vías aferentes o en las eferentes o si involucra una integración anormal sensorimotora debida a trastornos de los sistemas nerviosos central, autonómico o periférico. La ejecución correcta de estos estudios, así como su interpretación apropiada, con base en los mecanismos subyacentes de plasticidad neural, son guías para orientar mejor los protocolos de neurorrehabilitación.
Palabras clave
Distonías, Parálisis facial, Períodos silentes, Reflejos faciales, Tallo cerebral
SUMMARY
Functional neurological evaluation of the brainstem. Part I: the blink reflex
The blink reflex is the neural response elicited in the orbicular oculi muscle after single or paired supraorbital nerve stimulation, by either electrical, mechanical, acoustic, thermal, chemical or magnetic stimulation. It is made up of three responses called R1, R2 and R3. R1 is an early response that follows A beta fibers, and does not habituate. R2 is a middle–latency response that follows A beta and A delta fibers, tends to habituate and is modulated by sensorimotor suprasegmental structures. R3 is a long–latency response, generated by stimulation of a multisynaptic chain of neurons that involve type C fibers belonging to a complex pontothalamic–amigdalo–cerebellar pathway. It is also possible to record three silent periods if the blink reflex is obtained while the subject makes a voluntary facial muscle effort. The functional study of this reflex allows to define with certainty whether the lesion is in afferent or efferent pathways or if it involves an abnormal sensorimotor integration due to disorders of the central, autonomic or peripheral nervous systems. A correct execution of these studies, and their appropriate interpretation, based on the underlying mechanisms of neural plasticity, will guide toward better neurorehabilitation protocols.
Key words
Bainstem, Dystonia, Facial palsy, Facial reflexes, Silent periods
INTRODUCCIÓN
A pesar de los avances en neuroimágenes, biología molecular y nanotecnología, no es posible, aun en las manos de los más avezados clínicos, detectar ciertas anormalidades en pacientes con trastornos neurológicos en las vías aferentes, en el procesamiento central o en las vías eferentes relacionadas con la generación de los reflejos craneales, en estructuras del sistema nervioso que se encuentran, aparentemente, normales.1 Es en este punto donde se hace indispensable la evaluación de estas vías, por medio de estudios neurológicos funcionales que ayuden a ubicar, de manera más exacta, el sitio de la lesión. Discutiremos en esta serie, la neurología funcional de los reflejos craneales relacionados con las vías trigémino–faciales, dado que son los que se evalúan con más frecuencia en la práctica clínica, enfatizando en este trabajo en la generación e interpretación del reflejo del parpadeo (RP) obtenido por estimulación simple y pareada del nervio supraorbital (NESO) mientras la musculatura facial se encuentra en reposo o durante la activación voluntaria de la misma.
HISTORIA
Overend en 18962 informó, en una carta al editor de la revista Lancet, que al aplicar un estímulo mecánico a nivel supraorbital era posible obtener el RP; McCarthy, en 1901 (citado por Torres SA),3 demostró que estímulos táctiles aplicados en el NESO producían el parpadeo, de manera bilateral, y concluyó que estos eventos eran 'respuestas propias del nervio', idénticas al reflejo tendinoso.3 En 1952, Kugelberg obtuvo el registro electromiográfico del RP en seres humanos, al estimular eléctricamente el NESO.4 Shahani en 1970 demostró que este reflejo era mediado por receptores cutáneos5 y Kimura,6 en 1973, describió el papel de las interneuronas del tallo cerebral en la mediación de dicho reflejo. Más recientemente se demostró que el centro cortical de los movimientos faciales superiores, incluyendo los relacionados con el parpadeo, se encuentra ubicado en la región frontal mesial y no solo en el área motora como se había pensado durante décadas.7 Hoy se sabe que el RP se produce por estimulación eléctrica, mecánica, acústica, térmica, química o magnética aplicada sobre la cara. Dado lo práctico y útil que resulta, desde el punto de vista clínico, obtener este reflejo con estimulación eléctrica se discutirá este tipo de evaluación neurofuncional.
METODOLOGÍA
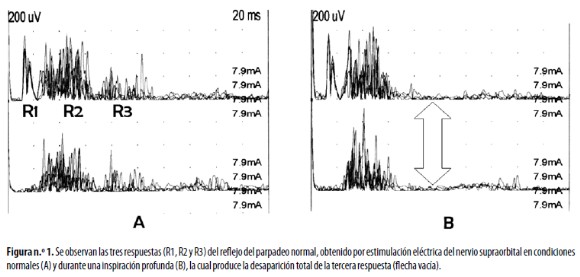
El RP se obtiene al aplicar un estímulo eléctrico, simple o pareado, en el NESO; las respuestas electromiográficas se registran en la porción inferior del músculo orbicular de los ojos, derecho e izquierdo. Los electrodos de estimulación se deben poner, aproximadamente, a 45 grados con el ánodo alejado de la glabela; el electrodo de tierra se pone debajo de la quijada. Los estímulos se aplican al azar, cada 45 a 60 segundos, para evitar la habituación de las respuestas, mientras el individuo permanece con los ojos cerrados. La intensidad del estímulo debe ser de 4 a 6 veces el umbral sensorial de cada individuo; se producen tres respuestas reflejas diferentes que se denominan R1, R2 y R3, que aparecen antes de que se produzca una respuesta muscular facial 8,18 (Figura n.°1a).
Generalmente, se hacen 4 registros con el fin de observar la consistencia de las respuestas reflejas. El individuo que se va a evaluar debe estar, idealmente, acostado y no debe haber fumado, por lo menos, durante seis horas antes del estudio dados los efectos de la nicotina sobre este reflejo.13 Usualmente se mide la latencia mínima de los registros obtenidos con estímulos simples del NESO. Las amplitudes no se tienen en cuenta, porque pueden variar entre 30% y 50% en sujetos normales; sin embargo, pueden ser útiles cuando se comparan en un mismo individuo.19,22 Cabe resaltar que los resultados obtenidos con estimulación eléctrica y magnética del nervio supraorbital son muy similares.23,25
Ver (Figura1)
La mayor cantidad de evaluaciones del tallo cerebral se ha llevado a cabo con estímulos simples, mientras los individuos que se van a estudiar tienen sus músculos faciales en reposo; solo recientemente se ha iniciado la investigación clínica del RP durante la actividad muscular facial voluntaria.24,27 En este último caso, la posición de los electrodos en la cara es similar a la utilizada en los estudios realizados cuando los músculos faciales se encuentran en reposo. El sujeto deberá mantener una contracción del músculo orbicular de los ojos entre 50% y 60% del esfuerzo máximo que pueda hacer con este músculo. Se mide la supresión electromiográfica entre cada una de las respuestas R1, R2 y R3, que sea superior al 50% de la actividad obtenida en el estudio hecho en reposo.18
Con la técnica de la doble estimulación, por su parte, es posible obtener la curva de recuperación de un reflejo dado y del circuito neural involucrado. El primer estímulo se llama condicionante y el segundo se denomina test; este último se aplica, progresivamente, a intervalos diferentes y cada vez más grandes, después de aplicar el estímulo condicionante; dichos estímulos deberán ser de igual intensidad. Las respuestas varían de acuerdo con el intervalo utilizado entre los estímulos y con el número de sinapsis involucradas en el circuito reflejo. La amplitud o duración de la respuesta obtenida con el estímulo test se expresa como un porcentaje del valor obtenido en la respuesta condicionada. La curva de recuperación se obtiene al colocar el porcentaje antes mencionado en el eje Y, y el intervalo de tiempo en el eje X. La intensidad del estímulo y la posición de los electrodos que estimulan el NESO y el registro de las respuestas reflejas son similares a los descritos en el RP obtenido por estimulación simple.19,23
NEUROBIOLOGÍA CLÍNICA
Con el individuo en reposo, la respuesta más temprana del RP que se obtiene al estimular el NESO, se llama R1. Esta es una respuesta homotópica, no visible al examen clínico y que aparece, aproximadamente, a los 10 milisegundos de haber aplicado el estímulo eléctrico al NESO e ipsilateral al sitio de estimulación. Los impulsos que la transmiten viajan por fibras mielinizadas A beta, de mediano calibre y utilizan circuitos sinápticos cortos que involucran de 1 a 3 interneuronas, hasta alcanzar las motoneuronas alfa que controlan la musculatura facial;8,29 son mediados por neurotransmisores gabaérgicos tipo B.30 Esta respuesta es estable y resistente a una gran cantidad de influencias suprasegmentales, incluyendo lesiones supratentoriales, trastornos de la conciencia y alteraciones cognitivas.19,24
La respuesta intermedia o R2 es bilateral, tiene una latencia aproximada de 30 milisegundos y una duración mayor que R1. Los impulsos que la producen viajan por fibras A beta de bajo umbral, aunque algunos sostienen que dicho componente también viaja por fibras A delta.31,32 Los estímulos continúan a través del tracto espinal en la región dorsolateral del puente y de la médula oblongada, para alcanzar luego la región más caudal del núcleo espinal trigeminal. De allí, los impulsos se transmiten por vías medulares polisinápticas que ascienden de manera ipsilateral y contralateral al lado estimulado de la cara, antes de alcanzar las motoneuronas alfa del nervio facial. Esta respuesta es inestable, se habitúa rápidamente y la modulan estructuras suprasegmentales sensorimotoras,19,22,32 que involucran neurotransmisores gabaérgicos tipo A.33
La tercera respuesta o respuesta tardía, se llama también R3. Esta tiene una latencia aproximada de 60 milisegundos y se registra bilateralmente.8,18 Los impulsos responsables de esta respuesta siguen vías multisinápticas que viajan por fibras tipo C; para su registro se requiere, en condiciones normales, la aplicación de estímulos de mayor intensidad que los utilizados para producir las respuestas R1 y R2 y es, además, más inestable que las dos anteriores. Sus conexiones centrales todavía no están muy bien definidas, pero se sabe que sigue una ruta compleja ponto–trigémino–amígdalo–talámico–cerebelar utilizando como vía final motoneuronas gama, sin alcanzar a tocar regiones espinales cervicales.34 En casos patológicos, esta respuesta puede aparecer antes que cualquier otra, por mecanismos mediados por liberación de la inhibición supraespinal que controla estas respuestas reflejas. La xilocaína,33 la capsaicina15, el shounousui – una sustancia emparentada con la capasaicina–,14 el topiramato,35 la inspiración profunda, la maniobra de Valsalva17,36 (Figura n.°1b) y la posición abierta o cerrada de los párpados durante el examen8,37 modifican el registro de esta respuesta. La nicotina la modula de manera selectiva y profunda.13,38
En ocasiones se puede registrar también una respuesta temprana, contralateral al sitio de la estimulación con latencia similar a R1, llamada R1k. Se la ha descrito en enfermedades neurológicas de origen central o periférico8,10,16,39 pero puede también aparecer en individuos normales, principalmente cuando hacen una contracción muscular facial voluntaria al momento de recibir el estímulo, o cuando los electrodos de estimulación se ponen muy cerca de la región glabelar.40 De otro lado, si el individuo hace una contracción muscular facial voluntaria, además de las tres respuestas ya mencionadas aparecen los denominados períodos silentes. Estos resultan de la inhibición transitoria, relativa o absoluta, de la actividad electromiográfica mientras se aplica cualquier estímulo, a la estructura neural relacionada con dicho músculo.41 En 1980, Sanes e Ison (citados por Leon–Sarmiento y colaboradores)18 hallaron un período silente en el RP; Eleck y su grupo (citados por Leon–Sarmiento y colaboradores)18, refinando la metodología, encontraron luego dos períodos silentes en el RP y más recientemente Leon–Sarmiento y colaboradores describieron tres períodos silentes en el RP, que hacen parte de los mecanismos inhibitorios del orbicular de los ojos.18
El primer período silente, o SR1, se origina durante el período refractario de las motoneuronas alfa; el segundo, o SR2, depende también, en parte, de dicho período refractario, pero involucra, además, la acción que en este lapso cumplen las células de Renshaw, recientemente descubiertas en núcleos del tallo cerebral. El tercer período silente, o SR3, resulta de una compleja mezcla de impulsos que incluyen la estimulación de fibras no mielinizadas de alto umbral, tipo C, su modulación por los husos neuromusculares y su interrelación con las motoneuronas gama relacionadas con los músculos faciales. Estos períodos silentes son regulados a nivel supraespinal por los ganglios basales, la corteza cerebral y el cerebelo.18
Finalmente, las respuestas obtenidas por estimulación pareada permiten investigar, principalmente, el estado de excitabilidad de las interneuronas del tallo cerebral.42,43
VALORES NORMALES
Luego de la estimulación eléctrica simple del NESO, y con el individuo en reposo, la R1 debe aparecer no más allá de los 13 milisegundos y las respuestas R2 –ipsilateral y contralateral– máximo a los 41 y 44 milisegundos, respectivamente.19,22,28 La R3 aparece, usualmente, después de los 60 milisegundos, ipsilateral y contralateralmente al sitio de estimulación.8,18 Las diferencias entre ambos lados de la cara, de las respuestas reflejas mencionadas son de menos de 1,2 milisegundos para R1 y de 8 milisegundos para R2; no hay estudios al respecto sobre R3.19,22,28,44 La latencia de R1 alcanza valores adultos a la edad de 2 años, y la de R2 entre los 5 y 6 años. La R3 aparece desde el nacimiento y tiende a desaparecer después de los 65 años.10,19,22,28 Ahora bien, si el individuo hace una contracción muscular facial voluntaria, el SR1 aparece en el rango de 18 a 27,9 milisegundos, el SR2 entre 62,3 y 83,9 milisegundos y el SR3 entre 103,7 y 141,8 milisegundos; dichos valores son similares de manera ipsilateral y contralateral al sitio de estimulación.18
Por otra parte, si el estímulo se aplica de manera pareada la respuesta R1 tiene una facilitación que alcanza el 250% de su valor, a los 30 a 40 milisegundos de intervalo; se reduce al 80% en el intervalo de 100 milisegundos y se recupera a intervalos de 200 a 500 milisegundos.24,26,28 En la práctica, la recuperación de la respuesta R2 es la más empleada. Usualmente esta respuesta desaparece hasta los 200 milisegundos, se recupera lentamente y alcanza, aproximadamente, el 50% de su valor a los 500 milisegundos y un 70% a 90% a los 1.500 milisegundos de intervalo.19,22,28 Los estudios de la curva de recuperación de la R3 son más escasos. Al parecer su restauración necesitaría más tiempo que la R2 y podría ser útil en la endofenotipificación de algunos trastornos del movimiento. En muchas ocasiones se confunde con una R2 prolongada, lo que genera problemas en el diagnóstico y seguimiento de los pacientes.18,43,44
APLICACIONES CLÍNICAS
Los estudios hechos con estimulación simple del NESO, mientras el individuo está en reposo, son útiles en pacientes con polineuropatías desmielinizantes como el síndrome de Guillain–Barré, la enfermedad de Charcot– Marie–Tooth y la neuropatía diabética. Con ellos se ha logado demostrar la prolongación de las latencias de R1 y R2 o, en ocasiones, la ausencia de las mismas, que puede incluso ser bilateral.45,46 Anormalidades muy similares se encuentran también en la esclerosis múltiple47 principalmente en la respuesta R2,45 lo cual contrasta con lo que ocurre en pacientes con paraparesia espástica tropical, enfermedad que suele confundirse clínicamente con la esclerosis múltiple.11 En esta última lo que se halla es una disminución de las latencias, principalmente de la R2, algo similar a lo descrito en la enfermedad de Parkinson y opuesto a lo que se encuentra en la enfermedad de Huntington, esto es, habituación y prolongación de la latencia de la respuesta R2.6,11,48
En la parálisis facial, sea idiopática o secundaria al síndrome de Ramsay–Hunt, tienen valor pronóstico y permiten saber con más confianza si la lesión es intraaxial o extraaxial tanto la medición de las latencias y amplitudes obtenidas por estimulación simple, como la relación que resulta de dividir la latencia de R1 por la del potencial de acción motor obtenido por estimulación directa del nervio facial y registrado en el músculo orbicular de los ojos.19,20 Cabe recordar que en las lesiones extraaxiales generalmente hay alteración simultánea de las respuestas R1 y R2, mientras que en las intraaxiales se pueden afectar separadamente dichas respuestas.19,41
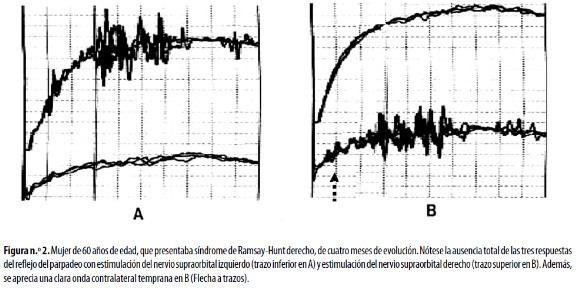
En la parálisis facial las anormalidades de las respuestas R1 y R2 se observan independientemente del sitio de estimulación,34 e incluyen un incremento del tamaño de la respuesta R2 contralateral al sitio afectado por la parálisis facial49 (Figura n.°2). También es posible registrar una respuesta temprana contralateral al sitio lesionado llamada R1k, la que, a su vez, se registra en pacientes con paraparesia espástica tropical, blefaroespasmo y el síndrome del hombre rígido, entre otros trastornos;8,10,39 esta respuesta se considera un signo de plasticidad aberrante del tallo cerebral.
Recientemente, Leon–Sarmiento describió la presencia aislada de la respuesta R3 en la parálisis de Bell, con ausencia de períodos silentes y cuyo RP, realizado de manera convencional, mostró los hallazgos clásicos descritos en esta enfermedad; así se estableció una nueva variante llamada parálisis facial discompleta.20,21,50,51 Junto con los hallazgos del RP, se deben analizar los que se obtengan por estimulación directa del nervio facial, los cuales coadyuvan a establecer un pronóstico más claro en esta enfermedad;20 llama la atención que los procesos de neurorrehabilitación empleados en pacientes con esta enfermedad, no se suelen documentar con estos estudios neurofuncionales.52 Estudios recientes, hechos con estimulación pareada, también han evidenciado cambios plásticos aberrantes en el tallo cerebral; desafortunadamente, errores en la interpretación de las respuestas investigadas no han permitido hasta ahora sacar conclusiones más completas.17,53 Esto se debe a que algunos investigadores no logran aún diferenciar la terminación de R2 del comienzo de R3 y las miden equivocadamente incluyendo a R3 en la duración de R217,44,53 lo cual influye en las conductas planteadas para rehabilitar a los pacientes.54
Ver (Figura2)
En la neuralgia del trigémino (tic doloroso) no se evidencian alteraciones de las dos primeras respuestas, mientras que la R1 puede ser anormal en el síndrome paratrigeminal.19,20 De otro lado, en el síndrome de la boca quemante, un trastorno que hace parte del diagnóstico diferencial de la neuralgia del trigémino, la más alterada es la excitabilidad de R3.55
Los pacientes con neurinomas del acústico pueden presentar alteraciones en las respuestas R1 y R2 del lado afectado.19,20 En los que tienen el síndrome de Wallenberg, la R1 es normal en el lado afectado, mientras que se puede presentar prolongación de la latencia de R2 o incluso ausencia de esta respuesta; en ocasiones, esta alteración se observa bilateralmente cuando se estimula el lado afectado, pero las respuestas de ambos lados son normales cuando se estimula el no afectado.19,22,28,41 Se han encontrado alteraciones de la R2 en pacientes con lesiones del tegmento lateral, aun cuando la fuerza y sensibilidad de la cara estaban preservadas.56 Las anormalidades detectadas en las dos primeras respuestas del RP en pacientes comatosos o con lesiones cerebrovasculares no son específicas, dada la amplia gama de áreas corticales que se pueden afectar en estos casos.57,58
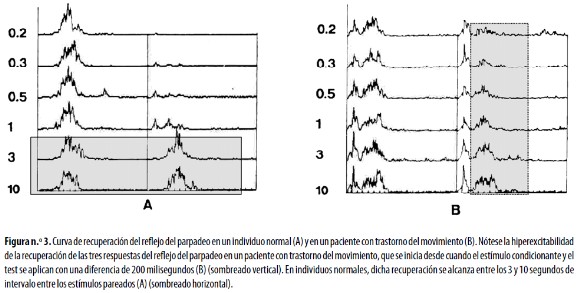
Al estudiar el RP con estimulación eléctrica simple del NESO se pueden detectar, en pacientes con algunos trastornos del movimiento, respuestas reflejas en músculos que en individuos normales no son excitables. Tal es el caso de pacientes con espasmo hemifacial en los que es posible registrar respuestas reflejas en el músculo orbicular de la boca del lado sano luego de estimular el NESO del lado afectado;59,63 dichas respuestas tienden a disminuir o incluso a desaparecer luego de la aplicación de toxina botulínica en el sitio del espasmo muscular.62,63 La acción central de esta sustancia más que su efecto periférico, es la mejor explicación del cambio de estas respuestas.64,66 Estos estudios son también muy útiles en el diagnóstico y seguimiento de pacientes con espasmo posparálisis facial.20,59,65,66 En pacientes con espasmo hemifacial, blefaroespasmo o enfermedad de Parkinson se ha encontrado disminución o ausencia de los períodos silentes que aparecen en reflejo orbicular de los ojos por estimulación simple del NESO; el más afectado ha sido el SP2. 18 El estudio de la R2 es el más usado para obtener las curvas de recuperación por estimulación pareada del NESO, en pacientes con estos trastornos neurológicos67,74 asociados a alteraciones extrapiramidales que producen una curva de recuperación 'a la
Ver (Figura3)
izquierda'.73,74 Dicha recuperación se encuentra francamente anormal en los pacientes con diversos trastornos como las distonías focales y generalizadas72 y las enfermedades de Parkinson y de Huntington 43,67,72,74 (Figura n.°3). En esta última enfermedad la R3 también está alterada no solo en los pacientes sino en sus familiares asintomáticos.43
Finalmente, en la migraña hay alteraciones de los períodos silentes y las respuestas tardías, principalmente de la R3, la cual, paradójicamente, se modifica luego de la aplicación de capsaicina. Esto se debe a una pérdida de la inhibición de los nociceptores supraespinales, con activación concomitante de las fibras A, que origina una comunicación aberrante entre estos dos tipos de fibras.75,76
REFERENCIAS BIBLIOGRÁFICAS
1. Leon–Sarmiento FE, Pradilla G, Calderon A, Duque JR. Dilación, dilatación e inclinación en hidrocefalia de presión normal. Rev Colomb Psiquiat 2008; 37: 280–286. [ Links ]
2. Overend W. Preliminary note on a new cranial reflex. Lancet 1896; 1: 619. [ Links ]
3. Torres SA. The blink reflex: comparative elecrophysiologic study in the domestic species. [Tesis doctoral]. Barcelona: Universidad Autónoma de Barcelona; 2002. [ Links ]
4. Kugelberg E. Facial reflexes. Brain 1952; 75: 285–296. [ Links ]
5. Shahani B. The human blink reflex. J Neurol Neurosurg Psychiatry 1970; 33: 792–800. [ Links ]
6. Kimura J. Disorder of interneurons in parkinsonism: the orbicularis oculi reflex with paired stimuli. Brain 1973; 96: 87–96. [ Links ]
7. Sohn YH, Voller B, Dimyan M, St Clair Ginson A, Hanakawa T, Leon–Sarmiento FE, Jung Hy, et al. Cortical control of voluntary blinking: a transcranial magnetic stimulation study. Clin Neurophysiol 2004; 115: 341–347. [ Links ]
8. Leon–S FE, Arimura K, Sonoda Y, Arimura Y, Osame M. Instability of R3 of the blink reflex in patients with HAM/ TSP. Funct Neurol 1994; 9: 199–202. [ Links ]
9. Leon–S FE, Arimura K, Arimura Y, Sonoda Y, Osame M. Contralateral early blink reflex in patients with HTLV–I associated myelopathy/tropical spastic paraparesis. J Neurol Sci 1995; 128: 51–57. [ Links ]
10. Leon–S FE, Sonoda Y, Osame M, Arimura Y, Arimura K. Orbicularis oculi reflex in HAM/TSP and other neurological disorders. Acta Med Col 1995; 20: 22–29. [ Links ]
11. Leon–S FE, Arimura K, Osame M. Multiple sclerosis and HTLV–I associated myelopathy are two distinct clinical entities. Mult Scler 1996; 2: 88–90. [ Links ]
12. Leon–S FE, Arimura K, Osame M. A re–evaluation of the afferent pathways and silent periods of the orbiculari oculi reflex in man. Medicas–UIS 1996; 10: 156–158. [ Links ]
13. Leon–S FE, Suwazono S, Takenaga S, Arimura K, Osame M. The effects of tobacco smoking on the short, middle and long latency responses of the blink reflex in humans. J Clin Neurophysiol 1997; 14: 144–149. [ Links ]
14. Leon–S FE, Arimura K, Suwazono S, Arimura Y, Osame M. The effects of shounousui on the three responses of the blink reflex in man. Muscle Nerve 1997; 20: 110–112. [ Links ]
15. Leon–S FE, Chavez M. Selective inhibition of ipsilateral and contralateral R3 of the blink reflex by capsaicin. Muscle Nerve 1997; 20: 1606–1607. [ Links ]
16. Leon–S FE, Pradilla G, Chavez MA, Deleon MA, Rueda OL, Bayona J. Contralateral early blink reflex in multifocal motor neuropathy. Electromyog Clin Neurophysiol 1998; 38: 419–422. [ Links ]
17. Leon–Sarmiento FE, Torres M. Orbiculari oculi reflex (R3) and the Valsalva maneuver. Rev Neurologia (Barcelona) 2001; 32: 1020–1022. [ Links ]
18. Leon–S FE, Arimura K, Osame M. Three silent periods in the orbiculari oculi reflex of man: normal findings and some clinical vignettes. Electromyog Clin Neurophysiol 2001; 41: 393–400. [ Links ]
19. Ongerboer de Visser BW, Cruccu G. Neurophysiological examination of the trigeminal, facial, hypoglossal, and spinal accessory nerves in cranial neuropathies and brain stem disorders. En: Brown WF, Bolton ChF, editores. Clinical Electromyography, 2a ed. Stoneham: Butterworth–Heinemann; 1993. p. 61–92. [ Links ]
20. Kimura J. Electrodiagnosis in Disease of Muscle and Nerve, 3a ed. Oxford: Oxford University Press; 2001. p. 1024 [ Links ]
21. Aramideh M, Valls–Sole J, Cruccu G, Ongerboer de Visser BW. Assessment of disorders of the cranial nerves. En: Brown WF, Bolton CF, Aminoff MJ, eds. Neuromuscular function and disease. Basic, clinical and electrodiagnostic aspects. Philadelphia: WB Saunders; 2002. p. 757–780. [ Links ]
22. Kaube H, Katsarava Z, Kaufer T, Diener H, Ellrich J. A new method to increase nociception specificity of the human blink reflex. Clin Neurophysiol 2000; 111: 413–416. [ Links ]
23. Auger RG, Stevens JC. Cranial reflexes. En: Daube JR, eds. Clinical Neurophysiology, 2a ed. Oxford: Oxford University Press; 2002. p. 382–393. [ Links ]
24. Leon–Sarmiento FE, Gomez A, Kimura J. Neurofisiología Clínica. En: Toro J, Yepes M, Palacios E, eds. Neurologia, 2a ed. México: McGraw Hill; 2009: en prensa. [ Links ]
25. Uribe CS, Franco A, Hernández D, Leon–Sarmiento FE. Electrodiagnóstico, electroencefalografía, potenciales evocados, electromiografía, estimulación magnética transcraneal. En: Uribe CS, Arana A, Lorenzana P, editores. Neurología. 7a ed. Medellín: CIB; 2009. p. 40–80. [ Links ]
26. Gomez–Wong E, Valls–Sole J. Effects of a prepulse stimulus on the masseteric inhibitory reflex in humans. Neurosci Lett 1996; 208: 183–186. [ Links ]
27. Sommer M, Wobker G, Ferbert A. Voluntary eyelid contraction modifies the blink reflex recovery cycle. Acta Neurol Scand 1998; 98: 29–35. [ Links ]
28. Aramideh M, Valls–Sole J, Cruccu G, Ongerboer de Visser BW. Cranial reflexes: electrodiagnostic technique, physiology, and normative data. En: Brown WF, Bolton CF, Aminoff MJ, eds. Neuromuscular function and disease. Basic, clinical and electrodiagnostic aspects. Philadelphia: WB Saunders; 2002. p. 443–453. [ Links ]
29. Trontelj MA. Trontelj JV. Reflex arc of the first component of the human blink reflex: a single motoneurone study. J Neurol Neurosurg Psychiatry 1978; 41: 538–547. [ Links ]
30. Pellegrini JJ, Evinger C. The trigeminally evoked blink reflex. II. Mechanisms of paired–stimulus suppression. Exp Brain Res 1995; 107: 181–196. [ Links ]
31. Cruccu G, Ferracuti S, Leardi MG, Fabbri A, Manfredi M. Nociceptive quality of the orbicularis oculi reflexes as evaluated by distinct opiate– and benzodiazepineinduced changes in man. Brain Res 1991; 556: 209–217. [ Links ]
32. Rossi B, Vignocchi G, Mazzoni M, Pardossi L, Bianchi F, Muratorio A. Causes of the instability of R3 component of electrically evoked blink reflex: role of the attention to the stimulus. Electromyogr Clin Neurophysiol 1993; 33: 49–53. [ Links ]
33. Rossi B, Risaliti R, Rossi A. The R3 component of the blink reflex in man: a reflex response induced by activation of high threshold cutaneous afferents. Electroencephalogr Clin Neurophysiol 1989; 73: 334–340. [ Links ]
34. Ellrich J, Hopf HC. The R3 component of the blink reflex: normative data and application in spinal lesions. Electroencephalogr Clin Neurophysiol 1996; 101: 349–355. [ Links ]
35. D'Aleo G, Sessa E, Di Bella P, Rifici C, Restivo DA, Bramanti P. Topiramate modulation of R3 nociceptive reflex in multiple sclerosis patients suffering paroxysmal symptoms. J Neurol 2001; 248: 996–999. [ Links ]
36. Leon–S FE, Bayona J, Bayona E. A new autonomic test, Part I. Salud UIS 1999; 32: 71–73. [ Links ]
37. Rossi B, Vignocchi MG. Methodological considerations on the use the blink reflex R3 component in the assessment of pain in man. Ital J Neurol Sci 1993; 14: 217–224. [ Links ]
38. Chen FP, Evinger C. Cerebellar modulation of trigeminal reflex blinks: interpositus neurons. J Neuro Sci 2006; 26: 10569–10576. [ Links ]
39. Nacimiento W, Podoll K, Graeber MB, Topper R, Möbius E, Ostemann H, et al. Contralateral early blink reflex in patients with facial nerve palsy: lndication for synaptic reorganization in the facial nucleus during regeneration. J Neurol Sci 1992; 109: 148–155. [ Links ]
40. Willer JC, Boulu P, Bratzlavsky M. Electrophysiological evidence for crossed oligosynaptic trigemino–facial connections in normal man. J Neurol Neurosurg Psychiatry 1984; 47: 87–90. [ Links ]
41. Aramideh M, Ongerboer de Visser BW. Brainstem reflexes: electrodiagnostic techniques, physiology, normative data, and clinical applications. Muscle Nerve 2002; 26: 14–30. [ Links ]
42. Kagohashi M, Okuma Y, Fujishima K, Kitada T, Mizuno Y. Blepharospasm associated with multiple system atrophy: a case report and review of the literature. Parkinsonism Relat Disord 2004; 10: 169–171. [ Links ]
43. de Tommaso M, Sciruicchio V, Spinelli A, Specchio N, Difruscolo O, Puca F, et al. Features of the blink reflex in individuals at risk for Huntington's disease. Muscle Nerve 2001; 24: 1520–1525. [ Links ]
44. Berardelli A, Rothwell JC, Day BL, Marsden CD. Pathophysiology of blepharospasm and oromandibular dystonia. Brain 1985; 108: 593–609. [ Links ]
45. Kimura J. An evaluation of the facial and trigeminal nerves in polyneuropathy: electrodiagnostic study in Charcot– Marie–Tooth disease, Gillian Barré syndrome and diabetic neuropathy. Neurology 1971; 21: 745–752. [ Links ]
46. Kimura J. Conduction abnormalities of the facial and trigeminal nerves in polyneuropathy. Muscle Nerve 1982; 5: 139–144. [ Links ]
47. Kimura J. Electrically elicited blink reflex in diagnosis of multiple sclerosis: Review of 260 patients over a sevenyear period. Brain 1975; 98: 413–426. [ Links ]
48. Esteban A, Gimenez–Roldan S. Blink reflex in Huntington's chorea and Parkinson's disease. Acta Neurol Scand 1975; 52: 145–157. [ Links ]
49. Manca D, Munoz E, Pastor P, Valldeoriola F, Valls–Sole J. Enhanced gain of blink reflex responses to ipsilateral supraorbital nerve afferent inputs in patients with facial nerve palsy. Clin Neurophysiol 2001; 112: 153–156. [ Links ]
50. Leon–S FE. Discomplete facial nerve palsy. Arch Med Res 2002; 7: 85–87. [ Links ]
51. Leon–Sarmiento FE, Bayona–Prieto J, Bayona EA. Cranial Reflexes: Basic Concepts and Clinical Applications. En: Pinto LC, ed. Neurofisiologia Clinica. Sao Paulo; 2006. p. 621–630. [ Links ]
52. Lazar RB. Principles of neurologic rehabilitation, 2a ed. New York: McGraw Hill; 1998. p. 876 [ Links ]
53. Syed NA, Delgado A, Sandbrink F, Schulman AE, Hallett M, Floeter MK. Blink reflex recovery in facial weakness: An electrophysiological study of adaptive changes. Neurology 1999; 52: 834–838. [ Links ]
54. Bayona J, Leon–Sarmiento FE, Bayona E. Neurorrehabilitación. En: Uribe CS, Arana A, Lorenzana P, editores. Neurología. 7ª ed. Medellín: CIB; 2009. p. 745–748. [ Links ]
55. Jaaskelainen SK, Forssell H, Tenovuo O. Electrophysiological testing of the trigeminofacial system: aid in the diagnosis of atypical facial pain. Pain 1999; 80: 191–200. [ Links ]
56. Aramideh M, Ongerboer de Visser BW, Koelman JH, Majoie CB, Holstege G. The late blink reflex abnormality due to lesions of the lateral tegmental field. Brain 1997; 120: 1685–1692. [ Links ]
57. Berardelli A, Accornero A, Cruccu G, Manfredi M. The orbicularis oculi response after hemispheral damage. J Neurol Neurosurg Psychiat 1983; 46: 837–843. [ Links ]
58. Kimura J, Wilkinson JT, Damasio H, Adams HR Jr, Shivapour E, Yamada T. Blink reflex in patients with hemispheric cerebrovascular accident (CVA). J Neurol Sci 1985; 67: 15–28. [ Links ]
59. Kimura J. Rodnitzky RL, Okawara S. Electrophysiologic analysis of aberrant regeneration after facial nerve paralysis. Neurology 1975; 25: 989–993. [ Links ]
60. Martinelli P, GiuJiani S, Ippoliti M. Hemifacial spasm due to peripheral injury of facial nerve: A nuclear syndrome? Mov Disord 1992; 7: 181–184. [ Links ]
61. Moller AR. Hemifacial spasm: ephaptic transmission or hyperexcitability of the facial motor nucleus? Exp Neurol 1987; 98:110–119. [ Links ]
62. Leon–S FE, Kim DS, Oh SJ, Claussen G. Control motor y nocicepción. Parte II: hemiespasmo facial y toxina botulínica. Acta Neurol Col 1999; 15: 75–81. [ Links ]
63. Kim DS, Leon–S FE, Claussen GC, Oh SJ. Synkinesis of the unaffected side in hemifacial spasm after botox injection. Muscle Nerve 1996; 19: 1222. [ Links ]
64. Leon–S FE, Arimura K, Chavez AM. A re–evaluation of the mechanism of action of botulinum toxin in facial movement disorders of man. Med Hypoth 1998; 51: 305–307. [ Links ]
65. Valls–Sole J. Facial palsy, postparalytic facial syndrome, and hemifacial spasm. Mov Disord 2002; Suppl 2: 49–52. [ Links ]
66. Eekhof JL, Aramideh M, Speelman JD, Devriese PP, Ongerboer De Visser BW. Blink reflexes and lateral spreading in patients with synkinesia after Bell's palsy and in hemifacial spasm. Eur Neurol 2000; 43: 141–146. [ Links ]
67. Carella F, Ciano C, Musicco M, Scaioli V. Exteroceptive reflexes in dystonia: A study of the recovery cycle of the R2 component of the blink reflex and of the exteroceptive suppression of the contracting sternocleidomastoid muscle in blepharospasm and torticollis. Mov Disord 1994; 9: 183–187. [ Links ]
68. Eekhof JL, Aramideh M, Bour LJ, Hilgevoord AA, Speelman HD, Ongerboer de Visser BW. Blink reflex recovery curves in blepharospasm, torticollis spasmodica, and hemifacial spasm. Muscle Nerve 1996; 19: 10–15. [ Links ]
69. Gomez–Wong E, Marti MJ, Tolosa E, Valls–Sole J. Sensory modulation of the blink reflex in patients with blepharospasm. Arch Neurol 1998; l55: 1233–1237. [ Links ]
70. Nakashima K, Rothwell JC, Thompson PD, Day BL, Berardelli A, Agostino R, et al. The blink reflex in patients with idiopathic torsion dystonia. Arch Neurol 1990; 47: 413–416. [ Links ]
71. Pauletti G, Berardelli A, Cruccu G, Agostino R, Manfedi M. Blink reflex and the masseter inhibitory reflex in patients with dystonia. Mov Disord 1993; 8: 495–500. [ Links ]
72. Tolosa E, Montserrat L, Bayes A. Blink reflex studies in focal dystonias: enhanced excitability of brain stem interneurones in cranial dystonia and spasmodic torticollis. Mov Disord 1988; 3: 61–69. [ Links ]
73. Leon–Sarmiento FE, Gutierrez CI, Bayona–Prieto J. Neurología funcional del blefaroespasmo. Medicina (Buenos Aires) 2008; 68: 318–324. [ Links ]
74. Leon–Sarmiento FE, Bayona–Prieto J, Gomez J. Neurophysiology of blepharospasm and multiple system atrophy: clues to its pathophysiology. Parkinsonims Relat Diord 2005; 11: 199–201. [ Links ]
75. Leon–Sarmiento FE, Bayona–Prieto J, Leon–S ME. Capsaicin effects on blinking. Arq Neuropsiquiat 2005; 63: 745–747. [ Links ]
76. Leon–Sarmiento FE, Schroeder N, Ruiz S. The capsacinblink reflex linkage in chronic migraine revisited. Cephalalgia 2008; 28: 676–677. [ Links ]
Recibido: octubre 28 de 2008
Aceptado: enero 04 de 2009