Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.22 no.4 Medellín Oct./Dec. 2009
ARTÍCULO DE REVISIÓN
Toxinas de serpientes con alto potencial terapéutico y su uso en la biomedicina
Animal toxins with high therapeutic potential and their use in biomedicine
Jaime Andrés Pereáñez Jiménez1, Leidy Johana Vargas Muñoz2
1Químico Farmacéutico, estudiante de Doctorado en Ciencias Básicas Biomédicas en el área de Bioquímica, Farmacología y Fisiología, Programa Ofidismo/Escorpionismo, Sede de Investigación Universitaria, Universidad de Antioquia, Medellín, Colombia. andrespj20@yahoo.es
2uímica Farmacéutica, estudiante de Doctorado en Ciencias Farmacéuticas, Programa Ofidismo/Escorpionismo, Sede de Investigación Universitaria, Universidad de Antioquia, Medellín, Colombia. johana2104@gmail.com
RESUMEN
Los venenos de animales son mezclas complejas de proteínas, péptidos, enzimas y trazas de elementos no proteicos tales como carbohidratos y sales, cuya finalidad es inmovilizar la presa y comenzar a digerirla; algunos de estos compuestos han sido aislados y caracterizados o descritos como toxinas letales, o se les han atribuido acciones potentes sobre proteínas específicas como, por ejemplo, las involucradas en la coagulación sanguínea. Debido al descubrimiento en 1971 del péptido que dio origen al captopril y al entendimiento de los efectos potenciales de las toxinas, se empezóa considerar que los venenos de animales son fuentes ricas en compuestos bioactivos, que no solo proporcionan las herramientas necesarias para descifrar los detalles moleculares de diversos procesos fisiológicos, sino que también sirven como fuente de inspiración para diseñar y desarrollar agentes terapéuticos. Este artículo expone la aplicación de nuevas alternativas terapéuticas y de modelos para el diseño de las mismas basados en algunas moléculas aisladas de venenos de serpientes con alto potencial en campos como la biomedicina y la farmacia.
Palabras clave
Agregación plaquetaria, Coagulación sanguínea, Desintegrina, Lectina del tipo C, Neurotoxina, Venenos
SUMMARY
Animal toxins with high therapeutic potential and their use in biomedicine Animal venoms are complex mixtures of proteins, peptides, enzymes and trace elements such as carbohydrates and salts, which serve to immobilize preys and to begin their digestion. Some of these compounds have been isolated and characterized, or described as lethal toxins, while others have powerful actions on specific proteins, such as those involved in blood coagulation. Due to the discovery in 1971 of the peptide that gave rise to captopril and to a better understanding of the potential effects of toxins, animal venoms started to be considered as rich sources of bioactive compounds, which not only provide the necessary tools to decipher molecular details of various physiological processes, but also are a source of inspiration to design and develop a range of new therapeutic agents. This review presents the application of new therapeutic options or models to design them based on certain molecules isolated from snake venoms, with high potential in fields such as biomedicine and pharmacy.
Key words
Blood coagulation, C–type lectin, Disintegrin, Neurotoxin, Platelet aggregation, Venoms
INTRODUCCIÓN
En la naturaleza existen animales con la capacidad de producir sustancias que pueden alterar los procesos fisiológicos normales de otras especies, las cuales reciben el nombre de venenos, y son mezclas complejas de proteínas, péptidos, enzimas y trazas de elementos no proteicos tales como carbohidratos y sales; este conjunto de elementos se utiliza para inmovilizar la presa y comenzar a digerirla y se almacena en unos reservorios especiales conocidos como glándulas venenosas.1,2 Por otro lado, una toxina es una molécula aislada, extraída o derivada de un animal, planta o microorganismo y que posee una acción específica,3 que altera puntos críticos del sistema fisiológico de la presa, por ejemplo, la hemostasis; algunas de estas moléculas, como las fosfolipasas A2 se unen al factor X de la cascada de coagulación y lo inhiben; otras como las serinproteasas, algunas de las cuales tienen acción similar a la trombina (thrombin–like) disminuyen la cantidad de fibrinógeno en el plasma, mientras que ciertas metaloproteasas causan degradación de la cadena á del fibrinógeno, impidiendo la formación apropiada del coágulo.4,6 En 1971, Ondetti y colaboradores descubrieron el péptido que dio origen al captopril, y desde entonces se ha considerado que los venenos de animales son fuentes ricas en compuestos bioactivos, potencialmente útiles.7,8 Se ha hallado en venenos de serpientes un sinnúmero de proteínas con actividades agonistas o antagonistas sobre proteínas y receptores específicos; tal especificidad convierte las toxinas en fuentes de inspiración para diseñar nuevas moléculas con actividad farmacológica; además, el descubrimiento de algunas proteínas que da origen a patentes suministra a los investigadores de campos como la biomedicina y la farmacia una herramienta indispensable para la innovación y la aplicación de dichas proteínas como alternativas terapéuticas. Este artículo pretende dar una visión actual del uso de algunas de estas moléculas como herramientas en diferentes campos de la biomedicina y la farmacia, y sobre su aplicación como nuevas opciones terapéuticas o como modelos para el diseño de las mismas. El artículo se centrará en las toxinas de los venenos de serpientes.
TOXINAS DE VENENOS DE SERPIENTES QUE AFECTAN EL SISTEMA HEMOSTÁTICO
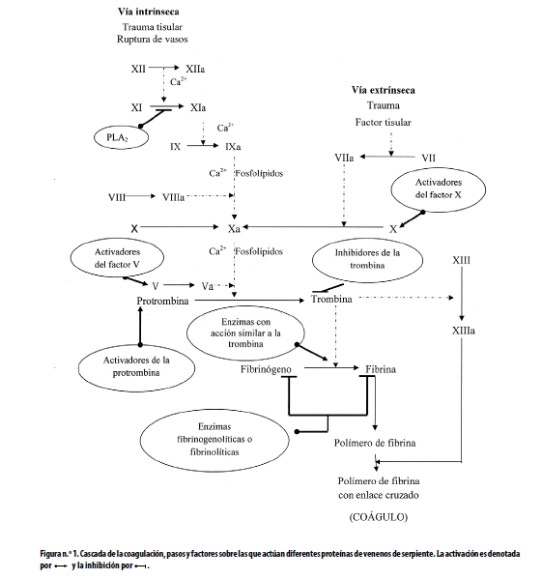
Los venenos de serpientes son una fuente rica en proteínas que afectan los mecanismos hemostáticos. Se las se puede clasificar en coagulantes y anticoagulantes; a las primeras pertenecen las activadoras de la protrombina y de los factores V y X de la coagulación; entre las segundas se encuentran las siguientes: activadoras de la proteína C e inhibidoras de la formación del complejo protrombina, fosfolipasas A2, enzimas fibrinogenolíticas o fibrinolíticas. Las enzimas con acción similar a la trombina (thrombin like), intermedias entre los verdaderos coagulantes y los anticoagulantes, son coagulantes in vitro y anticoagulantes in vivo. Estos venenos también afectan las plaquetas y pueden desencadenar hemorragias, en las que están involucradas toxinas como las desintegrinas y metaloproteasas.9,11Los principales tipos de proteínas de los venenos de serpientes que afectan la cascada de la coagulación están resumidos en la figura n.°1; estos activadores o inhibidores pertenecen a varias familias de proteínas: serinproteasas, metaloproteasas, lectinas del tipo C, desintegrinas y fosfolipasas A2. Debido al amplio rango de acciones de las toxinas sobre el sistema hemostático, han contribuido al estudio en este campo, lo que ha llevado al desarrollo de agentes útiles en el diagnóstico y el tratamiento de trastornos de la hemostasia, por lo que en esta sección del artículo se discutirán tales aplicaciones.
a. Enzimas con acción similar a la trombina y estudios de fibrinógeno
La trombina tiene la capacidad de clivar los fibrinopéptidos A y B (FPA y FPB) además de activar el factor XIII de la cascada de coagulación (Factor estabilizante de la fibrina). Algunas de las acciones de
Ver (Figura1)
estas enzimas, conocidas por la sigla SVTLE (del inglés snake venom thrombin–like enzymes), imitan los efectos de la trombina, pero usualmente clivan solo el FPA, aunque unas pocas ejercen su acción sobre el FPB; por ello, sin la hidrólisis de ambos fibrinopéptidos estas enzimas no son capaces de activar el factor XIII por lo que el sistema fibrinolítico hidroliza fácilmente los coágulos formados por ellas. Las SVTLE más utilizadas son la batroxobina, aislada de Bothrops atrox (Reptilase®, Pentapharm, Basilea, Suiza) y el ancrod (Viprimex®, (Knoll, Ludvisgshafen, Alemania), aislada de Callosellasma rhodostoma; esta última ha sido efectiva en el tratamiento de accidentes cerebrovasculares isquémicos.12 Por otro lado, la batroxobina se usa para propósitos diagnósticos: en química clínica existe el tiempo de reptilasa (Reptilase®, Pentapharm, Basilea, Suiza) como alternativa al tiempo de trombina en muestras que contienen heparina.13 Estas proteínas también se usan en el ensayo de antitrombina III, para el cual el plasma debe estar libre de fibrinógeno y no se puede añadir trombina, porque su reacción con la antitrombina III podría interferir con la prueba.14
Por otro lado, la fibrolasa aislada de Agkistrodon contortrix puede degradar ambas cadenas de la fibrina (á y â) y tiene potencial como agente trombolítico.15 En 2001 se produjo y fue sometida a estudios clínicos la Alfimeprasa® (Bayer Health Care) (una forma recombinante de esta fibrolasa).16 En la actualidad se encuentra en la segunda fase de los estudios clínicos como candidata para el tratamiento de oclusiones arteriales periféricas.17 También existen otras enzimas con la capacidad de hidrolizar coágulos in vitro e in vivo tales como afaacytina aislada de Cerastes cerastes,18 atroxasa, de Crotalus atrox 19 y la fibrogenasa, de Vipera lebetina.20
b. Activadores de la protrombina
De acuerdo con la necesidad de cofactores en la activación de la protrombina, se ha clasificado a estas proteínas en cuatro grandes grupos.21 En primer lugar se encuentran los activadores del grupo A que pertenecen a la superfamilia de las metaloproteasas, que no dependen de cofactores para activar la protrombina; una de las más estudiadas de este grupo es la ecarina aislada de Echis carinatus.22 Las del grupo B son proteínas formadas por dos subunidades que interactúan de forma no covalente y cuya activación requiere Ca2+; a este grupo pertenece la carinactivasa de E. carinatus.21 Los activadores del grupo C son serinproteasas con un peso molecular aproximado de 300 KDa, cuya activación requiere Ca2+ y fosfolípidos; estas enzimas se encuentran en serpientes australianas de la familia Elapidae y las más estudiadas son las obtenidas de Oxiuranus scuttelatus23,24 y la de Pseudonaja textiles.25,26 Finalmente, los activadores del grupo D requieren, además de Ca2+ y fosfolípidos, el factor Va de la cascada de coagulación; estas proteínas son homólogos estructurales del factor Xa.27 Los activadores de la protrombina tienen varias aplicaciones: se usan en la preparación de meizotrombina (uno de los productos principales de la activación de la protrombina),28,29 en la obtención de formas no enzimáticas de trombina y meizotrombina30 y en estudios de hidrólisis de protrombina.31
c. Activadores de los factores V y X de la cascada de coagulación
El veneno de la víbora de Russell (Doboia russelli) posee proteínas que activan estos dos factores de la coagulación. La molécula con preferencia por el factor V es una serinproteasa conocida como RVV–V (del inglés Russell viper venom V), cuya secuencia de aminoácidos está definida;32 es interesante que comparte el 68% de homología con la batroxobina y el 33% con la cadena B de la trombina. Se puede utilizar el RVV–V (Pentapharm, Basilea, Suiza) en ensayos de rutina del factor V, dada su alta selectividad para la activación de tal factor.33 Por el contrario, del activador del factor X conocido como RVVX (del inglés Russell Viper Venom X), también comercializado por la compañía Pentapharm, se sabe que su estructura incluye un dominio de desintegrina y otro de metaloproteasa, que activa directamente el factor X; además, se ha empleado esta proteína para cuantificar tal factor de la coagulación34 y es muy útil en los ensayos para diferenciar entre las deficiencias de los factores VII y X.35 En estudios recientes se aislaron dos activadores del factor X del veneno de Vipera ammodytes ammodytes, con un alto potencial para el tratamiento de pacientes con disfunción de los factores IXa o VIIa.36
d. Moduladores de la agregación plaquetaria
Muchos venenos de serpientes contienen toxinas que afectan la agregación plaquetaria, tales como serinproteasas, metaloproteasas de las clases PI a PIV, fosfolipasas A2, así como proteínas sin actividad enzimática, como lectinas del tipo C y desintegrinas; estas dos últimas son, de todas las anteriores, las consideradas como de mayor utilidad en estudios de modulación de la actividad plaquetaria.37,38
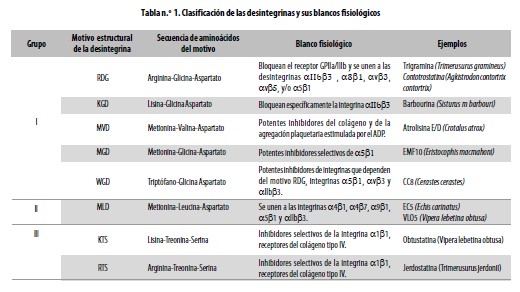
Desintegrinas: son proteínas con la capacidad de inhibir varias integrinas; se las puede clasificar en tres grupos de acuerdo con su selectividad por dichas moléculas de adherencia y por la presencia de unos motivos estructurales en su conformación tridimensional (Tabla n.°1). La inhibición de las integrinas dependientes del motivo RDG (arginina–aspartato–glicina) es uno de los principales objetivos en el tratamiento de muchas enfermedades, entre ellas los trastornos tromboembólicos, en los cuales se busca bloquear la integrina áIIâ3 (receptor del fibrinógeno), que se encuentra en la superficie de las plaquetas. Se ha utilizado la estructura de las desintegrinas como molde para el diseño de moléculas que se unen con alta afinidad al fibrinógeno endógeno; ello ha tenido como resultado la aprobación de dos nuevos medicamentos, el eptiftibatide (Integrilin®, Millenium Pharmaceuticals) y el tirofiban (Agrastat®, Merck & Co. Inc. Whitehouse Station, NJ, EEUU). Se modelóel primero a partir del sitio activo de la barbourina (Sistrurus barbouri), que de hecho es una proteína que contiene el motivo KDG (lisina–aspartato–glicina);39 se diseñóel segundo a partir de la echistatina (desintegrina que posee el motivo RDG).40,41 Ambos fármacos están aprobados para la terapia de la isquemia coronaria aguda y la prevención de las trombosis en pacientes intervenidos para angioplastia coronaria o inserción de stents.42,43
Los bloqueadores de las integrinas plaquetarias y especialmente los que tienen preferencia por la aIIbß3 podrían ser aplicables al tratamiento de ciertos tipos de cáncer, porque es bien sabido que las plaquetas contribuyen al crecimiento tumoral, la angiogénesis y las metástasis.44 La glicoproteína aIIbß3 es el receptor de mayor expresión en la membrana celular de las plaquetas, y puede interactuar con cada una de las cuatro proteínas de adherencia: fibrinógeno, fibronectina, factor de Von Willlebrand y vitronectina, que contienen el motivo RDG; por lo anterior, las desintegrinas aisladas de venenos de serpientes que contengan tal motivo estructural interfieren con la agregación plaquetaria al bloquear reversiblemente el receptor mencionado.
Ver (Tabla1)
Otra aplicación de las desintegrinas que contienen el motivo RDG ha sido la inhibición de la integrina avß3 como posible blanco farmacológico en la supresión del cáncer. Hasta el momento estas proteínas aisladas de venenos de serpientes han sido útiles para descifrar los mecanismos de la angiogénesis dependiente de avß3; desintegrinas como accutina,4 triflavina,46 salmosina,47 rhodostamina48,49 y contortrostatina50 inhiben dicha angiogénesis al unirse a las células endoteliales vía avß3; por lo anterior, se ha sugerido que la unión de las desintegrinas a tales células inhibe su movilidad y proliferación; el primer efecto se observa porque evita la interacción de la matriz extracelular con las células, mientras que el segundo se presenta posiblemente al inducir apoptosis. Estos mismos efectos se han observado en líneas celulares tumorales.51
Lectinas del tipo C: al igual que las proteínas fijadoras de manosa, las lectinas del tipo C son proteínas que se unen a carbohidratos en presencia de calcio y poseen un dominio de reconocimiento de carbohidratos (CRD, del inglés Carbohydrate Recognition Domain). Estructuralmente, se ha clasificado a estas proteínas en verdaderas lectinas del tipo C (porque contienen el CRD), y en proteínas similares a las lectinas del tipo C (CTLLP, del inglés C–type lectin–like proteins); estas últimas no poseen el dominio (loop) de unión al calcio y al carbohidrato. 52 Las CTLLP son moléculas con actividades coagulantes y anticoagulantes, que se unen a factores de la coagulación y a receptores de la membrana celular de las plaquetas de las que también son moduladoras; esta última actividad se lleva a cabo al interactuar con el factor de Von Willebrand (VWF) o con receptores específicos tales como la glicoproteína Ib (GPIb), a2ß1 o la glicoproteína VI (GPVI);53,54 por ejemplo la botrocetina y la bitiscetina, aisladas respectivamente de Bothrops jararaca y Bitis arietans forman complejos trimoleculares con VWF y GPIb para activar las plaquetas; resultados recientes indican que ellas deben interactuar con ambas proteínas para inducir la activación de tales células, contrariamente a lo que antes se pensaba, que la acción era mediada simplemente por la inducción de cambios de conformación en VWF.55,56 Por otro lado, la echiscetina aislada de Echis carinatus se une específicamente a la GPIb plaquetaria bloqueando la unión de la plaqueta al VWF y a la trombina,57 mientras que la convulxina, aislada de Crotalus durissus terrificus, activa las plaquetas por su interacción con GPVI.58 Igualmente, la proteína EMS16 aislada de Echis multisquamatus es un inhibidor selectivo potente del receptor del colágeno, la integrina a2ß1,59 mientras que la agretina de Callosellasma rhodostoma activa las plaquetas al unirse a a2ß1 y a GPIb.60
Por todo lo anterior, las CTLLP podrían servir para dilucidar los mecanismos involucrados en la coagulación y la activación plaquetaria, así como en la producción de nuevas moléculas útiles en el diagnóstico y tratamiento de algunos trastornos de la hemostasia, por su capacidad de interactuar con las plaquetas.
OTRAS TOXINAS AISLADAS DE VENENOS DE SERPIENTES
Toxinas que reconocen los receptores muscarínicos de la acetilcolina
Estas toxinas han sido aisladas de la mamba verde (Dendroaspis angusticeps).61,62 Debido a su potencia y selectividad pueden ser útiles en la investigación y la determinación de los diferentes papeles fisiológicos de los subtipos de receptores muscarínicos.63,64 Estos receptores son de gran importancia en enfermedades neurodegenerativas, tales como las de Alzheimer y Parkinson; de hecho, se describióla participación de receptores muscarínicos en la enfermedad de Alzheimer usando estas toxinas de mamba específicas para los diferentes subtipos de receptores.65
Toxinas que bloquean los canales de potasio
Estas proteínas se llaman dendrotoxinas y se han aislado de Dendroaspis sp. Estudios con diferentes canales de potasio clonados, indican que la a–dendrotoxina de la mamba verde (D. angusticeps) bloquea los canales de potasio Kv1.1, Kv1.2 y Kv1.6, mientras que la toxina K, de la mamba negra, D. polylepis, bloquea de preferencia los canales del tipo Kv1.1.66 Análogos estructurales de las dendrotoxinas han ayudado a definir las características de reconocimiento de diferentes canales de K+, mientras que dendrotoxinas marcadas radiactivamente han sido útiles en el descubrimiento de toxinas de otras fuentes que se unen a estos canales.66,67 Finalmente, por haber sido excelentes marcadores de los diferentes subtipos de canales de K+, estas moléculas se han convertido en herramientas importantes para el estudio de los mismos y dada la existencia de algunas condiciones fisiopatológicas asociadas a estos poros iónicos, cabe pensar que análogos de las dendrotoxinas pueden tener potencial terapéutico.
Toxinas con actividad analgésica que se unen a los receptores opioides
En este grupo se encuentra la hannalgesina, aislada de la cobra real (Ophiophaus hannah). Esta toxina se une a los receptores de opioides, causando una analgesia 2.700 veces más fuerte que la de la morfina; además, su efecto fue bloqueado por la naloxona (antagonista de dichos receptores), lo que ratifica su acción sobre los mismos.68
Recientemente se aisló, de la serpiente cascabel suramericana Crotalus durissus terrificus, otro péptido que ejerce su acción sobre estos blancos moleculares; recibióel nombre de crotalfina. Dicha molécula presentóuna fuerte actividad analgésica y antinociceptiva en modelos de dolor neuropático y, además, fue activa por las vías oral, intravenosa e intraplantar en ratones; se demostróque su acción era mediada por la activación de los receptores opioides tipo ê.69,70 Finalmente, se sabe que el dolor neuropático no responde muy bien a los medicamentos analgésicos convencionales los que, por otra parte, están asociados a una gran variedad de efectos adversos. Por ello, se necesitan avances en la investigación de nuevos agentes que hagan disminuir el dolor, como la hannalgesina y la crotalfina, que pueden llegar a ser moléculas modelo para el desarrollo de ese tipo de fármacos.
CONCLUSIÓN
Las toxinas son compuestos naturales producidos por plantas, animales y microorganismos; se las ha investigado durante años y se han convertido en fuentes potenciales para la descripción de nuevos agentes terapéuticos. Dilucidar la estructura, la actividad y los blancos farmacológicos de las toxinas conducirá a entender mejor el papel de algunas proteínas blanco en los procesos fisiológicos y a desarrollar nuevos fármacos dirigidos hacia la activación o inhibición de procesos fisiológicos específicos.
El estudio de los venenos de serpientes, y especialmente el de sus toxinas, se convierte ahora en una estrategia que aportará excelentes beneficios terapéuticos; el posible descubrimiento y caracterización de nuevas toxinas podría llevar a la descripción de nuevos blancos farmacológicos tomando como punto de partida toda la información estructural y funcional disponible y el uso de técnicas como la síntesis de péptidos en fase sólida y la espectrometría de masas.
Finalmente, por su complejidad y riqueza en moléculas bioactivas, los venenos poseen un gran potencial como fuente de agentes terapéuticos, propiedad que se debe aprovechar al máximo.
REFERENCIAS BIBLIOGRÁFICAS
1. Meier J, Stocker K.H. Biology and distribution of venomous snakes of medical importance and the composition of snake venoms. En: Meier J, White J, eds. Handbook of Clinical Toxicology of Animal Venoms and Poisons, 1a ed. Boca Raton, FL: CRC Press; 1995. p. 367–412. [ Links ]
2. Kovcha E. The origin of snakes and evolution of the venom apparatus. Toxicon 1987; 25: 65–106. [ Links ]
3. Gawade S. Therapeutic alternatives from venoms and toxins. Indian J Pharmacol 2007; 39: 260–264. [ Links ]
4. Marckland FS. Snake venom and hemostatic system. Toxicon 1998; 36: 1749–1800. [ Links ]
5. Kini RM. Anticoagulant proteins from snake venoms: structure function and mechanism. Biochem J 2006; 397: 377–387. [ Links ]
6. Kini RM. Structure–function relationships and mechanism of anticoagulant phospholipase A2 enzymes from snake venoms. Toxicon 2005; 45: 1147–1161. [ Links ]
7. Ondetti MA, Williams NJ, Sabo EF, Pluscec J, Weaver ER, Kocy O. Angiotensin–converting enzyme inhibitors from the venom of Bothrops jararaca. Isolation, elucidation of structure, and synthesis. Biochemistry 1971; 10: 4033– 4039. [ Links ]
8. Lewis R, Garcia M. Therapeutic potential of venom peptides. Nature Rev Drug Discov 2003; 2: 790–802. [ Links ]
9. White J. Snake venom and coagulopathy. Toxicon 2005; 45: 951–967. [ Links ]
10. Marsh NA. Inventory of haemorrhagic factors from the snake venoms. Thromb Haemost 1994; 71: 793–797. [ Links ]
11. Pirkle H. Thrombin–like enzymes from snake venoms: an updated inventory. Thromb Haemost 1998; 79: 675–683. [ Links ]
12. Samsa GP, Matchar DB, Williams GR, Levy DE. Cost effectiveness of ancrod treatment of acute ischaemic stroke: results from the Stroke Treatment with Ancrod Trial (STAT). J Eval Clin Prac 2002; 8: 61–70. [ Links ]
13. Funk C, Gmur J, Herold R, Straub PW. Reptilase–R, a new reagent in blood coagulation. Br J Haematol 1971; 21: 43–52. [ Links ]
14. Howie PW, Prentice CRM, McNicol GP. A method of antithrombin estimation using plasma defibrinated with ancrod. Br J Haematol 1973; 25: 101–110. [ Links ]
15. Markland FS. Snake venom fibrinogenolytic and fibrinolytic enzymes: an updated inventory. Thromb Haemost 1998; 79: 668–674. [ Links ]
16. Toombs CF. Alfimeprase: pharmacology of a novel fibrinolytic metalloproteinase for thrombolysis. Haemostasis 2001; 31: 141–147. [ Links ]
17. Swenson S, Toombs CF , Pena L, Johansson J, Markland FS,. Jr. Alpha–fibrinogenases. Curr Drug Targets Cardiovasc Haematol Disord 2004; 4: 417–435. [ Links ]
18. Laraba–Djebari F, Martin–Eauclaire MF, Mauco G, Marchot P. Afaacytin, an alpha beta–fibrinogenase from Cerastes cerastes (horned viper) venom, activates purified factor X and induces serotonin release from human blood platelets. Eur J Biochem 1995; 233: 756–765. [ Links ]
19. Baker BJ, Tu AT. Atroxase: a fibrinolytic enzyme isolated from the venom of Western diamondback rattlesnake: isolation, characterization and cloning. Adv Exp Med Biol 1996; 391: 203–211. [ Links ]
20. Gasmi A, Chabchoub A, Guermazi S, Karoui H, Elayeb M, Dellagi K. Further characterization and thrombolytic activity of a rat model of a fibrinogenase from Vipera lebetina venom. Thromb Haemost 1997; 86: 233–242. [ Links ]
21. Kini RM, Rao VS, Joseph JS. Procoagulant proteins from snake venoms. En: Bon C, Kini M, Markland FS, Marsh NA, Rosing J, eds. International Conference on Exogenous Factors affecting Thrombosis and Haemostasis. Haemostasis 2001; 31: 218–224. [ Links ]
22. Kornalik F, Vorlova Z. Ecarin test in diagnosis of dicoumarol therapy, liver diseases and DIC. Folia Haematol (Leipzig) 1988; 115: 483–487. [ Links ]
23. Owen WG, Jackson CM. Activation of prothrombin with Oxyuranus scutellatus scutellatus (Taipan snake) venom. Thromb Res 1973; 3: 705–714. [ Links ]
24. Speijer H, Govers–Riemslag JWP, Zwaal RFA, Rosing J. Prothrombin activation by an activator from the venom of Oxyuranus scutellatus (Taipan snake). J Biol Chem 1986; 261: 13258–13267. [ Links ]
25. Masci PP, Whitaker AN, De Jersey J. Purification and characterization of a prothrombin activator from the venom of the Australian brown snake, Pseudonaja textilis textilis. Biochem Int 1988; 17: 825–835. [ Links ]
26. Rao VS, Kini RM. Pseutarin c, a porthrombin activator from Pseudonaja textilis venom: Its structural and functional similarity to mammalian coagulation factor Xa–Va complex. Thromb Haemost 2002; 88: 611–619. [ Links ]
27. Rao VS, Joseph JS, Kini RM. Group D prothrombin activators from snake venom are structural homologues of mammalian blood coagulation factor Xa. Biochem J 2002; 369: 635–642. [ Links ]
28. Novoa E, Seegers WH. Mechanisms of á–thrombin and â–thrombin–E formation: use of ecarin for isolation of meizothrombin 1. Thromb Res 1980; 18: 657–668. [ Links ]
29. Rosing J, Tans G, 1988. Meizothrombin, a major product of factor Xa–catalysed prothrombin activation. Thromb Haemost 1988; 60: 355–360. [ Links ]
30. Rosing J, Tans G. Structural and functional properties of snake venom prothrombin activators. Toxicon 1992; 30, 1515–1527. [ Links ]
31. Stevens WK, Cote HCF, MacGillivray RTA, Nesheim ME. Calcium ion modulation of meizothrombin autolysis at Arg55–Asp56 and catalytic activity. J Biol Chem 1996; 271: 8062–8067. [ Links ]
32. Tokunaga F, Nagasawa K, Tamura S, Miyata T, Iwanaga S, Kisiel W. The factor V–activating enzyme (RVV–V) from Russell's viper venom. J Biol Chem 1988; 263: 17471– 17481. [ Links ]
33. Kisiel W, Canfield WM. Snake venom proteases that activate blood coagulation factor V. Methods Enzymol 1981; 80: 275–285. [ Links ]
34. Stocker K. Application of snake venom proteins in the diagnosis of hemostatic disorders. En: Stocker K, ed. Medical Use of Snake Venom Proteins, 1a ed. Boca Raton: CRC–Press; 1990. p. 213–252. [ Links ]
35. Quick AJ. Thromboplastin generation: effect of the Bell– Alton reagent and Russell's viper venom on prothrombin consumption. Am J Clin Pathol 1971; 55: 555–560. [ Links ]
36. Leonard A, Fox W, Trampuš–Bakija A, Krizaj IA. Two coagulation factor X activators from Vipera a. ammodytes venom with potential to treat patients with dysfunctional factors IXa or VIIa. Toxicon 2008; 52: 628–637. [ Links ]
37. Andrews RK, Berndt MC. Snake venom modulators of platelet adhesion receptors and their ligands. Toxicon 2000; 38: 775–791. [ Links ]
38. Wisner A, Leduc M, Bon C. (2002) C–type lectins from snake venoms: new tools for research in thrombosis and haemostasis. En: Ménez A, ed. Perspectives in Molecular Toxinology, 1a ed. UK: Wiley Chichester; 2002, p. 357–375. [ Links ]
39. Scarborough RM, Naughton MA, Teng W, Rose JW, Philips DR, Nannizzi L. Design of potent and specific integrin antagonists: peptide antagonists with high specificity for glycoprotein IIb–IIIa. J Biol Chem 1991; 268: 1066– 1073. [ Links ]
40. Marwick C. Nature's agents help heal humans–some now take steps to reciprocate. JAMA 1998; 279: 1679– 1681. [ Links ]
41. Hantgan RR, Stahle MC, Connor JH, Lyles DS, Horita DA, Rocco M, et al. The disintegrin echistatin stabilizes integrin alphaIIbbeta3's open conformation and promotes its oligomerization. J Mol Biol 2004; 342: 1625– 1636. [ Links ]
42. Pang JT, Fort S, Della Siega A, Cohen EA. Emergency coronary artery bypasses surgery in the era of glycoprotein IIb/IIIa receptor antagonist use. J Card Surg 2002; 17: 425–431. [ Links ]
43. Gilchrist IC. Platelet glycoprotein IIb/IIIa inhibitors in percutaneous coronary intervention: focus on the pharmacokinetic–pharmacodynamic relationship of eptifibatide. Clin Pharmacokinet 2003; 42: 703–720. [ Links ]
44. Trikha M, Nakada MT. Platelets and cancer: implications for antiangiogenic therapy. Semin Thromb Hemost 2002; 28: 39–44. [ Links ]
45. Yeh C H, Peng HC, Huang TF. Accutin, a new disintegrin inhibits angiogenesis in vitro and in vivo by acting as integrin alphabeta3 antagonist and inducing apoptosis. Blood 1998; 92: 3268–3276. [ Links ]
46. Sheu JR, Yen MH, Kan YC, Hung WC, Chang PT, Luk HN. Inhibition of angiogenesis in vitro and in vivo: comparison of the relative activities of triflavin, an Arg– Gly–Asp– containing peptide and anti–alpha(v)beta3 integrin monoclonal antibody. Biochem Biophys Acta 1997; 1336: 445–454. [ Links ]
47. Kim SI, Kim KS, Kim HS, Choi MM, Kim DS, Chung KH. Inhibition of angiogenesis by salmosin expressed in vitro. Oncol Res 2004; 14: 227–233. [ Links ]
48. Yeh CH, Peng HC, Yang RS, Huang TF. Rhodostomin, a snake venom disintegrin, inhibits angiogenesis elicited by basic fibroblast growth factor and suppresses tumor growth by a selective avß3 blockade of endothelial cells. Mol Pharmacol 2001; 59: 1333–1342. [ Links ]
49. Huang TF, Yeh CH, Wu WB. Viper venom components affecting angiogenesis. Haemostasis 2001; 31: 192–206. [ Links ]
50. Markland FS, Shieh K, Zhou Q, Golubkov V, Sherwin RP, Richters V. A novel snake venom disintegrin that inhibits human ovarian cancer dissemination and angiogenesis in an orthotopic nude mouse model. Haemostasis 2001; 31: 183–191. [ Links ]
51. Zhou Q, Sherwin RP, Parrish C, Richters V, Groshen SG, Tsao–Wei D. Contortrostatin, a dimeric disintegrin from Agkistrodon contortrix contortrix, inhibits breast cancer progression. Breast Cancer Res Treat 2000; 61: 249–260. [ Links ]
52. Drickamer K. C–type lectin–like domains. Curr Opin Struct Biol 1999; 9: 585–590. [ Links ]
53. Clemetson KJ, Navdaev A, Dormann D, Du XY, Clemetson JM. Multifunctional snake C–type lectins affecting platelets. Haemostasis 2001; 31: 148–154. [ Links ]
54. Andrews RK, Gardiner EE, Berndt MC. Snake venom toxins affecting platelet function. Methods Mol Biol 2004; 273: 335–348. [ Links ]
55. Fukuda K, Doggett TA, Bankston LA, Cruz MA, Diacovo TG, Liddington RC. Structural basis of von Willebrand factor activation by the snake toxin botrocetin. Structure (Camb) 2002; 10: 943–950. [ Links ]
56. Maita N, Nishio K, Nishimoto E, Matsui T, Shikamoto Y, Morita T, et al. Crystal structure of von Willebrand factor A1 domain complexed with snake venom, bitiscetin: insight into glycoprotein Iba binding mechanism induced by snake venom proteins. J Biol Chem 2003; 278: 37777–37781. [ Links ]
57. Navdaev A, Dormann D, Clemetson JM, Clemetson KJ. Echicetin, a GPIb–binding snake C–type lectin from Echis carinatus, also contains a binding site for IgMê responsible for platelet agglutination in plasma and inducing signal transduction. Blood 2001; 97: 2333–2341. [ Links ]
58. Polgar J, Clemetson JM, Kehrel BE, Wiedemann M, Magnenat EM, Wells TN, et al. Platelet activation and signal transduction by convulxin, a Ctype lectin from Crotalus durissus terrificus (tropical rattlesnake) venom via the p62/GPVI collagen receptor. J Biol Chem 1997; 272: 13576–13583. [ Links ]
59. Horii K, Okuda D, Morita T, Mizuno H. Crystal structure of EMS16 in complex with the integrin a2–I domain. J Mol Biol 2004; 341: 519–527. [ Links ]
60. Chung CH, Peng HC, Huang TF. Aggretin, a C–type lectin protein, induces platelet aggregation via integrin alpha(2)beta(1) and GPIb in a phosphatidylinositol 3– kinase independent pathway. Biochem Biophys Res Commun 2001; 285: 689–695. 61. Bradley KN. Muscarinic toxins from the green mamba. Pharmacol Ther 2000; 85: 87–109. [ Links ] [ Links ]
62. Harvey AL, Kornisiuk E, Bradley KN, Cervenansky C, Duran R, Adrover M, et al. Effects of muscarinic toxins MT1 and MT2 from green mamba on different muscarinic cholinoceptors. Neurochem Res 2002; 11: 1543–1554. [ Links ]
63. Potter LT. Snake toxins that bind specifically to individual subtypes of muscarinic receptors. Life Sci 2001; 68: 2541–2547. [ Links ]
64. Jerusalinsky D, Alfaro P, Kornisiuk E, Quillfeldt J, Alonso M, Rial Verde E, et al. Muscarinic toxins: novel pharmacological tools for the muscarinic cholinergic system. Toxicon 2000: 38: 747–761. [ Links ]
65. Mulugeta E, Karlsson E, Islam A, Kalaria R, Mangat H, Winblad B, et al. Loss of muscarinic M4 receptors in hippocampus of Alzheimer patients. Brain Res 2003; 960: 259–262. [ Links ]
66. Harvey AL, Roberston B. Dendrotoxins: Structure–activity relationships and effects on potassium ion channels. Curr Med Chem 2004; 11: 3065–3072. [ Links ]
67. Harvey AL. Twenty years of dendrotoxins. Toxicon 2001; 39: 15–26. [ Links ]
68. Pu XC, Wong PT, Gopalakrishnakone P. A novel analgesic toxin (hannalgesin) from the venom of king cobra (Ophiophagus hannah). Toxicon 1995; 33, 1425–1431. [ Links ]
69. Gutierrez VP, Konno K, Chacur M, Sampaio SC, Picolo G, Brigatte P, et al. Crotalphine induces potent antinociception in neuropathic pain by acting at peripheral opioid receptors. Eur J Pharmacol 2008; 594: 84–92. [ Links ]
70. Konno K, Picolo G, Gutierrez V P, Brigatte P, Zambelli VO, Camargo AC, et al. Crotalphine, a novel potent analgesic peptide from the venom of the South American rattlesnake Crotalus durissus terrificus. Peptides 2008; 29: 1293–1304. [ Links ]
Recibido: noviembre 26 de 2008
Aceptado: marzo 02 de 2009