Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.23 no.1 Medellín Jan./Mar. 2010
INVESTIGACIÓN ORIGINAL
Malaria vivax en niños: recurrencias con dosis total estándar de primaquina administrada durante 3 frente a 7 días
Vivax malaria in children: recurrences with standard total dose of primaquine administered in 3 vs. 7 days
Jaime Carmona–Fonseca1
1 Profesor titular. Grupo Salud y Comunidad, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. Carrera 51D n.° 62–29. Medellín, Colombia Teléfono (574) 219 60 24. Fax (574) 219 60 51 Correspondencia: Jaime Carmona–Fonseca jaimecarmonaf@hotmail.com
RESUMEN
Introducción: se ha evaluado poco en el mundo la eficacia del tratamiento con cloroquinaprimaquina para el ataque agudo y, sobre todo, para las recurrencias del paludismo vivax en niños; esos estudios en América Latina son muy escasos y casi inexistentes en Colombia.
Objetivo:evaluar la eficacia de dos dosificaciones de primaquina en menores de 18 años.
Materiales y métodos: estudio clínico controlado, no enmascarado, con asignación aleatoria del tratamiento. Se evaluaron dos grupos según la dosis de primaquina: 0,50 mg/kg/día por 7 días (0,50–7) frente a 1,17 mg/kg/día por 3 días (1,17–3).
Resultados: A. Curación del ataque agudo: eficacia del 100% en los dos grupos; B. Prevención delas recurrencias durante 120 días: ocurrieron recurrencias en 68,4% de los niños tratados con el esquema 1,17–3, y en 34,2% de los que recibieron el régimen 0,50–7.
Conclusiones: 1. La proporción de recurrencias a los 120 días en niños tratados con el esquema 0,50–7 (34,2%) fue significativamente menor que la de los niños que recibieron el régimen 1,17–3(68,4%). 2. El tiempo de administración de una misma dosis total de primaquina influye en su eficacia contra las recurrencias: a menos días, menor eficacia.
Palabras clave
Cloroquina, Colombia, Eficacia, Malaria, Plasmodium vivax, Primaquina, Recurrencias maláricas
SUMMARY
Introduction: Worldwide, the efficacy of cloroquine–primaquine for treating acute Plasmodium vivax malarious attacks has not been thoroughly evaluated. In Latin America such studies are scarce, and in Colombia, almost nonexisting.
Objective: To assess the efficacy of two regimens for administration of primaquine in children aged less than 18 years.
Methodology: A clinical, controlled, unmasked study was carried out, with randomized administration of two primaquine regimens, namely: 0.50 mg/kg/day for 7 days (0.50–7) vs. 1.17 mg/kg/day for 3 days (1.17–3).
Results: A. Healing of the acute attack: efficacy was 100% in both groups. B. Prevention of recurrences during 120 days: recurrences occurred in 68.4% of children treated with the 1.17–3 regimen, and in 34.2% of those receiving the 0.5–7 one.
Conclusions: 1. Proportion of recurrences during the 120 days follow–up was significantly lower (34.2%) in children receiving the 0.50–7 regimen than in those treated with the 1.17–3 one (68.4%). The length ofadministration of the same total dose of primaquine influenced its efficacy against recurrences: shorter periods of administration were associated with lesser efficacy.
Key words
Cloroquine, Colombia, Efficacy, Malaria, Malarious recurrences, Plasmodium vivax, Primaquine
INTRODUCCIÓN
Se dice que hay enfermedades olvidadas y entre estas puede estar la malaria en general, pero con seguridad, está la malaria por Plasmodium vivax. Y si la investigación tiene en el olvido a la malaria vivax, la que sucede en América parece no existir y más ignota aún es la malaria vivax que afecta a las embarazadas y los niños.
En los países donde el paludismo es endémico, la cantidad de población menor de 15 años es 40% o más del total y el paludismo en este grupo de edad es grave. A pesar de esto, la investigación de la malaria en los niños muestra un inmenso retraso con respecto a lo que sucede en los adultos y esta situación la reconoce la Organización Mundial de la Salud (OMS).1
Malaria vivax en América y Colombia
En Colombia, el departamento de Antioquia es una de las regiones donde más casos de paludismo ocurren yse registran y, dentro de este departamento, sucede lo mismo con las zonas de Urabá y Bajo Cauca.2,3 Según los datos censales de 2005, 40% de la población en estas dosáreas era menor de 15 años. En ese año, la tasa de malaria en el Bajo Cauca fue casi el doble de la hallada en Urabá: 83 frente a 47 casos de malaria por cada mil expuestos. En el municipio de Turbo (zona de Urabá), en 2005, la tasa de malaria —por 1.000 expuestos— fue 28,38 en la población general (malaria P. vivax 24,45; P. falciparum 3,11; mixta 0,82), 34,51 en los menores de 15 años y 25,40 en los de 15 y más años (cálculos a partir de datos de la Dirección Seccional de Salud de Antioquia –DSSA– sobre población y malaria).
P. vivax genera 40% de la malaria en el mundo y es la especie predominante en Oriente Medio, Asia, Oceanía, Centro y Sur América.1 En la mayor parte delas áreas donde predomina, las tasas de transmisión son bajas y la población afectada tiene, entonces, poca inmunidad al parásito, por lo que todos los grupos de edad están en riesgo.1 En 2005, la malaria por P. vivax tuvo una tasa promedio de 38 por mil en el Bajo Cauca (Antioquia, Colombia), más de cuatro veces la que correspondió a P. falciparum (9 por mil). La relación vivax:falciparum fue 3:1 en Bajo Cauca y 5:1 en Urabá (Antioquia, Colombia) (cálculos con datos de la DSSA para malaria en 2005).
El tratamiento general del ataque agudo de malaria vivax
El tratamiento estándar para el paludismo vivax, en niños y adultos, es cloroquina y primaquina, así: cloroquina 25 mg/kg/día, fraccionada en 10 mg/kg el día 1 y 7,5 mg/kg los días 2 y 3; primaquina (base) 0,25 mg/kg/día por 14 días.1,4,5 En Colombia, en adultos, este tratamiento ha demostrado eficacia del 100% para curar el ataque agudo (supresión de síntomas y signos y de parasitemia por un mínimo de 28 días continuos);6, 9 lo mismo sucede en América, donde la falla terapéutica ha sido raramente informada y demostrada solo dos veces.10,11 Para curar el ataque agudo del paludismo vivax se han ensayado variaciones del tratamiento estándar, como ha sucedido en Brasil.12,14
Tratamiento del paludismo vivax en niños
Ya se anotó el tratamiento del ataque agudo en niños. En cuanto a la curación clínica inmediata, en Brasil seevaluó el papel de diferentes dosis de primaquina luego de haber dado cloroquina.15
Para obtener la curación total (radical) del paludismo vivax deben prevenirse las recurrencias y recaídas con el uso de primaquina, la única droga disponible en forma abierta en el mercado (hay otras, pero reservadas por las fuerzas armadas de Estados Unidos). Mientras 50–60% de las infecciones por P. vivax en el sureste de Asia recaen, la frecuencia es menor en Indonesia (30%) e India (15–20%).1
Un estudio en Brasil, en mayores de 12 años, mostró eficacia antirrecurrencias (hasta 6 meses de seguimiento) estadísticamente similar con estos dos esquemas de administración de primaquina: dosis de 0,50 mg/kg/día por 7 días frente a 0,50 mg/kg/día por 14 días.12 Parece que la dosis total de primaquina es el principal determinante de la eficacia antirrecurencias y antirrecaídas,16,17 pero no se ha evaluado completamente la influencia del tiempo en que tal dosis total se administra: 3, 5, 7, 14, etc. días.
No tenemos informes sobre la evaluación de la eficacia antirrecurrencias del esquema cloroquina–primaquina en malaria vivax en niños en Colombia. Este informe presenta los resultados obtenidos con dos esquemas de primaquina para evaluar las eficacias para curar el ataque agudo y para prevenir las recurrencias durante p> 120 días.
MATERIALES Y MÉTODOS
Clase de estudio y diseño de la muestra
Se aplicó un diseño clínico, controlado, aleatorio, abierto (no enmascarado). El tamaño de la muestra se definió con base en n = (N Z2 p (1 – p )) / (N e2) + (Z2 p(1–p)),18 en donde N: tamaño de la población de menores de 18 años con paludismo vivax, en Turbo, estimado en 1.200; Z: unidades Z correspondientes a un intervalo de confianza del 95%; Z = 1,96; e: error de muestreo, definido en 12% en este trabajo; p: proporción de las recurrencias, estimada en 0,19 según el análisis de recurrencias en un grupo de estudios (datos sin publicar); 1–p: complemento de p. Esto llevó a un tamaño de 40 personas por tratamiento.
Todos los pacientes ingresaron al estudio de recurrencias tras ser curados de su ataque agudo concloroquina–primaquina y permanecido sin síntomas ni parasitemia por 28 días.
Los tratamientos se asignaron al azar: al llegar un paciente, se le dio el tratamiento indicado en una lista de números generados al azar (con el programa Epidat 3.1) y asociados con los tratamientos; el procedimiento se repitió al llegar otro paciente y así hasta completar el tamaño del grupo.
Los pacientes se captaron en puestos de malaria de Turbo (Urabá), tanto urbanos como rurales. Este municipio tiene alta endemia malárica, que ha sido descrita.2,3 Al llegar a consulta en el puesto de malaria, a cada paciente y su acudiente el médico de la investigación les informó verbalmente del estudio y los invitó a participar en él; se entrevistó y examinó a quienes aceptaron participar para saber si cumplían con los criterios de inclusión. La captación y seguimiento de los pacientes se hizo entre junio de 2005 y diciembre de 2008.
Criterios de inclusión
1. Malaria exclusivamente por P. vivax según el examen de gota gruesa; 2. No tener malaria grave (complicada) según la OMS;1 3. Tener parasitemia de 1.000 o más parásitos/μL; 4. Ser menor de 18 años; 5. No estar en embarazo según una prueba inmunológica en tirilla; 6. Tener actividad normal de glucosa 6–fosfato deshidrogenasa (G6PD), medida según la técnica cuantitativa (método normalizado de Beutler para valoración de la G6PD en hemolizados);19,20 7. Aceptar la participación en el estudio y firmar el consentimiento informado.
Criterios de exclusión
Después de haber ingresado al estudio, estas fueron las causas de exclusión del mismo: 1. Incumplir algún control en cualquiera de los tres días iniciales; 2. Negarse a tomar los medicamentos; 3. Consumir otro medicamento antipalúdico; 4. Retirar el consentimiento informado.
Tratamientos de primaquina evaluados y tiempode seguimiento
Todos los pacientes recibieron cloroquina (10 mg/kg/ día el día 1 y 7,5 mg/kg/día los días 2 y 3). Cada paciente recibió simultáneamente primaquina, según el grupode tratamiento. En este informe, los grupos se designan según la cantidad de miligramos de primaquina base por kilogramo de peso por día y la cantidad de días en que se dio la primaquina; por ejemplo: 0,50–7 indica 0,50 mg/kg/ día por 7 días:
1) 0,50–7: 0,50 mg/kg/día por 7 días; la dosis diaria es el > doble de la diaria estándar y la total es la estándar. 2) 1,17–3: 1,17 mg/kg/día por 3 días; la dosis diaria es 4,68 veces la diaria estándar y la total es la estándar.
La DSSA suministró los fármacos que se administraron a cada paciente con 150 a 200 mL de agua potable y un pastel. El médico de la investigación dio personalmente el tratamiento al paciente, comprobó que lo tomara y por media hora vigiló que no lo vomitara.
Medición del efecto o evento
El factor de exposición fue cada uno de los dos tratamientos con primaquina.
Primer efecto primario: la curación del ataque agudo de paludismo vivax. La eficacia para curar el ataque agudo se evaluó durante 28 días de seguimiento con criterios clínico (ausencia o presencia de síntomas o signos compatibles con malaria) y parasitario (ausencia o presencia de parasitemia) (cuatro controles clínicos y parasitológicos: a las 24 horas de tratamiento, a las 48 horas de tratamiento, a las 72 horas de tratamiento [24 horas después de haber terminado la cloroquina] y al día 28) y solo quienes hubiesen permanecido curados del ataque agudo entraron al seguimiento adicional hasta el día 120.
Segundo efecto primario: la recurrencia parasitaria, con o sin síntomas asociados y medida cada mes, después del día 28. El análisis de recurrencias se centró en su frecuencia a los 120 días.
Efecto secundario: todo evento adverso potencialmente asociado al tratamiento antimalárico. Se identificó cada evento y se midió su frecuencia en cada control.
Por efecto adverso se entendió cualquier síntoma o signo clínico nuevo, o el agravamiento de uno existente, ocurrido durante el período de tratamiento del paciente y limitado a los 28 días iniciales. Se evaluó la relación entre el efecto adverso y el medicamento mediante la siguiente escala: no se sabe, ninguna relación, posible, poco probable, probable, definitiva. Elresultado del efecto adverso se clasificó en recuperación completa, todavía presente (al terminar el seguimiento), secuelas, muerte, no se sabe. La conducta aplicada por el médico tratante se clasificó en ninguna, suspensión del tratamiento, hospitalización, otra. Se preguntó específicamente si el efecto adverso se consideraba serio, lo que se definió como cualquier manifestación clínica que tuviera como resultado la muerte del paciente, que amenazara su vida, que obligara a hospitalizarlo, que produjera incapacidad o discapacidad significativa o permanente, que pudiera ser peligroso de cualquier manera para el paciente o requiriera intervención para prevenir los resultados antes referidos.
Diagnóstico de malaria y evaluación médica y de laboratorio
El diagnóstico parasitario lo hizo un profesional de laboratorio clínico, con amplia experiencia en esa tarea. Se usaron las pruebas de gota gruesa y extendido de sangre periférica coloreadas con Field y Giemsa, respectivamente. El nivel de parasitemia se evaluó contando el número de formas asexuadas por cada 200 glóbulos blancos según los criterios de OMS–OPS.21
Un médico general, con experiencia en el diagnóstico y tratamiento de la malaria, evaluó a cada paciente del estudio antes del tratamiento y en los días de seguimiento.
Todos los pacientes se citaron al puesto de malaria para suministrarles cloroquina–primaquina en cada uno de los tres primeros días, mientras que en los días siguientes el equipo de investigación les llevó el tratamiento a la residencia.
Análisis de la información
El análisis de datos se hizo con los programas EpiInfo 6.04, Epidat 3.1 y SPSS 15.0. Todos los intervalos de confianza se calcularon para 95% y todas las decisiones sobre significación estadística se tomaron con p < 0,05.
Las proporciones de incidencia de recurrencias se analizaron de tres maneras22,23 con el programa Epidat 3.1: por intención de tratar, según el protocolo, y por el peor escenario. Una definición resumida de los tipos de análisis (N numerador, D denominador) es esta: intención de tratar: N recurrencias al final del seguimiento; D iniciaron el estudio; por protocolo:N recurrencias al final del seguimiento; D llegaron al final del seguimiento; peor escenario: N recurrencias al final del seguimiento + perdidos; D iniciaron el estudio.
Las proporciones calculadas tienen este orden de magnitud: peor escenario > protocolo > intención de tratar.
Se usan estas expresiones: D. E. desviación estándar, IC95% (Media) intervalo de confianza de 95% para la media o promedio, K–W Kruskal y Wallis.
Aspectos éticos
Los investigadores explicaron a cada paciente y a su acudiente los siguientes aspectos del trabajo: a) la investigación; b) las alternativas terapéuticas disponibles; c) las ventajas y desventajas de participar en la investigación; d) los riesgos que tenía al participar en el proyecto. Cada acudiente y paciente leyeron y firmaron el consentimiento informado. El Comité de Ética del Centro de Investigaciones Médicas de la Facultad de Medicina de la Universidad de Antioquia aprobó el proyecto y el consentimiento informado.
RESULTADOS
Se evaluaron 135 menores de 18 años de edad y solo 79 cumplieron con los criterios de inclusión. Los otros 56 no entraron al estudio porque no se comprometieron a asistir a los controles diarios de los tres primeros días de tratamiento, por dificultades económicas y ocupación de los padres.
Se asignaron a la intervención todos los 79 sujetos y todos recibieron el tratamiento previsto: 38 recibieron primaquina en dosis de 1,17 mg/kg por 3 días (grupo 1,17–3) y 41 en dosis de 0,50 mg/kg por 7 días (grupo 0,50–7). La intervención se mantuvo en todos los sujetos. En el seguimiento inicial de 28 días (evaluación de la eficacia del tratamiento para curar el ataque agudo) no hubo pérdidas. En el seguimiento posterior de 90 días (evaluación de la eficacia del tratamiento para prevenir las recurrencias) hubo seis pérdidas, todas en el grupo 0,50–7.
Los hombres fueron mayoría en los grupos. La edad varió entre 10 y 17 años. Tuvieron antecedentes de malaria en el último año 26% de los niños. El número de episodios palúdicos en el último año varió entre uno y cinco (p > 0,05). Los meses transcurridos desde elúltimo episodio (del previo al actual) fueron de 2 a 3 (p > 0,05). Los días de evolución del ataque malárico actual fueron 4,9 ± 3,4 (IC95% 3,9 a 5,8), sin diferencia entre grupos (p > 0,05).
En el conjunto de 79 sujetos, los síntomas más frecuentes en el momento del ingreso fueron fiebre, dolor de cabeza, escalofrío, sudoración (90–100%), dolor osteomuscular (68%), náusea (79%) y vómito (53%). Fue elevada la frecuencia de síntomas respiratorias (tos 47% y dificultad para respirar 21%). Los signos vitales estaban en el intervalo fisiológico, excepto la frecuencia el pulso, que estuvo alta en ambos grupos (95/minuto). Los signos más frecuentes fueron astenia (95%), palidez (63%) (conjuntival 21% o palmar 42%), hepatomegalia (37%), dolor abdominal al palpar (32%), esplenomegalia (11%) e ictericia (5%).
Curación del ataque agudo de paludismo vivax
Un grupo de pacientes tomó la cloroquina y la primaquina por tres días (CQ–3 + PQ–3 días), mientras que el otro grupo tomó la cloroquina por tres días y la primaquina por siete días (CQ–3 + PQ–7 días); ambos grupos tomaron ambos medicamentos desde el primer día. Todos los pacientes de ambos grupos se curaron de su paludismo agudo. La curación fue rápida, de tal forma que a las 24 horas de haber terminado de tomar la cloroquina todos estaban afebriles y sin parásitos.
Todos los pacientes permanecieron sin síntomas, signos y parásitos hasta el control del día 28, cuando empezó un seguimiento adicional de 90 días, para completar un total de 120 días, en los que se observó la incidencia de recurrencias.
Lo anterior implica que la combinación cloroquinaprimaquina fue siempre eficaz para curar el ataque agudo, independientemente de la dosis de primaquina (que varió) y con la dosis fija de cloroquina usada (dosis total: 25 mg/kg en tres fracciones, una cada 24 horas).
Eventos adversos
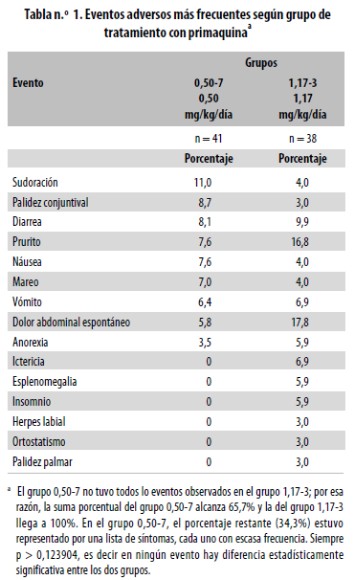
En los primeros siete días de seguimiento las quejas de los pacientes fueron frecuentes, aunque en general leves y siempre pasajeras; esas quejas se confundieron siempre con síntomas propios de la malaria: fiebre subjetiva, malestar, debilidad, cansancio, cefalea y anorexia. Nunca hubo ninguna queja grave ni que obligara a la intervención médica para instaurar untratamiento adicional o a hospitalizar al paciente; nunca dejaron secuelas manifiestas.No hubo diferencia estadísticamente significativa en la clase y frecuencia de eventos adversos según el grupo de tratamiento con PQ (Ver Tabla 1). Sin embargo, conviene señalar que algunos eventos (ictericia, esplenomegalia, palidez palmar, herpes labial, ortostatismo e insomnio) no ocurrieron en el grupo 0,50–7 y tuvieron frecuencias de 3 a 7% en el grupo 1,17–3.
En el grupo 1,17–3, que tomó dosis diarias muy altas de primaquina, el nivel de metahemoglobina, medido a las 24 horas de haber terminado de tomar la cloroquina y la primaquina, fue de 4,59 ± 3,15%. El valor mínimo fue 0,65% y el máximo, 10,53%. No se hallaron síntomas ni signos relacionados con metahemoglobinemia.
Frecuencia de recurrencias palúdicas según el tratamiento con primaquina
La pérdida de pacientes durante el seguimiento fue así; ninguna a los 60 días y 6 a los 120 días, todas en el grupo 0,50–7.
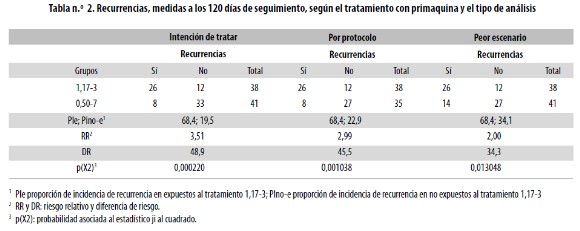
La frecuencia de recurrencias según la dosis de primaquina fue estadísticamente significativa tanto a los 60 como a los 120 días de seguimiento (p = 0,000002 y p = 0,000033, respectivamente): 52,6% en el grupo 1,17–3 frente a 4,9% en el grupo 0,50–7 al día 60; 68,4% en el grupo 1,17–3 frente a 22,8% en el grupo 0,50–7 al día 120. La razón entre las proporciones de recurrencias al día 60 fue 10,7 (por cada recurrencia en el grupo 0,50–7 hubo 10,7 recurrencias en el grupo 1,17–3. La razón entre las proporciones de recurrencias al día 120 fue 3,0. Esto indica que la gran mayoría de la recurrencias (78%) en el grupo 1,17–3 sucedió en los primeros 60 días de seguimiento, mientras que en el grupo 0,50–7 solo ocurrió el 22% de ellas en ese lapso de 60 días.
El estudio de las recurrencias acumuladas hasta el día 120 comparó los dos tratamientos según tres formas de análisis. Los resultados ratifican plenamente lo ya descrito en cuanto a la superioridad neta del tratamiento 0,50–7: con las tres técnicas, la proporción de incidencia de recurrencias es estadísticamente menor en el grupo 0,50–7 que en el otro (Ver Tabla 2). También se puede observar que siempre el valor del riesgo relativo (RR) es mayor que uno, como consecuencia de la mayor proporción de incidencia enlos expuestos al tratamiento 1,17–3 en niños, comparada con la ocurrida en el otro.
El tiempo (días) entre el ataque agudo y la primera recurrencia fue de 85 ± 46 en el grupo 1,17–3 y de 135 ± 51 en el grupo con 0,50–7 (p = 0,001) y entre la primera y la segunda recurrencias fue 47 ± 13 días en el grupo 1,17–3 y 62 ± 59 días en el grupo 0,50–7 (p = 0,784).
El número de recurrencias por persona varió entre una y tres y hubo diferencia significativa entre los grupos: 1,05 ± 0,85 recurrencias con 1,17–3 y 0,31 ± 0,68 con 0,50–7 (p = 0,003).
DISCUSIÓN
El cuadro clínico observado en estos pacientes fue similar, en general, a lo conocido para la malaria por P. vivax y por P. falciparum. Llamamos la atención sobre la elevada frecuencia de dolor osteomuscular en ambos grupos, hallazgo reiterado.24 También la llamamos sobre la escasa ocurrencia de dolor abdominal comparado con lo que sucede en adultos,7 que quizás se deba a las limitaciones de los niños para expresarlo en forma verbal. Asimismo, señalamos la elevada frecuencia de síntomas respiratorios (tos y dificultad para respirar). No fue claro si esto se debía a la presencia concomitante de infección respiratoria, aunque no pareció que fuera así. Por último, queremos resaltar la elevada frecuencia de náusea y vómito, lo cual puede tener repercusiones en el tratamiento (no tomar o vomitar los medicamentos), que aquí se descarta porque hubo supervisión estricta de estos eventos.
En cuanto a los signos clínicos en el momento del ingreso, vale destacar la presencia de palidez marcada en la conjuntiva o en las palmas, que podría indicar anemia, la cual es frecuente en los niños de estas zonas maláricas. En El Bagre, en 250 niños y adultos con malaria y 146 sin ella, se encontró anemia en 26% de los maláricos (entre aquellos con P. vivax afectó a 40% y entre los infectados por P. falciparum, a 60%) y en 17% de los no maláricos; entre los maláricos, la anemia afectó al 25% de los mayores de 15 años y al 30% de los menores de esa edad.25 En 82 niños con malaria vivax, en Turbo, se halló anemia en 53%.24 En El Bagre y Turbo (Antioquia, Colombia), en 2005–2006, en 93 niños de 4–10 años, se hallaron riesgos de desnutrición crónica en 52%, global en 47% y aguda en 15%; hubo parásitos intestinales patógenos en 80%; la hemoglobina (promedio) fue de 10,3 g/dL.26 En Medellín, en pacientes con malaria y hospitalizados por causa de ella, 45% presentó anemia y 5% anemia grave (menos de 5 g de hemoglobina por dL).27
Llama la atención la escasa presencia de fenómenos hemorrágicos porque es muy frecuente que haya trombocitopenia (menos de 150.000 plaquetas/μL) en los pacientes con malaria no complicada: nosotros informamos 8% de frecuencia en sujetos con paludismo vivax, en Turbo,28 que luego se informó en 71% de trombocitopenia: 77% de los casos por P. vivax y 63% de aquellos con P. falciparum presentaron trombocitopenia franca.29 En Medellín, en pacientes con malaria y hospitalizados por causa de ella, 36% presentó trombocitopenia, que fue el diagnóstico clínico más frecuente de todos, y predominó en los sujetos con P. vivax.27
Los eventos adversos asociados al tratamiento cloroquina–primaquina en malaria vivax fueron escasos, leves y pasajeros lo que concuerda con otros hallazgos nuestros 6,7,9,24,28 y ajenos.12,13,15 Pensamos que es conveniente administrar simultáneamente la cloroquina y la primaquina, en vez de hacerlo en forma secuencial, porque así se reduce el tiempo de tratamiento y no aumentan los eventos adversos, como se encontróaquí y se había informado antes.7,24 Las dosis diarias altas de primaquina (1,17–3) no se asociaron con eventos adversos más graves que las dosis medias (0,50–7), lo que corrobora informes anteriores.30 La metahemoglobinemia no fue un problema importante en los niños de ninguno de los dos grupos (1,17–3 y 0,50–7), tal como sucedió en adultos.30 Por eso afirmamos que es seguro administrar PQ en un lapso menor de 14 días, por ejemplo, en 7 días, si se satisfacen completamente algunas condiciones críticas: actividad normal de la G6PD, no estar en embarazo y tomarla con alguna comida (inclusive liviana).30
Una reciente revisión Cochrane sobre el uso de primaquina para prevenir las recurrencias de P. vivax señaló que 'los eventos adversos fueron escasamente informados, con tres estudios que informaron sobre brote cutáneo, vértigo, cefalea, dolor abdominal o náusea, y otros dos que reportaron que la primaquina fue bien tolerada'.31 Esto sugiere que los eventos adversos asociados a la primaquina pueden no ser graves pero que es necesario evaluarlos más estricta y sistemáticamente para obtener conclusiones más claras y sólidas. A pesar de las dosis diarias altas de primaquina no hallamos niveles de metahemoglobina mayores de 11% ni manifestaciones clínicas asociadas a esos niveles. En ningún paciente hubo manifestaciones gastrointestinales después de tomar la primaquina y debe insistirse en que el medicamento se tomó con alimentos, como se recomienda.30,32 El nivel normal de metahemoglobina en la sangre es de 1%. Cuando supera el 2% se habla de metahemoglobinemia. Los niveles de metahemoglobina menores de 20% no provocan signos ni síntomas en la mayoría de las personas. 33–35 A pesar de que la primaquina no mostró un problema importante de eventos adversos, hay que extremar las medidas preventivas y de vigilancia y recordar que en la población de Urabá, tanto en hombres sanos como en pacientes con malaria, la frecuencia de déficit de G6PD es de 14,8% y 9,5%, respectivamente.36
En cuanto a la curación del ataque agudo de malaria vivax con cloroquina–primaquina, los resultados confirman lo que siempre hemos hallado: tanto la cloroquina en monoterapia6 como su combinación con primaquina son absolutamente eficaces para eliminar en 72 horas, la fiebre y los parásitos, ya sea que se usen en forma secuencial (cloroquina los tres primeros días y primaquina a partir del día cuarto),9 o que se administren los dos medicamentos juntos desde el primer día;7,24 esa eficacia la hemos encontrado usando siempre cloroquina en la dosis estándar de 25 mg/kg/día dada en tres fracciones (10 mg/kg el día 1 y 7,5 mg/kg los días 2 y 3) y usando la primaquina en dosis variables tanto diarias como totales: la dosificación estándar 0,25 mg/kg/día por 14 días,37 en dosis diarias estándares pero totales menores que la estándar37 y en dosis diarias que fueron dos a cinco veces la estándar, pero con dosis total igual o menor que la estándar (Carmona–Fonseca J: datos en proceso de publicación). En niños de 4–10 años, de El Bagre y Turbo, usamos la monoterapia con cloroquina en dosis estándar (dosis total 25 mg/kg peso corporal, fraccionada en tres días: inicial, 10 mg/kg; luego cada 24 horas 7,5 mg/kg en cada uno) para tratar paludismo vivax no complicado y obtuvimos curación en el 100% de los casos (Carmona–Fonseca J: en proceso de publicación).
En los niños los síntomas palúdicos pueden ser graves y desarrollarse rápido. El deterioro se relaciona con el acelerado incremento de la parasitemia, que posiblemente tenga que ver con la menor masa de eritrocitos en los niños.38,39 Por tal situación urge contar con un tratamiento eficaz para controlar el ataque agudo y los datos de esta investigación confirman que cloroquina–primaquina es un esquema con eficacia del 100% en esta zona. Este dato concuerda con los informes de 2006 de Sucre, Venezuela, en niños hospitalizados por malaria vivax,40 de Tailandia en 2004 en pacientes ambulatorios41 y de Azerbaiján en 2004, también en pacientes ambulatorios:42 en Venezuela, el 100% se curó con cloroquina por 3 días y primaquina por 14 días; en Tailandia el 100% se curó con solo cloroquina por 3 días; y en Azerbaiján la cloroquina fue 100% eficaz en los primeros 14 días y la combinación con primaquina fue eficaz durante 28 días.
Para la prevención de las recurrencias, hemos evaluado la eficacia de la primaquina en varios esquemas de dosificación diaria y total y hemos hallado que con la
dosis diaria estándar (0,25 mg/kg/día) dada por 14 días (esquema estándar) se obtuvieron los mejores resultados (recurrencias: 18%), comparados con dosis totales menores que la estándar (tasa de recurrencia mayor de 35%)37 y con dosis totales iguales o menores que la estándar (tasa de recurrencia mayores de 40%) (Carmona–Fonseca J: datos en proceso de publicación).
En niños, el esquema de primaquina 1,17 mg/kg/día por 3 días tuvo significativamente más recurrencias que el esquema 0,50 mg/kg/día por 7 días (68,4% frente a 34,2%). La mayor eficacia de este último esquema también se expresó en el mayor tiempo transcurrido entre el ataque agudo y la primera recurrencia (129 ± 53 días en niños con 0,50–7 y 85 ± 46 días en niños con 1,17–3) y en el menor número de recurrencias por persona (0,47 ± 0,73 en niños con 0,50–7 contra 1,05 ± 0,85 de recurrencias en niños con 1,17–3).
Este trabajo comparó la misma dosis total de primaquina en función del tiempo en el que se administró (tres frente a siete días) y se halló que la frecuencia de recurrencias, a los 60 y a los 120 días, resultó significativamente menor en el grupo que la recibió en siete días. Es necesario comparar el desempeño del tratamiento 0,50–7 en niños con lo que suceda en adultos y comparar en niños el tratamiento 0,50–7 con el esquema estándar 0,25–14 (0,25 mg/kg/día por 14 días). En un estudio nuestro, en adultos, comparamos la eficacia antirrecurrencias de la dosis total estándar de PQ (210 mg) dada en tres y en catorce días y fue estadísticamente significativa la superioridad del tratamiento en 14 días, en relación de recurrencias a los 120 días de 1:4 (datos en proceso de publicación). En Brasil, en mayores de 12 años, el esquema 0,50–7 mostró una eficacia estadísticamente similar al esquema 0,25–14 y hubo cero recurrencias en seis meses de seguimiento.12 Esta frecuencia de recurrencias en seis meses en Brasil con el esquema 0,50–7 (cero) es absolutamente inferior a la registrada por nosotros con el mismo tratamiento en cuatro meses (34,2%). Es posible que ello se deba a las importantes diferencias regionales en la respuesta a PQ por parte de P. vivax, según se ha informado. En Tailandía, el riesgo de recurrencias fue dos veces el de Brasil y diez veces el de India,43 lo que explica el hecho de que en India 75 mg para un adulto (0,25 mg/kg/día por 5 días) seaneficaces para prevenir las recurrencias en 80–90% de los pacientes.44 Los esquemas regionales de PQ debieran considerar factores como el peso corporal, la proporción de recurrencias naturales y la respuesta local a la PQ.43 Es necesario explorar la administración de PQ en altas dosis y durante períodos variables de tiempo,44 asunto que hemos señalado y trabajado.7,24,30 En India, se evaluó la eficacia de la primaquina para evitar las recurrencias de P. vivax comparando un grupo (n = 723) que solo recibió cloroquina con otro que tomó esta más primaquina (n = 759) en dosis de 0,25 mg/kg/día por solo 5 días; ambos grupos fueron seguidos un año; la proporción de recurrencias con fiebre fue estadísticamente similar (p = 0,53): 8,6% en el grupo con solo cloroquina y 6,5% en el grupo cloroquinaprimaquina 45
En conclusión: a) la proporción de recurrencias a los 120 días en niños con el esquema 1,17–3 fue como mínimo el doble que la ocurrida en niños con el esquema 0,50–7 y, por ello, no se debe usar ese esquema de tres días; b) ) entre niños con diferente dosis diaria pero igual dosis total de primaquina hubo diferencia significativa en la proporción de recurrencias; c) el tiempo de administración de una misma dosis total de primaquina influye en su eficacia antirrecurrencias: a menos días, menor eficacia; d) los eventos adversos asociados al tratamiento cloroquina–primaquina fueron leves y pasajeros y nunca amenazaron la salud o la vida de los pacientes; e) no parece haber inconveniente para el uso simultáneo de cloroquina y primaquina en niños afectados por malaria vivax.
AGRADECIMIENTOS
Al personal de los puestos de malaria de Turbo por su ayuda. A los pacientes por su participación. A quienes hicieron y a quienes ayudaron en el trabajo de campo.
CONFLICTO DE INTERESES
Ninguno.
FINANCIACIÓN
Esta investigación fue financiada por Colciencias (código 1115–04–16497; contrato RC–253–20043; código 1115–04–16388; contrato RC–339–2004), Dirección Seccional de Salud de Antioquia (DSSA) y Universidad de Antioquia.
REFERENCIAS BIBLIOGRÁFICAS
1. WHO. World Health Organization (WHO). Guidelines for the treatment of malaria. Documento WHO/HTM/MAL/2006.1108. Geneva: WHO; 2006. [ Links ]
2. Carmona–Fonseca J. La malaria en Colombia, Antioquia y las zonas de Urabá y Bajo Cauca: panorama para interpretar la falla terapéutica antimalárica. Parte 1. Iatreia. 2003; 16: 299–318. [ Links ]
3. Carmona–Fonseca J. La malaria en Colombia, Antioquia y las zonas de Urabá y Bajo Cauca: panorama para interpretar la falla terapéutica antimalárica. Parte 2. Iatreia. 2004; 17: 34–53. [ Links ]
4. Colombia, Ministerio de Salud. Guía de atención clínica para el diagnóstico y tratamiento de la malaria. Bogotá: Minsalud; 1999. [ Links ]
5. Colombia, Ministerio de la Protección Social. Plan de implementación de combinaciones terapéuticas con derivados de artemisinina en áreas de alta transmisión de malaria en Colombia. Bogotá: Minprotección; 2006. [ Links ]
6. Blair S, Tobón A, Echeverri M, Álvarez G, Carmona–Fonseca J. Adecuada respuesta clínica y parasitológica de Plasmodium vivax a la cloroquina en Colombia (Turbo, Antioquia), 2001. Infectio 2002; 6: 21–26. [ Links ]
7. Carmona–Fonseca J, Álvarez G, Blair S. Malaria por Plasmodium vivax: curación del ataque agudo con tres dosis diferentes de primaquina y dosis fija de cloroquina. Antioquia, Colombia, 2003–2004. Biomédica 2006; 26: 353–365. [ Links ]
8. Castillo C, Osorio L, Palma G. Assessment of therapeutic response of Plasmodium vivax and Plasmodium falciparum to chloroquine in a malaria transmission free area in Colombia. Mem Inst Oswaldo Cruz 2002; 97: 559–562. [ Links ]
9. Lacharme L, Carmona–Fonseca J, Tobón A, Blair S. Respuesta de P. vivax al esquema terapéutico cloroquina–primaquina en Zaragoza y Turbo, Colombia, 1998. Infectio 1998; 2: 90–94. [ Links ]
10. Phillips E, Keystone J, Kain K. Failure of combined chloroquine and high dose primaquine therapy for Plasmodium vivax malaria acquired in Guyana, South America. Clin Infect Dis 1996; 23: 1171–1173. [ Links ]
11. Ruebush T, Zegarra J, Cairo J, Andersen E, Green M, Pillai D, et al. Chloroquine–resistant Plasmodium vivax malaria in Peru. Am J Trop Med Hyg 2003; 69: 548–552. [ Links ]
12. Abdon N, Pinto A, Silva R, de Souza J. Avaliação da resposta aos esquemas de tratamento reduzidos para malária vivax. Rev Soc Bras Med Trop 2001; 34: 343–343. [ Links ]
13. Da Silva R, Pinto A, Calvosa V, de Souza J. Esquemas terapêuticos encurtados para o tratamento de malária por Plasmodium vivax. Rev Soc Bras Med Trop 2003; 36: 235–239. [ Links ]
14. Pinto A, Azevedo C, da Silva J, de Souza J. Rev Inst Med Trop Sao Paulo 2003; 45: 327–331. [ Links ]
15. Pinto A, Ventura A, Calvosa V, Silva Filho M, Santos M, Silva R, et al. Clinical efficacy of four schemes for vivax malaria treatment in children [en Portugués]. J Pediatr (Rio J) 1998; 74: 222–227. [ Links ]
16. Baird J, Hoffman S. Primaquine therapy for malaria. Clin Infect Dis 2004; 39: 1336–1345. [ Links ]
17. Baird J, Rieckmann K. Can primaquine therapy for vivax malaria be improved? Trends Parasitol 2003; 19:115–120. [ Links ]
18. Martínez–Bencardino C. Muestreo. Bogotá: Ecoe; 1984: 45–47 [ Links ]
19. Beutler E. Glucose–6–phosphate dehydrogenase deficiency. Diagnosis, clinical and genetic implications. Am J Clin Pathol 1967; 47: 303–311. [ Links ]
20. OMS. Organización Mundial de la Salud. Normalización de las técnicas de estudio de la glucosa 6–fosfato deshidrogenasa. Ginebra: OMS; 1967. Serie Informes Técnicos 366. [ Links ]
21. López–Antuñano F. Diagnóstico microscópico de los parásitos de la malaria en la sangre. En: López–Antuñano F, Schmunis G, eds. Diagnóstico de malaria Volumen 512. Washington: OPS–OMS; 1988. p. 39–50. [ Links ]
22. Hulley S, Cummings S, Browner W, Grady D, Hearst N, Newman T. Designing Clinical Research. 2 ed. Philadelphia: Lippincott Williams & Wilkins; 2001. p.143–174. [ Links ]
23. Lozano J, Dennis R. El experimento clínico. In: Ruiz A, Morillo L, eds. Epidemiología clínica Investigación clínica aplicada. Bogotá: Editorial Panamericana; 2004. p. 233–64. [ Links ]
24. Carmona–Fonseca J, Uscátegui R, Correa A. Malaria vivax en niños: aspectos clínicos y respuesta a la cloroquina. Colombia Médica 2008; 39: 364–377. [ Links ]
25. Blair S, Álvarez G, Campuzano G. Relación entre anemia y malaria en una población rural de Colombia. Boletín Dir Malariol Saneam Amb (Venezuela) 1997; 37: 7–13. [ Links ]
26. Carmona–Fonseca J, Uscátegui R, Correa A. Parasitosis intestinal en niños de zonas palúdicas de Antioquia (Colombia). Iatreia 2009; 22: 1–10. [ Links ]
27. González L, Guzmán M, Carmona–Fonseca J, Lopera T, Blair S. Características clínico–epidemiológicas de 291 pacientes hospitalizados por malaria en Medellín (Colombia). Acta Med Colomb 2000; 25: 163–170. [ Links ]
28. Echeverri M, Tobón A, Álvarez G, Carmona J, Blair S. Clinical and laboratory findings of Plasmodium vivax malaria in Colombia, 2001. Rev Inst Med Trop São Paulo 2003; 45: 29–34. [ Links ]
29. Ríos–Orrego A, Alvarez–Castillo T, Carmona–Fonseca J, Blair–Trujillo S. Evolución temporal de las plaquetas y los anticuerpos antiplaquetarios en pacientes de área endémica con malaria no complicada. An Med Interna (Madrid) 2005; 22: 561–568 [ Links ]
30. Carmona–Fonseca J, Alvarez G, Maestre A. Methemoglobinemia and adverse events in Plasmodium vivax malaria patients associated with high doses of rimaquine treatment. Am J Trop Med Hyg 2009; 80: 188–193. [ Links ]
31. Galappaththy G, Omari A, Tharyan P. Review: Primaquine for preventing relapses in people with Plasmodium vivax malaria. The Cochrane Database of systematic Reviews 2007; Issue 1. [ Links ]
32. Clayman C, Arnold J, Hochwald R, Yount E, Edgcomb J, Alving A. Toxicity of primaquine in Caucasian. JAMA 1952; 149: 1563–1568. [ Links ]
33. Coleman M, Coleman N. Drug–induced methaemoglobinaemia. Drug Saf 1996; 14: 394–405. [ Links ]
34. Hall A, Kulig K, Rumack B. Drug–and chemicalinduced methaemoglobinaemia. Med Toxicol 1986; 1: 253–260 [ Links ]
35. van Heijst N. Metahemoglobinemia. IPCSIntox Databank [sitio en internet]. [Consulta: 22 junio 2005]. Disponible en: http://www.intox.org/databank/ocuments/treat/treats/trt40–s.htm. Consultada el 15 de abril de 2009. [ Links ]
36. Carmona–Fonseca J, Álvarez G, Ríos A, Vásquez M. Deficiencia de glucosa 6–fostato deshidrogenasa en hombres sanos y en pacientes maláricos; Turbo (Antioquia, Colombia). Rev Bras Epidemiol 2008; 11: 252–265. [ Links ]
37. Álvarez G, Piñeros J, Tobón A, Ríos A, Maestre A, Blair S, et al. Efficacy of three chloroquine–primaquine regimens for treatment of Plasmodium vivax malaria in Colombia. Am J Trop Med Hyg 2006; 75: 605–609. [ Links ]
38. Chongsuphajaisiddhi T. Malaria in paediatric practice. En: Wernsdorfer W, McGregor I, eds. Malaria: principles and practice of malariology. Edinburgh: Churchill Livingstone; 1988: 889–912. [ Links ]
39. Brabin B, Ganley Y. Imported malaria in children in the UK. Arch Dis Child 1997; 77: 76–81. [ Links ]
40. Rodríguez–Morales A, Sánchez E, Vargas M, Piccoo C, Colina R, Arria M. Anemia and thrombocytopenia in children with Plasmodium vivax malaria. J Trop Pediatrics 2006; 52: 49–51. Disponible en: http://cat.inist.fr/?aModele=afficheNcpsidt=17536051. Consultada el 15 de abril de 2009. [ Links ]
41. Vijaykadga S, Rojanawatsirivej C, Congpoung K, Wilairatana P, Satimai W, Uaekowitchai C, et al. Assessment of therapeutic efficacy of chloroquine for vivax malaria in Thailand. Southeast Asian J Trop Med Public Health 2004; 35: 566–569. [ Links ]
42. Valibayov A, Abdullayev F, Mammadov S, Gasimov E, Sabatinelli G, Kondrachine A, et al. Clinical efficacy of chloroquine followed by primaquine for Plasmodium vivax treatment in Azerbaijan. Acta Trop 2003; 88: 99–102. [ Links ]
43. Goller J, Jolley D, Ringwald P, Biggs B. Regional differences in the response of Plasmodium vivax malaria to primaquine as anti–relapse therapy. Am J Trop Med Hyg 2007; 76: 203–207. [ Links ]
44. Kshirsagar N. Malaria: anti malarial resistance and policy ramifications and challenges. J Postgrad Med 2006; 52: 291–263. [ Links ]
45. Yadav R, Ghosh S. Radical curative efficacy of fiveday regimen of primaquine for treatment of Plasmodium vivax malaria in India. J Parasitol 2002; 88: 1042–1044 [ Links ]
Recibido: 15 de abril de 2009
Aceptado: 13 de octubre de 2009