Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.23 no.2 Medellín Apr./June 2010
INVESTIGACIÓN ORIGINAL
El DHEAS incrementa la expresión de GluR2/3 y GLUR2 del receptor AMPA en el hipocampo de ratones C57/BL6
DHEAS increases levels of GluR2/3 and GluR2, AMPA receptor subunits, in C57BL/6 mice hippocampus
Carolina Ospina Villegas; Diego Sepúlveda–Falla; Álvaro Andrés Barrera–Ocampo; Gloria Patricia Cardona–Gómez
Área de Neurobiología Celular y Molecular, Grupo de Neurociencias de Antioquia, SIU, Facultad de Medicina, Universidad de Antioquia. Correspondencia: Gloria Patricia Cardona patricia.cardona@neurociencias.udea.edu.co
RESUMEN
El DHEAS es un neuroesteroide con efecto neuromodulador de la transmisión sináptica y en la neuroprotección, sin embargo las vías moleculares a través de las cuales se inducen estos cambios no están completamente claras. Como varios de los neuroesteroides actúan a través de los recetores ionotrópicos de glutamato, se evaluó el efecto del DHEAS en las subunidades GluR2 y GluR3 del receptor AMPA para esclarecer sus efectos. Con este fin se administró DHEAS o una sustancia control durante 7 días a ratones C57/BL6. La expresión de las subunidades se evaluó por Western blotting.
Los resultados presentados muestran que la administración prolongada de 40mg/kg/día de DHEAS a ratones C57/BL6 produce un incremento en los niveles de proteína de las subunidades GluR2/3 y GluR2 del receptor AMPA en el hipocampo.
Dado el papel específico que juega la subunidad GluR2 del receptor AMPA en el control de la entrada de calcio durante los procesos de muerte celular y de plasticidad sináptica, este hallazgo contribuye al estudio de los neuroesteroides como una estrategia terapéutica relevante en enfermedades neurodegenerativas y eventos cerebrovasculares.
Palabras clave
AMPA, Cerebelo, Corteza, DHEA, DHEAS, GluR2/3, GluR2, Hipocampo, Hipotálamo
SUMMARY
Dehydroepiandrosterone sulfate (DHEA–S) is a neurosteroid that has effects such as neuromodulator of synaptic transmission and neuroprotection. The specific signaling pathways for these effects are not elucidated yet. Given that, some neurosteroids act through the activation of ionotropic glutamate receptors, therefore the effect of DHEA–S on the subunits GluR2 and GluR3 of the AMPA receptor was evaluated. Either DHEA–S or a control substance was administered to C57/BL6 mice. Subunit expression of the AMPA receptor was analyzed by Western blotting.
Results show that long–term DHEA–S administration to C57/BL6 mice, increases the protein levels of the subunits GluR2 and GluR2/3 of the AMPA receptors located in the hippocampus.
Due to the role of AMPA receptor, specifically GluR2 subunit in the regulation of intracellular calcium levels, cellular apoptosis, and synaptic plasticity, the study of neurosteroids as a therapeutic strategy in neurodegenerative diseases and cerebrovascular events is very relevant.
Key words
AMPA, Cerebellum, Cortex, DHEA, DHEA–S, GluR2, GluR2/3, Hippocampus, Hypothalamus
INTRODUCCIÓN
Los neuroesteroides son sustancias que se acumulan en el sistema nervioso de modo independiente de las fuentes esteroidogénicas de glándulas endocrinas, los cuales pueden ser sintetizados de novo en el sistema nervioso y actúan principalmente a través de la activación de receptores nucleares modificando la transcripción genética;1 sus efectos en el sistema nervioso en animales incluyen cambios comportamentales tales como la facilitación de procesos de aprendizaje y memoria asociados a un efecto antiamnésico.2 En el contexto celular, participan en la regulación del nivel y del flujo de calcio; también modulan la transmisión sináptica a través de sus efectos directos o indirectos sobre diferentes receptores de neurotransmisores.3
Entre los neuroesteroides se encuentra la Dehidroepiandrosterona (DHEA), hormona esteroidea que corresponde al mayor producto de secreción de la glándula suprarrenal; así mismo, también se encuentra su forma sulfatada, el sulfato de dehidroepiandrosterona (DHEAS).4 Ambas sustancias se destacan por estar frecuentemente asociadas con mecanismos de aprendizaje y memoria;5 varios de estos efectos se pueden atribuir a su capacidad para interactuar directamente con receptores involucrados en procesos sinápticos. Por ejemplo, el DHEAS actúa como antagonista del receptor GABAA al interactuar con el sitio de unión a los barbitúricos6 y puede potenciar la liberación de norepinefrina que es inducida por N–Metil–D–Aspartato (NMDA)7; su administración y la de sulfato de pregnenolona sulfato (PREGS, por sus siglas del inglés pregnenolone sulfate) revierte los efectos amnésicos de la escopolamina, la cual bloquea los receptores colinérgicos muscarínicos mediante el receptor sigma1 (σ1R, del inglés: sigma 1 receptor).8 Por su parte, la DHEA potencia la actividad eléctrica evocada por NMDA en las neuronas CA3 del hipocampo vía ó1R,9 e incrementa el calcio intracelular mediante la activación de los receptores de glutamato NMDA.10 Finalmente, tanto el DHEAS como la DHEA reducen la muerte neuronal inducida por el kainato en el hipocampo.11
Varios de los circuitos cerebrales de aprendizaje y memoria emplean las sinapsis glutamatérgicas como pivote funcional de excitación y plasticidad. Los receptores ionotrópicos de glutamato, NMDAR y el receptor α –amino–3–hidroxil–5–metil–4–isoxazolpropionato (AMPAR) son fundamentales para estos procesos debido a su variada respuesta moduladora y dinámica temporal.12 El DHEAS es considerado como un neuroesteroide excitatorio debido a que actúa como modulador de los receptores NMDA. Por otro lado, varios de los efectos atribuidos a los neuroesteroides, tales como la modulación sináptica y el efecto antiamnésico, pueden deberse a la activación de σ1R, los que a su vez incrementan las respuestas mediadas por NMDA.13 Se ha demostrado sin embargo que la variedad en las respuestas sinápticas glutamatérgicas provienen del delicado equilibrio regulador resultante de la organización e interacción entre los receptores inotrópicos de glutamato NMDAR y AMPAR.12 Entre los neuroesteroides, hasta el momento solo el PREGS ha mostrado algún efecto indirecto en la modulación de AMPA;14 siendo la DHEA y el DHEAS dos de los neuroesteroides con mayor impacto en el aprendizaje y la memoria, aún no se ha estudiado el efecto de éstos sobre el receptor AMPA, el cual, como receptor ionotrópico de glutamato, permite la entrada de sodio y de calcio al interior de la célula para favorecer su despolarización y permitir la activación de diferentes cascadas de señalización celular. Este receptor se compone de cuatro subunidades, numeradas de GluR1 a GluR4, las cuales se combinan en un heterotetrámero para la formación del canal. La presencia de la subunidad GluR2 define la permeabilidad del receptor a los diferentes iones.15
El objetivo de este estudio es establecer el efecto de la DHEA y el DHEAS sobre la expresión de las subunidades GluR2 y GluR3 del receptor de AMPA, debido a la importancia de este receptor en procesos de plasticidad sináptica, el aprendizaje, la memoria y la supervivencia neuronal; igualmente, se considera su estudio dada la repercusión que dichos procesos tienen sobre diferentes enfermedades neurodegenerativas y neurológicas.
MATERIALES Y MÉTODOS
Animales
Los experimentos se realizaron in vivo en ratones macho wild type de la cepa C57BL6 a través de la administración subcutánea de DHEAS durante siete días para la posterior medición de los niveles de proteína GluR2/3 y GluR2 en hipocampo, corteza, cerebelo e hipotálamo. Los ratones utilizados provinieron del Bioterio SPF de la Sede de Investigación Universitaria (SIU), de la Universidad de Antioquia, su peso se encontraba entre 29 – 39 g y se mantuvieron en un ciclo luz/oscuridad 12h/12h, con ingestión de agua y alimentos ad libitum. Todos los procedimientos se realizaron de acuerdo con las disposiciones del Comité de Ética de la Universidad de Antioquia, siguiendo la normativa Colombiana (ley 84 de 1989 y la resolución 8430 de 1993).
Administración del fármaco
Como fármaco se utilizó DHEAS (Sigma–Aldrich) diluido en DMSO al 5% y solución salina al 0,9%, el cual se administró diariamente durante siete días, por vía subcutánea, entre las 5:00 pm y las 7:00 pm, en dosis de 20 y 40 mg/kg/día. Se utilizaron como controles ratones inyectados con solución salina y DMSO al 5% (vehículo).
Después de 24 horas de la aplicación de la última dosis los ratones fueron sacrificados por dislocación cervical, y decapitados para permitir la extracción del cerebro, el cual se almacenó a –20 °C. Los cuerpos fueron evaluados realizando una cuidadosa necropsia para identificar el aspecto morfológico de testículos, glándulas suprarrenales y piel. Posteriormente se realizó la disección del hipocampo, hipotálamo, corteza y cerebelo. Cada una de las muestras fue colocada en tampón de lisis que contenía NaCl 150 mM, Tris pH 7,4 20 mM, Glicerol al 10%, EDTA 1mM y NP40 al 1%, luego de lo cual fueron homogenizadas para almacenarlas en alícuotas a –20 %C.
Western blotting
La cuantificación de proteínas se realizó a través del método de Bradford adicionando a cada muestra 200 µL del reactivo colorante con la subsecuente medición de la unión de éste a una proteína desconocida y comparándola con cantidades conocidas de albúmina de suero bovino. La medición se realizó a 595nm en un espectrofotómetro (Biorad). Las alícuotas con extracto de 30 µg de proteína total y tampón de carga (0,37M Tris; pH 6,8; 50% glicerol, 10% SDS; 0,5MDTT y azul de bromofenol) se separaron a través de electroforesis en geles de poliacrilamida–dodecilsulfato sódico al 10%.
Después de la electroforesis las proteínas fueron transferidas a una membrana de nitrocelulosa en un sistema de transferencia a 250 mA durante dos horas, la cual se incubó con albúmina de suero bovino al 5%, y luego se lavó con Tris Tween 20 buffer saline. (TTBS) y se incubó con el anticuerpo primario durante una noche. Los anticuerpos primarios utilizados fueron GluR2/3 policlonal a una dilución de 1:1.000 (Producido por Eva García Galloway en el Instituto Cajal de España, y que reconoce a ambas subunidades GluR2 y GluR3); anticuerpo GluR2 monoclonal (MAB 397 de Chemicon, 1:1.000), y β–actina (Sigma–Aldrich, 1:1.000). Después de lavar se incubó con anticuerpo secundario acoplado a peroxidasa durante una hora, y se lavaron nuevamente con Tris buffer saline (TBS). Finalmente, la membrana se reveló por quimioluminiscencia y la cuantificación de las proteínas se realizó por densitometría a través el software Quantity One (Bio Rad); para evitar variaciones entre experimentos todas las muestras fueron procesadas en paralelo.
Análisis estadístico
Los datos fueron analizados con ANOVA seguido de la prueba post–hoc de Tukey para las comparaciones múltiples empleando el software Prisma 4; los valores son presentados como la media ± Error Medio Estándar (EMS); el asterisco (*) indica diferencia estadísticamente significativa p<0,05.
RESULTADOS
La administración de DHEAS produce un efecto tejido–específico
Las dosis de DHEAS administradas, así como su vía de administración, no produjeron cambios morfológicos en las glándulas suprarrenales ni en los testículos (Figura 1); tampoco se observó fibrosis de la piel que impidiera la correcta absorción del tratamiento administrado durante siete días (datos no mostrados). Finalmente, las dosis utilizadas fueron suficiente para observar cambios en las áreas cerebrales de ratones C57BL/6 que fueron evaluadas.
La DHEAS modula los niveles de GluR2/3 diferencialmente según su localización en el cerebro
La administración de DHEAS en dosis de 20 y 40 mg/kg/día por 7 días modifica los niveles de expresión de la subunidad GluR2/3 de un modo específico según la estructura cerebral estudiada, efecto que fue dosisdependiente. Así, en hipocampo se observa un incremento estadísticamente significativo (p=0,0080) en los niveles de GluR2/3 a una dosis de 40 mg/kg/día respecto al control (figura 2A). En corteza cerebral, al comparar el grupo control respecto al tratado con 20mg/kg/día de DHEAS, se observa una disminución estadísticamente significativa en los niveles de GluR2/3, con una p=0,0185 (figura 2B).
Por otro lado, la administración de 20 mg/kg/día de DHEAS produjo una disminución significativa (p=0,0479) de GluR2/3 en el cerebelo de los animales tratados con respecto al grupo control (figura 2D); una tendencia similar fue observada en el hipotálamo, aunque este último efecto no mostró ser estadísticamente significativo (figura 2C). Basados en estos resultados se concentraron los análisis posteriores en el hipocampo, debido a que este tejido cuenta con una alta expresión de receptores ionotrópicos de glutamato y es una zona de gran susceptibilidad a la excitoxicidad por glutamato en procesos de neurodegeneración y envejecimiento.
La DHEAS incrementa los niveles específicos de la subunidad de GluR2 en el hipocampo
Al incrementar la sensibilidad del experimento con un anticuerpo específico para la subunidad GluR2, se observó que el tratamiento con 40 mg/kg/día de DHEAS durante 7 días produce un aumento estadísticamente significativo (p=0,0249) en la expresión de la subunidad GluR2 del receptor de AMPA en el hipocampo (figura 3A). Estos resultados sugieren que el aumento previamente observado en los niveles de proteína con el anticuerpo GluR2/3 es a expensas de la subunidad GluR2. En contraste, el mismo tratamiento condujo a una ligera disminución de los niveles de GluR2 en la corteza, lo cual concuerda con los resultados presentados anteriormente (figura 3B); dicha tendencia no muestra sin embargo, significancia estadística (p=0,1041).
DISCUSIÓN
En este estudio se observó el efecto de la administración de dosis bajas de DHEAS durante 7 días en la modulación de las subunidades del receptor AMPA, sin que se encontrara alguna modificación visible macroscópicamente en las gónadas y glándulas suprarrenales, siendo estas últimas el sitio de mayor producción de DHEA en el organismo. Esto confirma que el sistema nervioso central es autónomo en cuanto a producción y respuesta al DHEAS.16 Los resultados obtenidos muestran que el tratamiento con DHEAS produce un efecto diferencial sobre el nivel de expresión de la subunidad GluR2/3 en varias regiones del cerebro de ratón. La modulación diferencial de la subunidad GluR2/3 de un modo tejidoespecifico es apoyada por estudios previos en ratas.17 Más específicamente, la variación en la expresión de la subunidad GluR2 sugiere una regulación específica de la subunidad por parte de DHEAS.
La combinación de las diferentes subunidades de AMPA permite modular su función a través de la modificación de la permeabilidad a los diferentes iones. Un mecanismo posible es la edición del RNA de la subunidad GluR2, lo que lleva a que el DNA genómico que codifica para el segmento hidrofóbico II de ésta subunidad, región que forma el poro en el canal, contenga el codón CAG (para glutamina), mientras que el cDNA presente el codón CGG (para arginina).18 Se propone que la arginina cargada positivamente sería suficiente para excluir al catión divalente de calcio, lo que hace que los receptores AMPA que contengan la subunidad GLUR2 sean impermeables a este ión.19 La regulación de la permeabilidad al calcio en el receptor AMPA tiene implicaciones en la inducción del aprendizaje y la memoria,20 así como en los mecanismos fisiopatológicos de la isquemia.21 Se ha observado activación diferencial de las adenosindeaminasas dependientes de RNA (ADAR1, ADAR2 y RED2) en plasticidad sináptica e isquemia,22 específicamente se observa activación de ADAR2 en isquemia, situación que explica la regulación de GluR2 y consecuente vulnerabilidad a esta noxa.23
En nuestros resultados, el aumento de las subunidades GluR2 y GluR3 en hipocampo muestra una modulación del receptor AMPA ante la presencia del neuroesteroide DHEAS y sugiere un aumento del número de receptores AMPA impermeables al calcio disponibles en tejido hipocampal. Concretamente, el DHEAS puede modular la expresión de la subunidad GluR2 de una manera positiva, incrementando sus niveles en el hipocampo; es así como en modelos de isquemia se ha observado una disminución de los niveles de GluR2 en hipocampo, la cual, cuando es inducida por la isquemia, favorece la permeabilidad y la entrada de calcio a través de los receptores AMPA permeables a este ión en neuronas piramidales CA1, determinando, al menos parcialmente, su vulnerabilidad al calcio.21
Por otro lado, el decremento en las subunidades GluR2 y GluR3, específicamente GluR2 en regiones como la corteza o el cerebelo, podría correlacionarse con un papel del DHEAS en procesos de plasticidad como la LTP (del inglés: Long Term Potentiation) y la LTD (del inglés: Long Term Depression), en donde la modulación de los niveles y el tráfico de las subunidades del receptor AMPA por medio de la desensibilización, modulación a la baja e internalización, hacen parte de los principales procesos para su inducción y mantenimiento.24
Los cambios en los niveles de las subunidades de AMPA fueron observados con la administración de DHEAS por siete días, y no fueron confirmados con su forma no sulfatada, la DHEA, en la corteza cerebral, el hipotálamo y el cerebelo, pero si en el hipocampo (datos no mostrados), hallazgos compartidos por estudios previos que proponen que ambos neuroesteroides ejercen roles diferentes sobre la fisiología celular.25,26 Aunque las dosis empleadas no son iguales (20 mg/kg/día vs 40 mg/kg/ día), si son comparables, pues con DHEA administrada a 20 mg/kg/día se han observado efectos sobre supervivencia neuronal y plasticidad,27 sugiriendo una vez más que el aumento de GluR2/3 y GluR2 observado por la DHEA y el DHEAS en el hipocampo de ratón estaría involucrado en eventos de protección y plasticidad sináptica en modelos de lesión cerebral.
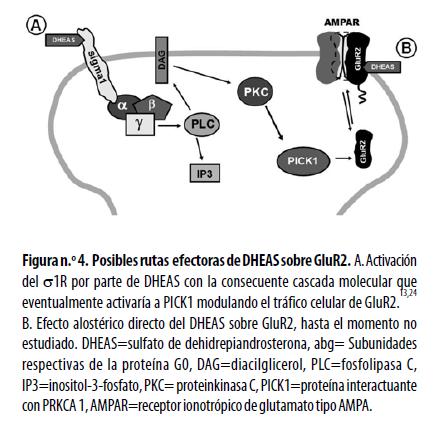
El aumento en los niveles de GluR2 podría explicar el efecto neuroprotector de DHEAS durante diferentes eventos de lesión celular, como la isquemia,23,28,29 pues el neuroesteroide disminuiría la permeabilidad de los receptores AMPA al calcio, evitando así la entrada excesiva del ión a la célula y la inducción de excitotoxicidad que conduce a la muerte neuronal, especialmente en el hipocampo, una región tan susceptible a este tipo de noxas.21 Sin embargo, no se ha descrito previamente una respuesta diferencial regional específica en la modulación de la subunidad GluR2 ante la administración de DHEAS, y no existen estudios previos que expliquen de manera directa o indirecta el efecto observado. Algunos estudios recientes muestran regulación de AMPA a través de el PREGS,14 neuroesteroide previo a la formación de la DHEA, el cual, según descripciones previas, señaliza por medio del ó1R.13 Es posible por lo tanto que el efecto producido por la DHEA y el DHEAS en el hipocampo observado en nuestro estudio medie su acción usando el σ1R, el cual, cascada abajo, activaría la Proteína Kinasa C (PKC), y finalmente, a través de ésta, a PICK1, proteína involucrada en el tráfico de la subunidad GluR2, tal como se ha sugerido en otras investigaciones13,24 y se muestra en el modelo hipotético en la figura 4 Adicionalmente, se debe explorar hasta qué punto la modulación de NMDA por parte de la actividad de AMPA se ve afectada por DHEAS, ya que estos dos receptores se autoregulan en procesos de plasticidad sináptica.30
En conclusión, el efecto obtenido con la administración de DHEAS sugiere que los efectos neuroprotectores y facilitadores del aprendizaje y la memoria podrían explicarse, al menos parcialmente, por el incremento de la subunidad GluR2, y por ende, en la disponibilidad de receptores AMPA impermeables al calcio. Estos hallazgos se convierten por lo tanto en un campo fértil de investigación para conocer más sobre los mecanismos de plasticidad sináptica y neuromodulación que sean útiles en el futuro como herramientas para el desarrollo de estrategias terapéuticas en enfermedades neurodegenerativas y eventos isquémicos cerebrovasculares.
AGRADECIMIENTOS
Adriana Restrepo (Médica Veterinaria) por su apoyo técnico en el bioterio SPF de la SIU Universidad de Antioquia. Esta investigación fue realizada bajo la financiación del CODI de la Universidad de Antioquia, proyecto #101105 y el apoyo del proyecto # 11150416372 de Colciencias.
REFERENCIAS BIBLIOGRÁFICAS
1. Mellon SH, Griffin LD. Neurosteroids: biochemistry and clinical significance. Trends Endocrinol Metab, 2002; 13(1): 35–43. [ Links ]
2. Vallee M, Mayo W, Koob GF, Le Moal M. Neurosteroids in learning and memory processes. Int Rev Neurobiol, 2001; 46: 273–320. [ Links ]
3. Gibbs TT, Russek SJ, Farb DH. Sulfated steroids as endogenous neuromodulators. Pharmacol Biochem Behav, 2006; 84(4): 555–567. [ Links ]
4. Baulieu EE, Robel P. Dehydroepiandrosterone (DHEA) and dehydroepiandrosterone sulfate (DHEAS) as neuroactive neurosteroids. Proc Natl Acad Sci U S A, 1998; 95(8): 4089–4091. [ Links ]
5. Dubrovsky BO. Steroids, neuroactive steroids and neurosteroids in psychopathology. Prog Neuropsychopharmacol Biol Psychiatry, 2005; 29(2): 169–192. [ Links ]
6. Maurice T, Phan VL, Urani A, Kamei H, Noda Y, Nabeshima T. Neuroactive neurosteroids as endogenous effectors for the sigma1 (sigma1) receptor: pharmacological evidence and theraapeutic opportunities. Jpn J Pharmacol, 1999; 81(2): 125–155. [ Links ]
7. Monnet FP, Mahe V, Robel P, Baulieu EE. Neurosteroids, via sigma receptors, modulate the [3H]norepinephrine release evoked by N–methyl–D–aspartate in the rat hippocampus. Proc Natl Acad Sci U S A, 1995; 92(9): 3774–3778. [ Links ]
8. Urani A, Privat A, Maurice T. The modulation by neurosteroids of the scopolamine–induced learning impairment in mice involves an interaction with sigma1 (sigma1) receptors. Brain Res, 1998; 799(1): 64–77. [ Links ]
9. Bergeron R, de MC, Debonnel G. Potentiation of neuronal NMDA response induced by dehydroepiandrosterone and its suppression by progesterone: effects mediated via sigma receptors. J Neurosci, 1996; 16(3): 1193–1202. [ Links ]
10. Compagnone NA, Mellon SH. Dehydroepiandrosterone: a potential signalling molecule for neocortical organization during development. Proc Natl Acad Sci U S A, 1998; 95(8): 4678–4683. [ Links ]
11. Kimonides VG, Khatibi NH, Svendsen CN, Sofroniew MV, Herbert J. Dehydroepiandrosterone (DHEA) and DHEA–sulfate (DHEAS) protect hippocampal neurons against excitatory amino acid–induced neurotoxicity. Proc Natl Acad Sci U S A, 1998; 95(4): 1852–1857. [ Links ]
12. Newpher TM, Ehlers MD. Glutamate receptor dynamics in dendritic microdomains. Neuron, 2008; 58(4): 472–497. [ Links ]
13. Monnet FP, Maurice T. The sigma1 protein as a target for the non–genomic effects of neuro(active)steroids: molecular, physiological, and behavioral aspects. J Pharmacol Sci, 2006; 100(2): 93–118. [ Links ]
14. Sedlacek M, Korinek M, Petrovic M, Cais O, Adamusova E, Chodounska H, Vyklicky L, Jr. Neurosteroid modulation of ionotropic glutamate receptors and excitatory synaptic transmission. Physiol Res, 2008; 57 Suppl 3: S49–S57. [ Links ]
15. Greger IH, Ziff EB, Penn AC. Molecular determinants of AMPA receptor subunit assembly. Trends Neurosci, 2007; 30(8): 407–416. [ Links ]
16. Maninger N, Wolkowitz OM, Reus VI, Epel ES, Mellon SH. Neurobiological and neuropsychiatric effects of dehydroepiandrosterone (DHEA) and DHEA sulfate (DHEAS). Front Neuroendocrinol, 2009; 30(1): 65–91. [ Links ]
17. Martin LJ, Blackstone CD, Levey AI, Huganir RL, Price DL. AMPA glutamate receptor subunits are differentially distributed in rat brain. Neuroscience, 1993; 53(2): 327–358. [ Links ]
18. Seeburg PH, Higuchi M, Sprengel R. RNA editing of brain glutamate receptor channels: mechanism and physiology. Brain Res Brain Res Rev, 1998; 26(2–3): 217–229. [ Links ]
19. Jonas P, Burnashev N. Molecular mechanisms controlling calcium entry through AMPA–type glutamate receptor channels. Neuron, 1995; 15(5): 987–990. [ Links ]
20. Duprat F, Daw M, Lim W, Collingridge G, Isaac J. GluR2 protein–protein interactions and the regulation of AMPA receptors during synaptic plasticity. Philos Trans R Soc Lond B Biol Sci, 2003; 358(1432): 715–720. [ Links ]
21. Soundarapandian MM, Tu WH, Peng PL, Zervos AS, Lu Y. AMPA receptor subunit GluR2 gates injurious signals in ischemic stroke. Mol Neurobiol, 2005; 32(2): 145–155. [ Links ]
22. Tanaka H, Grooms SY, Bennett MV, Zukin RS. The AMPAR subunit GluR2: still front and center–stage. Brain Res, 2000; 886(1–2): 190–207. [ Links ]
23. Peng PL, Zhong X, Tu W, Soundarapandian MM, Molner P, Zhu D, Lau L, Liu S, Liu F, Lu Y. ADAR2–dependent RNA editing of AMPA receptor subunit GluR2 determines vulnerability of neurons in forebrain ischemia. Neuron, 2006; 49(5): 719–733. [ Links ]
24. Greger IH, Esteban JA. AMPA receptor biogenesis and trafficking. Curr Opin Neurobiol, 2007; 17(3): 289–297. [ Links ]
25. Gil–ad I, Shtaif B, Eshet R, Maayan R, Rehavi M, Weizman A. Effect of dehydroepiandrosterone and its sulfate metabolite on neuronal cell viability in culture. Isr Med Assoc J, 2001; 3(9): 639–643. [ Links ]
26. Sicard F, Ehrhart–Bornstein M, Corbeil D, Sperber S, Krug AW, Ziegler CG, Rettori V, McCann SM, Bornstein SR. Age–dependent regulation of chromaffin cell proliferation by growth factors, dehydroepiandrosterone (DHEA), and DHEA sulfate. Proc Natl Acad Sci U S A, 2007; 104(6): 2007–2012. [ Links ]
27. Li Z, Cui S, Zhang Z, Zhou R, Ge Y, Sokabe M, Chen L. DHEA–neuroprotection and –neurotoxicity after transient cerebral ischemia in rats. J Cereb Blood Flow Metab, 2009; 29(2): 287–296. [ Links ]
28. Alsbo CW, Wrang ML, Moller F, Diemer NH. Is the AMPA receptor subunit GluR2 mRNA an early indicator of cell fate after ischemia? A quantitative single cell RT–PCR study. Brain Res, 2001; 894(1): 101–108. [ Links ]
29. Liu B, Liao M, Mielke JG, Ning K, Chen Y, Li L, El–Hayek YH, Gomez E, Zukin RS, Fehlings MG, Wan Q. Ischemic insults direct glutamate receptor subunit 2–lacking AMPA receptors to synaptic sites. J Neurosci, 2006; 26(20): 5309–5319. [ Links ]
30. Groc L, Choquet D. AMPA and NMDA glutamate receptor trafficking: multiple roads for reaching and leaving the synapse. Cell Tissue Res, 2006; 326(2): 423–438. [ Links ]
Recibido: agosto 25 de 2009
Aceptado: diciembre 22 de 2009