Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Iatreia
versão impressa ISSN 0121-0793
Iatreia v.23 n.3 Medellín jul./set. 2010
ARTÍCULO DE REVISIÓN
Tumores del estroma gastrointestinal (GIST): papel del cirujano en la era de la medicina molecular
Gastrointestinal stromal tumors (GIST): Role of the surgeon in the molecular medicine era
Juan Pablo Toro Vásquez1; Jorge Alberto Madrid Vélez2
1 Residente de Cirugía General, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
2 Cirujano Oncólogo, Profesor de Cirugía General, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. jamadrid@une.net.co
RESUMEN
Los tumores del estroma gastrointestinal (GIST, por la sigla en inglés de gastrointestinal stromal tumors) son neoplasias no epiteliales del tubo digestivo y del mesenterio caracterizadas por un patrón histológico y de inmunohistoquímica específico. Hasta 1983 se las clasificaba erróneamente como leiomiomas, leiomioblastomas y leiomiosarcomas; en ese año Mazur y Clark acuñaron el término ''tumor estromal''. Los GIST constituyen menos del 1% de los tumores malignos del tracto gastrointestinal y el 5% de los todos los sarcomas, con una incidencia de 0,68/100.000 habitantes. Se ha documentado que estos tumores son el resultado de mutaciones de los protoncogenes c-Kit y PDGFRα que alteran las cascadas de señales intracelulares. Pueden ocurrir desde el esófago hasta el ano y su forma de presentación clínica depende de la localización y el tamaño. Los GIST primarios son de tratamiento quirúrgico, mientras que en la fase avanzada se puede recurrir a la terapia molecular dirigida, luego del desarrollo del mesilato de imatinib. Hay controversia sobre las terapias adyuvante y neoadyuvante. El presente artículo es una actualización sobre los GIST con base en la literatura disponible al respecto.
Palabras clave
Cirugía laparoscópica, GIST, Mesilato de imatinib, Tumores del estroma grastrointestinal
SUMMARY
Gastrointestinal stromal tumors (GISTs) are a group of non-epithelial neoplasms that affect the gastrointestinal tract and the mesentery. They are characterized by specific histological and immunohistochemical patterns. Until 1983 GISTs were mistakenly classified as leiomyomas, leiomyoblastomas, and leiomyosarcomas. In that year Mazur and Clark introduced the term ''stromal tumor''. These neoplasms constitute less than 1% of gastrointestinal malignancies and 5% of all sarcomas. Their incidence is 0.68/100.000. It has been demonstrated that GISTs are the result of gain-of-function mutations of c-Kit and PDGFRα protoncogenes. They can appear anywhere from the esophagus to 1 Residente de Cirugía General, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia 1 Residente de Cirugía General, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. 2 Cirujano Oncólogo, Profesor de Cirugía General, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. Correspondencia: Jorge Madrid Vélez; jamadrid@une.net.co Recibido: agosto 10 de 2009 Aceptado: abril 26 de 2010 the anus. Clinical manifestations depend on their location and size. Treatment of primary GISTs is surgical but in the advanced stages they may be treated with imatinib mesylate, an effective, molecularly targeted therapy. Adjuvant and neoadjuvant therapy are a controversial issue. This article is an update on GISTs based on the available literature.
Key words
GIST, Imatinib mesylate, Laparoscopic surgery, Gastrointestinal stromal tumors
INTRODUCCIÓN
Los tumores del estroma gastrointestinal (GIST, por la sigla en inglés de gastrointestinal stromal tumors) pertenecen al grupo de los sarcomas de tejidos blandos1 y son los tumores mesenquimales más comunes del tracto gastrointestinal (TGI).2 Durante los últimos 30 años el desarrollo de la microscopía electrónica y las técnicas inmunohistoquímicas han permitido clasificar mejor este tipo de neoplasias y han definido claramente a los GIST como una entidad clínico-patológica individual.3 Sin embargo, para algunos patólogos y oncólogos, los términos leiomiosarcoma y GIST son intercambiables debido a que comparten un curso clínico similar.4 Actualmente hay un interés creciente en los GIST porque se los puede tratar efectivamente con un agente molecular específico. Desde hace varios años se viene utilizando un inhibidor molecular dirigido a los productos proteicos de los protoncogenes implicados en ellos, con resultados alentadores en estadios avanzados de la enfermedad.2,3 Sin embargo, la cirugía es el tratamiento de elección para los GIST primarios, y se está investigando intensamente el uso de la terapia combinada (adyuvante y neoadyuvante).
DEFINICIÓN
Los GIST son un grupo de tumores no epiteliales del tracto gastrointestinal y del mesenterio, caracterizados por un patrón histológico y de inmunohistoquímica específico.5 Histológicamente, son tumores de células fusiformes o epitelioides que pueden exhibir. características miogénicas o neurales o incluso carecer de diferenciación.1 Según las bases fisiopatológicas que implican una mutación del receptor KIT de tirosinaquinasa (TK, por la sigla en inglés de tyrosine kinase), algunos autores han propuesto la definición de ''tumor de células del marcapasos gastrointestinal''; esto se debe a la expresión de este receptor por la célula intersticial de Cajal (CIC) o célula marcapasos, que estaría implicada como precursora del GIST.6,7
ASPECTOS HISTÓRICOS
Anteriormente se clasificaba a los GIST, erróneamente, como leiomiomas, leiomioblastomas y leiomiosarcomas.4 Stout desde 1940 mostró especial interés en los tumores del TGI originados a partir de células musculares, pero fue solo en 1983 cuando Mazur y Clark acuñaron el término ''tumor estromal'' basados en la evidencia creciente de que ese tipo de neoplasia era una nueva entidad diagnóstica.8
El hecho que cambió radicalmente el enfoque diagnóstico de la enfermedad fue la publicación de Hirota y colaboradores en 1998 quienes caracterizaron las mutaciones del protoncogén c-KIT en más del 90% de los tumores del estroma gastrointestinal.6
EPIDEMIOLOGÍA
Los GIST, aunque son tumores mesenquimales frecuentes, constituyen menos del 1% de las neoplasias malignas del TGI y el 5% de todos los sarcomas. Datos de Estados Unidos indican una incidencia de 150 casos/año y 68/1.000.000.9,10 Hay un ligero predominio en hombres (54% ) y un pico máximo de aparición en la quinta a séptima décadas de la vida.11,12 No se dispone en Colombia de datos epidemiológicos acerca de la frecuencia de esta enfermedad.
Existe dificultad en el diagnóstico preoperatorio, pues se sabe poco de la etiología y los factores de riesgo. En el 63% de los casos se los diagnostica en el estadio localizado y las tasas de supervivencia de los pacientes a 1 y 5 años son del 80 y 43% , respectivamente.11
FISIOPATOLOGÍA
El genoma humano contiene aproximadamente 90 TK y 43 genes asociados a ellas, cuyos productos regulan la proliferación celular, la supervivencia, la diferenciación, la función y la motilidad.12 El gen c-Kit está localizado en el cromosoma 4 y codifica para un receptor transmembranal de TK tipo III llamado KIT (antígeno CD 117), expresado por las CIC, células hematopoyéticas, melanocitos y mastocitos. Más del 90% de los GIST y las CIC expresan el receptor KIT.1 Las mutaciones más frecuentes de c-Kit (70% de los casos) se identificaron en el exon 11 del gen (dominio de la yuxtamembrana), que resultan en la activación sostenida del receptor, aunque se han reportado otras mutaciones en distintas regiones.13 Menos del 5% de los GIST carecen de mutaciones de c-Kit; se trata de tumores CD 117 negativos en la inmunohistoquímica.14 Tales mutaciones de los protoncogenes c-Kit y PDGFRα alteran las cascadas de señales intracelulares lo que conduce a una proliferación celular acelerada, resistencia a la apoptosis y transformación celular oncogénica con los resultados finales de invasión, angiogénesis y metástasis.15,16
Es importante anotar que no todos los tumores KIT positivos son GIST. Muchos otros tipos de tumores expresan KIT, entre ellos: sarcoma sinovial, rabdomiosarcoma, angiosarcoma, sarcoma de Ewing, ciertos tipos de linfoma, tumores de células germinales, sarcomas granulocíticos y en síndromes de mastocitosis.16
HISTOPATOLOGÍA
Los GIST se caracterizan por ser masas friables no encapsuladas, de localización submucosa, intramural o subserosa, cuyo tamaño varía entre 2 y 30 cm. Usualmente tienen focos de necrosis central que predisponen a ruptura fácil en el momento de la resección quirúrgica.16 Los hallazgos histológicos revelan una neoplasia de células fusiformes con patrón fascicular.2 A pesar de su amplia gama de presentaciones, los diversos estudios han permitido caracterizarlos en tres tipos principales: fusiforme (70% ), epitelioide (20% ) y mixto (10% ).17 Pueden ser de alta o baja celularidad, con pleomorfismo nuclear y desde indiferenciados hasta completamente diferenciados.
INMUNOHISTOQUÍMICA
A diferencia de los tumores de músculo liso, los GIST son positivos en el 95% de los casos para la expresión de CD117.18,19 Además, se sabe que aproximadamente 60- 80% expresan CD34, 20-40% reaccionan a la actina de músculo liso (AML), 1-10% son inmunopositivos para la proteína S-100 y 5% expresan desmina.2,16 Entre estos marcadores, CD117, CD34 y desmina son una combinación útil para confirmar el diagnóstico; la desmina se utiliza principalmente para descartar leiomiosarcoma.20
LOCALIZACIÓN
Los GIST se pueden localizar en todo el TGI: estómago (50-60% ), intestino delgado (25-30% ), colon y recto (10% ), esófago (25% ), y en otros sitios como omento, mesenterio, páncreas, vesícula biliar y retroperitoneo (menos del 5% ).15,20
CLASIFICACIÓN
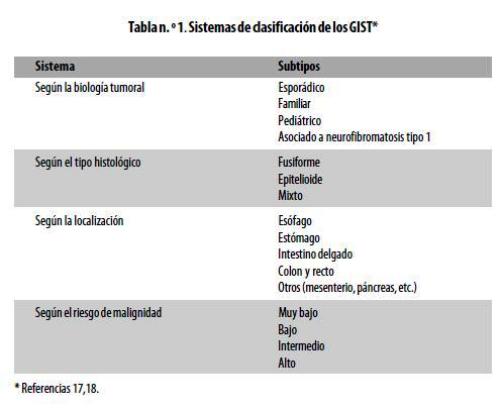
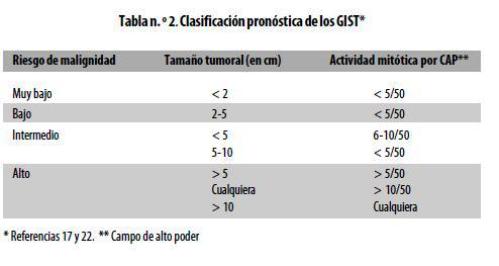
Los GIST se pueden clasificar de diversas formas (tabla nº 1). Miettinen y colaboradores caracterizaron más de 1.700 casos de estos tumores, lo que permitió establecer una clasificación pronóstica (tabla nº 2). Según ella, los tumores mayores de 5 cm y con más de 10 mitosis por 50 campos de alto poder (CAP) tienen un riesgo alto de malignidad y su tasa de mortalidad es de 50-86% .10,17,18,20
PRESENTACIÓN CLÍNICA
En los estadios iniciales los GIST son asintomáticos, pero luego hasta un 70% de los pacientes pueden desarrollar algún tipo de sintomatología que depende de la localización y el tamaño del tumor.1 Lo más frecuente es que se manifiesten por sangrado del TGI (54% de los casos) y dolor abdominal (16% ); también pueden ser hallazgos casuales al estudiar otras enfermedades (hasta en un 17% ) mediante procedimientos endoscópicos, laparoscópicos o radiográficos.21 Aunque es infrecuente (1,7% de los casos), el tumor puede romperse espontáneamente y manifestarse como un abdomen agudo.20
Generalmente el diagnóstico es tardío: la duración promedio de los síntomas es de 6 meses antes de detectar el tumor.1,2 Por lo general son sintomáticos los tumores mayores de 3 cm que se ulceran y necrosan produciendo dolor y sangrado.1
Los GIST de esófago se manifiestan con disfagia, hematemesis, pérdida de peso y dolor retroesternal. En las localizaciones gástrica y del intestino delgado se manifiestan con síntomas inespecíficos como hiporexia, pérdida de peso, dolor abdominal, dispepsia y sangrado. Los GIST colorrectales se manifiestan con dolor abdominal y distensión, alteraciones del hábito intestinal, sangrado del TGI inferior e incluso obstrucción y perforación.20
Por lo general el examen físico no aporta mucha información; solo en casos avanzados pueden encontrarse una masa palpable, ictericia si hay infiltración hepática o compresión de la vía biliar, ascitis cuando hay diseminación peritoneal y edema en los miembros inferiores si la masa es retroperitoneal.15,16
En la población pediátrica el curso clínico de estos tumores es similar al de los que ocurren en adultos, el pronóstico es favorable y generalmente hay asociación de historia familiar positiva para este tipo de neoplasia. Se ha descrito con alguna frecuencia la combinación de GIST gástrico, paraganglioma y condroma pulmonar, síndrome conocido como tríada de Carney, que es más frecuente en niños; en adultos se presenta en un 0,2% de los casos.22
DIAGNÓSTICO
Con frecuencia los GIST se diagnostican con el estudio del espécimen quirúrgico.2 El diagnóstico se basa en la identificación histológica estándar y en el estudio del comportamiento tumoral basado en la tasa mitótica.5
Las técnicas de inmunohistoquímica con los marcadores CD117, CD34, desmina, AML y proteína S-100 son métodos complementarios de diagnóstico.5 Aproximadamente el 5% de los GIST son CD117 negativos y deben ser considerados para un análisis molecular de mutaciones de c-KIT o PDGFRα.1-5,19
Los GIST se pueden detectar con la endoscopia digestiva como una masa submucosa, pero el rendimiento diagnóstico de esta técnica es bajo. Por el contrario, se han informado series con ultrasonido endoscópico y biopsia dirigida con aguja fina, con lo que se logra una precisión diagnóstica hasta del 80% .21,23,24 Sin embargo, debido al riesgo de ruptura tumoral con hemorragia y diseminación, es controversial el uso de la biopsia preoperatoria, ya sea endoscópica o percutánea, por lo que algunos autores la recomiendan solo en pacientes con tumores inoperables o recurrentes.2-5
Las técnicas de imagen disponibles para el diagnóstico de los GIST incluyen la tomografía axial computarizada (TAC), la resonancia nuclear magnética (RNM) y la tomografía por emisión de positrones con fluorodeoxiglucosa (FDG-PET); este último método es de especial utilidad para el seguimiento del paciente, dada la alta actividad glicolítica de estos tumores.5,25-27 Dependiendo de la experiencia y disponibilidad locales, se pueden usar la RNM o la TAC para la evaluación inicial de los pacientes con GIST y la exclusión de la presencia de metástasis.5
DIAGNÓSTICO DIFERENCIAL
Se debe hacer diagnóstico diferencial con todas las lesiones submucosas detectadas en un procedimiento endoscópico digestivo, tales como leiomiomas, schawnomas y quistes y remanentes pancreáticos.24 En general, se deben incluir en dicho diagnóstico todos los sarcomas del TGI y ciertos tumores epiteliales. También cabe diferenciar los GIST de la fibromatosis y de neoplasias KIT positivas.17
TRATAMIENTO
Enfermedad localizada
El tratamiento de un paciente con un GIST primario es la resección quirúrgica completa.1-5,8,10,20,28,29 Es suficiente hacer una resección en cuña o segmentaria del órgano afectado con márgenes macroscópicamente negativos y no necesariamente amplios, pues se acepta que el margen microscópico de resección no afecta la supervivencia.5,20,29-33
Está demostrado que no se requiere hacer linfadenectomía de rutina debido a que las metástasis ganglionares son muy raras y tienden a aparecer muy tarde en la evolución de la enfermedad; sin embargo, para las lesiones del estómago, intestino delgado, colon y recto, es recomendable resecar el omento, el mesenterio adyacente, el mesocolon y el mesorrecto, respectivamente. 1,4,20,28-31
Varios estudios apoyan el uso de técnicas mínimamente invasivas debido a que con ellas se obtienen resecciones oncológicas exitosas. Para los GIST gástricos, la resección en cuña, segmentaria o transgástrica apoyada en laparoscopia y laparoendoscopia es una alternativa excelente a la cirugía abierta.34-38 Los pacientes elegibles son los que tienen tumores entre 2-5 cm. Dicha resección en cuña es de elección para las lesiones de la pared anterior y de las curvaturas mayor y menor; en cuanto a los tumores de la pared posterior y del cardias, de mayor dificultad técnica, se debe practicar una resección transgástrica con la ayuda de endoscopia intraoperatoria. 34 La tasa de conversión a cirugía abierta es de 0-5% y aún no se conocen los resultados a largo plazo.34-37
No hay suficiente evidencia para asegurar que la cirugía abierta en pacientes con GIST sea superior a la cirugía laparoscópica o viceversa; esta última es una técnica segura y efectiva en centros con experiencia.36,37,39 Para los GIST de esófago, duodeno y recto la experiencia con la laparoscopia es limitada, las resecciones en cuña no son viables técnicamente por lo que el tratamiento de elección son las resecciones amplias.5 La supervivencia a 5 años luego de la resección completa puede ser de 54- 70% ; en contraste, el promedio de supervivencia de los pacientes no intervenidos es de solo 12 meses.20,30
Enfermedad avanzada
Un número variable de pacientes tienen metástasis en el momento del diagnóstico o un tumor recurrente durante el seguimiento postoperatorio. Los principales sitios de metástasis y recurrencia son el peritoneo y el hígado; las metástasis son raras por fuera del abdomen; pueden ocurrir en los pulmones o los huesos.2 La quimioterapia (QT) convencional y la radioterapia (RT) son inefectivas en los pacientes con GIST: las tasas de respuesta son menores del 5% .1-5
La primera línea de tratamiento en los pacientes con enfermedad avanzada es el mesilato de imatinib (Gleevec®, Novartis).1-5 Dicho medicamento es un inhibidor selectivo de ciertas TK, empleado inicialmente para el tratamiento de la leucemia mieloide crónica.40 Induce un bloqueo en los receptores KIT y PDGFR por lo que disminuye la proliferación e induce apoptosis de las células tumorales. En 2000 se reportó el primer caso de tratamiento exitoso en una paciente con GIST metastásico que recibió 400 mg diarios de imatinib.41 Este fármaco induce una respuesta parcial en el 45-50% de los pacientes y enfermedad estable sin progresión en un 30% , con tasas de supervivencia a uno y dos años del 90% y el 70% , respectivamente.2
Los estudios aleatorizados no han mostrado diferencia en la respuesta entre 400 mg y 800 mg al día; sin embargo, en algunos se ha hallado mayor supervivencia libre de progresión con dosis alta (400 mg dos veces al día).42- 44Los efectos adversos, más frecuentes con dosis altas, son: edema, exantema, naúseas, dolor abdominal y fatiga.45
Un grupo especial de GIST son refractarios al imatinib, al parecer debido a exteriorización del medicamento al espacio extracelular por bombas de membrana, al aumento de la unión a proteínas plasmáticas y a varias mutaciones intracelulares que lo inactivan.11,16 Diferentes publicaciones demuestran la eficacia del sunitinib, como agente de segunda línea, por lo cual se ha aprobado su uso para pacientes con intolerancia al imatinib o con GIST refractarios a él.10,46-50
La cirugía en los pacientes con enfermedad metastásica o recurrente parece tener poco valor, pero puede estar indicada para el tratamiento del paciente con metástasis hepáticas localizadas (pues la mayoría son multifocales) muy sintomáticas y con histología favorable.2 Algunas publicaciones favorecen el uso de quimioterapia intraperitoneal y resección quirúrgica en casos seleccionados, con resultados aceptables.51 Otras series pequeñas han demostrado alguna utilidad en el tratamiento con quimioembolización transarterial de metástasis hepáticas usando mitomicina, cisplatino, doxorrubicina y polivinil-alcohol con respuestas parciales en el 13% y enfermedad estable en el 69% .52
TERAPIA ADYUVANTE Y NEOADYUVANTE
Aún se está investigando el uso del mesilato de imatinib luego de la resección quirúrgica (adyuvante) o antes de esta (neoadyuvante).1-5,53 En la actualidad, estudios de fase III de terapia adyuvante como el de la Organización Europea para la Investigación y el Tratamiento del Cáncer (EORCT) en Europa y Australia y de fase II como el del Grupo Escandinavo de Sarcomas (SSG), tratan de aclarar el papel del imatinib en pacientes con GIST de alto riesgo llevados a resección, aunque los resultados no estarán disponibles hasta dentro de varios años.5 Recientemente se publicó un ensayo clínico controlado aleatorizado del Grupo de Oncología del Colegio Americano de Cirujanos (ACOSOG), según el cual el imatinib usado como adyuvante a dosis de 400 mg/día luego de la resección de GIST localizados de al menos 3 cm, mejora la supervivencia libre de recurrencia a un año comparado con un placebo.54
En cuanto a la terapia neoadyuvante, el Grupo de Oncología y Radioterapia (RTOG), en el que participan diversas entidades de Estados Unidos, reportó que el uso preoperatorio de mesilato de imatinib en pacientes con GIST localmente avanzado o metastásico, se asocia con tasas de supervivencia de 97% , 93% y 84% a uno, dos, y tres años, respectivamente, libre de progresión y sin aumento de las complicaciones operatorias ni la toxicidad.55 La terapia neoadyuvante es de especial interés en pacientes con GIST de esófago, y en los que es de gran importancia una operación que evite la pérdida de la función orgánica (por ejemplo, la del esfínter anal), en cuyos casos, un curso preoperatorio de imatinib con cirugía programada 4 a 6 meses luego del inicio de la terapia, haría citorreducción tumoral y facilitaría la resección.5
Van der Zwan y De Matteo2 propusieron un algoritmo simplificado para el tratamiento de los GIST (figura n.º 1).
PRONÓSTICO Y SEGUIMIENTO
Se consideran como factores de mal pronóstico, además del tamaño y la tasa mitótica, la necrosis intratumoral, la resección incompleta, la ruptura tumoral intraoperatoria, la infiltración a estructuras vecinas, la alta celularidad, el tipo de mutación del gen c-Kit y la localización en el intestino delgado.30,56 En general se acepta que la supervivencia global a un año es del 80% y a 5 años, del 43% .9
La Organización Mundial de la Salud (OMS) y el Grupo de Oncología del Suroeste (SWOG), de Estados Unidos, han establecido los criterios que definen el comportamiento de la enfermedad luego del comienzo de la terapia.44 (tabla n.º 3). Para el seguimiento, según el consenso de la Sociedad Europea de Oncología Médica (ESMO), los pacientes con tumores de alto riesgo se deben vigilar con TAC cada 3-4 meses por 3 años, luego cada 6 meses hasta los 5 años y luego anualmente.32 Para los pacientes con tumores de riesgo intermedio o bajo se acepta un control con TAC cada 6 meses por 5 años.5,32,33
CONCLUSIONES
Los GIST son una nueva entidad diagnóstica independiente con biología y fisiopatología muy bien estudiadas. La cirugía es el estándar de tratamiento para los pacientes con GIST localizados; con ella se obtienen tasas altas de curación; las resecciones limitadas son excelentes alternativas de tratamiento. El tratamiento de los GIST avanzados con agentes como imatinib y sunitinib es un ejemplo claro de terapia molecular dirigida. Las terapias adyuvante y neoadyuvante, así como las dosis adecuadas y el tiempo de tratamiento, son por ahora experimentales.
REFERENCIAS BIBLIOGRÁFICAS
1. Kosmadakis N, Visvardi E, Kartsaklis P, Tsimara M, Chatziantoniou A, Panopoulos L, et al. The role of surgery in the management of gastrointestinal stromal tumors (GISTs) in the era of imatinib mesylate effectiveness. Surg Oncol 2005; 14: 75-84. [ Links ]
2. Van der Zwan SM, DeMatteo RP. Gastrointestinal stromal tumor: 5 years later. Cancer 2005; 104: 1781-1788. [ Links ]
3. Blanke CD, Corless C. State-of-the art therapy for gastrointestinal stromal tumors. Cancer Invest 2005; 23: 274-280. [ Links ]
4. Clary BM, DeMatteo RP, Lewis JJ, Leung D, Brennan M. Gastrointestinal stromal tumors and leiomyosarcoma of the abdomen and retroperitoneum: A clinical comparison. Ann Surg Oncol 2001; 8: 290-299. [ Links ]
5. Blay J, Bonvalot S, Casali P, Choi H, Debiec-Richter H, Dei Tos P, et al. Consensus meeting for the management of gastrointestinal stromal tumors: Report of the GIST Consensus Conference of 20-21 March 2004, under the auspices of ESMO. Ann Oncol 2005; 16: 566-578. [ Links ]
6. Hirota S, Isozaki K, Moriyama Y. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science 1998; 279: 577-580. [ Links ]
7. Kindblom LG, Remotti HE, Aldenborg F, Meis- KindblomJM. Gastrointestinal pacemaker cell tumor (GIPACT): gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal. Am J Pathol 1998; 152: 1259-1269. [ Links ]
8. Mazur MT, Clark HB. Gastric stromal tumors. Reappraisal of histogenesis. Am J Surg Pathol 1983; 7: 507-519. [ Links ]
9. Von Mehren M, Watson JC. Gastrointestinal stromal tumors. Hematol Oncol Clin North Am 2005; 19: 547-564. [ Links ]
10. Gutierrez JC, De Oliveira LO, Perez EA, Rocha-Lima C, Livingstone AS, Koniaris LG. Optimizing diagnosis, staging, and management of gastrointestinal stromal tumors. J Am Coll Surg 2007; 205: 479-491. [ Links ]
11. Tran T, Davila J, Hashem B. The epidemiology of malignant gastrointestinal tumors: An analysis of 1458 cases from 1992 to 2000. Am J Gastroenterol 2005; 100: 162-168. [ Links ]
12. Krause D, Van Etten R. Tyrosine kinases as targets for cancer therapy. N Engl J Med 2005; 353: 172-187. [ Links ]
13. Nakahara M, Isozaki K, Hirota S, Miyagawa J, Hase- Sawada N, Taniguchi M, et al. A novel gain-of-function mutation of c-kit gene in gastrointestinal stromal tumors. Gastroenterology 1998; 115: 1090-1095. [ Links ]
14. Heinrich MC, Corless CL, Duensing A, McGreevey L, Chen CJ, Joseph N, et al. PDGFRα activating mutations in gastrointestinal stromal tumors. Science 2003; 299: 708-710. [ Links ]
15. Shinomura Y, Hirota S, Kinoshita K, Tsutsui S. Pathophysiology, diagnosis, and treatment of gastrointestinal stromal tumors. J Gastroenterol 2005; 40: 775-780. [ Links ]
16. D'Amato G, Steinert D, McAuliffe J, Trent J. Update on the biology and therapy of gastrointestinal stromal tumors. Cancer Control 2005; 12: 44-56. [ Links ]
17. Miettinen M, Sobin LH, Lasota J. Gastrointestinal stromal tumors of the stomach: A clinicopathologic immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up. Am J Surg Pathol 2005; 29: 52-68. [ Links ]
18. Fletcher CD, Berman JJ, Corless Cl. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Hum Pathol 2002; 33: 459-465. [ Links ]
19. Badalamenti G, Rodolico V, Fulfaro F, Cascio S, Cipolla C, Cicero G, et al. Gastrointestinal stromal tumors (GISTs): focus on histopathological diagnosis and biomolecular features. Ann Oncol 2007; 18 (Suppl. 6): 36-40. [ Links ]
20. Heinrich MC, Corless C. Gastric GI stromal tumors (GIST): the role of surgery in the era of targeted therapy. J Surg Oncol 2005; 90: 195-207. [ Links ]
21. Scarpa M, Bertin M, Ruffolo C, Polese L, D'Amico DF, Angriman I. A systematic review on the clinical diagnosis of gastrointestinal stromal tumors. J Surg Oncol 2008; 98: 384-392. [ Links ]
22. Miettinen M, Sobin LH, Lasota J. Gastrointestinal stromal tumors of the stomach in children and young adults: A clinicopathologic, immunohistochemical, and molecular genetic study of 44 cases with longterm follow-up and review of the literature. Am J Surg Pathol 2005; 29: 1373-1381. [ Links ]
23. Polkowski M. Endoscopic ultrasound and endoscopic ultrasound-guided fine-needle biopsy for the diagnosis of malignant submucosal tumors. Endoscopy 2005; 37: 635-645. [ Links ]
24. Wiech T. Histopathological classification of nonneoplastic and neoplastic gastrointestinal submucosal lesions. Endoscopy 2005; 37: 630-634. [ Links ]
25. Holdsworth CH, Badawi RD, Manola JB, Kijewski MF, Israel DA, Demetri GD, et al. CT and PET: early prognostic indicators of response to imatinib mesylate in patients with gastrointestinal stromal tumor. Am J Roentgenol 2007; 189: 324-330. [ Links ]
26. Choi H. Response evaluation of gastrointestinal stromal tumors. Oncologist 2008; 13 (Suppl. 2): 4-7. [ Links ]
27. Van den Abbeele AD. The lessons of GIST-PET and PET/CT: a new paradigm for imaging. Oncologist 2008; 13 (Suppl. 2): 8-13. [ Links ]
28. Hueman MT, Schulick RD. Management of gastrointestinal stromal tumors. Surg Clin North Am 2008; 88: 599-614. [ Links ]
29. Raut CP, Ashley SW. How I do it: surgical management of gastrointestinal stromal tumors. J Gastrointest Surg 2008; 12: 1592-1599. [ Links ]
30. DeMatteo RP, Lewis J, Leung D, Mudan S, Woodruff J, Brennan M. Two hundred gastrointestinal stromal tumors: Recurrence patterns and prognostic factors for survival. Ann Surg 2000; 231: 51-58. [ Links ]
31. Everett M, Gutman H. Surgical management of gastrointestinal stromal tumors: Analysis of outcome with respect to surgical margins and technique. J Surg Oncol 2008; 98: 588-593. [ Links ]
32. Casali PG, Jost L, Reichardt P, Schlemmer M, Blay JY. Gastrointestinal stromal tumors: ESMO clinical recommendations for diagnosis, treatment and followup. Ann Oncol 2008; 19 (Suppl. 2): 35-38. [ Links ]
33. Nishida T, Hirota S, Yanagisawa A, Sugino Y, Minami M, Yamamura Y, et al. Clinical practice guidelines for gastrointestinal stromal tumor (GIST) in Japan: English version. Int J Clin Oncol 2008; 13: 416-430. [ Links ]
34. Wayne JD, Richard HB. Limited gastric resection. Surg Clin North Am 2005; 85: 1009-1020. [ Links ]
35. Rosen MJ, Heniford BT. Endoluminal gastric surgery: the modern era of minimally invasive surgery. Surg Clin North Am 2005; 85: 989-1007. [ Links ]
36. Otani Y, Masahiro O, Naoki I, Maseru K, Tetsuro K, Koichiro K et al. Laparoscopic wedge resection of gastric submucosal tumors. Surg Laparosc Endosc Percutan Tech 2000; 10: 19-23. [ Links ]
37. Dholakia C, Gould J. Minimally invasive resection of gastrointestinal stromal tumors. Surg Clin North Am 2008; 88:1009-1018. [ Links ]
38. Catena F, Di Battista M, Fusaroli P, Ansaloni L, Di Scioscio V, Santini D, et al. Laparoscopic treatment of gastric GIST: report of 21 cases and literature's review. J Gastrointest Surg 2008; 12: 561-568. [ Links ]
39. Alam I, Kheradmand F, Alam S, Jamil A, Wilson I, Hurley M. Laparoscopic management of acutely presenting gastrointestinal stromal tumors: a study of 9 cases and review of literature. J Laparoendosc Adv Surg Tech A 2007; 17: 626-633. [ Links ]
40. Savage DG, Antman K. Imatinib mesylate: A new oral targeted therapy. N Engl J Med 2002; 346: 683- 693. [ Links ]
41. Joensuu H, Roberts P, Sarlomo M, Andersson L, Tervahartiala P, Tuveson D, et al. Effect of the tyrosine kinase inhibitor sti571 in a patient with a metastatic gastrointestinal stromal tumor. N Engl J Med 2001; 344: 1052-1056. [ Links ]
42. Verweij J, Casali P, Zalcberg J, LeCesne A, Reichardt P, Blay J, et al. Progression-free survival in gastrointestinal stromal tumours with high-dose imatinib: randomised trial. Lancet 2004; 364: 1127-1134. [ Links ]
43. Blanke CD, Rankin C, Demetri GD, Ryan CW, von Mehren M, Benjamin RS, et al. Phase III randomized, intergroup trial assessing imatinib mesylate at two dose levels in patients with unresectable or metastatic gastrointestinal stromal tumors expressing the kit receptor tyrosine kinase: S0033. J Clin Oncol 2008; 26: 626-632. [ Links ]
44. Patel S, Zalcberg JR. Optimizing the dose of imatinib for treatment of gastrointestinal stromal tumours: lessons from the phase 3 trials. Eur J Cancer 2008; 44: 501-509. [ Links ]
45. Demetri GD, von Mehren M, Blanke CD, Van Den Abeele A, Eisenber B, Roberts P, et al. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 2002; 347: 472-480. [ Links ]
46. Demetri GD, van Oosterom AT, Garrett CR, Blackstein ME, Shah MH, Verweij J, et al. Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: A randomised controlled trial. Lancet 2006; 368: 1329-1338. [ Links ]
47. Deeks ED, Keating GM. Sunitinib. Drugs 2006; 66: 2255- 2266. [ Links ]
48. Joensuu H. Second line therapies for the treatment of gastrointestinal stromal tumor. Curr Opin Oncol 2007; 19: 353-358. [ Links ]
49. Judson I, Demetri G. Advances in the treatment of gastrointestinal stromal tumours. Ann Oncol 2007; 18 (Suppl. 10): 20-24. [ Links ]
50. Hopkins TG, Marples M, Stark D. Sunitinib in the management of gastrointestinal stromal tumours (GISTs). Eur J Surg Oncol 2008; 34: 844-850. [ Links ]
51. Patel SR, Benjamin R. Management of peritoneal and hepatic metastases from gastrointestinal stromal tumors. Surg Oncol 2000; 9: 67-70. [ Links ]
52. Rajan D, Soulen M, Clark T, Baum R, Haskal Z, Shlansky-Goldberg R, et al. Sarcomas metastatic to the liver: Response and survival after cisplatin, doxorubicin, mitomycin-C, ethiodol, and polyvinyl alcohol chemoembolization. J Vasc Interv Radiol 2001; 12: 187-193. [ Links ]
53. Kitamura Y. Gastrointestinal stromal tumors: past, present, and future. J Gastroenterol 2008; 43: 499-508. [ Links ]
54. DeMatteo RP, Ballman KV, Antonescu CR, Maki RG, Pisters PW, Demetri GD, et al. Adjuvant imatinib mesylate after resection of localised, primary gastrointestinal stromal tumour: a randomised, doubleblind, placebo-controlled trial. Lancet 2009; 373: 1097-1104. [ Links ]
55. Eisenberg BL, Harris J, Blanke CD, Demetri GD, Heinrich MC, Watson JC, et al. Phase II trial of neoadjuvant/adjuvant imatinib mesylate (IM) for advanced primary and metastatic/recurrent operable gastrointestinal stromal tumor (GIST): early results of RTOG 0132/ACRIN 6665. J Surg Oncol 2009; 99: 42-47. [ Links ]
56. Lesalnieks I, Rümmele P, Dietmaier W, Jantsch T, Zülke C, Schlitt H, et al. Factors associated with disease progression in patients with gastrointestinal stromal tumors in the pre-imatinib era. J Clin Pathol 2005; 124: 740-748. [ Links ]
Recibido: agosto 10 de 2009
Aceptado: abril 26 de 2010