Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.23 no.4 Medellín Oct./Dec. 2010
ARTÍCULO DE REVISIÓN
Respuesta inadecuada a los patógenos y otros agresores: ¿deficiencia de Vitamina A?
Is inadequate response to pathogens and other aggressors due to vitamin A deficiency?
Lucía Carolina Leal Esteban1, Claudia Milena Trujillo Vargas2
1 Bacterióloga. Joven Investigadora de Colciencias. Grupo de Inmunodeficiencias Primarias, Universidad de Antioquia, Medellín, Colombia.
2 Bacterióloga, MSc, DSc. Profesora Asistente, Departamento de Microbiología y Parasitología, Facultad de Medicina, Universidad de Antioquia. Investigadora Asociada, Grupo de Inmunodeficiencias Primarias, Universidad de Antioquia, Medellín, Colombia. claudia.trujillo@siu.udea.edu.co
RESUMEN
La vitamina A desempeña un papel fundamental en el desarrollo de los tejidos y órganos gracias a su capacidad de promover la diferenciación celular y regular la apoptosis. Específicamente en el sistema inmune, esta vitamina tiene efectos muy importantes sobre componentes específicos tanto de la respuesta inmune innata como de la adaptativa. En la inmunidad innata, el ácido retinoico (AR) participa en la regeneración de las mucosas y epitelios, promueve la diferenciación de células como los neutrófilos y eosinófilos y potencia la fagocitosis. Además, ayuda a la migración de las diferentes células inmunes promoviendo la producción de metaloproteinasas de matriz extracelular. Aunque sus efectos en las células NK son más controversiales, se ha encontrado que el número y la función lítica de estas células disminuyen cuando hay deficiencia de vitamina A (DVA). Por otra parte, el AR influencia el desarrollo de la inmunidad adaptativa alterando el perfil de producción de citoquinas por parte de las células presentadoras de antígeno, lo que influye en la diferenciación de los linfocitos T ayudadores. En general, se ha observado que el AR amplifica la proliferación de las células T y potencia el desarrollo de células plasmáticas a partir de los linfocitos B maduros. Todos estos efectos tienen repercusiones importantes en la adecuada defensa contra las infecciones, especialmente en la infancia en la cual la DVA es un problema importante de salud pública, no solo en Colombia sino también en aproximadamente otros 60 países.
Palabras clave
Ácido retinoico, Células fagocíticas, Deficiencia de vitamina A, Linfocitos, Vitamina A
SUMMARY
Vitamin A plays a pivotal role in tissue and organ development due to its ability to regulate cellular differentiation and apoptosis. Moreover, this vitamin produces very important effects on specific components of innate and adaptative immune responses. Concerning the innate immune system, retinoic acid (RA) participates in the regeneration of mucosal surfaces and epithelia, also promoting neutrophil and eosinophil differentiation and enhancing phagocytosis. Additionally, vitamin A supports the production of extracellular matrix metalloproteinases enhancing the migration of different immune cells to effector sites. On the other hand, although the effects of vitamina A in the function of NK cells are more controversial, it is known that blood NK cell numbers and function are diminished during vitamin A deficiency (VAD). In adaptive immunity, RA influences the production of cytokines by antigen presenting cells, in turn, affecting the differentiation of naïve T lymphocytes into different T helper cell subpopulations. Overall, it has been established that RA increases T cell proliferation and enhances the development of plasma cell from mature B lymphocytes. Therefore, vitamin A is essential to promote suitable immune responses against pathogens, especially in children who are commonly affected by VAD not only in Colombia, but also in approximately 60 countries worldwide.
Key words Lymphocytes, Phagocytic cells, Retinoic acid, Vitamin A, Vitamin A deficiency
INTRODUCCIÓN
La palabra vitamina se deriva originalmente del término vitamine (amina vital), empleado por Casimir Funk al referirse al descubrimiento de Christian Eijkman de una amina extraída del pulimiento del arroz, que podía prevenir el beriberi.1 A pesar de que el compuesto al que se refería el primer autor no contenía aminas, el término acuñado se aplicó a toda una serie de sustancias encontradas en los alimentos, independientemente de su estructura química.
Las vitaminas son un grupo de nutrientes orgánicos complejos requeridos en cantidades mínimas, que se obtienen de la dieta porque el organismo no los sintetiza en cantidades suficientes y que son necesarios en una serie de funciones bioquímicas. Estos compuestos están implicados en una amplia variedad de procesos fisiológicos y desempeñan diversas funciones, como hormonas y antioxidantes, reguladores del crecimiento y la diferenciación de los tejidos, además de participar en el desarrollo embrionario y el metabolismo del calcio, entre otras.2
Las vitaminas A, D, E y K se clasifican como liposolubles. Estas vitaminas no se extraen tan fácilmente de la dieta como las hidrosolubles, por lo cual se almacenan en reservas importantes en los tejidos. En particular, las vitaminas A y D son muy diferentes de las demás porque sus respectivos metabolitos bioactivos, el ácido retinoico (AR) y 1,25-dihidroxivitamina D3, tienen propiedades hormonales. Estos dos metabolitos se sintetizan a partir de sus precursores, en diferentes células y tejidos y ejercen sus efectos en células blanco porque se unen a receptores hormonales nucleares.3
Fue en 1913 cuando Osborne y Mendel de la Universidad de Yale y Davis y McCollum de la Universidad de Wisconsin descubrieron simultáneamente la vitamina A. Fue la primera vitamina liposoluble descubierta y hoy en día se sabe que juega un papel esencial en gran número de funciones fisiológicas relacionadas con la visión, crecimiento, reproducción, hematopoyesis e inmunidad.
Los Centros para el Control y la Prevención de Enfermedades (CDC) de los Estados Unidos han reconocido que, en niños, la deficiencia de vitamina A (DVA: retinol de 20 µg/dL o menos en suero), se asocia a un cuadro de anemia y retardo en el crecimiento. Además, en mujeres embarazadas, la DVA puede incrementar el riesgo de mortalidad materna.4 Esta vitamina es de gran interés en inmunología y al respecto se han hecho muchos estudios tanto in vivo como in vitro, para dilucidar los mecanismos de acción de sus metabolitos sobre las diferentes células y procesos relacionados con el sistema inmune.
Gracias a este interés se ha empezado a considerar a la DVA no solo como la principal causa de ceguera infantil en países en desarrollo, sino como una causa importante de morbimortalidad infantil por las infecciones comunes. La Organización Mundial de la Salud (OMS), a través de su Sistema de Información de Deficiencia de Micronutrientes, planteó desde hace más de una década que la DVA moderada y grave es un problema significativo de salud pública en 60 países. Esta organización considera que alrededor de 3 millones de niños en edad preescolar están afectados clínicamente por esta deficiencia y que otros 251 millones pueden estarlo de forma subclínica, poniendo en riesgo su crecimiento y desarrollo adecuados.5 En Colombia, según datos de 1995, la prevalencia de concentración sérica o plasmática baja de retinol (20 o menos µg/dL o 0,78 o menos µmol/L) era de 13,6% en una población de 2.187 niños de 12 a 59 meses de edad.6 En 2005 se hizo un estudio que incluyó a 4.409 niños, de uno y otro sexo, de 12 a 59 meses, en áreas rurales y urbanas de 210 municipios colombianos; se encontró una prevalencia de 5,9% de concentración sérica o plasmática de retinol menor de 0,70 µmol/L.7
ESTRUCTURA, METABOLISMO Y TRANSPORTE
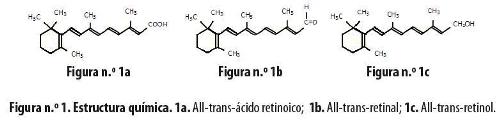
Todos los metabolitos derivados de la vitamina A se denominan retinoides y usualmente comprenden cuatro unidades isoprenoides unidas de forma cabeza-cola con 5 uniones dobles C-C conjugadas y un grupo terminal funcional en el extremo acíclico (Figura n.° 1).8 Además, se han desarrollado cientos de retinoides sintéticos cuya actividad biológica se está investigando. Estos compuestos se unen específicamente a los receptores X retinoides por lo cual se llaman rexinoides.
Dado que el organismo es incapaz de sintetizar vitamina A, todos los retinoides se deben obtener a partir de la dieta ya sea como vitamina A preformada (retinilésteres, retinol o ácido retinoico en muy pequeña proporción) a partir de, por ejemplo, la leche, la margarina, los huevos, el hígado y los cereales o como provitamina A (carotenoides) que se pueden encontrar en la zanahoria, la espinaca y el melón, entre otros.9
La forma predominante de vitamina A preformada de la dieta -los retinil-ésteres- se hidrolizan enzimáticamente en la luz intestinal, requisito indispensable para entrar a los enterocitos, gracias a la acción de las enzimas lipasa pancreática para triglicéridos y fosfolipasa B.9 Por otra parte, se ha demostrado que el retinol libre entra a los enterocitos por difusión simple y que el retinol no esterificado lo hace tanto por difusión facilitada mediada por proteínas o por difusión pasiva según se encuentre en concentraciones fisiológicas (150 nM) o farmacológicas (450-2.700 nM), respectivamente.10-11 Sin embargo, no se han identificado las proteínas implicadas en la captación del retinol.
Una vez en los enterocitos, el retinol se une a una proteína específica llamada proteína celular unidora de retinol tipo II (PCUR-II).12 Este polipéptido, de 16 KDa, se expresa principalmente en las células del epitelio absorbente del intestino delgado y pertenece a la familia de las proteínas intracelulares unidoras de lípidos.
Entre las funciones que se le atribuyen a la PCUR-II está la de unirse a trasportadores específicos en la membrana del borde en cepillo y permitir la difusión facilitada; puede actuar como un reservorio para mantener las concentraciones muy bajas de retinol libre y proteger a las células de sus propiedades detergentes y, lo más importante, PCUR-II puede presentar los retinoides a diferentes enzimas y así dirigir su metabolismo. Estudios con ratones deficientes en PCUR-II han demostrado que esta proteína desempeña una función importante pero no esencial en la absorción de la vitamina A, pues estos ratones, a pesar de ser mantenidos con una dieta rica en vitamina A, mostraron una reducción de solo un 40% en el almacenamiento hepático de retinilésteres comparados con ratones de tipo salvaje mantenidos con la misma dieta.13
La mayor parte del retinol se reesterifica con ácidos grasos de cadena larga en los enterocitos después de la absorción y se secreta en quilomicrones hacia los linfáticos junto con otros lípidos de la dieta. La unión del retinol con PCUR-II facilita su esterificación gracias a la acción de la enzima lecitina-retinol aciltransferasa (LRAT).12
Los quilomicrones son las lipoproteínas circulantes más grandes y contienen cientos de moléculas de triacilglicerol y fosfolípidos junto con carotenoides, retinil-ésteres, pequeñas cantidades de retinol y algunas apolipoproteínas. La mayoría de los retinil-ésteres que se forman se incorporan a los quilomicrones y estos se secretan desde el enterocito hasta la circulación linfática, y posteriormente a la sangre, en donde ocurre una serie de procesos que convergen en la formación de remanentes de quilomicrones.12 La principal degradación de estos remanentes, que mantienen una gran cantidad de retinilésteres, ocurre en los hepatocitos, pero la absorción de quilomicrones en tejidos extrahepáticos resulta importante para suplir de retinil-ésteres y carotenoides a diversos tejidos como la médula ósea, el bazo, el tejido adiposo, el músculo esquelético y los riñones.14
Debido a sus propiedades lipofílicas, los retinoides no se encuentran en el organismo de forma libre sino que, por el contrario, están asociados a proteínas especializadas en estabilizarlos y transportarlos a blancos tisulares específicos. En el hígado, los retinil-ésteres se hidrolizan y este retinol no esterificado se asocia a la proteína unidora de retinol (PUR) que se encuentra concentrada en el retículo endoplásmico del hepatocito. Esta asociación proteína-retinol inicia su translocación hacia el complejo de Golgi y posteriormente lidera su secreción al plasma. Además, una porción grande de retinol no esterificado en los hepatocitos se transfiere a otra clase de células hepáticas, las células Ito.12 De hecho, la mayor parte de los remanentes de quilomicrones que contienen retinil-ésteres absorbidos por los hepatocitos se transfieren a estas células, que constituyen el principal sitio de almacenamiento de los metabolitos de la vitamina A (50-80% de la cantidad total de retinol y retinil-ésteres del organismo).15
Las proteínas PCUR-I (proteína celular unidora de retinol con homología a PCUR-II) y LRAT, que se sobrexpresan en las células Ito, juegan un papel fundamental en el almacenamiento de los retinil-ésteres y controlan la movilización del retinol, lo que asegura una concentración plasmática de retinol de aproximadamente 1-2 µM.12 En 1968, Kanai y colaboradores lograron demostrar que el retinol en el plasma se encuentra unido específicamente a la PUR16 y aproximadamente el 95% de esta proteína en el plasma está asociado con la transtirretina (TTR),12 lo cual produce una merma en la filtración glomerular del retinol. Aunque la PUR se sintetiza principalmente en los hepatocitos, otros tejidos también tienen la capacidad de producirla; se ha establecido que el retinol recircula entre el plasma, el hígado y los tejidos extrahepáticos.17 El all-trans-ácido retinoico (ATRA) es un metabolito retinoide de alta actividad cuya síntesis a partir del all-trans-retinol ocurre en una reacción de dos pasos: la oxidación de retinol a retinal y la posterior oxidación de retinal a ácido retinoico (Figura n.° 2).12
En los tejidos, el all-trans-retinol se oxida a all-transretinal por medio de alcohol deshidrogenasas (ADH) o por deshidrogenasas/reductasas de cadena corta (DRC). Estas DRC utilizan como sustrato el all-transretinol unido a PCUR-I. De esta forma, las PCUR-I actúan como una chaperona para el retinol y lo dirigen para ser metabolizado por estas enzimas.18
Finalmente, el all-trans-retinal se oxida a all-transácido retinoico (ATRA) gracias a las enzimas de la familia aldehído-deshidrogenasas (ALDH), en una reacción irreversible y muy controlada.3 Estas enzimas se conocen en ratones como Raldh1 (también llamada Aldh1), Raldh2 (Aldh1a2) y Raldh3 (Aldh1a3).19 En seres humanos y otros mamíferos están presentes enzimas altamente homólogas a las de las familias ADH y ALDH,20 y cumplen con las mismas funciones, lo cual indica lo esencial de esta vía enzimática debido al papel fundamental del ácido retinoico en el organismo. Diferentes isoenzimas de Raldh se expresan además en algunas células del tracto digestivo, como las células epiteliales intestinales,21 las células dendríticas de las placas de Peyer y los nódulos linfáticos mesentéricos.22
RECEPTORES Y FUNCIONES DE LOS METABOLITOS DE LA VITAMINA A
Los amplios efectos que ejercen los retinoides son mediados por dos familias de receptores nucleares: los receptores de ácido retinoico (RAR) y los receptores X retinoides (RXR), y pueden presentarse como heterodímeros (RAR/RXR) u homodímeros (RXR/RXR).23 Tanto el ATRA como el 9-cis-ácido retinoico se unen con alta afinidad a los RAR, mientras que los RXR solo son activados por el 9-cis-ácido retinoico.23
En ausencia de ligando los receptores retinoides se encuentran principalmente en el núcleo y se unen de forma dimérica a secuencias específicas de ADN o a elementos de respuesta al ácido retinoico (ERAR),23 localizados dentro de la región promotora de genes blanco. Estos receptores unidos a los ERAR están asociados a complejos correpresores dotados de actividad histona-deacetilasa (HDAC). Después de que se produce la unión ligando-receptor, y debido a un cambio conformacional en la estructura de los receptores, los correpresores se disocian, permitiendo la unión de los coactivadores, asociados a complejos que muestran actividad de histona-acetiltransferasa (HAT), metiltransferasa, cinasa o de remodelamiento dependiente de ATP, lo cual hace que finalmente se descompacte la cromatina y se pueda dar comienzo a la actividad transcripcional.23
El ácido retinoico es clave en el desarrollo de los tejidos y órganos gracias a su capacidad de promover la diferenciación celular y regular la apoptosis. Diversos estudios han documentado la importancia de los retinoides en una amplia variedad de procesos fisiológicos directamente relacionados con la visión, la hematopoyesis, el desarrollo pulmonar, el sistema nervioso, la reproducción y el sistema inmune.24
VITAMINA A E INMUNIDAD INNATA
La deficiencia de vitamina A (DVA) afecta las barreras epiteliales mucosas de la conjuntiva y los tractos respiratorio, gastrointestinal y urogenital. Esto puede atribuirse a que la DVA causa hiperqueratosis por pérdida de las células caliciformes que son productoras de moco25 lo que genera una disminución de la resistencia a la infección por patógenos que normalmente serían atrapados en el moco y arrastrados hacia afuera gracias al flujo de este. En el tracto respiratorio, las bacterias que normalmente se eliminarían con el moco tienen mayor probabilidad de adherirse al epitelio afectado o a los sitios donde se produce una metaplasia escamosa debido a una deficiencia grave de vitamina A;26 de esta manera se puede producir un aumento del riesgo de infección invasiva. En ratas deficientes en vitamina A se ha demostrado que la mucosa gastrointestinal es incapaz de regenerarse adecuadamente, lo cual permite que los microorganismos patógenos invadan con mayor facilidad la mucosa; se genera así una mayor translocación bacteriana desde el intestino hacia los tejidos linfoides regionales y otros tejidos.27
Neutrófilos
En la maduración y función de los neutrófilos están involucrados dos factores de transcripción, C/EBPα y C/EBPε, que parecen ser inducidos por ATRA. Se ha demostrado que C/EBPε cuenta con un RAR en su región promotora por lo que es un blanco inmediato para el AR.28 Por otra parte, en estudios hechos con ratas se ha observado que en una deficiencia de vitamina A se afecta el desarrollo normal de los neutrófilos lo cual genera una disminución de la fagocitosis y de la eliminación de microorganismos.29 Paradójicamente, en ratones SENCAR deficientes en vitamina A, se observa un aumento en el número de granulocitos en la sangre periférica cuyo valor se restablece cuando reciben tratamiento con ácido retinoico.30 Sin embargo, no todas las cepas de ratones desarrollan neutrofilia durante la DVA, lo cual indica que la respuesta de los neutrófilos a una deficiencia de esta vitamina está determinada por las características genéticas del individuo, al menos en los modelos animales.
Macrófagos
Se ha observado que en estas células fagocíticas el AR inhibe la producción de citoquinas implicadas en la respuesta de células tipo Th1 y promueve la de aquellas que favorecen una respuesta Th2.31 Mehta y colaboradores analizaron el efecto ATRA en macrófagos peritoneales activados y observaron que este metabolito hace disminuir fuertemente el nivel de ARNm del factor de necrosis tumoral (TNF) y reduce la producción de óxido nítrico (ON) en macrófagos activados con lipopolisacárido (LPS).32 Usando células mononucleares de sangre de cordón umbilical y una línea celular de monocitos humanos THP-1, Kang y colaboradores observaron que el AR promueve la secreción de IL-10 e inhibe citoquinas inflamatorias como TNFα e IL-12.33 Estos resultados se correlacionan con los obtenidos por Cantorna y colaboradores, en los que se demuestra que la DVA lleva a una transcripción elevada de IL-12,34 mientras que el tratamiento con AR inhibe in vitro la producción de IL-12 por macrófagos.35 Paradojicamente, pese a que estos estudios sugieren que la DVA causa una mayor inflamación mediada por citoquinas proinflamatorias producidas por macrófagos, existen pruebas de que en tal deficiencia disminuyen la actividad fagocítica y la capacidad de los macrófagos peritoneales para eliminar bacterias, como el Sthapylococcus aureus;36 tal hallazgo se ha correlacionado con el hecho de que en la deficiencia en mención disminuyen en los fagocitos la capacidad de ingestión y la de reducir el azul de tetrazolio.37 Esto indica que la DVA promueve la inflamación mediante el incremento en la producción de IL-12 e IFN-γ pero afecta la capacidad de los macrófagos para ingerir y eliminar ciertas bacterias, un defecto que implica mayor replicación del patógeno en el sitio de la infección lo cual causa más inflamación y respuestas inmunes secundarias al proceso.
Células dendríticas
El AR puede modular también la presentación antigénica ejerciendo un efecto directo en la función de las células dendríticas. Estas actúan como presentadoras de antígeno y son capaces de iniciar la respuesta inmune interactuando con las células T. Por lo tanto, cualquier efecto que el AR pueda ejercer en las células dendríticas puede tener profundas implicaciones en la inmunidad adaptativa. Por ejemplo, el AR aumenta la expresión de las metaloproteinasas de matriz, lo cual incrementa la migración de las células dendríticas infiltrantes de tumor a los nódulos linfoides; con ello, potencialmente, se desencadena la respuesta de células T específica de tumor.38 Además, en presencia de estímulos inflamatorios como el TNF-α, el AR refuerza la maduración de estas células y su capacidad de ser presentadoras de antígeno; estos efectos son mediados por receptores RXR.39
Además, en un estudio reciente, Sun y colaboradores sugieren que las células dendríticas de las placas de Peyer inducen la diferenciación de las células T reguladoras (Treg) mediante un mecanismo dependiente de TGF-β y AR, un metabolito que se expresa en grandes cantidades en el tejido linfoide intestinal. La conversión de las células T vírgenes en Treg puede deteriorarse en presencia de inhibidores de las retinal-deshidrogenasas; ello indica que el AR facilita la generación de células Treg. 40
Linfocitos NK (células asesinas naturales)
Los linfocitos NK juegan un papel muy importante en la inmunidad innata por su capacidad de eliminar células infectadas con virus y células tumorales. A pesar de que no existen muchos estudios que relacionen la función de estas células con los metabolitos de la vitamina A, se ha demostrado en modelos murinos que en la DVA disminuyen tanto el número como la función citolítica de las células NK.41,42 Paradojicamente, Li y colaboradores, demostraron que el ATRA suprime la citotoxicidad de las células NK92 contra una línea celular blanco de manera dependiente de la dosis, y que los mecanismos por medio de los cuales ejerce su efecto el ATRA son la inhibición de la vía del factor nuclear κB (NF- κB) y la regulación negativa de la expresión de IFN-γ.43
Eosinófilos
Ueki y colaboradores estudiaron el papel de los metabolitos de la vitamina A en la homeostasis de los eosinófilos. Demostraron que estas células, purificadas a partir de sangre periférica humana, expresan los receptores para el AR y que si se cultivan en presencia de ATRA y 9-cis-AR tienen una tasa aumentada de supervivencia (asociada posiblemente a la regulación negativa de la caspasa 3 y a la inhibición de su actividad enzimática) e hipersegmentación nuclear.44
VITAMINA A Y RESPUESTA ADAPTATIVA
Linfocitos B
Los efectos del AR se pueden evidenciar desde el inicio del desarrollo de los linfocitos B. Usando como modelo ratones C57BL/6, se observó que el AR incrementa significativamente el número total de células B CD19+ en médula ósea y bazo.45 En este estudio, Chen y colaboradores confirman mediante experimentos in vitro que el aumento de las células B CD19+ está asociado a un acortamiento del tiempo de maduración de las células B y que en general la tasa reducida de progenitores linfoides de células B se debe a la maduración acelerada de estas células, efecto mediado por el receptor RARα. Además, evidenciaron que los factores de transcripción EBF1 y Pax-5 (necesarios para iniciar y mantener el proceso de linfopoyesis de células B, respectivamente)46 estaban elevados durante el tratamiento de los cultivos con ATRA y que los progenitores linfoides de células B humanas responden en forma similar ante el AR.
Por otra parte, el AR es un supresor de la proliferación de linfocitos B maduros, inducida por diversos estímulos. Se ha informado que el AR inhibe la proliferación de células B tanto de las estimuladas con receptor para antígeno del linfocito B (BCR, por la sigla en inglés de B cell antigen receptor) 47 como de las estimuladas mediante CD40 e IL-4;48 pese a ello, al mismo tiempo, incrementa la expresión en la superficie de los linfocitos B de la molécula CD38, lo que indica la diferenciación hacia el fenotipo de célula plasmática (CD38+/CD20-/IgD-).49
Con respecto a la producción de anticuerpos, se ha informado en modelos animales que durante la DVA, disminuye la síntesis de anticuerpos T dependientes. Además se ha observado que el AR induce eficientemente la secreción de IgA por parte de linfocitos B estimulados y cocultivados con células dendríticas.50 Sin embargo, la sola presencia de AR, sin células dendríticas, durante la activación de células B purificadas no es suficiente para producir este efecto. Recientemente se demostró que la óxido-nítrico-sintetasa (iNOS) y el óxido nítrico son importantes en la generación de células plasmáticas y en la secreción de IgA en las mucosas. 51 De forma muy interesante, el promotor del gen iNOS contiene un elemento de respuesta al ácido retinoico (RARE, por la sigla en inglés de retinoic acid response element) que se activa directamente por la unión del AR a su receptor RARα-RXRα.52 Es así como el AR puede contribuir indirectamente a la secreción de IgA induciendo iNOS y, en consecuencia, incrementando el nivel de óxido nítrico.
A pesar de los muchos informes que muestran el efecto potenciador del AR en la producción de IgA e IgG, también se ha observado el efecto contrario en la producción de IgE in vitro, cuando se estimula a las células mediante CD40 más IL-4.53
Linfocitos T
El AR amplifica la proliferación de las células T porque genera en ellas mayor secreción de IL-254 e inhibe la apoptosis, efecto mediado por RARα.55 Además, se ha observado un aumento de las funciones citotóxicas de estas células en presencia de AR.54
Gordy y colaboradores hacen una excelente descripción de cómo RARγ modula las funciones de los linfocitos T CD8+. Por ejemplo, la unión del ligando a RARγ puede generar un aumento en la producción de IFN-γ en los linfocitos T CD8+; esto podría ocurrir por la acción directa de RARγ en la transcripción de IFN-γ; sin embargo, no se ha identificado un sitio de unión del RAR al promotor del gen IFN-γ y por ello se sugiere que RARγ puede regular positivamente un producto intermedio que favorezca la producción de IFN-γ.56
Los metabolitos de la vitamina A también pueden modular respuestas más específicas de la inmunidad, como el balance Th1-Th2 y la diferenciación de células Treg y células Th17. Como se mencionó anteriormente, se ha documentado la asociación de la DVA con una menor respuesta de tipo Th2 e inversamente el suplemento con AR bloquea la producción in vivo e in vitro, de citoquinas de tipo Th1.31 El AR promueve la diferenciación celular de los linfocitos Th hacia Th2 porque induce la expresión del gen de la IL-4-57 De hecho, el AR puede bloquear la expresión de T-bet, un factor de transcripción clave para la respuesta Th1 y por el contrario promover los factores transcripcionales GATA-3, MAF y STAT6, todos ellos importantes para inducir la respuesta Th2.58
En un estudio en ratones, hecho por Benson y colaboradores, se demostró que el AR también refuerza claramente la expresión de Foxp3 en células T CD4+ estimuladas con antígeno o anti-CD3 y TGF-β. Los resultados muestran que casi el 100%de las células T llegaron a ser Foxp3+ en presencia de AR, y que este metabolito de la vitamina A refuerza el crecimiento de dichas células, aumenta su actividad supresora y las hace resistentes a una reversión al fenotipo Foxp3- in vivo.59 Al promover en las células T CD4+ el fenotipo Foxp3+, el AR bloquea la inducción de RORγt (del inglés, retinoic-acid-receptor-related orphan receptor-γt), un factor de transcripción clave para la diferenciación de células Th17.60 Cabe mencionar que este efecto depende de la concentración de AR. De hecho, el AR en bajas concentraciones parece ser importante para generar células Th17.50 En conclusión, el AR tiene un efecto doble en la tolerancia inmunológica: según su concentración, favorece la inducción de células Treg y puede simultáneamente bloquear o reforzar la diferenciación celular Th17.
Por otra parte, se ha observado que el AR facilita el establecimiento de los linfocitos estimulados antigénicamente en el tracto digestivo. Este proceso lo median la integrina α4β7 y el receptor de quimioquina CCR9 en las células T que se unen a MadCAM-1 y CCL25, moléculas expresadas en las células endoteliales de las vénulas postcapilares y las epiteliales del intestino delgado, respectivamente.61 En ratones deficientes en vitamina A, las células T efectoras o de memoria α4β7+CD4+ se encuentran prácticamente ausentes en los órganos linfoides secundarios del intestino.22 Esto se puede deber a que el AR potencia la expresión de α4β7 y CCR9 en células T CD4+ vírgenes cuando se activan con anticuerpos anti-CD3 y CD28.62 (Tabla n.° 1).
ESTUDIOS CLÍNICOS RELACIONADOS CON LA VITAMINA A, INMUNIDAD Y RESPUESTA A LAS INFECCIONES
La influencia de la vitamina A sobre la función inmune se ha estudiado ampliamente in vivo e in vitro en diferentes modelos experimentales; sin embargo, no existen suficientes estudios clínicos en seres humanos del impacto directo del suplemento de vitamina A como inmunomodulador. Durante años se han efectuado ensayos clínicos tratando de relacionar dicho suplemento con las enfermedades diarreicas; los resultados han sido heterogéneos.
En un estudio en India, se evaluó la capacidad del suplemento de vitamina A (200.000 UI de vitamina A o placebo en el momento de ingresar o al ser dado de alta del hospital) para restablecer la permeabilidad del tubo digestivo; se midió la excreción urinaria de lactulosa/manitol en 94 niños (edad promedio: 9 meses) hospitalizados por diarrea o enfermedad respiratoria. Todos los niños tratados con vitamina A recuperaron más rápidamente la integridad intestinal.63 Por otra parte, revisando ensayos clínicos relacionados con el suplemento de vitamina A en niños, Oliveira y Rondo64 encontraron que este se asocia a una reducción del riesgo de mortalidad por diarrea y sarampión en un 23-30%. Paradójicamente, en un estudio llevado a cabo en niños mejicanos de 6 a 15 meses de edad, quienes recibieron 20.000 o 45.000 UI de retinol dos veces por semana durante un año (según que fueran menores o mayores de 1 año), se observó que quienes recibieron el suplemento en comparación con el placebo presentaron mayores y más frecuentes episodios de diarrea. 65
Con respecto a la influencia del retinol en el recuento de glóbulos blancos en la sangre periférica, un estudio de corte transversal en mujeres embarazadas de África reveló que la concentración baja de retinol en sangre se relaciona con un recuento más alto de neutrófilos, hallazgo que concuerda con lo observado en animales deficientes en vitamina A.66 En otro estudio, en Indonesia, se observaron los efectos del suplemento de vitamina A (60 mg de retinol equivalente - RE) en niños de 3 a 6 años de edad; para el estudio se les extrajeron células mononucleares de sangre periférica y se procedió a marcarlas con anticuerpos fluorescentes y a analizarlas por citometría de flujo; se halló aumento en la proporción de linfocitos T CD4/CD8 y en la de células T CD4+ vírgenes (CD45RA); además, disminuyó la proporción de CD8 y de linfocitos T CD45RO después de 5 semanas de tratamiento, comparando con el grupo control.67 Jason y colaboradores estudiaron niños (edad promedio: 2,6 años) en Malawi – Africa, para evaluar la asociación entre el nivel sérico de vitamina A y los parámetros inmunológicos; hallaron asociación del nivel bajo de dicha vitamina (menos de 20 µg/mL) con mayor porcentaje de linfocitos NK: 8,3% contra 5,2% en niños con nivel por encima de 20 µg/mL (p = 0,008).68
También se ha observado que la carencia de vitamina A afecta directamente los niveles de ciertas citoquinas en la sangre periférica. En un estudio de corte transversal, efectuado en Venezuela en niños de 4 a 7 años que sufrían de DVA, se observó que la concentración sérica de IL-10 estaba reducida en comparación con la del grupo control.69 Por otra parte, en un ensayo sin asignación aleatoria ni grupo control placebo, se estudiaron 6 pacientes con diagnóstico de inmunodeficiencia común variable previamente caracterizados con bajo nivel plámatico de vitamina A, a quienes trataron con esta vitamina en dosis de 6.500 UI/día durante 6 meses; se observó que disminuía la concentración de TNF-α tanto en el plasma como en el sobrenadante del cultivo in vitro de monocitos, en comparación con los niveles basales.70
CONCLUSIONES
Aun en la actualidad, la deficiencia de vitamina A (DVA) sigue siendo un problema importante de salud pública en países como Colombia, especialmente en la población infantil. Esta condición afecta muchos aspectos de la respuesta inmune entre los cuales se encuentran las barreras naturales, la inmunidad innata y la adaptativa. Sin embargo, en las células del sistema inmune, sus efectos dependen en gran medida del estadio de diferenciación y del grado de deficiencia. De manera general, se acepta que la DVA promueve la inflamación pero afecta la fagocitosis, disminuye la producción de anticuerpos y la diferenciación y función de las células T ayudadoras del fenotipo Th2. Además, la DVA aumenta el porcentaje de células NK en la sangre periférica y disminuye el nivel de IL-10 en suero. Todos estos efectos se reflejan en una mayor susceptibilidad al desarrollo y gravedad de las infecciones en la infancia, aunque los estudios en esta área son aún controversiales y los efectos dependen muy probablemente de las características genéticas de la población en estudio. Por otra parte, se sabe que el suplemento de vitamina A altera la proporción de células inmunes en la sangre periférica pero aún no se conoce la relevancia de estos hallazgos en el funcionamiento correcto del sistema inmune tras las infecciones o los procesos tumorales. A nivel molecular, muchos genes relacionados con el sistema inmune contienen elementos de respuesta al ácido retinoico (ERAR) pero no se han descrito en su totalidad las vías de señalización implicadas en la trascripción de estos genes en respuesta al ácido retinoico. Se necesitan aún más estudios para describir estos eventos en detalle, lo que permitirá definir la eficacia real del suplemento con vitamina A en el mantenimiento de la homeostasis tanto del sistema inmune como de otros sistemas.
REFERENCIAS BIBLIOGRÁFICAS
1. Rosenfeld L. Vitamine--vitamin. The early years of discovery. Clin Chem, 1997; 43(4): 680-685. [ Links ]
2. Rosenberg IH. Challenges and opportunities in the translation of the science of vitamins. Am J Clin Nutr, 2007; 85(1): 325S-327S. [ Links ]
3. Mora JR, Iwata M, von Andrian UH. Vitamin effects on the immune system: vitamins A and D take centre stage. Nat Rev Immunol, 2008; 8: 685-698. [ Links ]
4. WHO, Vitamin A deficiency. World Health Organization; 2009 [citado 1 de diciembre de 2009]; Disponible en http://www.who.int/nutrition/topics/vad/en/index.html. [ Links ]
5. Mora JO, Gueri M, Mora OL. Vitamin A deficiency in Latin America and the Caribbean: an overview. Rev Panam Salud Públ, 1998; 4 (3): 178-186. [ Links ]
6. Castro de Navarro L NS. Encuesta nacional de micronutrientes, Colombia 1995. Bogotá,Colombia: Instituto Nacional de Salud, Profamilia; 1996. [ Links ]
7. WHO. WHO Global Database on Vitamin A Deficiency 2009 [citado 2009]; Data by country based on xerophthalmia and/or serum or plasma retinol concentration]. Disponible en http://www.who.int/vmnis/vitamina/en/. [ Links ]
8. Villamor E, Fawzi WW. Effects of vitamin A supplementation on immune responses and correlation with clinical outcomes. Clin Microbiol Rev, 2005; 18 (3): 446-464. [ Links ]
9. Harrison EH. Mechanisms of digestion and absorption of dietary vitamin A. Annu Rev Nutr, 2005; 25:87- 103. [ Links ]
10. Huang HS, Goodman DS. Vitamin A and carotenoids. I. Intestinal absorption and metabolism of 14c-labelled vitamin A alcohol and beta-carotene in the rat. J Biol Chem, 1965; 240: 2839-2844. [ Links ]
11. Hollander D. Intestinal absorption of vitamins A, E, D, and K. J Lab Clin Med, 1981; 97 (4): 449-462. [ Links ]
12. Blomhoff R, Blomhoff HK. Overview of retinoid metabolism and function. J Neurobiol, 2006; 66 (7) :606- 630. [ Links ]
13. E X, Zhang L, Lu J, Tso P, Blaner WS, Levin MS, et al. Increased neonatal mortality in mice lacking cellular retinol-binding protein II. J Biol Chem, 2002; 277 (39): 36617-36623. [ Links ]
14. Paik J, Vogel S, Quadro L, Piantedosi R, Gottesman M, Lai K, et al. Vitamin A: overlapping delivery pathways to tissues from the circulation. J Nutr, 2004; 134 (1): 276S-280S. [ Links ]
15. Senoo H. Structure and function of hepatic stellate cells. Med Electron Microsc, 2004; 37 (1): 3-15. [ Links ]
16. Kanai M, Raz A, Goodman DS. Retinol-binding protein: the transport protein for vitamin A in human plasma. J Clin Invest, 1968; 47 (9): 2025-2044. [ Links ]
17. Cifelli CJ, Green JB, Green MH. Dietary retinoic acid alters vitamin A kinetics in both the whole body and in specific organs of rats with low vitamin A status. J Nutr, 2005; 135 (4): 746-752. [ Links ]
18. Everts HB, Sundberg JP, Ong DE. Immunolocalization of retinoic acid biosynthesis systems in selected sites in rat. Exp Cell Res, 2005; 308 (2): 309-319. [ Links ]
19. Vasiliou V, Bairoch A, Tipton KF, Nebert DW. Eukaryotic aldehyde dehydrogenase (ALDH) genes: human polymorphisms, and recommended nomenclature based on divergent evolution and chromosomal mapping. Pharmacogenetics, 1999; 9 (4): 421-434. [ Links ]
20. Pares X, Farres J, Kedishvili N, Duester G. Mediumand short-chain dehydrogenase/reductase gene and protein families: Medium-chain and short-chain dehydrogenases/reductases in retinoid metabolism. Cell Mol Life Sci, 2008; 65 (24): 3936-3949. [ Links ]
21. Lampen A, Meyer S, Arnhold T, Nau H. Metabolism of vitamin A and its active metabolite all-trans-retinoic acid in small intestinal enterocytes. J Pharmacol Exp Ther, 2000; 295 (3): 979-985. [ Links ]
22. Iwata M, Hirakiyama A, Eshima Y, Kagechika H, Kato C, Song SY. Retinoic acid imprints gut-homing specificity on T cells. Immunity, 2004; 21 (4): 527-538. [ Links ]
23. Bastien J, Rochette-Egly C. Nuclear retinoid receptors and the transcription of retinoid-target genes. Gene, 2004; 328: 1-16. [ Links ]
24. Dawson MI. The importance of vitamin A in nutrition. Curr Pharm Des, 2000; 6 (3): 311-325. [ Links ]
25. McCullough FS, Northrop-Clewes CA, Thurnham DI. The effect of vitamin A on epithelial integrity. Proc Nutr Soc, 1999; 58 (2): 289-293. [ Links ]
26. Chang MM, Harper R, Hyde DM, Wu R. A novel mechanism of retinoic acid-enhanced interleukin-8 gene expression in airway epithelium. Am J Respir Cell Mol Biol, 2000; 22 (4): 502-510. [ Links ]
27. Wiedermann U, Hanson LA, Bremell T, Kahu H, Dahlgren UI. Increased translocation of Escherichia coli and development of arthritis in vitamin A-deficient rats. Infect Immun, 1995; 63 (8): 3062-3068. [ Links ]
28. Morosetti R, Park DJ, Chumakov AM, Grillier I, Shiohara M, Gombart AF, et al. A novel, myeloid transcription factor, C/EBP epsilon, is upregulated during granulocytic, but not monocytic, differentiation. Blood, 1997; 90 (7): 2591-2600. [ Links ]
29. Twining SS, Schulte DP, Wilson PM, Fish BL, Moulder JE. Vitamin A deficiency alters rat neutrophil function. J Nutr, 1997; 127 (4): 558-565. [ Links ]
30. Zhao Z, Ross AC. Retinoic acid repletion restores the number of leukocytes and their subsets and stimulates natural cytotoxicity in vitamin A-deficient rats. J Nutr, 1995; 125 (8): 2064-2073. [ Links ]
31. Iwata M, Eshima Y, Kagechika H. Retinoic acids exert direct effects on T cells to suppress Th1 development and enhance Th2 development via retinoic acid receptors. Int Immunol, 2003; 15 (8): 1017-1025. [ Links ]
32. Mehta K, McQueen T, Tucker S, Pandita R, Aggarwal BB. Inhibition by all-trans-retinoic acid of tumor necrosis factor and nitric oxide production by peritoneal macrophages. J Leukoc Biol, 1994; 55 (3): 336-342. [ Links ]
33. Kang BY, Chung SW, Kim SH, Kang SN, Choe YK, Kim TS. Retinoid-mediated inhibition of interleukin-12 production in mouse macrophages suppresses Th1 cytokine profile in CD4(+) T cells. Br J Pharmacol, 2000; 130 (3): 581-586. [ Links ]
34. Cantorna MT, Nashold FE, Hayes CE. In vitamin A deficiency multiple mechanisms establish a regulatory T helper cell imbalance with excess Th1 and insufficient Th2 function. J Immunol, 1994; 152 (4): 1515- 1522. [ Links ]
35. Na SY, Kang BY, Chung SW, Han SJ, Ma X, Trinchieri G, et al. Retinoids inhibit interleukin-12 production in macrophages through physical associations of retinoid X receptor and NFkappaB. J Biol Chem, 1999; 274 (12): 7674-7680. [ Links ]
36. Wiedermann U, Tarkowski A, Bremell T, Hanson LA, Kahu H, Dahlgren UI. Vitamin A deficiency predisposes to Staphylococcus aureus infection. Infect Immun, 1996; 64 (1): 209-214. [ Links ]
37. Sijtsma SR, Rombout JH, Dohmen MJ, West CE, van der Zijpp AJ. Effect of vitamin A deficiency on the activity of macrophages in Newcastle disease virusinfected chickens. Vet Immunol Immunopathol, 1991; 28 (1): 17-27. [ Links ]
38. Darmanin S, Chen J, Zhao S, Cui H, Shirkoohi R, Kubo N, et al. All-trans retinoic acid enhances murine dendritic cell migration to draining lymph nodes via the balance of matrix metalloproteinases and their inhibitors. J Immunol, 2007; 179 (7): 4616-4625. [ Links ]
39. Geissmann F, Revy P, Brousse N, Lepelletier Y, Folli C, Durandy A, et al. Retinoids regulate survival and antigen presentation by immature dendritic cells. J Exp Med, 2003; 198 (4): 623-634. [ Links ]
40. Sun CM, Hall JA, Blank RB, Bouladoux N, Oukka M, Mora JR, et al. Small intestine lamina propria dendritic cells promote de novo generation of Foxp3 T reg cells via retinoic acid. J Exp Med, 2007; 204 (8): 1775-1785. [ Links ]
41. Bowman TA, Goonewardene IM, Pasatiempo AM, Ross AC, Taylor CE. Vitamin A deficiency decreases natural killer cell activity and interferon production in rats. J Nutr, 1990; 120 (10): 1264-1273. [ Links ]
42. Dawson HD, Li NQ, DeCicco KL, Nibert JA, Ross AC. Chronic marginal vitamin A status reduces natural Nutr, 1999; 129 (8): 1510-1517. [ Links ]
43. Li A, He M, Wang H, Qiao B, Chen P, Gu H, et al. Alltrans retinoic acid negatively regulates cytotoxic activities of nature killer cell line 92. Biochem Biophys Res Commun, 2007; 352 (1): 42-47. [ Links ]
44. Ueki S, Mahemuti G, Oyamada H, Kato H, Kihara J, Tanabe M, et al. Retinoic acids are potent inhibitors of spontaneous human eosinophil apoptosis. J Immunol, 2008; 181 (11): 7689-7698. [ Links ]
45. Chen X, Esplin BL, Garrett KP, Welner RS, Webb CF, Kincade PW. Retinoids accelerate B lineage lymphoid differentiation. J Immunol, 2008; 180 (1): 138- 145. [ Links ]
46. Nutt SL, Heavey B, Rolink AG, Busslinger M. Commitment to the B-lymphoid lineage depends on the transcription factor Pax5. Nature, 1999; 401 (6753): 556-562. [ Links ]
47. Chen Q, Ross AC. Inaugural Article: Vitamin A and immune function: retinoic acid modulates population dynamics in antigen receptor and CD38-stimulated splenic B cells. Proc Natl Acad Sci USA, 2005 ; 102 (40): 14142-14149. [ Links ]
48. Chen Q, Ross AC. Retinoic acid promotes mouse splenic B cell surface IgG expression and maturation stimulated by CD40 and IL-4. Cell Immunol, 2007; 249 (1): 37-45. [ Links ]
49. Morikawa K, Nonaka M. All-trans-retinoic acid accelerates the differentiation of human B lymphocytes maturing into plasma cells. Int Immunopharmacol, 2005; 5 (13-14): 1830-1838. [ Links ]
50. Uematsu S, Fujimoto K, Jang MH, Yang BG, Jung YJ, Nishiyama M, et al. Regulation of humoral and cellular gut immunity by lamina propria dendritic cells expressing Toll-like receptor 5. Nat Immunol, 2008; 9 (7): 769-776. [ Links ]
51. Tezuka H, Abe Y, Iwata M, Takeuchi H, Ishikawa H, Matsushita M, et al. Regulation of IgA production by naturally occurring TNF/iNOS-producing dendritic cells. Nature, 2007; 448 (7156): 929-933. [ Links ]
52. Zou F, Liu Y, Liu L, Wu K, Wei W, Zhu Y, et al. Retinoic acid activates human inducible nitric oxide synthase gene through binding of RARalpha/RXRalpha heterodimer to a novel retinoic acid response element in the promoter. Biochem Biophys Res Commun, 2007; 355 (2): 494-500. [ Links ]
53. Scheffel F, Heine G, Henz BM, Worm M. Retinoic acid inhibits CD40 plus IL-4 mediated IgE production through alterations of sCD23, sCD54 and IL-6 production. Inflamm Res, 2005; 54 (3): 113-118. [ Links ]
54. Ertesvag A, Engedal N, Naderi S, Blomhoff HK. Retinoic acid stimulates the cell cycle machinery in normal T cells: involvement of retinoic acid receptormediated IL-2 secretion. J Immunol, 2002; 169 (10): 5555-5563. [ Links ]
55. Szondy Z, Reichert U, Bernardon JM, Michel S, Toth R, Karaszi E, et al. Inhibition of activation-induced apoptosis of thymocytes by all-trans- and 9-cisretinoic acid is mediated via retinoic acid receptor alpha. Biochem J, 1998; 331 ( Pt 3): 767-774. [ Links ]
56. Gordy C, Dzhagalov I, He YW. Regulation of CD8(+) T cell functions by RARgamma. Semin Immunol, 2009; 21 (1): 2-7. [ Links ]
57. Lovett-Racke AE, Racke MK. Retinoic acid promotes the development of Th2-like human myelin basic protein-reactive T cells. Cell Immunol, 2002; 215 (1): 54-60. [ Links ]
58. Dawson HD, Collins G, Pyle R, Key M, Weeraratna A, Deep-Dixit V, et al. Direct and indirect effects of retinoic acid on human Th2 cytokine and chemokine expression by human T lymphocytes. BMC Immunol, 2006; 7: 27 doi: 10.1186/1471-2172-7-27. [ Links ]
59. Benson MJ, Pino-Lagos K, Rosemblatt M, Noelle RJ. All-trans retinoic acid mediates enhanced T reg cell growth, differentiation, and gut homing in the face of high levels of co-stimulation. J Exp Med, 2007; 204 (8): 1765-1774. [ Links ]
60. Mucida D, Park Y, Kim G, Turovskaya O, Scott I, Kronenberg M, et al. Reciprocal TH17 and regulatory T cell differentiation mediated by retinoic acid. Science, 2007; 317 (5835): 256-260. [ Links ]
61. Svensson M, Marsal J, Ericsson A, Carramolino L, Broden T, Marquez G, et al. CCL25 mediates the localization of recently activated CD8alphabeta(+) lymphocytes to the small-intestinal mucosa. J Clin Invest, 2002; 110 (8): 1113-1121. [ Links ]
62. Iwata M. Retinoic acid production by intestinal dendritic cells and its role in T-cell trafficking. Semin Immunol, 2009; 21 (1): 8-13. [ Links ]
63. Thurnham DI, Northrop-Clewes CA, McCullough FS, Das BS, Lunn PG. Innate immunity, gut integrity, and vitamin A in Gambian and Indian infants. J Infect Dis, 2000; 182 (Suppl 1): S23-S28. [ Links ]
64. Oliveira JM, Rondo PH. Evidence of the impact of vitamin A supplementation on maternal and child health. Cad Saude Publica, 2007; 23 (11): 2565-2575. [ Links ]
65. Kurt Z, Long YM, Hertzmark E, Santos JI, Rosado JL. A double-blind, randomized, clinical trial of the effect of vitamin A and zinc supplementation on diarrheal disease and respiratory tract infections in children in Mexico City, Mexico. Am J Clin Nutr, 2006; 83 (3): 693-700. [ Links ]
66. Gomo E, Vennervald BJ, Ndhlovu PD, Kaestel P, Nyazema NZ, Friis H. Reference values and predictors of white blood cell subset counts: a cross-sectional study among HIV seronegative pregnant women in Zimbabwe. Eur J Obstet Gynecol Reprod Biol, 2003; 107 (2): 156-162. [ Links ]
67. Semba RD. Vitamin A and immunity to viral, bacterial and protozoan infections. Proc Nutr Soc, 1999; 58 (3): 719-727. [ Links ]
68. Jason J, Archibald LK, Nwanyanwu OC, Sowell AL, Buchanan I, Larned J, et al. Vitamin A levels and immunity in humans. Clin Diagn Lab Immunol, 2002; 9 (3): 616-621. [ Links ]
69. Leal JY, Castejon HV, Romero T, Ortega P, Gomez G, Amaya D, et al. Serum values of cytokines in children with vitamin A deficiency disorders. Invest Clin, 2004; 45 (3): 243-256. [ Links ]
70. Aukrust P, Muller F, Ueland T, Svardal AM, Berge RK, Froland SS. Decreased vitamin A levels in common variable immunodeficiency: vitamin A supplementation in vivo enhances immunoglobulin production and downregulates inflammatory responses. Eur J Clin Invest, 2000; 30 (3): 252- 259. [ Links ]
Recibido: diciembre 15 de 2009
Aceptado: abril 27 de 2010