Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.23 no.4 Medellín Oct./Dec. 2010
PRESENTACIÓN DE CASOS
Quiste broncogénico: presentación de un caso en el período neonatal
Bronchogenic cyst: report of a case in the neonatal period
Olga Lucía Morales Múnera1, Mabel Viviana Valencia Muñoz2, María de la Luz Valencia Chávez3, Íngrid Bissinger Nishikuni4
1 Neumóloga Pediatra. Hospital Universitario San Vicente de Paúl, Medellín, Colombia. Docente de la Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. olmmunera@yahoo.com
2 Residente de Pediatría, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
3 Neumóloga Pediatra. Docente de la Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
4 Alergóloga. Docente de la Facultad de Medicina, Universidad de Antioquia y de la Universidad San Martín, Medellín, Colombia.
RESUMEN
El quiste broncogénico es una malformación de la pared ventral del intestino primitivo que genera alteraciones en el desarrollo del árbol traqueobronquial. Presentamos el caso de un varón recién nacido con un quiste broncogénico en el lóbulo superior derecho, remitido a la unidad de cuidados intensivos neonatales del Hospital Universitario San Vicente de Paúl, de Medellín, por dificultad respiratoria progresiva y quiste torácico congénito. El tratamiento quirúrgico –lobectomía- fue exitoso.
Los quistes brocogénicos son un grupo heterogéneo; pueden ser únicos o múltiples y generalmente están confinados a un segmento o lóbulo pulmonar; su sintomatología se debe a compresión o sobreinfección y depende del lugar y el tamaño del quiste; el tratamiento de elección es el quirúrgico aun en pacientes asintomáticos.
Palabras clave
Período neonatal, Quiste broncogénico
SUMMARY
Bronchogenic cysts are malformations of the ventral wall of the primitive gut that disturb the development of the tracheo-bronchial tree. We report the case of a newborn male with a bronchogenic cyst in the right upper lobe, referred to the neonatal intensive care unit at Hospital Universitario San Vicente de Paul, in Medellín, Colombia, because of progressive respiratory distress. Surgical treatment by lobectomy was successful. Bronchogenic cysts are a heterogeneous group of abnormalities. They may be single or multiple and are usually confined to a pulmonary segment or lobe. Symptomatology is due to compression or superinfection, and depends on the location and size of the cyst. Treatment of choice is surgery even in asymptomatic patients.
Key words
Bronchogenic cyst, Neonatal period
INTRODUCCIÓN
Las malformaciones congénitas quísticas del pulmón se originan de la porción ventral del intestino primitivo; son entidades clínicas raras que pueden afectar la vía aérea, el parénquima pulmonar, las arterias y el drenaje venoso. En este grupo se incluyen: la malformación adenomatoidea quística, el secuestro pulmonar, el enfisema lobar congénito y el quiste broncogénico; muchas de las lesiones son híbridas, con características de malformación adenomatoidea quística y secuestro pulmonar.1-3
El diagnóstico se establece por la radiografía de tórax en un 20 a 77% de los casos; la tomografía contrastada de tórax evidencia mejor las malformaciones multiquísticas, la presencia de aire y la interfaz aire/líquido; también puede mostrar la afectación perilesional no sospechada en la radiografía y, además, permite delimitar mejor las lesiones.4,5 Con el uso de la ecografía gestacional y de la resonancia magnética antenatal ha aumentado la detección de estas anomalías in útero, lo cual permite programar la atención del parto y el tratamiento posnatal del niño; además, hacer el diagnóstico diferencial con anormalidades extratorácicas como la hernia diafragmática congénita. Sin embargo, no se puede definir con exactitud la naturaleza de la lesión con las imágenes prenatales ni con las posnatales. Más recientemente, con el uso de la resonancia magnética ultrarrápida, que elimina los artificios causados por los movimientos fetales y la respiración materna, se logran imágenes de alta calidad que le dan más precisión al diagnóstico.2,6
Si las lesiones quísticas son grandes pueden comprimir el esófago lo que produce dificultad para deglutir y se traduce como polihidramnios. También pueden comprimir el pulmón de lo que resulta hipoplasia pulmonar; en esas condiciones el pulmón es incapaz de hacer un intercambio gaseoso adecuado, lo que puede llevar al desarrollo de hipertensión pulmonar y persistencia de la circulación fetal. Las lesiones que desvían el mediastino producen no solo compresión del pulmón sino también alteración del retorno venoso al corazón produciendo una hidropesía fetal (hydrops fetalis) no inmune que se manifiesta como ascitis fetal, derrame pericárdico o pleural, edema de la piel y el cuero cabelludo.1 La hidropesía causa placentomegalia con mala perfusión en la cual se presenta lesión endotelial con liberación de factores vasoactivos.
En este artículo se describen el quiste broncogénico en diferentes edades y los tratamientos establecidos y se presenta un paciente con sintomatología perinatal y quiste broncogénico, en cuya ecografía prenatal no se había identificado la imagen quística posiblemente por haberla hecho en los primeros meses del embarazo.
PRESENTACIÓN DEL CASO
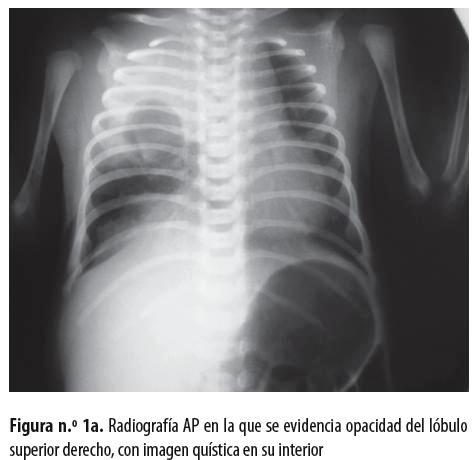
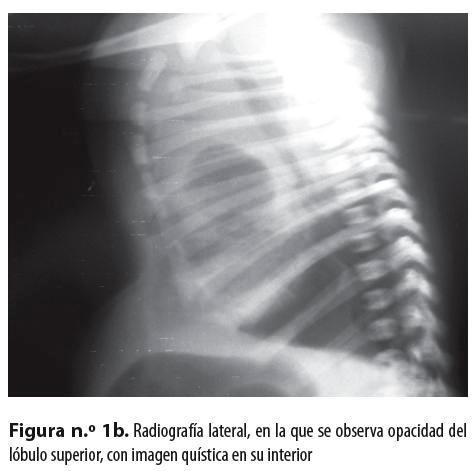
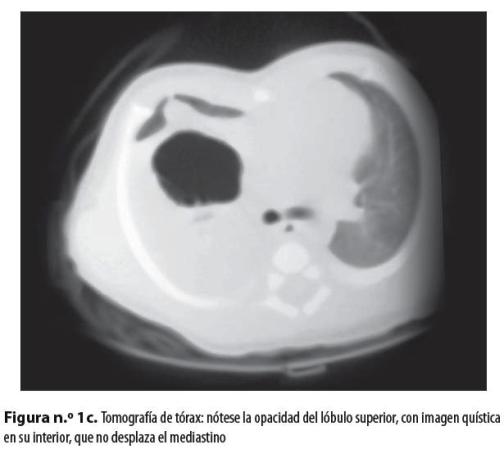
Neonato de sexo masculino, producto de madre primigestante de 22 años, quien hizo control prenatal hasta los siete meses, con ecografía gestacional normal; nació de 36 semanas por parto en vértice espontáneo sin complicaciones, con peso de 2.660 gramos y talla de 45 centímetros; APGAR al nacer: 8 al minuto y 10 a los 5 minutos; no requirió reanimación con presión positiva, pero posteriormente presentó síndrome de dificultad respiratoria progresiva. En una radiografía de tórax (figuras n.° 1a y 1b) se evidenció opacidad del lóbulo superior derecho con imagen quística en su interior; se hizo tomografía sin contraste en la que se observó una imagen quística a cuyo alrededor había consolidación (figura n.° 1c). Se hizo remisión al Hospital Universitario San Vicente de Paúl, de Medellín, con diagnóstico de malformación congénita pulmonar.
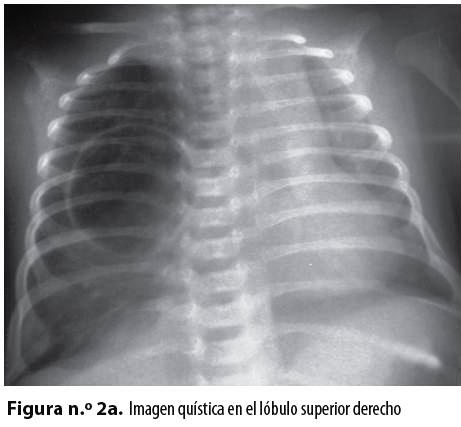
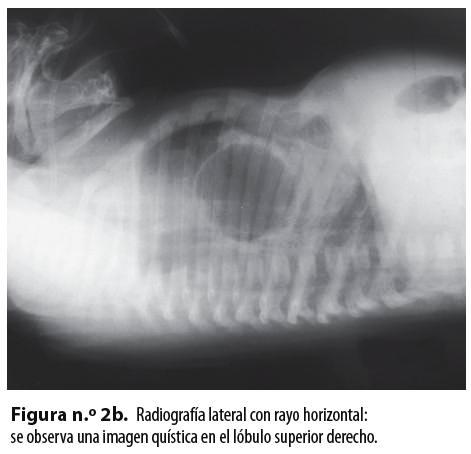
Se plantearon, como diagnósticos de trabajo, un quiste broncogénico con atelectasia alrededor y una malformación adenomatoidea quística; se tomó una radiografía de tórax AP y lateral con rayo horizontal que mostró una imagen radiolúcida bien definida en el lóbulo superior derecho (Figuras n.° 2a y 2b).
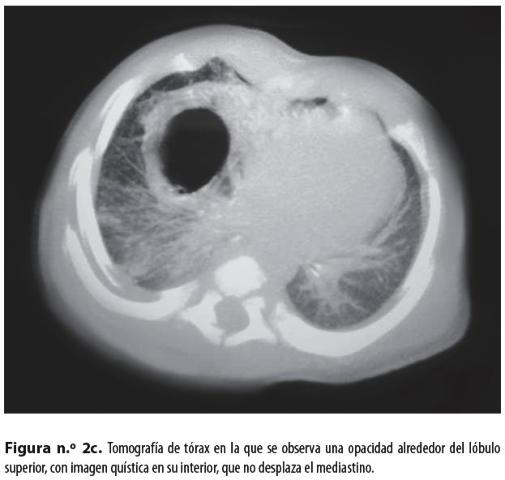
Se hizo el diagnóstico de quiste broncogénico y, para el procedimiento quirúrgico, se tomó una nueva tomografía (Figura n.° 2c)
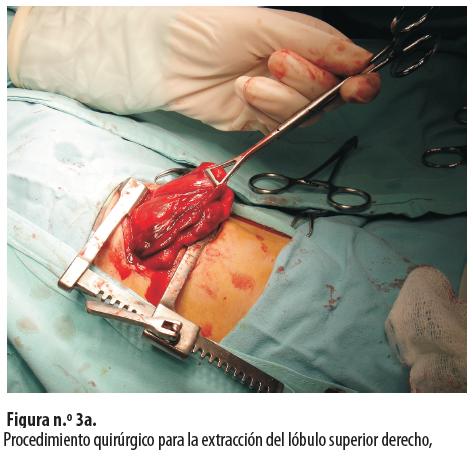
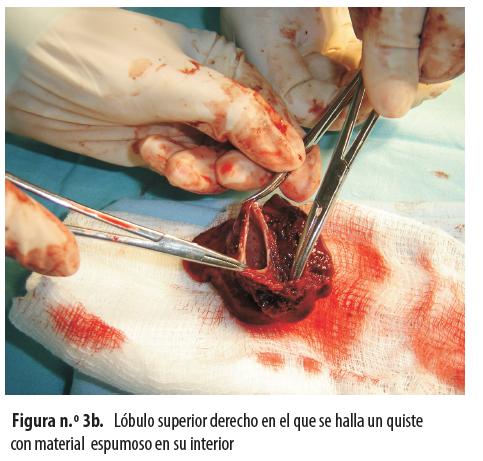
Se le hizo lobectomía del lóbulo superior derecho (figuras n.° 3a y 3b).
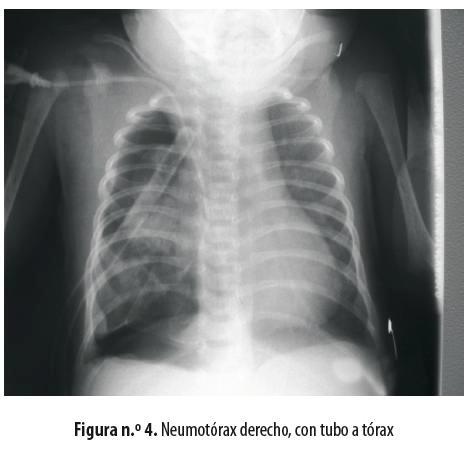
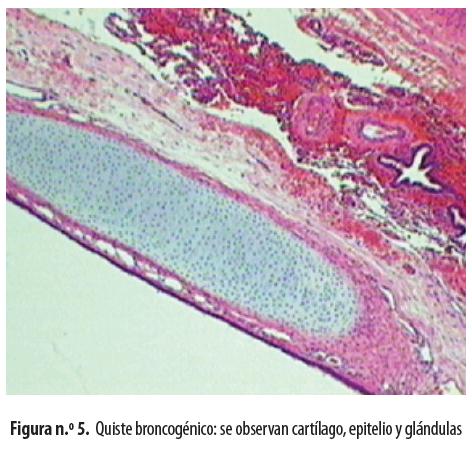
Una vez extubado se lo trasladó a la unidad de cuidados intensivos neonatales. Al día siguiente del procedimiento quirúrgico presentó neumotórax a tensión que mejoró con succión continua (figura n.º 4). Permaneció una semana en la UCI y ocho días más en el hospital y salió en muy buenas condiciones generales, sin dificultad respiratoria ni oxígeno domiciliario. El informe de patología fue ''Quiste broncogénico'' (Figura n.º 5)
DISCUSIÓN
El quiste broncogénico es una malformación congénita infrecuente de la pared ventral del intestino primitivo, del cual procede el árbol traqueobronquial; sin embargo, es una de las malformaciones quísticas más frecuentes en el mediastino; se presenta entre las semanas quinta y decimosexta de la gestación debido a que un segmento de la yema bronquial queda desconectado de la porción principal en desarrollo; presenta estrecha conexión con el árbol traqueobronquial pero no incorpora tejido mesenquimatoso pulmonar, como sí sucede en el secuestro pulmonar, aunque puede comunicarse con él a través de un bronquio accesorio; en algunas ocasiones puede comunicarse con el esófago por medio de un tejido fibroso; es rara la asociación con otros defectos congénitos, excepto cuando su presentación es cervical en cuyo caso pueden coexistir anormalidades de la columna vertebral y el pericardio y duplicación gástrica.7-9
El primero que describió esta malformación fue Blackader en 1911; Maier en 1948 informó la primera resección quirúrgica y Bush en 2001 estableció una nueva clasificación de las enfermedades congénitas pulmonares en la que se incluyó el quiste broncogénico como una malformación torácica congénita.7
El quiste broncogénico representa alrededor de 25% de todas las malformaciones congénitas pulmonares y el 10% de las masas mediastinales en los niños, no tiene relación con la raza o el sexo, ni se puede predecir el riesgo de sufrirla por el antecedente familiar de una lesión similar. Algunos autores citan un ligero predominio en varones.7 La mayoría de los casos se identifican en personas mayores de 15 años; son pocos los informes de casos en neonatos. 9-12
Hay quistes broncogénicos únicos, múltiples y multiloculados; en cuanto a la localización, puede ser parenquimatosa, mediastinal y en otros sitios menos frecuentes, a saber: cuello, pericardio, cavidad abdominal y tejido celular subcutáneo. Solo el 1% de los quistes broncogénicos ocurren por encima de la aorta.7,11,13,14
Los quistes más frecuentes son los mediastinales con 65-86% de los casos, de preferencia en el mediastino medio y posterior, principalmente al lado derecho, en el tercio distal de la tráquea o proximal al bronquio principal; son poco sintomáticos; pueden tener comunicación con el interior de la tráquea y comprimir el esófago.7,9,14,15 Los quistes broncogénicos mediastinales se pueden dividir en paratraqueales, que están unidos a la pared de la tráquea por encima de la bifurcación de esta; carinales, cercanos a la carina y el esófago; hiliares; unidos a un bronquio lobar, y paraesofágicos que pueden estar unidos al esófago o comunicados con él, pero tienen relación con el árbol bronquial.16
Aproximadamente un tercio de los casos son intraparenquimatosos, generalmente más sintomáticos que los mediastinales porque pueden comunicarse con el árbol bronquial; están confinados a un segmento o lóbulo, pueden ser subpleurales (55% ), en la parte media del pulmón (30% ) y perihiliares (15% ); más comúnmente se hallan en los lóbulos inferiores (60% ).7,14,17
Tanto en adultos como en niños se han descrito otras localizaciones aberrantes: piel, tejido subcutáneo, pericardio, diafragma, región cervical, región retroperitoneal e intraperitoneal.9,11,18,19
El cuadro clínico varía de acuerdo con la localización, el tamaño y la edad de presentación, que puede ser en cualquier momento de la vida, desde el período neonatal hasta la edad adulta.7-9,12,15,20 De 44 a 72% de los quistes son sintomáticos y de 30 a 65% de los asintomáticos llegan a ser sintomáticos durante el seguimiento.21
Manifestaciones clínicas como la dificultad respiratoria pueden ser más evidentes en menores de un año, como consecuencia de la distorsión, angulación y compresión de la vía aérea. Cuando la obstrucción afecta la vía aérea superior (OVAS), la hiperextensión del cuello la libera, hecho que es más importante en neonatos y lactantes; también se pueden manifestar por infecciones recurrentes, tos, estridor, sibilancias y hemoptisis que pueden ser secundarios a compresión de estructuras vecinas y a alteraciones del drenaje vascular adyacente. El estridor, las sibilancias, la dificultad respiratoria y la tos, que son los síntomas más frecuentes, pueden aumentar al comer o al llorar. 14,16
En el examen físico se pueden encontrar aumento de la frecuencia respiratoria, retracción supraesternal, tiraje subcostal, estertores difusos bilaterales y signos de condensación pulmonar en casos de procesos infecciosos agregados, que pueden cursar con fiebre, expectoración y dolor torácico; en el Hospital Universitario Nacional de Taiwán se encontró que los gérmenes principalmente implicados en esta sobreinfección son Pseudomonas aeruginosa, Klebsiella pneumoniae, Aspergillus fumigatus y Streptococcus viridans. Solo dos pacientes presentaron sobreinfección por micobacterias. 17,22
Otros síntomas pueden ser disfagia, arritmias, pericarditis recurrente, insuficiencia cardíaca derecha, compresión de la vena cava superior y, en el caso de los quistes abdominales, náuseas, vómito y dolor epigástrico.7,8
Existen informes de complicaciones secundarias al quiste broncogénico como la atresia bronquial, simulación de aneurisma traumático de la aorta, embolia aérea durante un vuelo en avión o síndrome de vena cava superior en adultos por compresión vascular.
El diagnóstico diferencial se debe hacer con otras lesiones quísticas congénitas o adquiridas, tales como quistes de duplicación esofágica, enfisema lobar, secuestro pulmonar, malformación adenomatoidea quística, tuberculosis especialmente cuando las lesiones tienen un nivel hidroaéreo, enfermedades por hongos, bula infectada, absceso pulmonar y quiste hidatídico. Cuando el quiste congénito parenquimatoso se sobreinfecta es muy difícil diferenciarlo de un absceso pulmonar y solo el cuadro clínico de infecciones pulmonares repetidas y la demostración de un nivel hidroaéreo sugieren la existencia de un quiste congénito.7,8,23
El diagnóstico prenatal ecográfico de lesión quística pulmonar ocurre hasta en 70% de los casos;2 las tres posibilidades diagnósticas más frecuentes son la malformación adenomatoidea quística congénita, el secuestro pulmonar y el quiste broncogénico. El crecimiento intrauterino progresivo de las lesiones pulmonares quísticas puede llevar a falla cardíaca, hidropesía fetal y, posteriormente, muerte fetal. El tamaño de las lesiones in útero cambia con el tiempo y puede evolucionar de tres maneras diferentes: a) aumento del tamaño que se puede acompañar de hidropesía fetal; b) estabilidad durante toda la gestación; c) disminución del tamaño o desaparición, por lo que una lesión inicialmente grande no necesariamente se relaciona con un mal pronóstico.1,2
La mayoría de las lesiones observadas in útero disminuyen de tamaño entre las semanas 32 y 34 de la gestación y las que van a desaparecer son usualmente ecodensas en la ecografía gestacional.1 Las que persisten pueden o no ser sintomáticas.3 Es muy raro que las lesiones que ya produjeron hidropesía disminuyan de tamaño o desaparezcan. En la serie de casos de Adzick se encontró que el pronóstico de las malformaciones quísticas pulmonares dependía de su tamaño y de las alteraciones fisiológicas secundarias.1,2 Los quistes que desaparecen pueden haber sido quistes infecciosos adquiridos.18 No está claro si en el período posnatal se resuelven las lesiones. Los pacientes asintomáticos al nacimiento generalmente tienen radiografías de tórax normales pero pueden tener lesiones aparentes en la tomografía.2,10 Todos los pacientes con evidencia de lesiones quísticas prenatales, incluso los asintomáticos, requieren radiografía y tomografía de tórax, para definir si la lesión desapareció in útero.2,10,12
Hasta en dos tercios de los casos el diagnóstico presuntivo se hace con la radiografía de tórax; hay diferentes patrones radiográficos según la localización del quiste y su comunicación con el árbol traqueobronquial; pueden ser nódulos bien definidos, de apariencia homogénea o quística, con nivel hidroaéreo o asociarse a infecciones como neumonía;5,9 en algunos pacientes la radiografía de tórax puede ser interpretada como normal; el hallazgo del quiste puede ser casual, principalmente en adultos jóvenes. En los recién nacidos se puede evidenciar una opacidad pulmonar por el líquido amniótico retenido por obstrucción; en la localización mediastinal se evidencia una masa hiliar o mediastinal de bordes lisos y paredes bien definidas; los de localización parenquimatosa se hallan en los lóbulos inferiores en el 75% de los casos, su diámetro promedio es de 2 a 4 centímetros y generalmente su tamaño no aumenta, a menos que se sobreinfecten en cuyo caso se puede ver un nivel hidroaéreo. Si un bronquio principal está afectado puede haber un fenómeno de válvula y ocasionar atrapamiento de aire con sobredistensión pulmonar secundaria que se puede confundir con el enfisema lobar congénito.7,9
La tomografía computarizada de tórax puede mostrar quistes que no se ven en la placa simple o definir mejor su localización, que es un dato importante para la cirugía.7,9,10 El quiste broncogénico se evidencia en la tomografía como una masa bien definida de contorno lobular o liso, con paredes uniformemente delgadas y densidades de contenido líquido en la mitad de los casos; puede tener zonas de mayor densidad por contenido mucoide, sangre o pus; hasta en el 36% de los casos puede tener contenido quiste puede desplazar las estructuras mediastinales principalmente la tráquea y el esófago, o afectar el parénquima pulmonar con producción de atelectasias o infecciones recurrentes.7,9
Según su contenido, los quistes parenquimatosos se pueden clasificar por tomografía con contraste en tres tipos: los de tipo 1 son quistes simples, con líquido en su interior; los de tipo 2 contienen aire y fluido, y en los de tipo 3 se identifica una masa de tejido blando.17
En la resonancia magnética los quistes broncogénicos son hipointensos en T1 a menos que sean complejos en cuyo caso la intensidad es variable según el contenido proteico; en T2 siempre son hiperintensos. En la mitad de los casos el esofagograma demuestra la compresión extrínseca del esófago, principalmente en los quistes de localización paraesofágica o cervical, y dependiendo del tamaño y la posición del quiste. 7,18
Histológicamente el quiste no infectado tiene paredes delgadas; el criterio histológico diferencial básico es el hallazgo de una membrana de revestimiento epitelial, que prueba el origen congénito, pero los procesos infecciosos pueden destruirla y hacer imposible su diferenciación; está compuesta por epitelio columnar ciliado; la pared puede contener cartílago, músculo liso, glándulas bronquiales y tejido nervioso; el contenido del quiste puede variar de un líquido claro a un material mucoide. 5,7,8,19,20
Todos los casos de fetos y recién nacidos con quistes sintomáticos son quirúrgicos; en cuanto a los asintomáticos, se ha planteado la observación pero la mayoría de los autores recomiendan el tratamiento quirúrgico, usualmente lobectomía por toracotomía; la evolución es impredecible y pueden desarrollarse complicaciones graves hasta en 2% de los casos, como infecciones, hemorragias, disfagia y adenocarcinoma.5,9,15,20,21,23-25
En la actualidad se hacen tratamientos in útero de estas malformaciones: aspiración de quistes, inserción de derivaciones (shunts) pulmonar-amnióticas y resección. El tratamiento del polihidramnios incluye amniocentesis repetidas, indometacina y las derivaciones toracoamnióticas.1,3,26
Existen tratamientos mínimamente invasivos como aspiración, resección, electrocauterio o escleroterapia de la lesión por videotoracoscopia. 4,21,26,27
Algunos autores proponen esperar a que el paciente cumpla 6 meses, edad a la que algunas de estas lesiones pueden haber desaparecido. 2,27,28 Las contraindicaciones de la toracoscopia son raras y no tiene restricciones por edad o peso; se interviene incluso a prematuros de menos de 1.500 gramos.27
Antes del tratamiento quirúrgico rutinario de los pacientes con quistes broncogénicos, la tasa de mortalidad era hasta de 100% ; con la cirugía se redujo a 0-14% .4,7 Las complicaciones posquirúrgicas son mínimas aunque se han descrito casos de síndrome de reexpansión pulmonar, infección del área quirúrgica con posible sepsis y parálisis del nervio laríngeo recurrente secundaria a la inflamación periquística. 24,25 En general el pronóstico posquirúrgico es excelente debido a la resección no significativa del tejido pulmonar normal.29
REFERENCIAS BIBLIOGRÁFICAS
1. Adzick NS. Management of fetal lung lesions. Clin Perinatol, 2009; 36: 363-376. [ Links ]
2. Shanti C, Klein M. Cystic lung disease. Sem Pediatr Surg, 2008; 17: 2-8. [ Links ]
3. Truitt A, Carr S. Cassese J, Kurkchubasche A, Tracy T, Luks F. Perinatal management of congenital cystic lung lesions in the age of minimally invasive surgery. J Pediatr Surg, 2006; 41: 893-896. [ Links ]
4. Horak E, Bodner J, Gassner I, Schmid T, Simma B, Grässl G, et al. Congenital cystic lung disease: Diagnostic and therapeutic considerations. Clin Pediatr, 2003; 42: 251-261. [ Links ]
5. Aktogu S, Yuncu G, Halilcolar H, Ermete S, Buduneli T . Bronchogenic cysts: clinicopathological presentation and treatment. Eur Respir J, 1996; 9: 2017-2021. [ Links ]
6. Williams H, Johnson K. Imaging of congenital cystic lung lesions. Pediatr Respir Rev, 2002; 3: 120-127. [ Links ]
7. Salcedo M, Alva L, Sotelo R, Peña E, Lule M, Falcón V. Quiste broncogénico: reporte de dos casos y revisión de la literatura. Rev Inst Nal Enf Respir, 2004; 17: 35-41. [ Links ]
8. Fuentes E, Corona SB, Martín MA. Quiste pulmonar congénito gigante asociado a hipoplasia pulmonar. Presentación de un caso y revisión de la literatura. Rev Cubana Cir [online]. 2004; 43 (3-4), pp. 0-0. ISSN 0034-7493. [ Links ]
9. Pardo M, Tantaleán J, Melgar E. Quiste broncogénico en el período neonatal. Paediatrica, 2004; 6: 108- 111. [ Links ]
10. Dale PJ, Shaw NJ. Bronchogenic cyst presenting in the neonatal period. Acta Paediatr, 1994; 83: 1102- 1103. [ Links ]
11. Sedwick J, Giannoni C. Bronchogenic cyst of the oropharynx and hypopharynx in a neonate. Otolaryngol Head Neck Surg, 2001; 125: 105-106. [ Links ]
12. Tsunezuka Y, Shimizu Y, Tanaka N, Ishikawa N, Ohama K. Progressive intraparenchymal bronchogenic cyst in a neonate. Ann Thorac Cardiovasc Surg, 2008; 14: 32-34. [ Links ]
13. Ozel SK, Kazez A, Koseogullari A, Akpolat N. Scapular brochogenic cysts in children: case report and review of the literature. Pediatr Surg Int, 2005; 21: 847-845. [ Links ]
14. Stewart B, Cochran A, Iglesia K, Speights VO, Ruff T. Unusual case of stridor and wheeze in an infant: Tracheal bronchogenic cyst. Pediatr Pulmonol, 2002; 34: 320-323. [ Links ]
15. Ahrens B, Wit J, Schmitt M, Wahn U, Niggemann B, Paul K. Symptomatic bronchogenic cyst in a sixmonth- old infant: Case report and review of the literature. J Thorac Cardiovasc Surg, 2001; 122: 1021- 1023. [ Links ]
16. Chang YC, Chang YL, Chen SY, Wang TC, Yang PC, Liu HM, et al. Intrapulmonary bronchogenic cysts: Computed tomography, clinical and histopathologic correlations. J Formos Med Assoc, 2007; 106: 8-15. [ Links ]
17. Vázquez R, Parejo J, Barragán F, González A, De los Santos, S. Obstrucción de la vía aérea superior provocada por un quiste broncogénico en un paciente asmático. Rev Soc Neumol Sur, 1996; 8: 39-43. [ Links ]
18. Tireli G, Ozbey H, Temiz A, Salman T, Celik A. Bronchogenic cyst: a rare congenital cystic malformation of the lung. Surg Today, 2004; 34: 573-576. [ Links ]
19. Yohena T, Kuniyoshi M, Kono T, Uehara T, Uehara T, Miyahira T, et al. Novel approach for a pulmonary bronchogenic cyst: a report of a case. Ann Thorac Cardiovasc Surg, 2005; 11: 249-251. [ Links ]
20. Liman ST, Dogan Y, Topcu S, Karabulut N, Demirkan N, Keser Z. Mycobacterial infection of intraparenchymal bronchogenic cysts. Respir Med, 2006; 100: 2060-2062. [ Links ]
21. Kim EY, Lee WJ, Jang KT. Retroperitoneal bronchogenic cyst mimicking a pancreatic cystic tumour. Case report. Clin Radiol, 2007; 62: 491-494. [ Links ]
22. Sauvat F, Fusaro F, Jaubert F, Galifer B, Revillon Y. Paraesophageal bronchogenic cyst: first case reports in pediatric. Case report. Pediatr Surg Int, 2006; 22: 849-851. [ Links ]
23. Kosar A, Tezel C, Orki A, Kiral H, Arman B. Bronchogenic cysts of the lung: Report of 29 cases. Heart Lung Circul, 2009; 30: 1-5. [ Links ]
24. Shanmugam G, MacArthur K, Pollock J. Congenital lung malformation: Antenatal and postnatal evaluation and management. Eur J Cardiothorac Surg, 2005; 27: 45-52. [ Links ]
25. Vaos G, Zevras N, Antypas G. Bronchogenic cyst of the lung mimicking a pulmonary hydatid cyst in a child. Pediatr Surg Int, 2005; 21: 383-385. [ Links ]
26. Michel JL, Revilon Y, Montupet P, Sauvat F, Sarnacki S, Fekete CN. Thoracoscopic treatment of mediastinal cysts in children. J Pediatr Surg, 1998; 33: 1745-1748. [ Links ]
27. Fuentes E. Resultados del tratamiento quirúrgico del quiste broncogénico. Rev Cubana Cir [online] 2006; 45 (3-4), pp. 0-0. ISSN 0034-7493. [ Links ]
28. Rice D, Putnam J. Case report. Recurrent bronchogenic cyst causing recurrent laryngeal nerve palsy. Eur J Cardiothorac Surg, 2002; 21: 561-563. [ Links ]
29. Kumar AN. Perinatal management of common neonatal thoracic lesions. Ind J Pediatr, 2008; 75: 931-937. [ Links ]
Recibido: marzo 14 de 2010
Aceptado: abril 05 de 2010