Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.24 no.1 Medellín Jan./Mar. 2011
ARTÍCULO DE REVISIÓN
Moléculas que participan en el transporte materno-fetal de hierro: importancia del receptor 1 de transferrina y de la ferroportina en la placenta humana
Molecules implicated in maternal-fetal iron transport across the placental barrier: Role of Transferrin Receptor 1 and Ferroportin
Lady Vanessa Corrales Agudelo1; Beatriz Elena Parra Sosa2; Juan Guillermo Maldonado Estrada3; Luis Carlos Burgos Herrera4
1 Nutricionista Dietista. Estudiante de maestría en Ciencias Básicas Biomédicas, línea Bioquímica Nutricional. Corporación Ciencias Básicas Biomédicas, Universidad de Antioquia, Medellín, Colombia. vanecora@gmail.com
2 Nutricionista Dietista, M Sc en Ciencias Básicas Biomédicas. Profesora y miembro del Grupo de Investigación en Alimentación y Nutrición Humana, Universidad de Antioquia, Escuela de Nutrición y Dietética, Medellín, Colombia.
3 Médico veterinario y zootecnista, M Sc, Ph D, Profesor de la Universidad de Antioquia, Escuela de Medicina Veterinaria y miembro del Grupo Reproducción, Medellín, Colombia.
4 MD, Magíster en Bioquímica. Universidad de Antioquia, Facultad de Medicina, Departamento de Bioquímica y Fisiología, Medellín Colombia.
RESUMEN
La transferencia placentaria adecuada de hierro es crucial para satisfacer los altos requerimientos que el feto tiene de este mineral y para promover su crecimiento y desarrollo intrauterinos apropiados; de otra parte, contribuye a prevenir la ferropenia y la anemia, entidades muy frecuentes durante los dos primeros años de vida, y que se asocian con aumento de la morbilidad y la mortalidad en la infancia. La placenta es un órgano capaz de efectuar diferentes adaptaciones en la producción de las moléculas que participan en el transporte materno-fetal de hierro en respuesta al estado celular de este mineral, para asegurar la mayor disponibilidad para el feto. Esta revisión pretende acercar al lector a los mecanismos metabólicos y moleculares relacionados con la captación y el transporte de hierro por la placenta y con su salida hacia el feto, así como su regulación, para proporcionar elementos que le permitan comprender integralmente la importancia de un adecuado estado de hierro materno antes de la gestación y durante ella.
PALABRAS CLAVE
Embarazo, Hierro, Nutrición Materna, Receptores de Transferrina
SUMMARY
An adequate placental transfer of iron is critical to satisfy the high fetal requirements of this mineral, and to promote proper intrauterine growth and development. It also contributes to the prevention of iron deficiency and anemia, both of which are very frequent during the first two years of life, and associate with increased rates of morbidity and mortality. Different adaptations may occur in the placenta in the production of molecules that take part in the mother-tofetus iron transfer. With them, iron availability to the fetus is assured. Our aim with this review is to familiarize readers with the metabolic and molecular mechanisms of placental iron uptake, transport, regulation and release. With this knowledge, the importance of an adequate maternal iron state before and during pregnancy may be better understood.
KEY WORDS
Iron, Maternal Nutrition, Pregnancy, Receptors, Transferrin
INTRODUCCIÓN
El hierro es un nutriente esencial para el metabolismo celular en los mamíferos, debido a que forma parte de metaloenzimas y otras proteínas que participan en diferentes procesos biológicos necesarios durante todas las etapas del proceso vital, tales como la producción celular de energía, la síntesis de neurotransmisores y de ARN y ADN, el metabolismo de las hormonas, el crecimiento y desarrollo, la maduración sexual y la respuesta inmune. 1 La anemia ferropénica es uno de los problemas nutricionales más prevalentes en el mundo y las poblaciones más vulnerables son las mujeres gestantes y los niños menores de cinco años.2,3 En la población infantil, la anemia se asocia con menor desarrollo mental, motor y socioemocional o con alteraciones en el funcionamiento neurofisiológico,4 todo lo cual repercute negativamente en el bienestar y la salud del individuo y en su productividad en la vida adulta.
La anemia materna también es un problema de salud pública y, por supuesto, un determinante del estado de hierro fetal, del lactante y del niño en los primeros años de vida. En países desarrollados afecta a 23% de las embarazadas, pero su prevalencia es mucho mayor en países en vías de desarrollo donde 52% de las mujeres gestantes presentan este diagnóstico.3 Colombia no es ajena a esta situación y en la primera Encuesta de la Situación Nutricional en el país se halló una prevalencia de 44,7%.5
El requerimiento total de hierro durante un embarazo normal es aproximadamente 1.240 mg, lo que exige a la madre absorber en promedio 4,4 mg/día para satisfacer sus demandas y las del feto;6 por esta razón, las necesidades de hierro aumentan con respecto a las de la mujer no gestante,7 hasta cifras que son imposibles de satisfacer únicamente a partir de fuentes naturales de alimentos, por lo que se recomienda recurrir a un suplemento nutricional así como también incrementar la ingesta de alimentos que sean fuente de hierro hemínico (carnes y vísceras) por su mayor biodisponibilidad, especialmente en países en vías de desarrollo en los cuales la absorción del mineral en la dieta es baja y la prevalencia de anemia alta.3 La ingesta de un suplemento con dosis moderadas de hierro, 30 a 60 mg de hierro elemental por día, se considera eficaz para prevenir la anemia durante la gestación, la cual tiene efectos perjudiciales para la salud de la madre y el niño.8 Las principales consecuencias funcionales de la anemia por deficiencia de hierro durante el embarazo son: el incremento del riesgo perinatal en la madre y en el neonato, el mayor riesgo de mortalidad infantil y el bajo peso al nacer.9,10 Pese a que la recomendación de ingerir un suplemento de hierro durante la gestación no es universal, debido a la controversia de algunos estudios que muestran un aumento del estrés oxidativo en la madre,11 se recomienda como una medida preventiva y de salud importante durante el embarazo y cuando existe anemia materna, debido a que la transferencia de cantidades adecuadas de hierro al feto permite la mielinización normal del sistema nervioso central del niño, y previene deficiencias de hierro durante la infancia.3,12 Por lo tanto, un adecuado estado de hierro materno es particularmente importante durante el embarazo y en los primeros dos años de vida para garantizar el óptimo desarrollo físico y cognitivo del niño.12
El feto recibe de la madre todo lo necesario para su formación y el medio para comunicarse entre ellos es la placenta. Las reservas de hierro con las que cuenta la madre son de 300 a 400 mg y, precisamente, esta misma cantidad se transfiere en la gestación desde la madre hacia el feto sin contar las pérdidas y otras demandas fisiológicas de hierro durante el embarazo. En el tercer trimestre, el feto alcanza su máximo crecimiento y desarrollo; para que ellos sean óptimos la comunicación placentaria materno-fetal se incrementa.11,13,14 En la placenta existe un sistema encargado de regular el transporte de hierro y las proteínas que participan en él se localizan en las superficies materna y fetal de la membrana placentaria; pese a estar presentes durante toda la gestación, al parecer, estas moléculas tienen mayor expresión desde la semana 24 hasta el final del embarazo.15
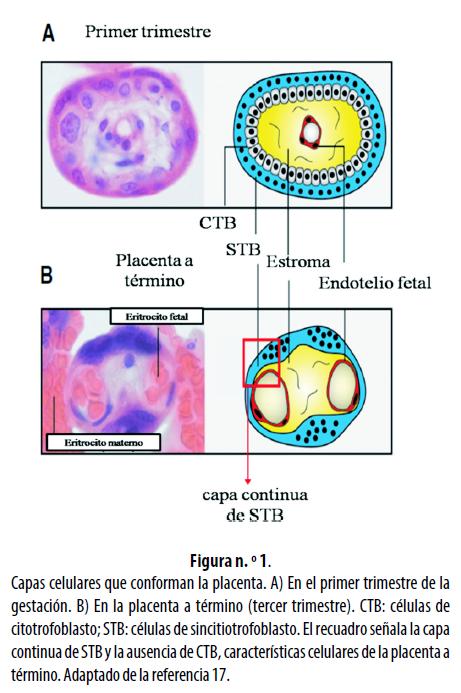
La placenta está formada por diferentes capas celulares que separan la circulación fetal de la materna, formando dos espacios bien delimitados; el primero es el espacio intervelloso, que comprende la circulación materna, y el segundo, el espacio vascular velloso del feto.16 La superficie de las vellosidades está cubierta por células de trofoblasto (llamadas sincitiotrofoblasto) ancladas a una lámina basal; en el primer trimestre el trofoblasto está constituido por una capa interna de células de citotrofoblasto mononucleadas, que se diferencian y fusionan para formar la capa externa ininterrumpida del sincitiotrofoblasto.17 La figura n.° 1 muestra las capas celulares que conforman la placenta y el cambio que sufren entre el primer y tercer trimestres de la gestación.
Entre las capas celulares que permiten la separación materno-fetal, la membrana del sincitiotrofoblasto es la de mayor importancia en la regulación del transporte de hierro, por lo cual se hace necesario señalar su diferenciación de acuerdo con la parte materna o fetal que entre en contacto con ella; así, el segmento apical del sincitiotrofoblasto es aquel inmediato al espacio materno, y el segmento basal es el que está de cara al espacio fetal.16
GENERALIDADES DEL TRANSPORTE MATERNOFETAL DE HIERRO
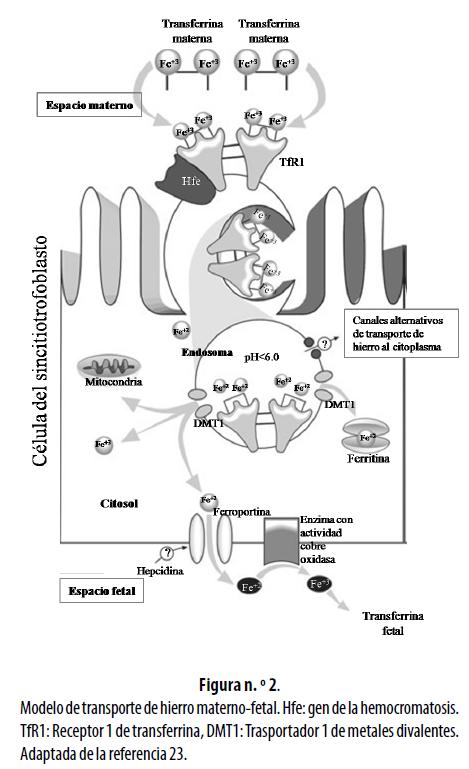
El transporte materno-fetal de hierro es unidireccional conservando el sentido madre-feto; se inicia con la captación por la membrana apical y termina con la salida del mineral por la membrana basal.17 La figura n.° 2 muestra la representación esquemática general de dicho transporte. El primer intermediario en este transporte es el Receptor 1 de la transferrina (Transferrin Receptor- type 1, o TfR1), una glicoproteína localizada en ambas membranas (apical y basal) del sincitiotrofoblasto, con alta afinidad para ligar la transferrina diférrica sintetizada por los hepatocitos maternos y por las vellosidades del citotrofoblasto y del sincitiotrofoblasto; en la membrana apical la transferrina saturada con el ion férrico se une al TfR115,16,18-21 y este complejo se internaliza en endosomas recubiertos por clatrina;17 una bomba ATPasa acidifica el medio y cuando se alcanza un pH de 5,6 permite que el hierro pase del estado férrico (Fe+3) al ferroso (Fe+2) y se disocie del complejo transferrina-TfR1;20,21 luego, este último se recicla retornando a la membrana apical para formar nuevos complejos.22-24
Al parecer, el ion ferroso pasa del endosoma al citoplasma mediante una glicoproteína con 12 dominios transmembrana conocida como el Transportador 1 de metales divalentes (Divalent Metal Transporter 1, o DMT1), la cual también se localiza en la membrana basal del sincitiotrofoblasto16,19,25 y presenta dos isoformas conocidas como DMT1 con elemento de respuesta al hierro (DMT1-IRE) y DMT1 sin elemento de respuesta al hierro (DMT1-no IRE), que se diferencian por la presencia o ausencia de elementos de respuesta al hierro (IRE, por la sigla en inglés deIron Response Element) en la región no traducida (UTR, por la sigla en inglés de Untranslated Region) 3'del ARN mensajero (ARNm). En el primer trimestre de la gestación, la isoforma predominante es el
DMT1-IRE, pero ambas isoformas se hallan en la placenta y ejercen funciones de captación y salida de múltiples metales divalentes y, al igual que en otros tejidos, muestran mayor afinidad por el hierro;25 sin embargo, es posible que la salida de hierro del endosoma al citoplasma también se dé por canales alternativos, lo cual aún no está claro.23
Existen otras moléculas esenciales para el transporte materno-fetal de hierro; tal es el caso de la ferroportina, que se expresa en la membrana basal del sincitiotrofoblasto, donde facilita el paso de Fe+2 a la circulación fetal, para que pueda incorporarse a la transferrina fetal.15,16,26,27Antes de su unión con esta ocurre una oxidación de Fe+2 a Fe+3, por la presencia de una enzima con actividad cobre-oxidasa, homóloga de la hefastina, que al parecer se encuentra en la membrana basal de la placenta. Este proceso es similar al que ocurre en el enterocito duodenal con la hefastina y, además, puede incluir proteínas chaperonas del metabolismo del cobre como la Atox1que se une con este mineral para entregarlo a dos proteínas Cu-ATPasas, la ATP7A o proteína de Menkes y la ATP7B, que está alterada en la enfermedad de Wilson.13,16,23,28-30
El TfR1 y la ferroportina son las principales proteínas que participan en el transporte materno-fetal de hierro;15 como ya se mencionó, el TfR1 se encuentra en ambas membranas, pero en esta revisión cobra mayor importancia el que está localizado en la membrana apical, puesto que es la proteína que, en primera instancia, participa en la captación de hierro por la placenta desde la circulación materna. Igualmente es relevante la ferroportina, proteína transmembrana ubicada en la membrana basal de la placenta, que se identifica como la principal exportadora de hierro desde las células placentarias a la circulación fetal y, por ende, regula el flujo de hierro desde el sincitiotrofoblasto.15,23,27,31 Además, es importante tener en cuenta que en el tercer trimestre de gestación, la placenta incrementa la expresión de ferroportina,26 posiblemente como respuesta a la mayor demanda fetal de hierro, debida en parte al aumento del volumen de células hemáticas, del peso y la masa fetales y de las reservas de hierro que se utilizarán en los primeros meses después del nacimiento.11
EL RECEPTOR 1 DE TRANSFERRINA Y LA FERROPORTINA El TfR1
es un receptor homodimérico transmembrana24 que contiene 760 aminoácidos; el peso molecular por monómero es 95 kDa y están unidos por dos puentes disulfuro.31,32 El TfR1 presenta un extremo corto N-terminal hacia el citoplasma, un solo dominio transmembrana y un largo ectodominio C-terminal extracelular con 640 aminoácidos; el ectodominio está dividido en tres regiones estructuralmente diferentes denominadas: dominio proteasa, dominio apical y dominio helical. El dímero TfR1 une dos moléculas de transferrina para formar el complejo transferrina-TfR1, que se internaliza por endocitosis.32,33 Cada monómero tiene un dominio citoplasmático con una secuencia consenso de internalización y un dominio extracelular que liga una sola molécula de transferrina.24
La ferroportina es una proteína conformada por 571 aminoácidos,34 tiene 12 dominios transmembrana, con ambos extremos (N y C terminales) en el citoplasma y puede funcionar como proteína monomérica o dimérica.24,34,35 En los dominios citoplasmáticos de la proteína ocurren la fosforilación y la ubiquitinación, procesos necesarios para la degradación de la proteína por la hepcidina.34,36-38
REGULACIÓN DE LAS PROTEÍNAS QUE INTERVIENEN EN EL TRANSPORTE MATERNO-FETAL DE HIERRO
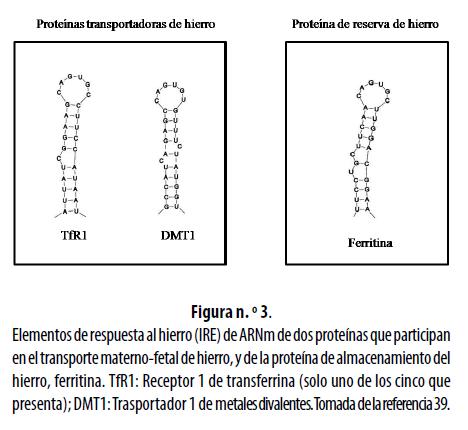
La síntesis de las proteínas que participan en el transporte, el almacenamiento y la utilización de hierro se controla de forma coordinada después de la transcripción, por el contenido de hierro intracelular. La regulación depende de la interacción entre las proteínas citoplasmáticas denominadas IRP (por la sigla en inglés de Iron Regulating Proteins), que actúan como sensores del hierro, y los IRE que son estructuras en forma de tallo o asa de 26 a 30 nucleótidos, ubicadas en las moléculas de ARNm. La figura n.° 3 esquematiza los IRE del Receptor 1 de la transferrina y del Transportador 1 de metales divalentes, que participan en el transporte materno-fetal de hierro, y de la ferritina, responsable de su almacenamiento. 31,39
Existen dos tipos de IRP: IRP1 e IRP2; ambos pertenecen a la superfamilia de las aconitasas y regulan el metabolismo del hierro por su unión, con altas afinidad y especificidad, a los IRE, lo que modifica la traducción de las proteínas participantes en el metabolismo del hierro.24,40 Los IRE pueden estar en la UTR 3'del ARNm, una región que controla la estabilidad y la síntesis de proteínas;41 por lo tanto, cuando el IRE está en dicha región, las IRP permiten el proceso de traducción, pero cuando el IRE está en la UTR 5'de un ARNm, la unión de las IRP lo bloquea.24 Dos de las proteínas que participan en el transporte materno- fetal de hierro han sido identificadas con IRE en la UTR 3': el TfR1 y el DMT1 (figura n.° 3); en tanto que otras proteínas como la ferroportina y la ferritina contienen IRE en la UTR 5'.41
En la placenta humana la actividad de la IRP1está directamente relacionada con la concentración de ARNm del TfR1.2 Tanto la traducción del ARNm del TfR1 como del de la ferroportina son controladas por un sistema conformado por el IRE/IRP.24,40 El ARNm del TfR1 presenta de tres a cinco IRE en la UTR 3', mientras que otros como el ARNm de la ferritina tienen solo uno y en la UTR 5'.24
Cuando aumentan los requerimientos de hierro, la unión de las IRP estabiliza el ARNm del TfR1 y bloquea la traducción del mensaje de la ferritina; así se incrementa la captación de hierro y disminuyen las reservas; sin embargo, cuando existe suficiente hierro celular, se observa lo contrario.24,39 Estos efectos en la traducción suceden mediante la activación del sistema IRE/IRP, al cual responden tanto el TfR1 como la ferritina, proteínas que poseen el IRE en la UTR 3'y 5', respectivamente. En condiciones de deficiencia de hierro, las IRP se unen a los IRE e incrementan el nivel de ARNm del TfR1, así como también de las proteínas TfR1 y DMT1, a la vez que se detiene la traducción de la ferritina, lo que permite un incremento final en la disponibilidad de hierro para la placenta, que compensa la captación deficiente de hierro por el feto.29,40
La concentración de cobre en la madre afecta el nivel de hierro y la expresión de proteínas placentarias que intervienen en su transporte. Así, cuando la madre recibe una dieta baja en cobre, disminuye la concentración de este en la placenta, comportamiento que no muestra el hierro; sin embargo, en el hígado fetal disminuyen tanto el hierro como el cobre, lo cual refleja la interacción que tienen estos nutrientes; por ejemplo, en placentas de ratas que recibieron dietas bajas en cobre, aumentaron los niveles del TfR1 y DMT1, comportamiento similar al que tienen frente a una deficiencia de hierro.30 En macrófagos se estudió el papel que cumple el cobre en la expresión de la ferroportina; así, cuando las células recibieron cobre se produjo un incremento en el ARNm de la ferroportina aumentando el nivel de la proteína. Este hallazgo sugiere que el cobre puede inducir un estímulo transcripcional de la ferroportina y cumplir un papel en la salida del hierro.42 Todo esto permite pensar en posibles mecanismos acoplados entre el cobre y el hierro para mantener bajo control el nivel de hierro materno y el transporte placentario de este micronutriente.
La homeostasis del hierro materno-fetal involucra a todas las moléculas intermediarias de su metabolismo. Cuando el Fe+2 pasa del endosoma al citoplasma mediante el DMT1, se decide su destino de acuerdo con las demandas fetales; por ejemplo, ante un paso suficiente de hierro capaz de suplir las exigencias del feto, parte de este mineral se almacena en la ferritina para estar disponible especialmente en el segundo y tercer trimestres de la gestación, períodos en los cuales la demanda fetal de hierro aumenta aceleradamente. La ferritina es una molécula citosólica que refleja las reservas de hierro; se compone de 24 subunidades de dos tipos de cadenas: una pesada (H) y una liviana (L); el hierro parece tener mayor afinidad por la cadena H por lo cual se une poco o nada a la cadena L.43 Una vez que la ferritina libera el hierro, la ferroportina se encarga de pasarlo a la circulación fetal.37 Sin embargo, la ferritina también se ve afectada por el estado del hierro; así, en los casos de anemia moderada disminuye de manera importante la expresión de ambas cadenas en la placenta, y desciende aún más cuanto más grave es la anemia.27
La acumulación de hierro en la ferritina es inversamente proporcional a la concentración de ferroportina, debido a que esta no solo capta el hierro del citosol, sino también el de la ferritina antes de que esta proteína de reserva se degrade.37 No obstante, cuando disminuye la actividad de la IRP1 se incrementan las concentraciones de ferritina y de ferroportina, y por tanto aumenta la reserva de hierro en la placenta y, en forma moderada, el transporte de hierro al feto. Este mecanismo ocurre normalmente en la segunda mitad de la gestación, cuando se acelera el crecimiento fetal y se expande el volumen sanguíneo.15 En el caso de la expresión de ferroportina en la placenta humana, los resultados de estudios como el de Li en 2008 indican que en este tejido la ferroportina puede no estar regulada por el sistema IRE/IRP, sino por otros factores o vías que participan directa o indirectamente en la regulación del flujo de hierro hacia la placenta.27 Por lo tanto, es posible que los cambios en la expresión de la ferroportina no sean influenciados por los estados de deficiencia o exceso de hierro en las células placentarias, como sí lo son los de otras proteínas tales como el TfR1 y el DMT1 que aumentan, mientras que la ferritina disminuye, en estados de depleción del mineral.23,27,29
Además, la ferroportina puede comportarse como receptor de la hepcidina, péptido de 25 aminoácidos sintetizado en el hígado, que participa en la homeostasis del hierro al unirse con la ferroportina, porque induce su internalización y posterior degradación las cuales interrumpen el flujo de hierro de la placenta a la circulación fetal. 36,37,44-47 Para que la hepcidina pueda inducir la degradación de la ferroportina, es necesario que esta proteína se fosforile; en cultivos celulares de ratón que expresaron ferroportina, De Domenico y colaboradores encontraron en 2007 que cuando disminuye la concentración plasmática de hierro también lo hace la síntesis de hepcidina, hecho que permite el incremento de la ferroportina y la salida de hierro a la circulación.45
En ausencia de hepcidina los mecanismos celulares pueden ser los principales reguladores de la expresión de la ferroportina. Uno de los mecanismos propuestos es el control postranscripcional mediante el sistema IRE/IRP; al respecto, el ARNm de la ferroportina contiene un IRE en la UTR 5', similar a los ARNm que codifican para las cadenas de la ferritina. El sistema IRE/IRP tiene importancia en la regulación postranscripcional de la expresión de la ferritina: en condiciones de baja concentración de hierro, las IRP se unen al IRE 5'en el ARNm de la ferritina y bloquean su traducción, pero cuando la concentración de hierro es alta, las IRP no se unen al IRE permitiendo la traducción.48 Es posible entonces que este mismo sistema postranscripcional dependiente de hierro se presente en la expresión de la ferroportina; sin embargo, el mecanismo aún no está claro, incluso es necesario caracterizar mejor los IRE de la ferroportina para entender adecuadamente su regulación.39
Cuando se estudió el fenómeno de la regulación de la ferroportina en líneas celulares de macrófagos de ratón, se encontró que en los macrófagos suplementados con hierro se incrementaba la expresión del ARNm de la ferroportina, por lo que la modulación de la expresión de esta proteína puede ser efectiva ante la presencia de hierro, mientras que el control postranscripcional del sistema IRE/IRP es bajo; además, la transcripción de la ferroportina es determinante cuando el nivel de hepcidina es bajo como en la anemia.48
El papel de la hepcidina en el transporte materno-fetal de hierro no está claro hasta el momento. En 2004, Martin y colaboradores encontraron una merma en la expresión de ARNm del TfR1 en la placenta, desarrollo de anemia grave y muerte al nacimiento, en embriones de ratones transgénicos a los que se les indujo la expresión de hepcidina, lo que sugiere que este péptido producido por los embriones puede bloquear el transporte maternofetal de hierro.49 Estos resultados coinciden con los de Ganz y colaboradores, en 2006, quienes además sugieren que la hepcidina es un regulador negativo del transporte de hierro tanto en la placenta como en el intestino delgado.47,50 Como consecuencia del bloqueo en la trasferencia materno-fetal de hierro, ocurre una sobrecarga de hierro en la placenta y se inactiva el sistema IRP1/IRE, lo que aumenta la síntesis de ferritina y reduce la expresión de ARNm del TfR1 en la placenta.49 Sin embargo, estudios en ratas permiten deducir que la hepcidina del hígado fetal puede regular de manera positiva la expresión del TfR1 en la placenta y de esta manera modular la captación de hierro desde la sangre materna.51
En 2003 O'Brien y colaboradores2 analizaron la transferencia de hierro al feto durante el último trimestre de la gestación, en tres grupos de mujeres que recibieron suplementos con diferentes dosis de hierro, y a quienes se les administraron isótopos estables del mismo elemento por vía oral e intravenosa en el último mes de la gestación. En el momento del parto, se extrajo una muestra de sangre del cordón umbilical y otra del talón del neonato. En este trabajo se encontraron una relación lineal entre la concentración materna de TfR1 y la transferencia de trazas de hierro al feto (r = 0,379; p < 0,02), y una relación inversa entre la concentración de ferritina en el cordón y en la muestra de sangre fetal (r = -0,432; p = 0,04,), lo que permitió concluir que el hierro de la dieta materna estaba relacionado con la transferencia materno-fetal de hierro y con la concentración de hierro neonatal.2 Experimentos, tanto en animales alimentados con diferentes concentraciones de hierro como en cultivos de células BeWo (células de coriocarcinoma con propiedades similares a las del sincitiotrofoblasto de la placenta humana) deficientes en hierro, demostraron que la carencia de este mineral incrementó la expresión de ARNm del TfR1.23,27,28 Igualmente, la expresión de transferrina por el sincitiotrofoblasto se incrementa ante situaciones adversas que no permiten satisfacer las demandas de hierro fetal; este es el caso de gestantes con enfermedades como la hipertensión o la diabetes gestacional;52 además, bajo restricciones dietéticas de hierro, el nivel de ARNm del DMT1-IRE se incrementa y con él también lo hace la cantidad de la proteína DMT1 en la placenta.23,28
De lo anterior se concluye que la capacidad de transferencia de hierro por la placenta se puede incrementar ante un estado de deficiencia de hierro materno.28 Este hecho se explica porque la placenta tiene la capacidad de sufrir adaptaciones con el fin de suministrarle al feto los nutrientes necesarios. Las modificaciones pueden ocurrir durante las diferentes etapas de la gestación y se dan a partir del flujo o intercambio sanguíneo, de cambios en las membranas apical y basal o en la expresión y la actividad de los transportadores de nutrientes. Estos ajustes buscan brindarle al feto una mejor adecuación de los requerimientos a partir del hierro que provea la madre, hecho que se conoce como programación metabólica.53 Al respecto, los resultados de estudios en neonatos hijos de madres anémicas sugieren que el feto es capaz de mantener un nivel adecuado de hierro cuando la madre presenta una deficiencia leve o moderada de este mineral, aunque tal comportamiento no es igual en los casos de gestantes con diagnóstico de anemia grave. 8 Sin embargo, se deben considerar las implicaciones o el impacto que estas adaptaciones tengan sobre la salud materna y la del feto; al respecto se requiere mayor investigación.
CONCLUSIÓN
El adecuado estado de hierro materno es indispensable para su transferencia al feto en crecimiento y desarrollo; ante una deficiencia de hierro en la madre, ocurren modificaciones en la placenta para optimizar su transporte; sin embargo, aún falta comprender algunos mecanismos de respuesta placentaria y las implicaciones que ellos puedan tener sobre la salud materno-fetal; pese a lo anterior, el bienestar del feto predomina sobre el de la madre. Las proteínas placentarias que participan en el transporte materno-fetal de hierro por lo general también lo hacen en el metabolismo del hierro en otros tejidos, lo cual ha servido como orientación para deducir lo que ocurre en el transporte intraplacentario de este mineral, aunque se requiere conocer las funciones específicas de algunas proteínas en la placenta, como es el caso de canales proteicos alternativos que facilitan el paso del hierro del endosoma al citoplasma en la membrana del sincitiotrofoblasto, de la hepcidina, de la enzima con actividad cobre-oxidasa y de la regulación de la ferroportina. Igualmente, es importante continuar el estudio sobre el control de la expresión de dichas proteínas en la placenta, de su comportamiento ante el estado del hierro materno y de las interacciones que pueden surgir con las proteínas o péptidos reguladores producidos por el feto.
AGRADECIMIENTOS
Los autores agradecen a la Vicerrectoría de Investigación de la Universidad de Antioquia la financiación del presente trabajo mediante la estrategia de sostenibilidad 2010.
REFERENCIAS BIBLIOGRÁFICAS
1. Pizarro F, Calvo E. El significado a mediano y largo plazo de la deficiencia de hierro y zinc durante los primeros dos años de vida, para asegurar un buen crecimiento temprano En: Uauy R, Carmuega E, Barker B, Directores. Impacto del crecimiento y desarrollo temprano sobre la salud y bienestar de la población. Perspectivas y reflexiones desde el Cono Sur. Argentina, Chile y Uruguay: Instituto Danone del Cono Sur; 2009. p. 49-55. [ Links ]
2. O'Brien KO, Zavaleta N, Abrams SA, Caulfield LE. Maternal iron status influences iron transfer to the fetus during the third trimester of pregnancy. Am J Clin Nutr 2003; 77: 924-930. [ Links ]
3. WHO/UNICEF/UNU. Prevalence and epidemiology of iron deficiency. In: WHO, editor. Iron deficiency anaemia: assessment, prevention, and control. A guide for programme managers. Geneva: World Health Organization; 2001. p. 15-21. [ Links ]
4. Gleason G, Scrimshaw N. An overview of the functional significance of iron deficiency. In: Kraemer K, Zimmermann M, editors. Nutritional Anemia. Germany: Sight and life; 2007. p. 45-57. [ Links ]
5. Instituto Colombiano de Bienestar Familiar, Profamilia, Instituto Nacional de Salud, Universidad de Antioquia, Organización Panamericana de la Salud. Encuesta Nacional de la Situación Nutricional en Colombia 2005. Bogotá, D.C.: Panamericana Formas e Impresos S. A; 2006. p. 144-153. [ Links ]
6. Milman N. Prepartum anaemia: prevention and treatment. Ann Hematol 2008; 87: 949-959. [ Links ]
7. Food and Nutrition Board, Institute of Medicine. Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. Washigton DC: National Academy Press; 2001. p. 344-349. [ Links ]
8. Paiva AA, Rondo PH, Pagliusi RA, Latorre MR, Cardoso MA, Gondim SS. Relationship between the iron status of pregnant women and their newborns. Rev Saude Publica 2007; 41: 321-327. [ Links ]
9. Ren A, Wang J, Ye RW, Li S, Liu JM, Li Z. Low firsttrimester hemoglobin and low birth weight, preterm birth and small for gestational age newborns. Int J Gynaecol Obstet 2007; 98: 124-128. [ Links ]
10. Levy A, Fraser D, Katz M, Mazor M, Sheiner E. Maternal anemia during pregnancy is an independent risk factor for low birthweight and preterm delivery. Eur J Obstet Gynecol Reprod Biol 2005; 122: 182-186. [ Links ]
11. Scholl TO. Iron status during pregnancy: setting the stage for mother and infant. Am J Clin Nutr 2005; 81: 1218-1222. [ Links ]
12. Hay G, Refsum H, Whitelaw A, Melbye EL, Haug E, Borch-Iohnsen B. Predictors of serum ferritin and serum soluble transferrin receptor in newborns and their associations with iron status during the first 2 years of life. Am J Clin Nutr 2007; 86: 64-73. [ Links ]
13. Danzeisen R, Fosset C, Chariana Z, Page K, David S, McArdle HJ. Placental ceruloplasmin homolog is regulated by iron and copper and is implicated in iron metabolism. Am J Physiol Cell Physiol 2002; 282: C472-478. [ Links ]
14. Gude NM, Roberts CT, Kalionis B, King RG. Growth and function of the normal human placenta. Thromb Res 2004; 114: 397-407. [ Links ]
15. Bradley J, Leibold EA, Harris ZL, Wobken JD, Clarke S, Zumbrennen KB, et al. Influence of gestational age and fetal iron status on IRP activity and iron transporter protein expression in third-trimester human placenta. Am J Physiol Regul Integr Comp Physiol 2004; 287: 894-901. [ Links ]
16. Bastin J, Drakesmith H, Rees M, Sargent I, Townsend A. Localisation of proteins of iron metabolism in the human placenta and liver. Br J Haematol 2006; 134: 532-543. [ Links ]
17. Fuchs R, Ellinger I. Endocytic and transcytotic processes in villous syncytiotrophoblast: role in nutrient transport to the human fetus. Traffic 2004; 5: 725-738. [ Links ]
18. Morris BR, Boockfor FR. Transferrin expression by placental trophoblastic cells. Placenta 2004; 25: 45-52. [ Links ]
19. Georgieff MK, Wobken JK, Welle J, Burdo JR, Connor JR. Identification and localization of divalent metal transporter-1 (DMT-1) in term human placenta. Placenta 2000; 21: 799-804. [ Links ]
20. Aisen P. Transferrin receptor 1. Int J Biochem Cell Biol 2004; 36: 2137-2143. [ Links ]
21. Ikuta K, Yersin A, Ikai A, Aisen P, Kohgo Y. Characterization of the interaction between diferric transferrin and transferrin receptor 2 by functional assays and atomic force microscopy. J Mol Biol 2010; 397: 375-384. [ Links ]
22. Heaton SJ, Eady JJ, Parker ML, Gotts KL, Dainty JR, Fairweather-Tait SJ, et al. The use of BeWo cells as an in vitro model for placental iron transport. Am J Physiol Cell Physiol 2008; 295: C1445-1453. [ Links ]
23. McArdle HJ, Andersen HS, Jones H, Gambling L. Copper and iron transport across the placenta: regulation and interactions. J Neuroendocrinol 2008; 20: 427-431. [ Links ]
24. Anderson GJ, Vulpe CD. Mammalian iron transport. Cell Mol Life Sci 2009; 66: 3241-3261. [ Links ]
25. Chong WS, Kwan PC, Chan LY, Chiu PY, Cheung TK, Lau TK. Expression of divalent metal transporter 1 (DMT1) isoforms in first trimester human placenta and embryonic tissues. Hum Reprod 2005; 20: 3532-3538. [ Links ]
26. Le NT, Richardson DR. Ferroportin1: a new iron export molecule? Int J Biochem Cell Biol 2002; 34: 103-108. [ Links ]
27. Li YQ, Yan H, Bai B. Change in iron transporter expression in human term placenta with different maternal iron status. Eur J Obstet Gynecol Reprod Biol 2008; 140: 48-54. [ Links ]
28. Gambling L, Danzeisen R, Gair S, Lea RG, Charania Z, Solanky N, et al. Effect of iron deficiency on placental transfer of iron and expression of iron transport proteins in vivo and in vitro. Biochem J 2001; 356: 883-889. [ Links ]
29. Gambling L, Danzeisen R, Fosset C, Andersen HS, Dunford S, Srai SK, et al. Iron and copper interactions in development and the effect on pregnancy outcome. J Nutr 2003; 133 (5 Suppl): S1554-S1556. [ Links ]
30. Andersen HS, Gambling L, Holtrop G, McArdle HJ. Effect of dietary copper deficiency on iron metabolism in the pregnant rat. Br J Nutr 2007; 97: 239-246. [ Links ]
31. Beaumont C, Vaulont S. Iron homeostasis. In: Beaumont C, Beris P, Beuzard Y, Brugnara C, editors. Disorders of erythropoiesis, erythrocytes and iron metabolism: París: The Handbook; 2009. p. 488-511. [ Links ]
32. Yersin A, Osada T, Ikai A. Exploring transferrin-receptor interactions at the single-molecule level. Biophys J 2008; 94: 230-240. [ Links ]
33 Lambert LA, Mitchell SL. Molecular evolution of the transferrin receptor/glutamate carboxypeptidase II family. J Mol Evol 2007; 64: 113-128. [ Links ]
34. Rice AE, Mendez MJ, Hokanson CA, Rees DC, Bjorkman PJ. Investigation of the biophysical and cell biological properties of ferroportin, a multipass integral membrane protein iron exporter. J Mol Biol 2009; 386: 717-732. [ Links ]
35. De Domenico I, Ward DM, Musci G, Kaplan J. Evidence for the multimeric structure of ferroportin. Blood 2007; 109: 2205-2209. [ Links ]
36. De Domenico I, Lo E, Ward DM, Kaplan J. Hepcidininduced internalization of ferroportin requires binding and cooperative interaction with Jak2. Proc Natl Acad Sci U S A 2009; 106: 3800-3805. [ Links ]
37. De Domenico I, Vaughn MB, Li L, Bagley D, Musci G, Ward DM, et al. Ferroportin-mediated mobilization of ferritin iron precedes ferritin degradation by the proteasome. EMBO J 2006; 25: 5396-5404. [ Links ]
38. Ganz T. The role of Hepcidin in iron homeostasis. In: Yehuda S, Mostofsky DI, editors. Iron deficiency and overload, from basic biology to clinical medicine. New York: Humana Press; 2010. p. 51-64. [ Links ]
39. Piccinelli P, Samuelsson T. Evolution of the ironresponsive element. RNA 2007; 13: 952-966. [ Links ]
40. Cairo G, Bernuzzi F, Recalcati S. A precious metal: Iron, an essential nutrient for all cells. Genes Nutr 2006; 1: 25-39. [ Links ]
41. Leipuviene R, Theil EC. The family of iron responsive RNA structures regulated by changes in cellular iron and oxygen. Cell Mol Life Sci 2007; 64: 2945-2955. [ Links ]
42. Park BY, Chung J. Effects of various metal ions on the gene expression of iron exporter ferroportin-1 in J774 macrophages. Nutr Res Pract 2008; 2: 317-321. [ Links ]
43. Li L, Fang CJ, Ryan JC, Niemi EC, Lebron JA, Bjorkman PJ, et al. Binding and uptake of H-ferritin are mediated by human transferrin receptor-1. Proc Natl Acad Sci U S A 2010; 107: 3505-3510. [ Links ]
44. Ganz T, Nemeth E. Iron imports. IV. Hepcidin and regulation of body iron metabolism. Am J Physiol Gastrointest Liver Physiol 2006; 290: 199-203. [ Links ]
45. De Domenico I, Ward DM, Langelier C, Vaughn MB, Nemeth E, Sundquist WI, et al. The molecular mechanism of hepcidin-mediated ferroportin downregulation. Mol Biol Cell 2007; 18: 2569-2578. [ Links ]
46. Fleming MD. The regulation of hepcidin and its effects on systemic and cellular iron metabolism. Hematology Am Soc Hematol Educ Program. 2008:151-158. [ Links ]
47. Ganz T. Molecular control of iron transport. J Am Soc Nephrol 2007; 18: 394-400. [ Links ]
48. Aydemir F, Jenkitkasemwong S, Gulec S, Knutson MD. Iron loading increases ferroportin heterogeneous nuclear RNA and mRNA levels in murine J774 macrophages. J Nutr 2009; 139: 434-438. [ Links ]
49. Martin ME, Nicolas G, Hetet G, Vaulont S, Grandchamp B, Beaumont C. Transferrin receptor 1 mRNA is downregulated in placenta of hepcidin transgenic embryos. FEBS Lett 2004; 574: 187-191. [ Links ]
50. Ganz T. Hepcidin and its role in regulating systemic iron metabolism. Hematology Am Soc Hematol Educ Program. 2006:29-35. [ Links ]
51. Gambling L, Czopek A, Andersen HS, Holtrop G, Srai SK, Krejpcio Z, et al. Fetal iron status regulates maternal iron metabolism during pregnancy in the rat. Am J Physiol Regul Integr Comp Physiol 2009; 296: R1063-1070. [ Links ]
52. Kralova A, Svetlikova M, Madar J, Ulcova-Gallova Z, Bukovsky A, Peknicova J. Differential transferrin expression in placentae from normal and abnormal pregnancies: a pilot study. Reprod Biol Endocrinol 2008; 6: 27-35. [ Links ]
53. Sibley CP, Brownbill P, Dilworth M, Glazier JD. Review: Adaptation in placental nutrient supply to meet fetal growth demand: implications for programming. Placenta 2010; 31 (Suppl): S70-74. [ Links ]