Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.24 no.3 Medellín July/Sept. 2011
INVESTIGACIÓN ORIGINAL
Epidemiología de la retinopatía del prematuro en Medellín, 2003-2008
Retinopathy of prematurity: epidemiology in Medellín, Colombia, 2003-2008
Mónica María Giraldo Restrepo1; Andrea Hurtado Guzmán1; Jorge Hernando Donado Gómez2; Mercedes Cecilia Molina Betancur3
1 Médica Oftalmóloga, Universidad Pontificia Bolivarina, Medellín, Colombia.
2 Médico Epidemiólogo Clínico, Hospital Pablo Tobón Uribe. Profesor Titular Universidad Pontificia Bolivariana, Medellín, Colombia.
3 Médica Oftalmóloga Retinóloga, Clínica de Oftalmología San Diego, Medellín, Colombia. Carrera 32B # 10-30, Medellín Colombia; mogiraldo@yahoo.com
RESUMEN
Objetivo: describir las características clínicas y demográficas y los factores de riesgo de neonatos con retinopatía de la prematuridad (ROP), detectados en el programa de tamización de la Clínica Universitaria Bolivariana, en la ciudad de Medellín, Colombia, durante los años 2003 a 2008.
Metodología: se revisaron los registros de 1.080 neonatos. Los criterios para tamización fueron: 32 o menos semanas de edad gestacional (EG) y 1.600 gramos o menos de peso al nacer (PN). Se creó una base de datos en la que se registraron las variables demográficas, algunos factores de riesgo maternos y neonatales, la clasificación de la ROP y el tratamiento requerido. Se analizaron y compararon los resultados con la epidemiología regional e internacional.
Resultados: la prevalencia global de ROP fue del 18,2% (197 neonatos), con EG media de 29,53 semanas y PN medio de 1.230 gramos. En menores de 1.250 gramos dicha prevalencia fue del 40%. Los factores de riesgo más frecuentes fueron la enfermedad de membrana hialina, la sepsis (p = 0,00) y la preeclampsia; 125 de los 197 niños (63,5%) recibieron terapia con oxígeno (p = 0,00). El 10,2 % de los neonatos con ROP requirieron tratamiento quirúrgico.
Conclusión: con el presente estudio, se aportan datos estadísticos actualizados referentes a la prevalencia de ROP y a los factores de riesgo en nuestra población.
PALABRAS CLAVE
Epidemiología, Prematuro, Retinopatía de la Prematuridad, Tamización Neonatal
SUMMARY
Objectives: To describe the clinical and demographic characteristics, and the neonatal and maternal risk factors for retinopathy of prematurity (ROP) in patients detected by means of a screening program at a university-affiliated clinic in Medellín, Colombia, between 2003 and 2008.
Methods: The charts of 1.080 neonates were reviewed. Screening criteria were: 32 weeks or less of gestational age and/or 1.600 grams or less of neonatal weight. The following information was included in a data base: demographic variables, selected neonatal and maternal risk factors, classification of retinopathy and type of treatment. Results were statistically analyzed and compared with those of regional and international reports on the epidemiology of ROP.
Results: Global ROP prevalence was 18.2% (197 neonates), mean gestational age was 29.53 weeks and mean birth weight, 1.230 grams. Prevalence was 40% in infants with birth weight under 1.250 grams. The most frequent risk factors were: hyaline membrane disease, sepsis (p=0.00) and preeclampsia. One hundred and twenty five infants (63.5%) received oxygen therapy (p=0.00). Surgical treatment was required by 10.2% of infants.
Conclusion: These results provide up to date information on the prevalence and risk factors of ROP in a specific Colombian population.
KEY WORDS
Epidemiology, Neonatal Screening, Prematurity, Retinopathy of Prematurity
INTRODUCCIÓN
Se denomina retinopatía de la prematuridad (ROP, por la sigla en inglés de retinopathy of prematurity) a la retinopatía vasoproliferativa que se presenta en recién nacidos pretérmino (RNPT) quienes, a causa de su inmadurez, nacen con el sistema vascular retiniano incompleto, que en el período posnatal experimenta un desarrollo anómalo. La principal causa de la ROP es la prematuridad per se asociada a otros factores de riesgo, entre ellos la oxigenoterapia prolongada o mal monitorizada, la presencia de enfermedad cardiopulmonar y problemas cerebrales asociados (1).
La ROP es una de las principales causas de ceguera infantil en los países del Tercer Mundo; en Colombia es responsable del 23,9% de los casos (2,3); generalmente se debe a la falta de diagnóstico y tratamiento oportunos por la carencia de programas adecuados de tamización. Disminuir la incidencia de esta enfermedad es prioridad mundial de las organizaciones que buscan eliminar la ceguera, por tratarse de una entidad con gran potencial de prevención y porque, al presentarse en el inicio de la vida, representa un gran número de años de ceguera y por ende de incapacidad laboral.
El diagnóstico de la ROP se hace mediante el examen oftalmoscópico oportuno a los niños en riesgo de presentarla, que para los países con desarrollo alto son los neonatos con peso al nacer (PN) de 1.500 gramos o menos y edad gestacional (EG) de 30 semanas o menos (4). En Antioquia existe la percepción por parte de los examinadores que se puede presentar en niños más grandes, por lo que se ha ampliado el rango de peso a todos los menores de 1.800 gramos y a los comprendidos entre 1.800 y 2.000 gramos con factores de riesgo asociados; el rango de edad también se ha ampliado a todos los menores de 34 semanas.
Se habla actualmente de la presencia de una epidemia de ROP en los países en vías de desarrollo (5), que sería la tercera y cuyas causas incluyen una mezcla de las que ocasionaron la primera y la segunda, en los países desarrollados, en los años cuarenta y setenta, respectivamente. La primera epidemia se debió a la monitorización inadecuada del oxígeno en unidades de cuidados intensivos neonatales (UCIN) de bajo nivel tecnológico (6). La segunda fue desencadenada por las mejoras tecnológicas de dichas unidades, que trajeron un incremento en la supervivencia de los neonatos con menores PN y EG (7).
La tamización es fundamental para el diagnóstico oportuno y la optimización de los recursos disponibles en Antioquia. Los criterios de inclusión de los neonatos que van a ser examinados deben ser claros y específicos, basados en estudios epidemiológicos para determinar la población en riesgo de cada región (8). Se ha descrito en literatura reciente que los bebés con ROP en países con desarrollo moderado (índice de desarrollo humano entre 76 y 153) (9) son más grandes y más maduros, por lo que no se pueden tomar como propias las guías de países con alto desarrollo (5).
En Antioquia no tenemos datos recientes sobre la epidemiología de la ROP, ni se han hecho estudios representativos que permitan definir las guías de tamización. El objetivo del presente estudio fue describir y analizar las características clínicas y demográficas y los factores de riesgo neonatales y maternos de la ROP, durante los años 2003 a 2008, y analizar el programa actual de tamización de la Clínica Universitaria Bolivariana (CUB), de Medellín, Colombia.
METODOLOGÍA
En este estudio observacional analítico de corte transversal, se revisaron todos los registros de los neonatos examinados para ROP en la CUB de la ciudad de Medellín, entre los años 2003 y 2008. Los pacientes provinieron de la Unidad de Cuidados Intensivos Neonatales (UCIN) de la CUB, de otras instituciones de Medellín y de otros municipios del departamento de Antioquia. Se excluyeron seis registros que carecían de los datos de EG y PN, imprescindibles para el estudio.
Los criterios de inclusión para tamizar, definidos por el Servicio de Oftalmología, fueron: RNPT con 32 semanas o menos de EG, RNPT con 1.600 gramos o menos de PN y RNPT entre 1.601 y 1.800 gramos con curso clínico inestable, basado en las recomendaciones de las Academias Americanas de Pediatría y Oftalmología (4) modificadas para nuestra población o superiores a estas a juicio del pediatra. El examen de fondo de ojo fue hecho por un retinólogo con experiencia en ROP (M.C.M.B), previa dilatación farmacológica (con tres gotas de la mezcla resultante de agregar 20 gotas de fenilefrina al 10% a un frasco de 15 mL de tropicamida al 1%, aplicadas cada 5 minutos); se hizo oftalmoscopía indirecta con lente de 20 dioptrías e indentación escleral. El primer examen se realizó entre la cuarta y sexta semanas de vida, con revisiones hasta la vascularización retiniana completa. Cada niño se calificó con el grado máximo de retinopatía detectado según la Clasificación Internacional de la ROP (ICROP) (10,11).
El tratamiento quirúrgico se indicó en los pacientes con retinopatía estadio 3 de la ICROP, con enfermedad umbral, definición de CRYO-ROP (CRYO, por el inglés cryotherapy) (12,13) o con enfermedad preumbral, según definición de ET-ROP (por la sigla en inglés de early treatment for retinopathy of prematurity study) (14,15) y en neonatos en zona II estadio 2 que por razones socioeconómicas no pudieran permanecer en la ciudad para el seguimiento adecuado (dos casos). En los estadios 4 y 5 se efectuó cirugía vitreorretiniana (ICROP) (10,11).
Hasta el año 2006 el tratamiento quirúrgico fue con crioterapia; en 2007 y 2008 se iniciaron los tratamientos con láser de diodo (16). Los procedimientos se hicieron bajo anestesia local asistida. La crioterapia se aplicó con un equipo Frigitronics (Frigitronics, Inc. Shelton) equipado con una pieza de mano de 1 mm, con lente de 20 dioptrías e indentador escleral. Las marcas de crío se aplicaron en los 360 grados de la retina por delante del anillo fibrovascular hasta la ora serrata; fueron de intensidad moderada y con aplicaciones continuas y no superpuestas. En el tratamiento con láser de diodo (IRIS, Medical, Inc), las marcas se aplicaron en la retina avascular, inmediatamente por delante del anillo fibrovascular, con extensión hasta la ora serrata y en 360 grados. Las marcas fueron de moderada intensidad, confluentes y variaron entre 150 y 400 mW y de 0,2 a 0,3 segundos.
Se registraron las siguientes variables: EG, PN, edad posnatal y edad al momento del examen, sexo, producto de embarazo múltiple, oxigenoterapia y factores de riesgo neonatales como: membrana hialina, taquipnea transitoria del recién nacido (TTRN), sepsis, neumonía, cardiopatía congénita, apnea, anoxia perinatal, meningitis y enterocolitis necrosante; también los siguientes factores de riesgo materno: preeclampsia, infección urinaria, diabetes gestacional, eclampsia y síndrome HELLP. Se consignaron además la presencia de ROP, su estadio, la zona afectada y el tipo de tratamiento: consulta única sin necesidad de otros exámenes, tratamiento no quirúrgico (observación) o tratamiento quirúrgico.
Se recolectaron los datos en un formulario y se tabularon en tablas de Excel. Para analizarlos se utilizaron las frecuencias absolutas y relativas para variables categóricas y la media ± desviación estándar o la mediana con rango intercuartílico para las variables continuas. En los análisis exploratorios de datos se empleó la prueba t student para muestras independientes o la U de Mann Whitney para comparar las medias de variables cuantitativas, según su distribución normal o no. Para la comparación de variables categóricas se empleó la prueba Ji cuadrado de independencia o la exacta de Fischer. Para todos los análisis se empleó un alfa de 0,05 a dos colas. Los resultados se analizaron en el programa SPSS 13.0 (Chi IL).
El estudio siguió los principios de la Declaración de Helsinki para la investigación en seres humanos y contó con el aval del Comité de Ética en Investigaciones de la Universidad Pontificia Bolivariana.
RESULTADOS
La muestra del estudio la compusieron 1.080 neonatos, de los cuales, 499 (46,2%) fueron del sexo masculino y 581 (53,8%), del femenino. La edad gestacional promedio fue 31,47 ± 2,6 semanas (rango 24-39); el peso promedio fue 1.536 ± 404 gramos (rango 650-3.700); el promedio de la edad postnatal, al momento del examen, fue de 36,72 semanas (rango 26-60 y rango intercuartílico 35-38).
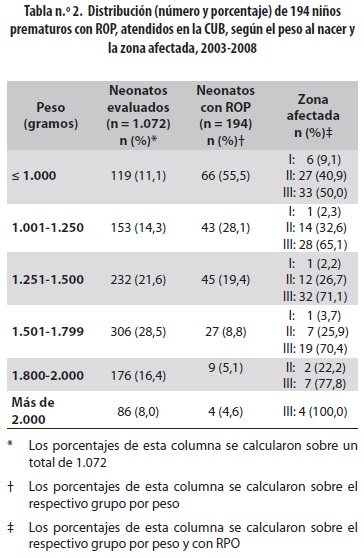
Se diagnosticó ROP en 197 de los 1.080 prematuros (18,2%), de los cuales 102 (51,8%) estaban en el estadio 1 (tabla n.º 1); de los 197, nueve se clasificaron en zona I (4,6%), 62 en zona II (31,5%) y 126 en zona III (63,9%). La edad gestacional promedio de los prematuros con ROP fue 29,53± 2,486 semanas (rango 25-36); el PN promedio fue 1.230 ± 342 gramos (rango 650-2.100). La proporción de ROP en menores de 1.000 gramos fue 55,5%, y de ellos, un 48,4% presentó compromiso en las zonas I y II (tabla n.º 2).
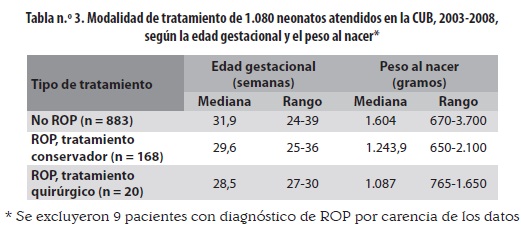
En la tabla n.º 3 se presentan la edad gestacional y el peso de los grupos sin ROP, ROP con tratamiento conservador y ROP con tratamiento quirúrgico.
Del grupo con ROP, a 168 (85,3%) se les hizo tratamiento no quirúrgico (seguimiento hasta el alta) y a 20 (10,2%), tratamiento quirúrgico (tabla n.º 3); de los 9 restantes (4,6%), un paciente no se reportó y a ocho se los dio de alta. La distribución por zona afectada en los neonatos que requirieron cirugía fue como sigue: 30% zona I, 65% zona II y 5% zona III. De estos niños, el 40% presentaron sepsis como factor de riesgo asociado.
En la tabla n.º 4 se presentan los factores de riesgo; los más frecuentes fueron: membrana hialina (24,9%), preeclampsia (18,3%) y sepsis (15,7%).
En las tablas n.º 5 y 6 se presenta un análisis exploratorio de factores de riesgo conocidos para el desarrollo de ROP en nuestros pacientes; se observa que en el grupo de ROP se encontraron (sobre 188 pacientes) 81 (43.1%) de sexo masculino y 107 (56,9%) del femenino; 22 (11.2%) neonatos fueron producto de embarazo gemelar, 125 (63.5%) recibieron terapia con oxígeno y 31 (15,7%) tuvieron sepsis.
DISCUSIÓN
Los avances de la neonatología han aumentado la tasa de supervivencia de neonatos cada vez más inmaduros, razón por la cual se ha incrementado la incidencia de ROP, no solo de sus formas benignas, sino también de las más graves, que pueden conducir a la pérdida total de la visión (17). Según Gilbert, en Colombia es responsable del 23,9% de los casos de ceguera infantil (5). Otros autores informan hasta un 33,8% (2). Es una de las causas principales de ceguera prevenible y esto incluye no solo la prevención primaria de la ocurrencia de la enfermedad, que compete a pediatras y ginecólogos, sino también la prevención secundaria (de la pérdida de la visión), campo del oftalmólogo. El primer paso de esta última es el diagnóstico oportuno que se logra mediante programas de tamización bien estructurados, adecuados para cada población (18).
Es de anotar que las variaciones en los criterios de tamización están directamente relacionadas con el nivel de desarrollo; en países desarrollados, debido a sus excelentes condiciones tecnológicas, han ido desplazando la evaluación a neonatos cada vez más pequeños, a la vez que van excluyendo a los más grandes, y es así como en la actualidad se están centrando en menores de 1.000 gramos y de 30 semanas de gestación (4). Es una situación muy diferente a la de los países en vías de desarrollo, en los que se presenta ROP en neonatos más grandes y maduros (5,19); ante tales discrepancias, es lógico que si se aplicaran las mismas guías de los países desarrollados se perdería un porcentaje importante de los pacientes en riesgo de desarrollar una ROP potencialmente cegadora; por ejemplo, el límite superior de peso en los trabajos multicéntricos (1.500 gramos) dejaría por fuera el 12% de nuestros pacientes (5,19,20); ante estos hechos, es imprescindible conocer las características de los neonatos en riesgo en cada población.
En el presente estudio observacional analítico de corte transversal, analizamos la prevalencia de ROP en un período de seis años, en los pacientes admitidos al programa de tamización en la Clínica Universitaria Bolivariana de la ciudad de Medellín; es de anotar que a dicho programa acuden neonatos provenientes de varias UCIN de la ciudad así como de centros de referencia de otros municipios del departamento de Antioquia. Encontramos una prevalencia global de retinopatía de la prematuridad del 18,2%; este porcentaje es menor que el hallado en otros estudios, debido a la inclusión de 568 prematuros mayores de 1.500 gramos correspondientes al 52,6% de los 1.080 niños examinados. Cuando se incluyeron los menores de 1.250 gramos la prevalencia fue de 40,1%, más baja que la informada en los estudios de CRYO-ROP (12), 65,8%, y ET-ROP, 68% (14). La mayor prevalencia encontrada en estos estudios se puede explicar porque ellos tienen una mayor tasa de supervivencia de niños con menor peso. Sin embargo, si comparamos la prevalencia en neonatos con pesos comprendidos entre 1.250 y 1.800 gramos, nuestra estadística es mayor que la reportada por Yanovitch y colaboradores: (21) 13,38% frente a 4,2%, datos que confirman lo que sucede en nuestros países, o sea, la presencia de ROP en niños de mayor peso.
Otros estudios de incidencia global en América Latina son: el de Bancalari y colaboradores (Chile) que informaron en su muestra de 248 neonatos con peso menor de 1.500 gramos una incidencia global del 28,2% (22); el de García y colaboradores (Cuba) en 66 neonatos menores de 1.750 gramos quienes hallaron una incidencia de 24,2% (23) y el de Doig y colaboradores (Perú) que hallaron hasta un 70,6% en 136 neonatos menores de 1.500 gramos (24); incidencia alta en relación con los otros países. Con respecto a estudios en Colombia, encontramos limitantes como el escaso número de trabajos publicados y el tamaño reducido de sus muestras; en la ciudad de Bogotá, en una población de 195 neonatos menores de 37 semanas encontraron 19,5% con ROP (25). En Medellín, en 1993, un estudio hecho en el Hospital General, halló una proporción del 23% en 65 neonatos menores de 1.500 gramos, menor que la encontrada en nuestro estudio en el mismo grupo de peso (30,5%) (26).
Nuestros hallazgos en cuanto a prevalencia y gravedad de la ROP, según los grupos de peso, confirman lo informado en la literatura: el 55% de los menores con 1.000 gramos o menos tuvieron ROP, y de estos, la mitad la tuvo en las zonas I y II; de 1.001 a 1.250 gramos la prevalencia de ROP fue 28,1%; en el grupo de 1.251 a 1.500 gramos fue 19,4%; en el de 1.501 a 1.800 gramos fue de 8,8% y en el de 1.801 a 2.000 gramos, del 5,1%. Cabe anotar que a partir de los 1.800 gramos no se encontró afectación de la zona I y que en los mayores de 2.000 gramos, de 83 pacientes examinados solo el 4,6% presentaron retinopatía y todos fueron en zona III.
En cuanto a la ROP grave, Gilbert informó que se presenta en neonatos con pesos comprendidos entre 737 y 763 gramos y entre 25,3 y 25,6 semanas, en los países con índice de desarrollo humano alto, mientras en países como Colombia, con índice de desarrollo medio se presenta en rangos de peso entre 903 y 1.527 gramos y entre 26,3 y 33,5 semanas (5). En nuestro estudio encontramos pacientes con ROP grave en el rango de peso entre 765 y 1.650 gramos y en edades gestacionales entre 27 y 32 semanas. Se puede observar que tuvimos casos en neonatos con peso mayor que el mencionado anteriormente.
Encontramos 9,6% de ROP grave, porcentaje mayor que el 6% descrito en el departamento de Santander (27).
Con respecto a los factores de riesgo para ROP, cabe anotar que pueden existir variaciones tecnológicas en su control o monitorización, en las diferentes ciudades y aun dentro de las mismas comunidades, lo que puede contribuir a las diferencias en la prevalencia de ROP y obliga a buscar y recopilar estadísticas propias para cada comunidad; ello da lugar a unas reglas de tamización diferentes a las de otros países, propias para la población que se considere. De los factores de riesgo evaluados tuvieron una influencia estadísticamente significativa en la presentación de la retinopatía, la edad gestacional (p = 0,00), el peso al nacer (p = 0,00), la oxigenoterapia (p = 0,005) y la sepsis (p = 0,00); y no la tuvieron, el sexo (p = 0,331) y el embarazo múltiple (p = 0,51).
En nuestro estudio, la sepsis también influyó en la gravedad de la retinopatía, puesto que fueron los neonatos que requirieron tratamiento quirúrgico los que la presentaron en mayor proporción (40%). Este factor se encuentra en la literatura asociado tanto a la mayor incidencia como al fracaso en el tratamiento quirúrgico (21,28).
Esperamos haber aportado información que contribuya a determinar los criterios de tamización para ROP en Antioquia. Con base en nuestros resultados, por ejemplo, se deduce lo innecesaria que es la inclusión de neonatos mayores en estos programas, que solo representa desgaste para el examinador, sobrecosto para el programa y un traumatismo innecesario para los neonatos (5,8,19,20). Sugerimos para la ciudad de Medellín incluir en la tamización a todos los prematuros con menos de 1.600 gramos de peso al nacer, y a todos aquellos entre 1.601 y 1.800 gramos que hayan presentado factores de riesgo. Consideramos que para nuestra población es más confiable el PN que la EG, puesto que esta última a menudo está sujeta a datos imprecisos aportados por las madres, sumados a la limitante sociocultural para la asistencia oportuna al control prenatal.
Es de resaltar el valor agregado que tiene nuestro programa de tamización, aunque esta no se lleve a cabo dentro de una UCIN, porque se evalúan neonatos en riesgo sin cita previa y sin cobro; de otra forma no tendrían fácil acceso al servicio por problemas socioeconómicos o de afiliación al sistema de salud.
AGRADECIMIENTOS
Los autores expresan su agradecimiento al equipo del programa de tamización de ROP de la Clínica Universitaria Bolivariana.
REFERENCIAS BIBLIOGRÁFICAS
1. Wright KW, Sami D, Thompson L, Ramanathan R, Joseph R, Farzavandi S.A physiologic reduced oxygen protocol decreases the incidence of threshold retinopathy of prematurity. Trans Am Ophthalmol Soc. 2006 Jan;10478-84. [ Links ]
2. Zuluaga C, Sierra MV, Asprilla E. Causas de ceguera infantil en Cali Colombia. Colombia Médica. 2005;36(4):235-238. [ Links ]
3. Gilbert C, Rahi J, Eckstein M, O'Sullivan J, Foster A. Retinopathy of prematurity in middle-income countries. Lancet. 1997 Jul 5;350(9070):12-4. [ Links ]
4. Screening examination of premature infants for retinopathy of prematurity. Pediatrics. 2006 Mar;117(2):572-6. [ Links ]
5. Gilbert C, Fielder A, Gordillo L, Quinn G, Semiglia R, Visintin P, et al. Characteristics of infants with severe retinopathy of prematurity in countries with low, moderate, and high levels of development: implications for screening programs. Pediatrics. 2005 May;115(5):e518-25. [ Links ]
6. Campbell K. Intensive oxygen therapy as a possible cause of retrolental fibroplasia; a clinical approach. Med J Aust. 1951 Jul 14;2(2):48-50. [ Links ]
7. Valentine PH, Jackson JC, Kalina RE, Woodrum DE. Increased survival of low birth weight infants: impact on the incidence of retinopathy of prematurity. Pediatrics. 1989 Sep;84(3):442-5. [ Links ]
8. Elder JE. Is it time to review the screening guidelines for retinopathy of prematurity? J Paediatr Child Health. 2008 Apr;44(4):159-60. [ Links ]
9. Programa de las Naciones Unidas para el Desarrollo. Informes sobre desarrollo humano [Internet]. PNUD. 2003;3.(cited 2009 Feb 20) Available from: http://hdrstats.undp.org/es/paises/perfiles/COL.html [ Links ]
10. An international classification of retinopathy of prematurity. The Committee for the Classification of Retinopathy of Prematurity. Arch Ophthalmol. 1984 Aug;102(8):1130-4. [ Links ]
11. The International Classification of Retinopathy of Prematurity revisited. Arch Ophthalmol. 2005 Jul;123(7):991-9. [ Links ]
12. Multicenter trial of cryotherapy for retinopathy of prematurity: preliminary results. Cryotherapy for Retinopathy of Prematurity Cooperative Group. Pediatrics. 1988 May;81(5):697-706. [ Links ]
13. Palmer EA, Flynn JT, Hardy RJ, Phelps DL, Phillips CL, Schaffer DB, et al. Incidence and early course of retinopathy of prematurity. The Cryotherapy for Retinopathy of Prematurity Cooperative Group. Ophthalmology. 1991 Nov;98(11):1628-40. [ Links ]
14. Early Treatment For Retinopathy Of Prematurity Cooperative Group. Revised indications for the treatment of retinopathy of prematurity: results of the early treatment for retinopathy of prematurity randomized trial. Arch Ophthalmol. 2003 Dec;121(12):1684-94. [ Links ]
15. Good WV, Hardy RJ, Dobson V, Palmer EA, Phelps DL, Quintos M, et al. The incidence and course of retinopathy of prematurity: findings from the early treatment for retinopathy of prematurity study. Pediatrics. 2005 Jul;116(1):15-23. [ Links ]
16. González I, Ferrer C, Pueyo M, Melcon B, Ferrer E, Honrubia FM. Diode laser photocoagulation in retinopathy of prematurity. Eur J Ophthalmol. 1997;7(1):55-8. [ Links ]
17. Solano A, Serrano JC. Retinopatía del prematuro. In: Oftalmología pediátrica, guías de manejo. Bogotá D.C. Icono; 2006. p. 49-66. [ Links ]
18. Trese MT. What is the real gold standard for ROP screening? Retina. 2008 Mar;28(3 Suppl):S1-2. [ Links ]
19. Elder JE. Is it time to review the screening guidelines for retinopathy of prematurity? J Paediatr Child Health. 2008 Apr;44(4):159-60. [ Links ]
20. Quinn GE. Retinopathy of prematurity in Brazil: an emerging problem. J Pediatr (Rio J). 2007;83(3):191-3. [ Links ]
21. Yanovitch TL, Siatkowski RM, McCaffree M, Corff KE. Retinopathy of prematurity in infants with birth weight>or=1250 grams-incidence, severity, and screening guideline cost-analysis. J AAPOS. 2006 Apr;10(2):128-34. [ Links ]
22. Bancalari A, González R, Vásquez C, Pradenas L. Retinopatía del prematuro: incidencia y factores asociados. Rev Chi Pediatr. 2000;71(2):114-121. [ Links ]
23. García Fernández Y, Fernández Ragi RM, Rodríguez Rivero M, Pérez Moreno E. Incidencia de la retinopatía de la prematuridad. Rev Cubana Pediatr. 2007;79(2). [ Links ]
24. Doig Turkowsky J, Chafloque Cervantes A, Valderrama Rocha P, Valderrama Torres R, Vega Vega R, Vela Balladares P, et al. Incidencia de retinopatía de la prematuridad y su evolución en niños sobrevivientes de muy bajo peso al nacer egresados del Instituto Especializado Materno Perinatal de Lima. Rev Peru Pediatr. 2007;60(2):88-92. [ Links ]
25. Cortes Camacho A, Villamizar Cajiao MA. Incidencia de la retinopatía de la prematurez en prematuros nacidos vivos en el Hospital Universitario Clínica San Rafael. Rev Soc Col Oftalmol. 2008;41(3):686-707. [ Links ]
26. Lopera C. MM. Incidencia de retrinopatia de la prematuridad en recién nacidos pretermino de peso menor de 1500 gramos Hospital General de Medellín. CES Med. 1994;8(2):81-88. [ Links ]
27. Ortiz M, Serrano J, Varon C, Sánchez R, J. C. Retinopatía de la prematuridad. UCIN. 2007;(7):18-25. [ Links ]
28. Bourla DH, Gonzales CR, Valijan S, Yu F, Mango CW, Schwartz SD. Association of systemic risk factors with the progression of laser-treated retinopathy of prematurity to retinal detachment. Retina. 2008 Mar;28(3 Suppl):S58-64. [ Links ]
Recibido: junio 30 de 2010
Aceptado: marzo 03 de 2011