Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.24 no.4 Medellín Oct./Dec. 2011
ARTÍCULO DE REVISIÓN
Linfoma cutáneo de células T Revisión del tema con énfasis en la inmunopatogénesis
Cutaneous T-cell lymphoma: Review with emphasis on immunophatogenesis
Victoria Eugenia Duque Giraldo1; Margarita María Velásquez Lopera2
1 Magíster en Ciencias Básicas Biomédicas-Inmunología, Universidad de Antioquia, Medellín, Colombia. vickyduque@gmail.com
2 Dermatóloga, Doctora en Ciencias Básicas Biomédicas-Inmunología. Profesora y Jefa de la Sección de Dermatología, Grupo de Investigación Dermatológica GRID, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
Recibido: agosto 20 de 2010
Aceptado: julio 18 de 2011
RESUMEN
Bajo el término linfoma cutáneo de células T (LCCT) se agrupa una serie de enfermedades que tienen en común la presencia de un clon maligno de células T y la afectación de la piel. La micosis fungoide (MF) es la forma más común de LCCT, seguida por el síndrome de Sèzary (SS). La causa definitiva de la MF es desconocida. El inmunofenotipo de la mayoría de los casos de MF es de células T de memoria CD3+CD4+CD45RO+CLA+CD8-. Los linfocitos T CD4+ malignos migran hasta la epidermis y se localizan alrededor de las células de Langerhans (LC). En el SS las células pierden el epidermotropismo e infiltran extensamente la dermis, la sangre y otros tejidos; estas células presentan un inmunofenotipo predominante de células T neoplásicas CD3+CD4+CD8-CD7-CD26- CD158k+CD94-. El perfil Th2 y la supresión de respuestas Th1 son dos factores críticos en la progresión de la enfermedad. Se han evaluado muy poco las alteraciones en la regulación inmune en el LCCT. Un mejor entendimiento de la función de las células T y de la inmunobiología de los LCCT permitiría mejorar el pronóstico, el tratamiento y el seguimiento de los pacientes con estas neoplasias.
PALABRAS CLAVE
Células T reguladoras, Linfoma de células T, Micosis Fungoide, Síndrome de Sèzary
SUMMARY
The term cutaneous T-cell lymphoma (CTCL) refers to several diseases that have in common the presence of a malignant T-cell clone with involvement of the skin. Mycosis fungoides (MF) is the most common form of CTCL, followed by the Sèzary syndrome (SS). The cause of mycosis fungoides is unknown. Immunophenotype of most cases of MF is made up by memory T cells CD3+CD4+CD45RO+CLA+CD8-. Malignant T CD4+ lymphocytes migrate to the epidermis and localize around Langerhans cells. In SS, cells loose their epidermotropism and extensively infiltrate the dermis, blood and other tissues. These cells present a predominant immunophenotype of neoplasic T cells CD3+CD4+CD8-CD7-CD26-CD158k+CD94-. The Th2 profile and the supression of Th1 responses are two critical factors in the progression of the disease. Alterations in the immune regulation in CTCL have not been thoroughly evaluated. A better understanding of T-cell function and of the immunobiology of CTCL would allow to improve the prognosis, therapy and follow-up of patients with these neoplasias.
KEY WORDS
Mycosis Fungoides, Regulatory T-Cells, Sèzary Syndrome, T-Cell Lymphoma
INTRODUCCIÓN
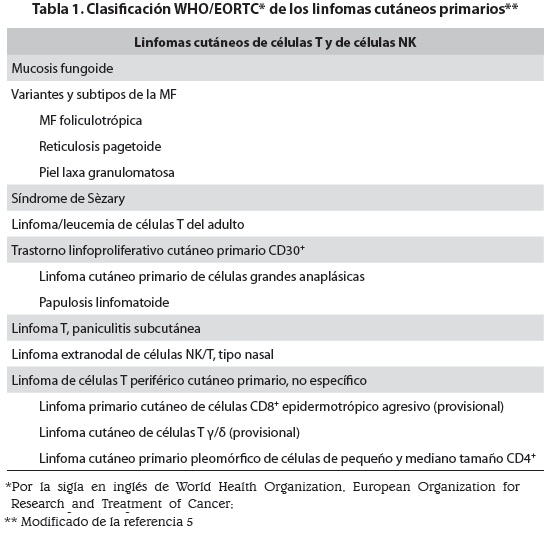
Se ha utilizado el término linfoma cutáneo de células T (LCCT) para agrupar una serie de enfermedades que tienen en común la presencia de un clon maligno de células T en piel, las cuales varían en cuanto a su histología, inmunofenotipo y pronóstico. La micosis fungoide (MF) es la forma más común y más estudiada de LCCT, seguida por el síndrome de Sèzary (SS). Entre otras formas menos frecuentes de LCCT se pueden citar: el linfoma/leucemia de células T del adulto, los trastornos linfoproliferativos CD30+ y el linfoma extranodal de células NK/T (tabla 1) (1). Esta revisión se centra en la inmunopatogénesis de la MF y el SS.
La MF representa el 1% de todos los linfomas no Hodgkin extraganglionares y más del 50% de todos los LCCT; afecta principalmente a adultos mayores de 50 años, con predominio en hombres (relación hombre/mujer: 2/1), aunque también se han descrito casos en niños y adolescentes, posiblemente por el mejoramiento en las técnicas diagnósticas empleadas (2). La enfermedad tiene un curso clínico con progresión lenta que puede durar años e incluso décadas antes del diagnóstico. Clásicamente la MF comienza con el estadio de parches, caracterizado por presentar una o varias zonas de eczema y descamación fina, localizadas en áreas no expuestas a la luz, que pueden ser recurrentes y desaparecer espontáneamente sin dejar cicatriz; clínicamente se puede confundir con las lesiones producidas por otras enfermedades como el vitiligo, lo cual dificulta su diagnóstico (figuras 1A y 1B). Luego de un período de varios meses o años la MF evoluciona al estadio de placas, que son bien definidas, induradas, de color violáceo e intensamente pruriginosas (figura 1C). En el estadio tumoral aparecen en toda la superficie corporal nódulos rojos y violáceos, de superficie lisa, con mayor frecuencia en la cara y los pliegues inguinal, antecubital, axilar e inframamario. Los tumores aparecen sobre placas antiguas de MF o en zonas de piel no afectadas previamente por la enfermedad. Su crecimiento es progresivo y pueden ulcerarse rápidamente (figura 1D).
El estadio de eritrodermia (síndrome de Sèzary, variante leucémica del LCCT) puede aparecer en la evolución de una MF o de novo en el 5% de los casos. Las células pierden el epidermotropismo e infiltran extensamente la dermis. La afectación hematológica se caracteriza por la presencia de más del 5% (1.000 células/µL) de mononucleares atípicos (células de Sèzary) en la circulación. La afectación de la piel es amplia, con prurito intenso y descamación generalizada; en los estadios avanzados de la enfermedad, las células, además de infiltrar la piel, invaden los ganglios, el bazo, el hígado y la médula ósea. Las células de Sèzary son de origen extramedular, de gran tamaño, con escaso citoplasma y núcleo grande cerebriforme (1). La gravedad de la MF se clasifica en cuatro estadios (I-IV) de acuerdo con su extensión en la piel, ganglios, sangre y vísceras: estadio leve (IA-IIA) y estadio grave (IIB-IVB) (3,4).
Factores involucrados en el desarrollo de MF/SS
Análisis por reacción en cadena de polimerasa (PCR) de los rearreglos del gen de las cadenas Vb del receptor del linfocito T (TCR, por la sigla en inglés de T cell receptor) han permitido la detección de células malignas en muestras de sangre periférica de pacientes en los estadios tempranos de la enfermedad con bajo número de parches o placas en la piel, lo cual sugiere que las células del clon maligno recirculan y pueden afectar sitios distantes, por lo que la enfermedad, aun en sus etapas iniciales, no se considera localizada a un solo segmento cutáneo (5). Hasta el momento no ha sido posible determinar si la transformación maligna de los linfocitos ocurre en la sangre periférica o directamente en el tejido; se sabe que en la sangre periférica el clon de linfocitos T de memoria CD4+CD45RO+ expresa en su superficie moléculas de adherencia como el antígeno leucocitario cutáneo (CLA, por la sigla en inglés de cutaneous lymphocyte antigen) y CCR4 (por la sigla en inglés de C-C chemokyne receptor type 4), que interaccionan con la E-selectina y con el ligando 17 de quimiocinas (CCL17, por la sigla en inglés de chemokyne [C-C motif] ligand 17) en las vénulas poscapilares de la dermis, respectivamente. La unión de estas moléculas permite la entrada de linfocitos T a la dermis y la epidermis, en donde interaccionan con las células de Langerhans (LC, por la sigla en inglés de Langerhans cells) que proveen los estímulos necesarios para inducir la expansión clonal de los linfocitos malignos (6,7).
Aún se desconoce el agente etiológico de la MF pero se han propuesto los siguientes: la persistencia antigénica, las infecciones virales, la exposición ocupacional a carcinógenos como pesticidas, los productos empleados en las industrias del papel y el vidrio, el licor y el cigarrillo y alteraciones genéticas.
La proliferación de las células malignas alrededor de las células de Langerhans epidérmicas, que conforma los microabscesos de Pautrier, sugiere que la generación del tumor podría deberse a la presentación antigénica constante de antígenos específicos aún no identificados (5,7). Se ha debatido ampliamente el papel del virus linfotrópico humano tipo 1 (HTLV-1) en el desarrollo y progresión del LCCT. Algunas de las evidencias más importantes de asociación entre MF y HTLV-1 han sido la presencia de ADN de HTLV-1 en células mononucleares de sangre periférica (CMSP) y en lesiones de piel de algunos pacientes con MF en Dinamarca (8-10). Por el contrario, estudios llevados a cabo en muestras de suero y biopsias de piel de pacientes en diferentes países como Dinamarca, Polonia e Irán no encontraron asociación entre LCCT y esta infección viral (11-13). De acuerdo con estas evidencias, no es posible concluir si hay o no relación entre las infecciones por HTLV-1 y el LCCT. Puede ser que el papel etiológico del HTLV-1 varíe en las diferentes poblaciones estudiadas.
Se ha asociado la infección por citomegalovirus (CMV) con el LCCT. La infección activa por CMV tiene efectos directos sobre la expansión y activación de las poblaciones de células CD8+ y NK lo que puede contribuir al desarrollo de la enfermedad tumoral. El CMV inhibe la expresión de las moléculas del complejo mayor de histocompatibilidad clase I (MHC-I) en las células infectadas y disminuye la producción de IFN-γ por los macrófagos. Herne y colaboradores (14) hallaron que el 97% de los 116 individuos con LCCT participantes en su estudio tenían títulos más altos de IgG para CMV que los controles sanos. Estos hallazgos les permitieron concluir que la infección latente por CMV podría tener un papel en la patogénesis del LCCT probablemente por mecanismos de presentación antigénica crónica que induce la proliferación de las células T y hace disminuir la apoptosis de las células T del clon maligno (15)
Poco se sabe del papel de la infección por el virus de Epstein-Barr (EBV) en el desarrollo de la MF. Sin embargo, se propone que dicha infección podría contribuir a la patogénesis de la enfermedad por la generación de un ambiente inmunosupresor que permitiría a las células tumorales escapar de la respuesta inmunológica (16-19).
Se ha relacionado a algunas alteraciones genéticas como deleciones (1p, 17p, 10q), adiciones (4q, 18y 17q) y translocaciones, además de inestabilidad en microsatélites, con el desarrollo y la progresión de la enfermedad (20,21). Estos fenómenos contribuyen a la presencia de mutaciones en distintos genes: supresores de tumores, reguladores del ciclo celular, implicados en la expansión clonal y en la evasión de la respuesta inmune como p53, p15, p16, Jun B, y PTEN (por la sigla en inglés de phosphatase and tensin homologue). Las alteraciones en estos genes aparecen tardíamente en el curso del LCCT lo cual sugiere que se presentan a consecuencia de los cambios inmunológicos y no como causa del linfoma (1,22).
Se cree que el desarrollo de la enfermedad podría tener una base genética: en 1933 Cameron y colaboradores (23) reportaron el caso de una mujer de 45 años y su hija de 28 años con MF eritrodérmica. Hodak y colaboradores reportaron la asociación de la presencia de HLA DRB1*11 y DQB*03 con el desarrollo de MF en seis familias en Israel, lo que confirma el posible papel del HLA en la susceptibilidad a la enfermedad (24).
Inmunopatogénesis de la MF/SS
Histológicamente, las lesiones de MF se caracterizan por la infiltración de numerosos linfocitos T tanto en la dermis como en la epidermis (figura 2A), con especial tropismo por los folículos y las glándulas sudoríparas, o linfocitos solitarios alineados en la membrana basal (uno a cinco linfocitos por campo, 20X) (25), y por la aparición de los microabscesos de Pautrier caracterizados por linfocitos T CD4+ alrededor de una célula de Langerhans (figura 2B) (26). El inmunofenotipo de la mayoría de las MF corresponde a células T de memoria CD3+CD4+CD45RO+CLA+CD25+CD8-, que pierden la expresión de antígenos como CD2, CD3, CD5 y CD7 y expresan proteínas citotóxicas como TIA-1 y granzima B (27). Por su parte, las células de Sèzary presentan un inmunofenotipo variable (expresión diferencial de los marcadores de superficie), lo que dificulta su identificación, CD3-CD4+CD8-CD7-CD26- CD158k+CD94-; la expresión diferencial de estos marcadores les confiere la capacidad de evadir la respuesta antitumoral (5,28).
Entre los mecanismos que controlan la migración y el posicionamiento de las células T en la piel están las quimiocinas producidas por los queratinocitos, tales como CCL7, CCL27 y CCL4, y la expresión de receptores para las mismas como CCR4, CXCR4, CCR10 y el antígeno leucocitario cutáneo (CLA) (6,7,29). Además, las quimiocinas tienen la capacidad de incrementar la afinidad y avidez de unión entre las integrinas de los linfocitos (b1 y b2) y sus receptores endoteliales como la molécula 1 de adherencia intercelular (ICAM-1, por la sigla en inglés de intercellular adhesion molecule-1) permitiendo su activación y dando lugar a la formación de los microabcesos de Pautrier, marca histológica de la enfermedad (7). Estudios comparativos de la expresión de receptores de quimiocinas en cada estadio de la MF encontraron que los niveles de expresión de CCR4 y CXCR3 se encontraban disminuidos en el estadio tumoral y que los de CCR7, receptor asociado con el tráfico de linfocitos a los ganglios linfáticos, se encontraban aumentados (7,27,30). La expresión diferencial de estos receptores de superficie se considera de gran importancia en la diseminación de la enfermedad y en la capacidad de invasión de diferentes órganos y tejidos por el clon maligno.
Algunas evidencias apuntan a que las interacciones entre el clon maligno y las células presentadoras de antígeno (APC, por la sigla en inglés de antigenpresenting cells) pueden variar en diferentes estadios de la enfermedad y en los distintos modelos estudiados. Berger y colaboradores (31) en estudios in vitro reportan que el clon maligno podría contribuir al mantenimiento y la supervivencia de las células dendríticas inmaduras por mecanismos que incluyen la coestimulación mediante CD40/CD40L. A diferencia de esto, en estadios avanzados de la enfermedad, las células T disminuyen la expresión de CD40L lo que contribuye a las deficiencias en la presentación antigénica y a la inmunosupresión asociada a la MF/SS (31,32).
Aún no está dilucidado el efecto de las citocinas producidas en el microambiente tumoral sobre la progresión de la enfermedad. Se sabe que en los estadios iniciales de la MF es muy baja la proporción de células tumorales que producen citocinas como IL-4 e IL-5 en el infiltrado cutáneo, mientras que es muy alto el porcentaje de células T CD8+ productoras de citocinas como IFN-γ e IL-2, lo que induce una respuesta principalmente Th1. A medida que avanza la enfermedad, se evidencia un aumento en la producción de citocinas Th2 como IL-4, IL-5 y de citocinas inmunorreguladoras como IL-10 producidas por las células T malignas que suprimen las respuestas Th1 y representan un mecanismo de evasión de la respuesta antitumoral (33). En este mismo sentido, el incremento en el mARN de IL-10 y la disminución del mARN de IFN-γ se han asociado con el aumento en la densidad del clon maligno en la piel a medida que la enfermedad progresa de lesiones tipo parche o placa a tumor (figura 3) (30,34-37).
Vowels y colaboradores (35) demostraron que biopsias de piel obtenidas de pacientes con SS presentaban niveles altos de mARN para IL-4 e IL-5 producidas por el clon maligno, cuando se las comparaba con muestras de piel obtenidas de zonas no afectadas y de controles sanos. De igual forma, estos autores demostraron que células mononucleares de sangre periférica de pacientes con SS producían más IL-4 y menos IL-2 e IFN-γ, que controles sanos (figura 3).
Wysocka y colaboradores (38) observaron una disminución progresiva, a medida que aumentaba el recuento de células malignas circulantes, en la producción de citocinas como IL-2, IL-4, IL-12, IL-13, IL-15, IL-18 e IFN-γ en células mononucleares de sangre periférica de pacientes con SS. Tal disminución estaba relacionada con la merma de células dendríticas mieloides y plasmocitoides en estos pacientes. En biopsias de piel de pacientes con LCCT se ha visto sobrexpresión de IL-15, citocina relacionada con la inhibición de la apoptosis de células T después de exposición al antígeno y de promover la expansión y persistencia de las células T CD4 (figura 3) (27,39).
Posible papel de las células T reguladores y Th17 en el desarrollo y progresión del LCCT
El conocimiento de las subpoblaciones de células reguladoras ha definido una nueva etapa en el desarrollo investigativo sobre la generación y el control de la respuesta inmune. Hasta el momento se han caracterizado dos poblaciones de células T reguladoras CD4+ (Treg); una es la de células reguladoras naturales o tímicas CD4+CD25highFOXP3+CTLA-4highCD127-/ lowGITR+, cuya función es determinada en el timo, y otra es la de células Treg adaptativas o inducidas, que adquieren su función reguladora en la periferia (40). En las Treg adaptativas se incluyen las Tr1 (CD4+IL-10+), las Th3 (CD4+TGF-b+) y las de fenotipo similar a las naturales CD4+CD25highFOXP3+; estas se diferencian en la periferia a partir de células T CD4+CD25- por mecanismos que incluyen la presentación antigénica en presencia de IL-10 y TGF-b producidos por las DC o por otras células reguladoras (40).
Algunos autores han propuesto que el LCCT podría ser una neoplasia de células T reguladoras. Berger y colaboradores (41) demostraron que cuando se cultivaban células malignas CD4+ con DC que habían sido pulsadas con células tumorales apoptóticas, adquirían el fenotipo y la función de células T reguladoras, caracterizados por la alta expresión de moléculas como CD25, CTLA-4 y FOXP3, y por la producción de citocinas inmunorreguladoras como IL-10 y TGF-b. Otra evidencia en este sentido es la presencia de concentraciones más altas de IL-10 en la sangre periférica de pacientes con LCCT, lo que sugiere que esta citocina podría favorecer la generación de células Treg adaptativas. A su vez, las células reguladoras adaptativas Tr1, productoras de cantidades altas de IL-10, podrían favorecer mecanismos de escape de la respuesta antitumoral (42). Sin embargo, se requiere mayor evidencia experimental a este respecto.
En general, se ha evaluado poco la regulación inmune en el LCCT. Entre las evidencias reportadas, Tiemessen y colaboradores (43) sugirieron que la disfunción observada en las Treg de algunos pacientes con LCCT podría estar correlacionada con la progresión del tumor; estos resultados se obtuvieron en un grupo de diez pacientes con SS, en los que se observó que el porcentaje de células T CD4+CD25+ era similar entre pacientes y controles sanos; sin embargo, en su estudio observaron que cuatro de los pacientes tenían disminuida la expresión de FOXP3 y la función reguladora. Otros autores han planteado que las células Treg naturales y adaptativas podrían impedir la generación y activación de células antitumorales en el LCCT e incrementar las alteraciones en las poblaciones de células CD8+ (44).
En un estudio realizado por Klemke y colaboradores (45) se encontró que las células malignas no presentaban un fenotipo regulador, por lo que concluyeron que las células Treg no son las responsables del desarrollo de la enfermedad. En este mismo estudio informaron la disminución de la población de células Treg en pacientes con SS y concluyeron que posiblemente estas células tengan un papel importante en la gravedad de este síndrome comparado con otros tipos de LCCT.
Además, estudios de inmunohistoquímica en biopsias de pacientes con LCCT han permitido evidenciar la presencia de células FOXP3+ infiltrantes en la dermis y la epidermis. Sin embargo, no se ha podido demostrar que sean las células del clon maligno las que están expresando dicho factor; posiblemente el microambiente tumoral permita la inducción del fenotipo regulador, exacerbando el fenotipo de inmunosupresión observado en los pacientes y la evasión de la respuesta antitumoral (45,46).
Recientemente se identificó tanto en ratones como en humanos un nuevo fenotipo de células CD4+, las Th17. Estas células se caracterizan por la producción de citocinas como IL17A, IL17F, IL-21, IL-22, IL-26 y CCL20 (en humanos). Existen evidencias tanto en ratones como en humanos indicadoras de que las células Th17 están involucradas en procesos inflamatorios y en el desarrollo de autoinmunidad, pero aún se desconoce su papel exacto en la inmunidad tumoral (47,48). La IL-17 es una citocina proinflamatoria que se encuentra asociada con el estímulo de la producción de otras citocinas como IL-6, IL-1 β, TNF-α e IFN-γ; también con el incremento en la expresión de CD40, citocinas quimiotácticas como IL-8, factores de crecimiento hematopoyético como los factores estimulantes de colonias de granulocitos (G-GSF) y de granulocitos-macrófagos (GM-CSF), los cuales promueven el crecimiento y la maduración de las células mieloides reclutadas a los sitios de inflamación. Además de lo anterior, IL-17 es un puente entre la inmunidad innata y la adaptativa al inducir la expresión de moléculas como ICAM-1 incrementando la activación de las células T (49).
En años recientes se ha tratado de dilucidar la posible relación entre las células Treg y Th17. En humanos existen reportes en los que se muestra que las células Treg no son capaces de suprimir la proliferación de las células Th17 (50-51). De hecho, se ha demostrado que las Treg tienen la capacidad de inducir la diferenciación de células CD4+ de memoria a células Th17 (50), inclusive algunas células Treg son capaces de producir grandes cantidades de IL-17 y de expresar simultáneamente los factores de transcripción FOXP3 y RORC, que se consideran los específicos de las células Treg y Th17, respectivamente (52,53). Mangan y colaboradores (54) demostraron que la adición de TGF-b a células T CD4+ vírgenes induce la diferenciación a Th17, efecto que aumenta con la adición de anticuerpos neutralizantes anti-IFN-g y anti- IL-4. En otros experimentos, estos autores demostraron que la adición de IL-6 a los cultivos induce la merma de la expresión de FOXP3, mientras que el bloqueo de IL-6 estimula la generación de células T reguladoras. La interrelación entre las células Treg y Th17 se considera importante para el mantenimiento del balance entre una respuesta inmune eficiente y el daño patológico.
Estudios clínicos y experimentos en modelos animales han sugerido el papel de las células Th17 y las citocinas asociadas con la respuesta Th17 en el desarrollo de tumores como melanomas (55), cáncer de ovario (56), cáncer de mama (57), cáncer de pulmón (58), entre otros, pero hasta el momento no está claro si estas células están implicadas en el progreso o inhibición del tumor.
Se plantea la posibilidad que entre las alteraciones en la regulación inmune en LCCT participen las células Th17, especialmente en los casos asociados a infecciones virales con HTLV-1, citomegalovirus y virus de Epstein-Barr. La persistencia de las respuestas Th17 podría estar favorecida por la disminución de las citocinas Th1, especialmente el IFN-β, y por el aumento de la IL-10 observado en los pacientes con LCCT, y por la posible generación de células reguladoras adaptativas tanto Tr1 como Th3, estas últimas productoras de TGF-β, citocina directamente relacionada con la inducción del linaje Th17 (49,59). La expresión de mARN para IL-17 y la producción de IL-17 fueron informadas en líneas celulares derivadas de pacientes con MF y SS (60). También se ha informado un aumento en la producción de IL-17 en células mononucleares de sangre periférica aisladas de pacientes con MF en estadio leve y la producción de esta citocina disminuye a medida que avanza la enfermedad (37). El papel de las células Th17 en LCCT aún no está completamente entendido.
Resistencia a la apoptosis como mecanismo de evasión de la respuesta inmunológica
Luego de una respuesta efectora se elimina la mayoría de las células T activadas para prevenir su acumulación excesiva y el daño tisular por un mecanismo denominado muerte inducida por activación (AICD, por la sigla en inglés de activationinduced cell death). Después de la activación de las células T y del control del antígeno que desencadenó la respuesta inmune, se activa la vía apical de muerte celular por la unión del ligando Fas (FasL, CD95L) con su receptor de superficie (CD95) (61).
Algunas evidencias sugieren que la acumulación de las células tumorales se debe a su resistencia a la apoptosis y no solamente al aumento de la proliferación. Las células del clon maligno regulan negativamente la expresión de receptores de muerte como Fas y el TNF-R1 (61). Klemke y colaboradores (62) encontraron que las células de los pacientes con LCCT eran resistentes a la AICD; mostraron que estas células tenían niveles elevados de cFLIP (proteína inhibidora de CD95) y que además eran incapaces de regular positivamente la expresión de CD95L después de la activación. Observaron además que las células de estos pacientes presentaban niveles reducidos de señalización a través del TCR, lo que les permite escapar de los mecanismos de muerte por activación.
Alteraciones inmunológicas en la MF y su papel en la progresión de la enfermedad
Entre las alteraciones inmunológicas descritas en MF/SS están la disminución de las células Th1 y de la actividad de las células NK, la eosinofilia, el aumento de IgE e IgA, la alteración de la respuesta de los linfocitos a mitógenos, el cambio en la expresión de receptores de superficie y diferencias en el perfil de citocinas (63).
En la progresión de la MF se observa disminución en las células CD8+ y NK, que conduce a alteraciones en la defensa contra microorganismos, permitiendo la reactivación de infecciones como el herpes zóster, la aparición de melanoma maligno, cáncer de piel no melanoma y otras neoplasias como cáncer de colon y mama (64).
En el SS se ha evidenciado la disminución de las DC lo cual puede contribuir a trastornos en la producción de citocinas y disminución en el desarrollo de la inmunidad celular. En los pacientes con MF/SS disminuye el porcentaje de células dendríticas plasmocitoides CD123+ CD11c-/low, y en estas células disminuye la producción de IFN-α e IL-12 (63).
Alteraciones en la respuesta inmunológica inducidas por el clon maligno: evidencias basadas en los efectos del tratamiento
En el manejo de la MF/SS se emplean tratamientos que actúan directamente en la piel y/o terapias sistémicas. La selección de la terapia depende del estadio de gravedad del tumor. Muchas de las alteraciones inmunológicas descritas en MF/SS las genera el clon maligno, puesto que tras su eliminación con el tratamiento revierten muchos de los defectos inmunes. Luego del tratamiento pueden restaurarse la producción de citocinas Th1, la activación exitosa de células efectoras contra las células tumorales y la función de las APC. Muchos de los medicamentos utilizados tienen la capacidad de inducir apoptosis de las células tumorales y, además, inhiben la producción de IL-4 y su efecto supresor. La estrategia central para la eliminación de las células malignas es el uso de agentes que puedan inducir apoptosis potenciando la capacidad de las APC para procesar las células apoptóticas e inducir una respuesta citotóxica. Estudios realizados por Berger y colaboradores (31) demuestran que DC de pacientes con MF pulsadas con células apoptóticas del mismo paciente tienen la capacidad de potenciar la presentación antigénica y por ende la respuesta inmunológica; este fenómeno, observado in vitro, podría ser semejante a lo que ocurre en los pacientes luego de recibir la fotoféresis.
Entre los tratamientos de primera línea para la MF en el estadio de parches o placas limitadas (menos del 10% de la superficie corporal) están los corticosteroides tópicos y la fotoquimioterapia PUVA (psoralén más fototerapia con luz ultravioleta A), los cuales inducen apoptosis de las células malignas, disminuyen el número de LC lo que interrumpe la presentación antigénica persistente a las células malignas. En los tratamientos para MF en estadios avanzados, la administración de IFN-α potencia la actividad citotóxica de los CD8+ y las células NK, suprime la producción de citocinas tipo Th2 y aumenta la expresión de Fas incrementando el porcentaje de apoptosis de las células malignas (27). En los pacientes que presentan afectación hematológica (SS), la utilización de fotoféresis extracorpórea (ECP, por la sigla en inglés de extracorporeal photopheresis), induce apoptosis de las células malignas en la sangre periférica y promueve la generación de DC a partir de monocitos de sangre periférica, que captan los antígenos derivados de las células malignas apoptóticas para presentarlos a los linfocitos T CD8+ por mecanismos de presentación cruzada. Los linfocitos T CD8+ generan respuestas antitumorales eficientes que contribuyen al control de la enfermedad (27).
Como se mencionó anteriormente, poco se sabe del papel que juegan las células Treg en el desarrollo del LCCT; existen pocas evidencias de terapias utilizadas para aumentarlas en número, o para suprimir su acción reguladora. Sin embargo, se ha propuesto utilizar anticuerpos bloqueantes anti-CTLA-4, anti-IL-10 y anti- TGF-β en la terapia del LCCT, porque se ha visto que tienen la capacidad de revertir los efectos inhibidores observados en el sistema inmune (63). El desarrollo de terapias que permitan mejorar el pronóstico de la enfermedad incluso en los estadios tempranos sería de gran importancia para lograr una mayor tasa de supervivencia de los pacientes con LCCT.
CONCLUSIONES
El LCCT es una enfermedad crónica y progresiva caracterizada por la presencia de un clon maligno de células T en la piel. Durante la progresión de la enfermedad se observa un perfil de citocinas tipo Th2 y una disminución en la respuesta Th1, lo que se asocia a un estado de inmunosupresión que predispone a la aparición de segundas neoplasias y enfermedades infecciosas. De tal forma que la regulación de las citocinas Th1 y Th2 parece ser un factor crítico en la progresión de la enfermedad (37). Lo anterior podría tener aplicaciones terapéuticas importantes como la terapia de reemplazo de citocinas Th1 con proteínas recombinantes.
Las evidencias de la presencia de células CD4+CD25high en los linfomas cutáneos sugieren que el LCCT podría ser una neoplasia de células T reguladoras, o estar muy relacionado con alteraciones en la regulación inmune (40). Estudios encaminados a la comprensión de la inmunobiología de las células Treg y Th17 en pacientes con LCCT podrían contribuir al diseño de nuevas estrategias terapéuticas y de herramientas para evaluar el pronóstico y hacer seguimiento clínico. Los avances en las técnicas diagnósticas permitirán en un futuro el tratamiento temprano de los LCCT.
REFERENCIAS BIBLIOGRÁFICAS
1. Hwang ST, Janik JE, Jaffe ES, Wilson WH. Mycosis fungoides and Sezary syndrome. Lancet. 2008 Mar 15;371(9616):945-57. [ Links ]
2. Onsun N, Kural Y, Su O, Demirkesen C, Buyukbabani N. Hypopigmented mycosis fungoides associated with atopy in two children. Pediatric dermatology. 2006 Sep-Oct;23(5):493-6. [ Links ]
3. Prince HM, Whittaker S, Hoppe RT. How I treat mycosis fungoides and Sezary syndrome. Blood. 2009 Nov 12;114(20):4337-53. [ Links ]
4. Olsen E, Vonderheid E, Pimpinelli N, Willemze R, Kim Y, Knobler R, et al. Revisions to the staging and classification of mycosis fungoides and Sezary syndrome: a proposal of the International Society for Cutaneous Lymphomas (ISCL) and the cutaneous lymphoma task force of the European Organization of Research and Treatment of Cancer (EORTC). Blood. 2007 Sep 15;110(6):1713-22. [ Links ]
5. Willemze R, Jaffe ES, Burg G, Cerroni L, Berti E, Swerdlow SH, et al. WHO-EORTC classification for cutaneous lymphomas. Blood. 2005 May 15;105(10):3768-85. [ Links ]
6. Kallinich T, Muche JM, Qin S, Sterry W, Audring H, Kroczek RA. Chemokine receptor expression on neoplastic and reactive T cells in the skin at different stages of mycosis fungoides. The Journal of investigative dermatology. 2003 Nov;121(5):1045-52. [ Links ]
7. Wu XS, Lonsdorf AS, Hwang ST. Cutaneous T-cell lymphoma: roles for chemokines and chemokine receptors. The Journal of investigative dermatology. 2009 May;129(5):1115-9. [ Links ]
8. Wantzin GL, Thomsen K, Nissen NI, Saxinger C, Gallo RC. Occurrence of human T cell lymphotropic virus (type I) antibodies in cutaneous T cell lymphoma. Journal of the American Academy of Dermatology. 1986 Oct;15(4 Pt 1):598-602. [ Links ]
9. Wantzin GL. [Human T-cell leukemia (lymphoma) virus (HTLV-I) antibodies in Danish patients with cutaneous T-cell lymphoma]. Der Hautarzt; Zeitschrift fur Dermatologie, Venerologie, und verwandte Gebiete. 1986 May;37(5):263-5. [ Links ]
10. Ranki A, Niemi KM, Nieminen P, Krohn K. Antibodies against retroviral core proteins in relation to disease outcome in patients with mycosis fungoides. Archives of dermatological research. 1990;282(8):532-8. [ Links ]
11. Morozov VA, Syrtsev AV, Ellerbrok H, Nikolaeva EV, Bavykin AS, Pauli G. Mycosis fungoides in European Russia: no antibodies to human T cell leukemia virus type I structural proteins, but virus-like sequences in blood and saliva. Intervirology. 2005 Nov-Dec;48(6):362-71. [ Links ]
12. Shohat M, Shohat B, Mimouni D, Pauli G, Ellerbrok H, David M, et al. Human T-cell lymphotropic virus type 1 provirus and phylogenetic analysis in patients with mycosis fungoides and their family relatives. The British journal of dermatology. 2006 Aug;155(2):372-8. [ Links ]
13. Pawlaczyk M, Filas V, Sobieska M, Gozdzicka-Jozefiak A, Wiktorowicz K, Breborowicz J. No evidence of HTLV-I infection in patients with mycosis fungoides and Sezary syndrome. Neoplasma. 2005;52(1):52-5. [ Links ]
14. Herne KL, Talpur R, Breuer-McHam J, Champlin R, Duvic M. Cytomegalovirus seropositivity is significantly associated with mycosis fungoides and Sezary syndrome. Blood. 2003 Mar 15;101(6):2132-6. [ Links ]
15. Ghosh K. CMV seropositivity and mycosis fungoides--the Indian perspectives. Blood. 2003 Oct 1;102(7):2706-7. [ Links ]
16. Novelli M, Merlino C, Ponti R, Bergallo M, Quaglino P, Cambieri I, et al. Epstein-Barr virus in cutaneous T-cell lymphomas: evaluation of the viral presence and significance in skin and peripheral blood. The Journal of investigative dermatology. 2009 Jun;129(6):1556-61. [ Links ]
17. Noorali S, Yaqoob N, Nasir MI, Moatter T, Pervez S. Prevalence of mycosis fungoides and its association with EBV and HTLV-1 in Pakistanian patients. Pathol Oncol Res. 2002;8(3):194-9. [ Links ]
18. Noorali S, Pervez S, Moatter T, Soomro IN, Kazmi SU, Nasir MI, et al. Characterization of T-cell non- Hodgkin's lymphoma and its association with Epstein-Barr virus in Pakistani patients. Leukemia & lymphoma. 2003 May;44(5):807-13. [ Links ]
19. Chang YT, Liu HN, Chen CL, Chow KC. Detection of Epstein-Barr virus and HTLV-I in T-cell lymphomas of skin in Taiwan. The American Journal of dermatopathology. 1998 Jun;20(3):250-4. [ Links ]
20. Scarisbrick JJ, Mitchell TJ, Calonje E, Orchard G, Russell-Jones R, Whittaker SJ. Microsatellite instability is associated with hypermethylation of the hMLH1 gene and reduced gene expression in mycosis fungoides. The Journal of investigative dermatology. 2003 Oct;121(4):894-901. [ Links ]
21. Lin WM, Girardi M. More or less: copy number alterations in mycosis fungoides. The Journal of investigative dermatology. Apr;130(4):926-8. [ Links ]
22. Mao X, Lillington D, Scarisbrick JJ, Mitchell T, Czepulkowski B, Russell-Jones R, et al. Molecular cytogenetic analysis of cutaneous T-cell lymphomas: identification of common genetic alterations in Sezary syndrome and mycosis fungoides. The British journal of dermatology. 2002 Sep;147(3):464-75. [ Links ]
23. Cameron OJ. Mycosis fungoides in mother and in daughter. Arch Dermatol Syphilol. 1933; 27 (2): 232-236 [ Links ]
24. Hodak E, Klein T, Gabay B, Ben-Amitai D, Bergman R, Gdalevich M, et al. Familial mycosis fungoides: report of 6 kindreds and a study of the HLA system. Journal of the American Academy of Dermatology. 2005 Mar;52(3 Pt 1):393-402. [ Links ]
25. Ackerman AB, Nakano S. A critique of classifications of lymphoma in historical perspective (and a proposal for how a classification that actually works can be formulated). The American Journal of dermatopathology. 1999 Jun;21(3):288-93. [ Links ]
26. Glusac EJ. Criterion by criterion, mycosis fungoides. The American Journal of dermatopathology. 2003 Jun;25(3):264-9. [ Links ]
27. Kim EJ, Hess S, Richardson SK, Newton S, Showe LC, Benoit BM, et al. Immunopathogenesis and therapy of cutaneous T cell lymphoma. J Clin Invest. 2005 Apr;115(4):798-812. [ Links ]
28. Bahler DW, Hartung L, Hill S, Bowen GM, Vonderheid EC. CD158k/KIR3DL2 is a useful marker for identifying neoplastic T-cells in Sezary syndrome by flow cytometry. Cytometry. 2008 May;74(3):156-62. [ Links ]
29. Campbell JJ, O'Connell DJ, Wurbel MA. Cutting Edge: Chemokine receptor CCR4 is necessary for antigen-driven cutaneous accumulation of CD4 T cells under physiological conditions. J Immunol. 2007 Mar 15;178(6):3358-62. [ Links ]
30. Asadullah K, Docke WD, Haeussler A, Sterry W, Volk HD. Progression of mycosis fungoides is associated with increasing cutaneous expression of interleukin-10 mRNA. The Journal of investigative dermatology. 1996 Dec;107(6):833-7. [ Links ]
31. Berger CL, Hanlon D, Kanada D, Dhodapkar M, Lombillo V, Wang N, et al. The growth of cutaneous T-cell lymphoma is stimulated by immature dendritic cells. Blood. 2002 Apr 15;99(8):2929-39. [ Links ]
32. French LE, Huard B, Wysocka M, Shane R, Contassot E, Arrighi JF, et al. Impaired CD40L signaling is a cause of defective IL-12 and TNF-alpha production in Sezary syndrome: circumvention by hexameric soluble CD40L. Blood. 2005 Jan 1;105(1):219-25. [ Links ]
33. Hoppe RT, Medeiros LJ, Warnke RA, Wood GS. CD8- positive tumor-infiltrating lymphocytes influence the long-term survival of patients with mycosis fungoides. Journal of the American Academy of Dermatology. 1995 Mar;32(3):448-53. [ Links ]
34. Lessin SR, Vowels BR, Rook AH. Retroviruses and cutaneous T-cell lymphoma. Dermatol Clin. 1994 Apr;12(2):243-53. [ Links ]
35. Vowels BR, Lessin SR, Cassin M, Jaworsky C, Benoit B, Wolfe JT, et al. Th2 cytokine mRNA expression in skin in cutaneous T-cell lymphoma. The Journal of investigative dermatology. 1994 Nov;103(5):669-73. [ Links ]
36. Papadavid E, Economidou J, Psarra A, Kapsimali V, Mantzana V, Antoniou C, et al. The relevance of peripheral blood T-helper 1 and 2 cytokine pattern in the evaluation of patients with mycosis fungoides and Sezary syndrome. The British journal of dermatology. 2003 Apr;148(4):709-18. [ Links ]
37. Chong BF, Wilson AJ, Gibson HM, Hafner MS, Luo Y, Hedgcock CJ, et al. Immune function abnormalities in peripheral blood mononuclear cell cytokine expression differentiates stages of cutaneous T-cell lymphoma/mycosis fungoides. Clin Cancer Res. 2008 Feb 1;14(3):646-53. [ Links ]
38. Wysocka M, Zaki MH, French LE, Chehimi J, Shapiro M, Everetts SE, et al. Sezary syndrome patients demonstrate a defect in dendritic cell populations: effects of CD40 ligand and treatment with GM-CSF on dendritic cell numbers and the production of cytokines. Blood. 2002 Nov 1;100(9):3287-94. [ Links ]
39. Asadullah K, Haeussler-Quade A, Gellrich S, Hanneken S, Hansen-Hagge TE, Docke WD, et al. IL-15 and IL-16 overexpression in cutaneous T-cell lymphomas: stage-dependent increase in mycosis fungoides progression. Experimental dermatology. 2000 Aug;9(4):248-51. [ Links ]
40. Sakaguchi S. Naturally arising CD4+ regulatory t cells for immunologic self-tolerance and negative control of immune responses. Annual review of immunology. 2004;22:531-62. [ Links ]
41. Berger CL, Tigelaar R, Cohen J, Mariwalla K, Trinh J, Wang N, et al. Cutaneous T-cell lymphoma: malignant proliferation of T-regulatory cells. Blood. 2005 Feb 15;105(4):1640-7. [ Links ]
42. Kasprzycka M, Zhang Q, Witkiewicz A, Marzec M, Potoczek M, Liu X, et al. Gamma c-signaling cytokines induce a regulatory T cell phenotype in malignant CD4+ T lymphocytes. J Immunol. 2008 Aug 15;181(4):2506-12. [ Links ]
43. Tiemessen MM, Mitchell TJ, Hendry L, Whittaker SJ, Taams LS, John S. Lack of suppressive CD4+CD25+FOXP3+ T cells in advanced stages of primary cutaneous T-cell lymphoma. The Journal of investigative dermatology. 2006 Oct;126(10):2217-23. [ Links ]
44. Gallimore A, Godkin A. Regulatory T cells and tumour immunity - observations in mice and men. Immunology. 2008 Feb;123(2):157-63. [ Links ]
45. Klemke CD, Fritzsching B, Franz B, Kleinmann EV, Oberle N, Poenitz N, et al. Paucity of FOXP3+ cells in skin and peripheral blood distinguishes Sezary syndrome from other cutaneous T-cell lymphomas. Leukemia. 2006 Jun;20(6):1123-9. [ Links ]
46. Wada DA, Wilcox RA, Weenig RH, Gibson LE. Paucity of intraepidermal FoxP3-positive T cells in cutaneous T-cell lymphoma in contrast with spongiotic and lichenoid dermatitis. Journal of cutaneous pathology. May;37(5):535-41. [ Links ]
47. Ji Y, Zhang W. Th17 cells: positive or negative role in tumor?. Cancer Immunol Immunother. Jul;59(7):979- 87. [ Links ]
48. Zou W, Restifo NP. T(H)17 cells in tumour immunity and immunotherapy. Nature reviews. Apr;10(4):248-56. [ Links ]
49. Afzali B, Lombardi G, Lechler RI, Lord GM. The role of T helper 17 (Th17) and regulatory T cells (Treg) in human organ transplantation and autoimmune disease. Clin Exp Immunol. 2007 Apr;148(1):32-46. [ Links ]
50. Evans HG, Suddason T, Jackson I, Taams LS, Lord GM. Optimal induction of T helper 17 cells in humans requires T cell receptor ligation in the context of Toll-like receptor-activated monocytes. Proceedings of the National Academy of Sciences of the United States of America. 2007 Oct 23;104(43):17034-9. [ Links ]
51. Weaver CT, Harrington LE, Mangan PR, Gavrieli M, Murphy KM. Th17: an effector CD4 T cell lineage with regulatory T cell ties. Immunity. 2006 Jun;24(6):677-88. [ Links ]
52. Beriou G, Costantino CM, Ashley CW, Yang L, Kuchroo VK, Baecher-Allan C, et al. IL-17-producing human peripheral regulatory T cells retain suppressive function. Blood. 2009 Apr 30;113(18):4240-9. [ Links ]
53. Ayyoub M, Deknuydt F, Raimbaud I, Dousset C, Leveque L, Bioley G, et al. Human memory FOXP3+ Tregs secrete IL-17 ex vivo and constitutively express the T(H)17 lineage-specific transcription factor RORgamma t. Proceedings of the National Academy of Sciences of the United States of America. 2009 May 26;106(21):8635-40. [ Links ]
54. Mangan PR, Harrington LE, O'Quinn DB, Helms WS, Bullard DC, Elson CO, et al. Transforming growth factor-beta induces development of the T(H)17 lineage. Nature. 2006 May 11;441(7090):231-4. [ Links ]
55. Alexandrakis MG, Pappa CA, Miyakis S, Sfiridaki A, Kafousi M, Alegakis A, et al. Serum interleukin-17 and its relationship to angiogenic factors in multiple myeloma. European journal of internal medicine. 2006 Oct;17(6):412-6. [ Links ]
56. Kato T, Furumoto H, Ogura T, Onishi Y, Irahara M, Yamano S, et al. Expression of IL-17 mRNA in ovarian cancer. Biochemical and biophysical research communications. 2001 Apr 6;282(3):735-8. [ Links ]
57. Horlock C, Stott B, Dyson PJ, Morishita M, Coombes RC, Savage P, et al. The effects of trastuzumab on the CD4+CD25+FoxP3+ and CD4+IL17A+ T-cell axis in patients with breast cancer. British journal of cancer. 2009 Apr 7;100(7):1061-7. [ Links ]
58. Numasaki M, Watanabe M, Suzuki T, Takahashi H, Nakamura A, McAllister F, et al. IL-17 enhances the net angiogenic activity and in vivo growth of human non-small cell lung cancer in SCID mice through promoting CXCR-2-dependent angiogenesis. J Immunol. 2005 Nov 1;175(9):6177-89. [ Links ]
59. Zheng SG. The Critical Role of TGF-beta1 in the Development of Induced Foxp3+ Regulatory T Cells. International journal of clinical and experimental medicine. 2008;1(3):192-202. [ Links ]
60. Ciree A, Michel L, Camilleri-Broet S, Jean Louis F, Oster M, Flageul B, et al. Expression and activity of IL-17 in cutaneous T-cell lymphomas (mycosis fungoides and Sezary syndrome). International journal of cancer. 2004 Oct 20;112(1):113-20. [ Links ]
61. Wu J, Nihal M, Siddiqui J, Vonderheid EC, Wood GS. Low FAS/CD95 Expression by CTCL Correlates with Reduced Sensitivity to Apoptosis that Can Be Restored by FAS Upregulation. The Journal of investigative dermatology. 2008 Oct 16. [ Links ]
62. Klemke CD, Brenner D, Weiss EM, Schmidt M, Leverkus M, Gulow K, et al. Lack of T-cell receptorinduced signaling is crucial for CD95 ligand upregulation and protects cutaneous T-cell lymphoma cells from activation-induced cell death. Cancer research. 2009 May 15;69(10):4175-83. [ Links ]
63. Hansen ER. Immunoregulatory events in the skin of patients with cutaneous T-cell lymphoma. Archives of dermatology. 1996 May;132(5):554-61. [ Links ]
64. Evans AV, Scarisbrick JJ, Child FJ, Acland KM, Whittaker SJ, Russell-Jones R. Cutaneous malignant melanoma in association with mycosis fungoides. Journal of the American Academy of Dermatology. 2004 May;50(5):701-5. [ Links ]