Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.25 no.1 Medellín Jan./Mar. 2012
INVESTIGACIÓN ORIGINAL
Caracterización de la comunidad bacteriana aerobia en sanguijuelas (Hirudinea), Haementeria sp. (Glossiphoniidae) y Oxytychus ornatus (Macrobdellidae) de El Bagre, Antioquia
Characterization of the aerobic bacterial community in leeches Haementeria sp (Hirudinea: Glossiphoniidae) y Oxytychus ornatus (Hirudinea: Macrobdellidae) de El Bagre, Antioquia
Auxilio Ramírez Pérez1; Catalina Gómez Carmona2; Laura López Isaza3; Luz Elena Velásquez Trujillo4
1 Bacterióloga y Laboratorista Clínica. Docente, Escuela de Microbiología. Universidad de Antioquia. Investigadora del Grupo de Microbiología Ambiental, Escuela de Microbiología, Universidad de Antioquia, Medellín, Colombia.
2 Microbióloga y Bioanalista. Estudiante de Maestría en Biología, Instituto de Biología, Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia. Investigadora de la Unidad de Malacología Médica y Tremátodos del Programa de Estudio y Control de Enfermedades Tropicales/PECET. Facultad de Medicina. Universidad de Antioquia. Investigadora del Grupo de Microbiología Ambiental, Escuela de Microbiología, Universidad de Antioquia, Medellín, Colombia. catalina.carmona@gmail.com
3 Microbióloga y Bioanalista. Banco de Sangre, Hospital Pablo Tobón Uribe, Medellín, Colombia.
4 Bióloga, MSc. Docente, Escuela de Microbiología, Universidad de Antioquia. Coordinadora de la Unidad de Malacología Médica y Tremátodos del Programa de Estudio y Control de Enfermedades Tropicales/PECET. Facultad de Medicina. Universidad de Antioquia. Coordinadora del Grupo de Microbiología Ambiental, Escuela de Microbiología, Universidad de Antioquia, Medellín, Colombia.
Recibido: octubre 08 de 2010
Aceptado: marzo 29 de 2011
RESUMEN
Se ha incrementado el uso terapéutico de las sanguijuelas y se ha demostrado que ellas pueden inocular bacterias causantes de infecciones en el 20% de los pacientes. El hallazgo en Antioquia de dos especies de sanguijuelas promisorias para hirudoterapia motivó este estudio para identificar las bacterias en la superficie, la probóscide y el intestino de estos anélidos y evaluar su sensibilidad a antibióticos. Las sanguijuelas estudiadas se identificaron como Haementeria sp., y Oxytychus ornatus. Muestras de la superficie, boca e intestino de ambos anélidos se inocularon en agar sangre, agar sangre con ampicilina y agar eosina azul de metileno. La identificación de las bacterias y su sensibilidad a antibióticos se evaluaron por el método automatizado Vitek (Biomerieux®). Se hicieron en total 26 aislamientos pertenecientes a 12 especies de nueve géneros. Enterobacter cloacae fue la especie más frecuente en ambos anélidos. Las bacterias fueron sensibles a los antibióticos comúnmente empleados en las infecciones causadas por este tipo de microorganismos. Se sugiere hacer profilaxis con antibióticos en los pacientes que reciban terapia con los anélidos investigados e implementar los protocolos estandarizados para el lavado de los animales antes de su uso y para el aseo de los acuarios en donde se los mantenga.
PALABRAS CLAVE
Hirudoterapia, Infecciones Bacterianas, Sanguijuelas.
SUMMARY
Therapeutic use of leeches (hyrudotherapy) has increased, and it has been shown that they can transmit bacteria associated with infections in 20% of patients. Two species of leeches have been found in Antioquia, Colombia, apparently promising for such therapy. This study was done to identify bacteria in the surface, mouth and intestine of these species and to test the antibiotic sensitivity of the isolates. The studied species were Haementeria sp., and Oxytychus ornatus. Specimens were obtained from their surface, mouth and intestine. Blood agar, blood agar with ampicillin, and eosine-methylene blue agar were used as culture media. Identification and sensitivity tests were carried out with the Vitek (Biomerieux®) automated method. A total of 26 isolates was obtained belonging to 12 species and nine genera. Isolates were sensitive to the commonly used antibiotics. We suggest to do antibiotic prophylaxis in patients undergoing hyrudotherapy, and to implement standardized protocols to disinfect the animals before use and for the cleaning of the aquarium where they are kept.
KEY WORDS
Bacterial Infections, Hyrodutherapy, Leeches.
INTRODUCCIÓN
El empleo de las sanguijuelas con propósitos curativos, conocido como hirudoterapia, se encuentra ampliamente documentado en textos antiguos y contemporáneos (1). En la actualidad las investigaciones sobre los anélidos hematófagos se enfocan en diversos aspectos, entre ellos la identificación y aplicación de las sustancias que liberan en el hospedero durante la ingesta de sangre, con efectos anticoagulante, vasodilatador, inhibidor de la agregación plaquetaria y antinflamatorio, entre otros (2-6). Asimismo, se busca reducir los riesgos durante los tratamientos médicos con las diferentes especies de sanguijuelas, como Hirudo medicinalis, H. verbana, H. orientalis, Hirudinaria manillensis y Asiaticobdella buntonensis, identificando las bacterias procedentes de la superficie del cuerpo, la boca y el tracto digestivo, debido a que el 20% de los pacientes tratados con los hirudíneos desarrollan infecciones que se generan durante el procedimiento en los sitios expuestos a las sanguijuelas (7-11). En consecuencia, se hacen estudios para determinar la sensibilidad de esa microbiota a los antibióticos, con el fin de establecer criterios de administración profiláctica a los pacientes que van a ser tratados con los hirudíneos (12-14).
En Colombia se tienen registros acerca de la presencia de hirudíneos en ecosistemas naturales (15). Sin embargo, no se ha evaluado ni puesto en práctica su uso en el ámbito clínico. Por ello el hallazgo de sanguijuelas en Antioquia, promisorias para hirudoterapia, constituyó un estímulo para llevar a cabo el presente estudio, con el fin de hacer la identificación taxonómica de la comunidad bacteriana que habita en la superficie, boca e intestino de los anélidos, así como para determinar la sensibilidad de los microorganismos a los antibióticos.
MATERIALES Y MÉTODOS
Este estudio fue aprobado en junio de 2006 por el Comité de Ética para la Experimentación con Animales, de la Universidad de Antioquia.
Captura: durante noviembre de 2007 se recolectaron 41 sanguijuelas en una fuente de agua dulce ubicada en la zona minera del municipio de El Bagre, al nordeste del departamento de Antioquia, Colombia, a 07º 35' latitud N y 74º 48' longitud O, a 50 msnm, con una temperatura promedio de 28 °C. Los animales se transportaron vivos por vía aérea, en agua del lugar, al Laboratorio de Malacología Médica y Tremátodos, del Programa de Estudio y Control de Enfermedades Tropicales (PECET) de la Universidad de Antioquia, donde se mantuvieron en acuarios con agua declorinada y con temperatura similar a la del sitio de captura. El agua de los acuarios se cambió diariamente. No se les suministró alimento.
Las sanguijuelas se separaron por morfotipos y se dispusieron en acuarios independientes. Seis ejemplares de cada morfotipo se fijaron para su estudio taxonómico. Para el análisis de la microbiota se utilizaron 12 ejemplares del morfotipo 1 y 17 del morfotipo 2. Cada ejemplar se relajó sobre una placa de hielo durante 30 minutos; para obtener la microbiota se les barrió la superficie con un hisopo de alginato estéril que se sumergió en 3 mL de agua peptonada; 100 µl de esta solución se sembraron en agar sangre, agar eosina azul de metileno y agar sangre con ampicilina (20 mg/L), cubriendo la totalidad de la superficie del agar con un asa. Se incubó a 37 °C y el crecimiento microbiano se observó a las 24 y 48 horas.
El mismo ejemplar se limpió con alcohol yodado y se disecó asépticamente en cámara de bioseguridad bajo estereomicroscopio. Se tomaron muestras de la probóscide y el intestino que se sometieron a ultrasonido durante tres minutos. Se inocularon 100 µl de la solución, que se incubaron y leyeron siguiendo el procedimiento descrito para las muestras de superficie. Las colonias obtenidas se reaislaron en agar nutritivo y se incubaron a 37°C durante 48 horas; a cada colonia se le hicieron coloración de Gram, prueba de oxidasa (Biomerieux®) e identificación bioquímica por el sistema automatizado Vitek 1 (Biomerieux®).
Para evaluar la respuesta microbiana a los antibióticos, se calculó un tamaño muestral por conveniencia correspondiente al 50% de las colonias de cada especie bacteriana aislada, las cuales se escogieron mediante un proceso de muestreo aleatorio simple; de esta manera se buscó tener una representación adecuada de las colonias de las especies bacterianas identificadas. Cada cepa seleccionada se evaluó con antibióticos específicos dependiendo del tipo de microorganismo y, de acuerdo con las normas del Clinical and Laboratory Standard Institute (CLSI), se la clasificó como sensible (S), de sensibilidad intermedia (I) o resistente (R). La concentración inhibitoria mínima (CIM) para cada antibiótico se da en µg/mL (16).
RESULTADOS
Posición taxonómica de las sanguijuelas: en las sanguijuelas recolectadas se identificaron dos morfotipos, asignados a dos familias: Glossiphoniidae que se caracteriza por presentar una probóscide, con la cual se alimenta de sangre de vertebrados, estuvo representada por Haementeria sp. (Fillippi, 1848). Y Macrobdellidae que se caracteriza por presentar tres mandíbulas bien formadas con menos de 100 dentículos, con los cuales se alimentan de sangre, estuvo representada por Oxytychus ornatus (Weyenbergh, 1883).
Identificación de la microbiota asociada a las sanguijuelas: en total se aislaron 12 especies bacterianas pertenecientes a nueve géneros, cuya distribución varió según la especie de hirudíneo y la ubicación en el animal. De las 12 especies, 11 fueron de bacilos gramnegativos y la restante fue un coco.
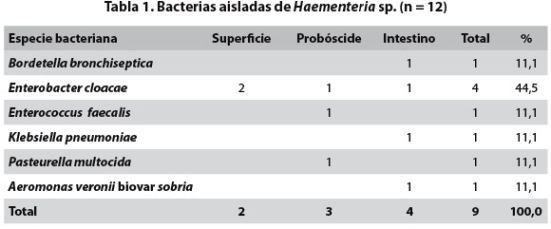
En 8 de las 12 Haementeria sp., se hicieron nueve aislamientos provenientes de igual número de muestras. Pertenecieron a seis géneros y seis especies; cuatro de los aislamientos fueron de Enterobacter cloacae. Los otros cinco géneros bacterianos estuvieron representados por un aislamiento cada uno (tabla 1).
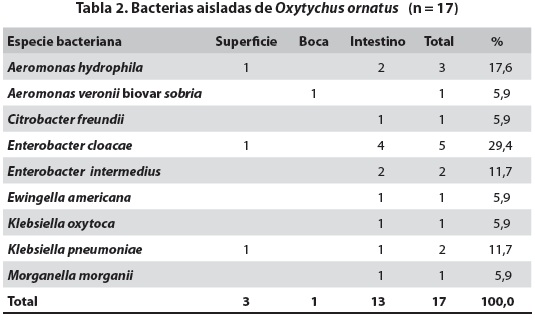
En 12 de los ejemplares de O. ornatus se hicieron 17 aislamientos provenientes de igual número de muestras. Pertenecieron a seis géneros y nueve especies. La especie predominante fue E. cloacae (cinco aislamientos; 29,4%), seguido de Aeromonas hydrophila (tres aislamientos; 17,6%). Se obtuvieron dos aislamientos de Enterobacter intermedius y dos de Klebsiella pneumoniae y un aislamiento de cada uno de los cinco microorganismos restantes (tabla 2).
El total de aislamientos fue de 26: 9 en Haementeria sp., y 17 en Oxytychus ornatus. Como se observa en las tablas 1 y 2, el mayor número de aislamientos (n=17) provino del intestino. De la superficie del cuerpo solo se aislaron cinco y de la región oral, cuatro. Se observa además que la especie bacteriana más ubicua y frecuente fue E. cloacae, puesto que se obtuvo de intestino, probóscide y superficie de las dos especies de hirudíneos en repetidas ocasiones. La siguió K. pneumoniae presente en ambos anélidos y aislada tanto del intestino como de la superficie del cuerpo. A. veronii biovar sobria se aisló del intestino de Haementeria sp. y de la probóscide de O. ornatus.
Pruebas de sensibilidad a antibióticos
Se estudió la sensibilidad a los antibióticos de aislamientos de 10 especies (16). En la tabla 3 se presentan los resultados obtenidos para las cuatro más frecuentes: E. cloacae, A. veronii biovar sobria, K. pneumoniae y A. hydrophila. Se destaca la sensibilidad de estas cuatro especies a meropenem, imipenem y amikacina.
DISCUSIÓN
Esta constituye la primera evaluación de la flora bacteriana de las sanguijuelas silvestres Haementeria sp., y Oxytychus ornatus, recolectadas en Colombia; la diversidad de géneros encontrada es similar a la registrada para otras especies de sanguijuelas en otros países (7, 9,10), lo que corrobora lo planteado por Wilken y Appleton en 1996 (11) acerca de la tendencia natural de las sanguijuelas a alojar microorganismos del ambiente (17). Tal es el caso del hallazgo en ambas especies de sanguijuelas de Enterobacter cloacae en el intestino y la superficie, que coincide con lo informado por otros autores (11,18). La alta frecuencia de este microorganismo y su presencia en la superficie, boca e intestino podrían obedecer al hábito alimentario de la sanguijuela o a que hace parte de su microbiota (19,20).
Es importante destacar la presencia de Aeromonas debido a que A. hydrophila ha sido responsable de infecciones en el 6,5% de los pacientes sometidos a hirudoterapia en Francia, en tanto que A. veronii biovar sobria se ha visto relacionada con casos de meningitis (21-23). Queda por establecer si estas bacterias son simbiontes de Haementeria sp., y Oxytychus ornatus, tal como sucede en H. medicinalis (19,20,24,25).
En lo que respecta a la profilaxis con antibióticos, medida cuya validez está por demostrar, proponemos el uso de los betalactámicos y las cefalosporinas de cuarta generación, debido a su eficacia contra las bacterias que aislamos de Haementeria sp., y Oxytychus ornatus; sin embargo, otros autores sugieren, con base en sus experiencias, usar aminoglucósidos y fluoroquinolonas (26). Cabe señalar la importancia de disponer de una amplia variedad de antibióticos para la profilaxis, ante la posible aparición de microorganismos resistentes.
Finalmente, se recomienda atender las indicaciones sobre la desinfección externa de las sanguijuelas antes de usarlas en las terapias, utilizando una solución de ácido hipocloroso (12,5 ppm) que suprime las bacterias externas sin causarles efectos negativos a los animales (27).
REFERENCIAS BIBLIOGRÁFICAS
1. Weinfeld AB, Yuksel E, Boutros S, Gura DH, Akyurek M, Friedman JD. Clinical and scientific considerations in leech therapy for the management of acute venous congestion: an updated review. Ann Plast Surg. 2000 Aug;45(2):207-12. [ Links ]
2. Conforti ML, Connor NP, Heisey DM, Hartig GK. Evaluation of performance characteristics of the medicinal leech (Hirudo medicinalis) for the treatment of venous congestion. Plast Reconstr Surg. 2002 Jan;109(1):228-35. [ Links ]
3. Michalsen A, Klotz S, Lüdtke R, Moebus S, Spahn G, Dobos GJ. Effectiveness of leech therapy in osteoarthritis of the knee: a randomized, controlled trial. Ann Intern Med. 2003 Nov 4;139(9):724-30. [ Links ]
4. Chudzinski-Tavassi AM, Bermej E, Rosenstein RE, Faria F, Sarmiento MIK, Alberto F, et al. Nitridergic platelet pathway activation by hementerin, a metalloprotease from the leech Haementeria depressa. Biol Chem. 2003 Sep;384(9):1333-9. [ Links ]
5. Vera C, Blu A, Torres M. [Leeches, today and yesterday present parasites]. Rev Chilena Infectol. 2005 Mar;22(1):32-7. [ Links ]
6. Heckmann JG, Dütsch M, Neundörfer B, Dütsch F, Hartung U. Leech therapy in the treatment of median nerve compression due to forearm haematoma. J Neurol Neurosurg Psychiatry. 2005 Oct;76(10):1465. [ Links ]
7. Eroglu C, Hokelek M, Guneren E, Esen S, Pekbay A, Uysal OA. Bacterial flora of Hirudo medicinalis and their antibiotic sensitivities in the Middle Black Sea Region, Turkey. Ann Plast Surg. 2001 Jul;47(1):70-3. [ Links ]
8. Silver AC, Rabinowitz NM, Küffer S, Graf J. Identification of Aeromonas veronii genes required for colonization of the medicinal leech, Hirudo verbana. J Bacteriol. 2007 Oct;189(19):6763-72. [ Links ]
9. Laufer AS, Siddall ME, Graf J. Characterization of the digestive-tract microbiota of Hirudo orientalis, a european medicinal leech. Appl Environ Microbiol. 2008 Oct;74(19):6151-4. [ Links ]
10. Bickel KD, Lineaweaver WC, Follansbee S, Feibel R, Jackson R, Buncke HJ. Intestinal flora of the medicinal leech Hirudinaria manillensis. J Reconstr Microsurg. 1994 Mar;10(2):83-5. [ Links ]
11. Wilken GB, Appleton CC. Bacteriological investigation of the occurrence and antibiotic sensitivities of the gut-flora of the potential southern African medicinal leech, Asiaticobdella buntonensis (Hirudinidae). J Hosp Infect. 1993 Mar;23(3):223-8. [ Links ]
12. Nonomura H, Kato N, Ohno Y, Itokazu M, Matsunaga T, Watanabe K. Indigenous bacterial flora of medicinal leeches and their susceptibilities to 15 antimicrobial agents. J Med Microbiol. 1996 Dec;45(6):490-3. [ Links ]
13. Bauters TGM, Buyle FMA, Verschraegen G, Vermis K, Vogelaers D, Claeys G, et al. Infection risk related to the use of medicinal leeches. Pharm World Sci. 2007 Jun;29(3):122-5. [ Links ]
14. Hermansdorfer J, Lineaweaver W, Follansbee S, Valauri FA, Buncke HJ. Antibiotic sensitivities of Aeromonas hydrophila cultured from medicinal leeches. Br J Plast Surg. 1988 Nov;41(6):649-51. [ Links ]
15. Sket B, Trontelj P. Global diversity of leeches (Hirudinea) in freshwater. Hydrobiologia. 2008;595(1):129- 137. [ Links ]
16. Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing; seventeenth informational supplement. Clinical and laboratory standards institute. 2007;27(1). [ Links ]
17. Joseph SW, Carnahan AM, Brayton PR, Fanning GR, Almazan R, Drabick C, et al. Aeromonas jandaei and Aeromonas veronii dual infection of a human wound following aquatic exposure. J Clin Microbiol. 1991 Mar;29(3):565-9. [ Links ]
18. Haycox CL, Odland PB, Coltrera MD, Raugi GJ. Indications and complications of medicinal leech therapy. J Am Acad Dermatol. 1995 Dec;33(6):1053-5. [ Links ]
19. Indergand S, Graf J. Ingested blood contributes to the specificity of the symbiosis of Aeromonas veronii biovar sobria and Hirudo medicinalis, the medicinal leech. Appl Environ Microbiol. 2000 Nov;66(11):4735-41. [ Links ]
20. Graf J, Kikuchi Y, Rio RVM. Leeches and their microbiota: naturally simple symbiosis models. Trends Microbiol. 2006 Aug;14(8):365-71. [ Links ]
21. Sartor C, Limouzin-Perotti F, Legré R, Casanova D, Bongrand M-C, Sambuc R, et al. Nosocomial Infections with Aeromonas hydrophila from Leeches. Clin Infect Dis. 2002 Jul 1;35(1):E1-5. [ Links ]
22. Ardehali B, Hand K, Nduka C, Holmes A, Wood S. Delayed leech-borne infection with Aeromonas hydrophilia in escharotic flap wound. J Plast Reconstr Aesthet Surg. 2006 Jan;59(1):94-5. [ Links ]
23. Ouderkirk JP, Bekhor D, Turett GS, Murali R. Aeromonas meningitis complicating medicinal leech therapy. Clin Infect Dis. 2004 Feb 15;38(4):e36-7. [ Links ]
24. Graf J. Symbiosis of Aeromonas veronii biovar sobria and Hirudo medicinalis, the medicinal leech: a novel model for digestive tract associations. Infect Immun. 1999 Jan;67(1):1-7. [ Links ]
25. Siddall ME, Worthen PL, Johnson M, Graf J. Novel role for Aeromonas jandaei as a digestive tract symbiont of the North American medicinal leech. Appl Environ Microbiol. 2007 Jan;73(2):655-8. [ Links ]
26. Clark NM, Femino JE, Chenoweth CE. Aeromonas infection after medicinal leech therapy: case reports and review. Infectious Diseases in Clinical Practice. 2001;(10):211-18. [ Links ]
27. Aydin A, Nazik H, Kuvat SV, Gurler N, Ongen B, Tuncer S, et al. External decontamination of wild leeches with hypochloric acid. BMC Infect Dis. 2004 Aug 25;10(4):28. [ Links ]