Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.25 no.1 Medellín Jan./Mar. 2012
INVESTIGACIÓN ORIGINAL
Caracterización clínica, epidemiológica e histopatológica de pacientes con diagnóstico de queratosis actínica
Clinical, epidemiological and histopathological characterization of patients with actinic keratosis
Carolina Giraldo Sierra1; Carolina Montes Gallo1; John Jairo Zuleta Tobón2; Luis Alfonso Correa3; Catalina María Vasco4; Gloria Sanclemente Mesa5
1 Dermatológa, IPS Universitaria, Universidad de Antioquia, Medellín, Colombia.
2 Docente, Departamento de Ginecología y Obstetricia, Universidad de Antioquia, Medellín, Colombia.
3 Docente de Dermatopatología, Sección de Dermatología, Universidad de Antioquia, Medellín, Colombia.
4 Investigadora del Grupo de Investigación Dermatológica-GRID, de la Universidad de Antioquia, Medellín, Colombia.
5 Coordinadora, Grupo de Investigación Dermatológica - GRID, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. Dermatóloga, IPS Universitaria, Universidad de Antioquia. Dirección: Calle 51 A # 62-42, IPS Universitaria, Sede Ambulatoria, Medellín, Colombia. gsanclemente@une.net.co
Recibido: diciembre 03 de 2010
Aceptado: marzo 14 de 2011
RESUMEN
Introducción: en otros países se han descrito ciertos factores relacionados con el desarrollo de queratosis actínica (QA).
Objetivo: describir las características clínicas, epidemiológicas e histopatológicas de pacientes institucionales de Medellín, con diagnóstico de QA.
Metodología: estudio descriptivo de pacientes con QA. Se aplicó una encuesta estructurada tomando datos demográficos, clínicos y relacionados con el desarrollo de la QA.
Resultados: se incluyeron 153 pacientes (58 hombres [37,9%] y 95 mujeres [62,1%]), con edad promedio de 70 años. Tenían 75 años o más 64 pacientes (41,8%). Ciento ocho pacientes (70,6%) refirieron haber tenido un grado alto de exposición solar en la niñez; 76 (49,7%) tenían el antecedente de fumar y 16 de estos (21,1%) aún fumaban; 46 (30,1%) informaron el antecedente de un familiar con cáncer de piel. Setenta y tres (47,7%) realizaban las actividades tanto bajo techo como al aire libre; 80 (52,3%) informaron que se aplicaban protector solar y 37 (24,4%) usaban gorra o sombrero por la época en que fueron encuestados. Predominó el fototipo II (101 pacientes; 66%) y había daño actínico moderado en 76 (49,7%). Cuando hubo un solo patrón histológico predominó el atrófico (12%) y cuando hubo dos, el atróficohiperqueratósico (18,7%).
Conclusiones: las características fenotípicas y de exposición de los pacientes con QA estudiados en Medellín (Colombia) son similares a las reportadas en la literatura.
PALABRAS CLAVE
Carcinoma escamocelular cutáneo, Colombia, Epidemiología, Queratosis Actínica.
SUMMARY
Introduction: Several factors related with the development of actinic keratosis (AK) have been reported in other countries.
Objective: To describe the clinical, epidemiological and histopathological characteristics of patients with diagnosis of AK in Medellín, Colombia.
Methodology: This was a descriptive study of patients with AK. A structured survey including demographic, clinical and epidemiological information was applied.
Results: 153 patients were included (58 men [37.9%] and 95 women [62.1%]) with an average age of 70 years. Sixty four patients (41.8%) were aged 75 years or more. With regard to their personal history, 108 individuals (70.6%) had a high degree of solar exposure during childhood; 76 (49.7%) reported the habit of smoking and 16 out of these (21.1%) still smoked. In 46 (30.1%) there was a family history of skin cancer. Regarding individual habits, 73 (47.7%) carried out both indoor and outdoor activities, 80 (52.3%) reported the use of sunscreen and 37 (24.4%) used hat or cap at the time of the study. Fitzpatrick's type II phototype predominated (101 patients; 66%) and 76 (49.7%) had moderate actinic damage. The predominant single histologic subtype corresponded to the atrophic type (12%) and the main mixed subtype was the atrophichyperkeratotic subtype (18.7%).
Conclusions: Clinical, epidemiological and histopathological features found among two institutional populations with AK in Medellin (Colombia) were similar to those reported in the literature.
KEY WORDS
Actinic Keratosis, Colombia, Epidemiology, Skin squamous cell carcinoma.
INTRODUCCIÓN
La queratosis actínica (QA) es una entidad precursora del carcinoma escamocelular cutáneo, que es una de las neoplasias más frecuentes en el mundo (1,2), y afecta principalmente a individuos de raza blanca; se han informado cálculos de riesgo para sufrir un carcinoma escamocelular (CEC) en pacientes inmunocompetentes con QA previas, que oscilan entre 0,025% y 20% por año y por lesión (3,4), con mayor riesgo en pacientes inmunosuprimidos (5,6).
A pesar de que las QA se han considerado históricamente como lesiones premalignas, de acuerdo con estudios realizados durante la última década, se las debiera clasificar como neoplasias intraepiteliales queratinocíticas (KIN, por la sigla en inglés de keratinocytic intraepithelial neoplasias); se ha recomendado su inclusión dentro de una secuencia para el desarrollo posterior de CEC, similar a la que se ha demostrado en la displasia cervical (7-11). De hecho, en un estudio reciente, se ha encontrado una expresión de genes similar en las QA y en el CEC, lo que sugeriría un papel precursor de las primeras en dicha transformación maligna cutánea (12).
Entre los principales factores de riesgo para el desarrollo de QA reportados en otros países se encuentran los siguientes: el fototipo cutáneo claro (fototipos I-III), la exposición solar acumulada (crónica), los ojos y el cabello claros (13-15). De forma importante, en países con estaciones se ha encontrado una mayor relación de la exposición solar prolongada y acumulativa (crónica) con el carcinoma escamocelular (16). No obstante, y aunque poco se sabe de este tipo de relación en países sin estaciones como Colombia, lo que sí se ha podido cuantificar son unos altos índices de radiación ultravioleta en Medellín (17), zona en la cual se concentra la mayor población dermatológica que acude al Hospital Universitario San Vicente de Paúl (HUSVP) y a la IPS (institución prestadora de servicios de salud) de la Universidad de Antioquia (Medellín, Colombia). A esto se suma el hallazgo reciente de que la mayoría de la población de Medellín (58%) no utiliza ningún implemento o crema para protegerse del sol y apenas un 2% de ella sabe lo que significa el índice ultravioleta (UVI) (18).
Con base en las anteriores consideraciones, el objetivo de este trabajo fue describir las características sociales, demográficas, clínicas e histopatológicas de los pacientes inmunocompetentes con diagnóstico de QA que acudieron a consulta dermatológica al HUSVP y a la IPS de la Universidad de Antioquia, entre septiembre de 2009 y abril de 2010.
MATERIALES Y MÉTODOS
Se hizo un estudio observacional descriptivo en el que se incluyeron pacientes mayores de 18 años con diagnóstico clínico e histológico de QA en zonas expuestas al sol, que acudieron a la consulta externa del HUSVP y a la IPS de la Universidad de Antioquia entre el 9 de septiembre de 2009 y el 30 de abril de 2010, y que aceptaron participar en el estudio. Los criterios clínicos utilizados para el diagnóstico de QA, de acuerdo con Marks (19), fueron: placa eritematosa o levemente hiperpigmentada, áspera al tacto y con escamas adherentes. Se excluyeron los pacientes trasplantados, los que hubieran presentado cáncer de otros órganos y los que tuvieran algún otro tipo de inmunosupresión o tratamiento inmunodepresor (esteroides sistémicos, inmunosupresores, neoplasia de base, VIH). También se excluyeron las personas cuya condición física o mental impedía hacer la encuesta o tomar la biopsia, al igual que los individuos con algún trastorno genético cutáneo que los predispusiera al desarrollo de cáncer de piel tales como el xeroderma pigmentoso y la epidermodisplasia verruciforme.
Las variables demográficas y clínicas y los factores relacionados se extrajeron de una encuesta que los investigadores aplicaron a cada paciente, previa firma del consentimiento informado. A cada paciente se lo interrogó acerca del lugar de origen, antecedentes laborales, aspectos concernientes a la enfermedad (inicio de la lesión, antecedentes personales o familiares, tratamientos previos), presencia de factores de riesgo (verrugas vulgares, cigarrillo, grado de exposición solar en la infancia y ocupacional, fototipo de la piel, antecedente de radiación ionizante, uso de medios de fotoprotección físicos o químicos) y se evidenció el grado de daño actínico. Este último se interpretó como la presencia de telangiectasias, arrugas, lentigines, elastosis solar o púrpura actínica y se clasificó en grave si se evidenciaban más de 10 lesiones, moderado (entre cuatro y nueve lesiones) y leve (tres o menos lesiones). La exposición solar en la infancia se definió como leve: actividades al aire libre solo en época de vacaciones; moderada: actividades al aire libre todos los fines de semana y grave: actividades al aire libre diariamente. La exposición solar en el momento de la encuesta se midió de acuerdo con el número de horas por semana de exposición solar así: leve: 0-19 horas; moderada 20-40 horas; grave: más de 40 horas. Las actividades llevadas a cabo en los últimos 10 años se clasificaron de acuerdo a si se habían realizado al aire libre (más de seis horas al día), en un aula, oficina o recinto cerrado (más de seis horas al día) o en los dos anteriores. El uso de antisolar se clasificó en sí (uso diario de protector solar), no (no ha usado protector solar) y a veces (uso de protector solar solo en vacaciones o al practicar deportes o en paseos). De forma similar, el uso de gorra o sombrero se clasificó en sí (uso diario de dichos implementos), no (no uso de ningún implemento) y a veces (uso de cualquiera de estos implementos solo en vacaciones o al practicar deportes o en paseos).
Toma de muestras
Con el fin de confirmar el diagnóstico clínico de QA, a todos los pacientes se les tomó una biopsia de piel con sacabocados desechable # 4 de una lesión que necesariamente debía estar localizada en un área fotoexpuesta. Para la histopatología con microscopía de luz se tiñó el corte del tejido con hematoxilina y eosina. Cada placa histológica fue leída por un dermatopatólogo para confirmar el diagnóstico clínico de QA y hacer su clasificación histológica.
Muestra
La muestra fue por conveniencia y correspondió a los casos consecutivos de pacientes con diagnóstico clínico de QA que acudieron a la consulta externa del HUSVP o a la consulta ambulatoria de la IPS de la Universidad de Antioquia (Medellín- Colombia).
Plan de análisis
Las variables cualitativas se resumieron con números absolutos y proporciones; las cuantitativas discretas con mediana y rango intercuartílico, y las continuas con media o mediana, con su respectiva medida de dispersión (desviación estándar o rango intercuartílico), según su distribución, la cual se valoró con la prueba de Kolmogorov-Smirnov. La encuesta se tabuló en el programa Excel del Office 2007 y el análisis se hizo con el programa estadístico Statistical Package for Social Sciences software: SPSS (versión 15; SPSS Inc, Chicago, IL, Estados Unidos).
RESULTADOS
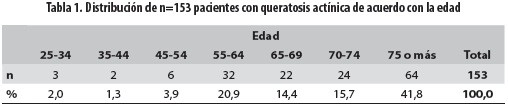
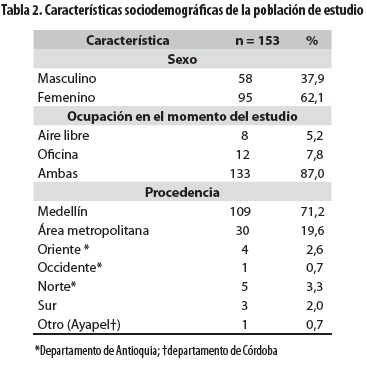
Se incluyeron 153 pacientes (58 hombres [37,9%] y 95 mujeres [62,1%]) con edad promedio de 70 años (rango: 29 a 96 años); 64 pacientes (41,8%) tenían 75 o más años (tabla 1). La mayoría de ellos procedía de Medellín (71,2%) y su área metropolitana (19,6%), y la ocupación principal, teniendo en cuenta el predominio del sexo femenino, eran las labores del hogar (59,6%) (tabla 2).
Con respecto a los antecedentes personales, ningún paciente había recibido radiación ionizante (radioterapia); 67 (43,8%) recordaban haber presentado por lo menos una verruga vulgar en la vida, con mayor frecuencia en las manos (21,6%). Por otra parte, 46 pacientes (30,1%) tenían el antecedente familiar de cáncer de piel, principalmente en hermanos (13,7%) (tabla 3).
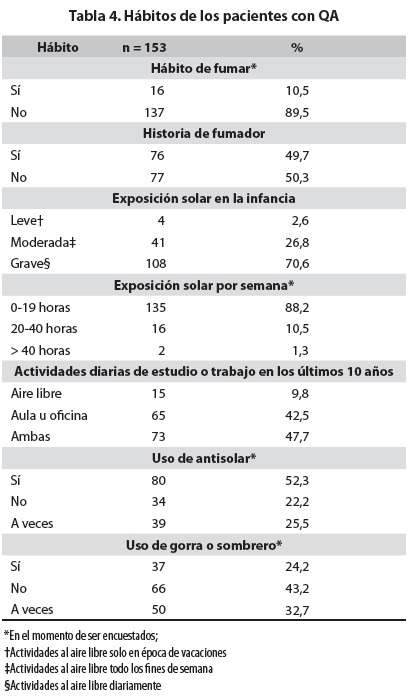
Con respecto a los hábitos, 76 pacientes (49,7%) tenían antecedente de haber fumado cigarrillo, pero solo 16 de ellos (21,1%) lo hacían en el momento de la encuesta. La exposición solar en la infancia fue descrita como intensa o grave por 108 pacientes (70,6%) y moderada por 41 (26,8%); la exposición solar ocupacional y recreativa en el momento de la encuesta osciló entre 0 y 40 horas semanales, y 73 pacientes (47,7%) informaron que realizaban tanto actividades bajo techo como al aire libre. Ochenta pacientes (52,3%) informaron el uso permanente de protector solar y 37 (24,2%) usaban gorra o sombrero al ser encuestados (tabla 4).
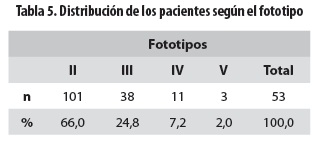
En relación con el fenotipo, de acuerdo con la escala de Fitzpatrick, 101 pacientes (66%) correspondieron al fototipo II, 38 (24,8%) al fototipo III, 11 (7,2%) al fototipo IV y 3 (2%) al fototipo V; no se encontraron pacientes con el fototipo I ni con el VI (tabla 5).
En lo referente al grado de daño actínico basado en la presencia de telangiectasias, arrugas, lentigines, elastosis solar o púrpura actínica, se encontró que 50 pacientes (32,7%) tenían daño actínico leve, 4 (2,60%) lo tenían entre leve y moderado, en 76 (49,7%) era moderado y en 23 (15%) era grave.
Por último, con respecto a la clasificación de las QA por subtipos histológicos, se encontró que en 37 pacientes (24,7%) había un solo subtipo; en 75 (50%) había dos subtipos simultáneos y en 38 (25,3%) había tres o más subtipos en una sola lesión. Por otra parte, el subtipo histológico hiperqueratósico se encontró combinado con otros tipos en un 41,33% de las muestras.
Cabe destacar que solo se estudiaron histopatológicamente 150 biopsias; las tres restantes se descartaron por problemas técnicos en el procesamiento del tejido.
DISCUSIÓN
En otros países se ha informado que los pacientes con QA presentan ciertas características fenotípicas que predisponen al desarrollo de estas lesiones. Sin embargo, en Colombia, hasta donde tenemos conocimiento, o en lo revisado, no se han encontrado estudios descriptivos similares a este que hayan incluido tanto las características fenotípicas y sociodemográficas, como los hallazgos histopatológicos de las QA.
La edad de nuestros pacientes está en el rango de 29 a 96 años, con una media de 70,86. Al analizar la variable edad, de acuerdo con lo informado en la literatura,(20) observamos que 41,8% de nuestros pacientes eran mayores de 75 años, lo que concuerda con los resultados de otros estudios cuyos pacientes tenían edades de presentación similares (3,21-24), lo que se explicaría por una mayor exposición solar acumulada a lo largo de la vida. De hecho, en la población caucásica, se ha encontrado que la prevalencia de estas lesiones es menor del 10% en la tercera década de la vida, pero supera el 80% cuando se examinan personas en la séptima década (3,21). Además, en Australia, donde la QA y el cáncer de piel son muy comunes, se ha reportado una prevalencia de 40% a 50% en la población mayor de 40 años (22,23), mientras que en el norte de Inglaterra fue de 34,1% en hombres y de 18,2% en mujeres mayores de 70 años (24).
Llama la atención que en nuestro estudio de 153 pacientes se encontraron más mujeres que hombres (62,1% y 37,9% respectivamente), con una relación mujer/hombre de 1,6 a 1. Lo anterior difiere de lo informado en la literatura en la que se ha descrito un predominio de las QA en los hombres, relacionado, de acuerdo con esos estudios, con la mayor exposición solar tanto ocupacional como recreacional de los varones (25-27); pero en el estudio de Holman y colaboradores (28), en pacientes entre los 50 y 86 años la prevalencia tiende a igualarse entre hombres y mujeres (66% y 56%, respectivamente). El resultado obtenido en nuestro estudio se podría explicar por la mayor proporción de mujeres en la consulta dermatológica lo que se observa tanto en la población que acude al HUSVP como en la IPS Universitaria; en efecto: de septiembre de 2009 a abril de 2010, consultaron a los servicios dermatológicos de estas instituciones 10.086 pacientes de los cuales 5.860 (58,1%) fueron mujeres.
Aún no se sabe cuál sería el tiempo mínimo necesario de exposición solar de la población colombiana para inducir el riesgo de precáncer o de cáncer cutáneo; sería importante explorar en el futuro si existe un incremento en la exposición solar de las mujeres en nuestro medio según sus actividades al aire libre, ya sea por recreación o por las labores propias de muchas de nuestras amas de casa (por ejemplo: llevar o traer los niños al colegio o a la escuela cinco días a la semana con exposiciones al medio día, llevarle el almuerzo al medio día al esposo cinco días a la semana, etc.).
Con respecto a la ocupación en el momento de la encuesta, 85 de nuestros pacientes (55,6%) trabajaban en las labores del hogar, seguidos por 34 (22,2%) que eran jubilados, los cuales durante su vida laboral compartieron actividades en espacios cerrados y al aire libre. A este respecto, se sabe que las QA representan una enfermedad ocupacional de las personas que trabajan al aire libre (27), e históricamente las primeras descripciones de la enfermedad se hicieron en navegantes, pescadores y granjeros (29). En congruencia con lo anterior, se ha encontrado que los trabajadores al aire libre presentan una exposición diaria y crónica a la RUV lo que les incrementa el riesgo de desarrollar neoplasias. Budhwar y colaboradores (30) compararon 46 trabajadores de la India que estaban expuestos entre ocho y 10 horas a la luz solar, con un grupo control, y encontraron un aumento significativo de complejos de uniones cruzadas entre el ADN y proteínas de la célula como un posible marcador de exposición solar. Por lo tanto, el hallazgo en nuestro estudio de un predominio de QA en individuos dedicados a labores del hogar y en pacientes jubilados podría estar relacionado con una exposición solar importante en el pasado, mas no reciente.
Con respecto a la historia familiar de nuestros pacientes, llama la atención que un porcentaje importante (30,1%) tenían antecedente de cáncer de piel; este hallazgo es un aporte para estudios posteriores de causalidad porque en lo revisado de la literatura no se han encontrado publicaciones sobre esta relación con respecto a las QA, a diferencia del CEC en el cual está claro que la historia familiar de cáncer cutáneo es un factor de riesgo importante en el desarrollo de la enfermedad (31,32).
En nuestro estudio 76 pacientes (49,7%) tenían antecedente de haber fumado cigarrillo, pero solo 16 de ellos (21,1%) lo hacían en el momento de la encuesta. Basados en lo anterior estos datos pueden ser el punto de partida para estudios epidemiológicos observacionales analíticos que confirmen o excluyan la posible relación entre el hábito de fumar y el desarrollo de QA.
En este estudio se discriminaron la exposición solar en la niñez, la exposición solar semanal y las actividades llevadas a cabo en los últimos 10 años. Con respecto a la primera variable, encontramos que el 70,6% de los pacientes habían tenido una exposición solar grave en la infancia, descrita como una actividad diaria al aire libre bajo el sol. Este alto porcentaje indica que nuestra población tiene una alta radiación solar acumulada, que podría haberle conferido un mayor riesgo para el desarrollo de las QA. A esto se suma el papel potencial del alto grado de intensidad solar de Medellín (17), puesto que informes de otros países han mostrado asociación entre la intensidad solar y el desarrollo de cáncer y precáncer cutáneo: se ha encontrado una mayor relación en poblaciones de zonas ubicadas en latitudes bajas (33,34) o en poblaciones blancas que han migrado hacia estas (35).
Al evaluar la exposición solar semanal actual de nuestros pacientes, llama la atención que fluctuó entre 0-41 horas por semana, pero que el mayor porcentaje de pacientes (88,2%) se encontraba en el rango de 0-19 horas semanales. Lo anterior posiblemente estaría influenciado por haber adquirido mayor información sobre la exposición solar en los medios de comunicación o por otros conductos como en las citas médicas, tal como ya se había encontrado en un estudio poblacional anterior en la ciudad de Medellín (18).
En nuestro estudio se indagó acerca del uso reciente de protector solar, y se evidenció que aproximadamente el 52,2% de los pacientes lo estaban utilizando en el momento de la encuesta, lo que también se podría explicar por la constante indicación de su uso por parte de los dermatólogos. No obstante, llama la atención que sea mínimo o nulo el uso de implementos de protección, costumbre que ya había sido detectada en el estudio ya citado hecho en Medellín en el que un 58% de los encuestados no utilizaban ningún implemento o crema para protegerse del sol (18). A este respecto, sería muy importante explorar desde cuándo estos pacientes comenzaron a usar protector solar, con el fin de determinar con mayor exactitud si lo utilizaban en el pasado y por cuánto tiempo se lo han estado aplicando.
La mayoría de nuestros pacientes (66%) correspondieron al fototipo II, seguidos del fototipo III (24,8%); se encontró un 51,6% de los pacientes con el color de piel descrito como blanco y un 26,8% como blanco-trigueño. Aunque esta última clasificación del color de la piel no cuenta con un proceso de validación o fiabilidad, los hallazgos obtenidos concuerdan con los reportes en estudios previos, según los cuales los fototipos claros son los más afectados por las QA, explicado esto por una mayor sensibilidad a la radiación ultravioleta ante la falta de la protección natural dada por la melanina cutánea. El hallazgo de estos fototipos II y III en nuestra población se refuerza por lo encontrado en un estudio llevado a cabo en escolares del Oriente Antioqueño en el que se reportó un traslapamiento en la dosis eritema mínima (DEM) entre ambos fototipos, por lo que es muy difícil su diferenciación en lo que respecta a la sensibilidad solar de la piel (36).
De forma interesante, en este estudio un alto porcentaje de pacientes (43,8%) tenía el antecedente personal de verrugas víricas. Entonces será importante evaluar mediante estudios futuros dicha asociación pues recientemente, y debido a la alta frecuencia de detección del ADN de algunos genotipos del virus del papiloma humano (VPH) en el cáncer no-melanoma y en las queratosis actínica, se ha sugerido que estos virus podrían tener relación con el desarrollo de estas neoplasias (37,38). De hecho, algunos de estos genotipos de PVH, y en especial los relacionados con la epidermodisplasia verruciforme, tienen la capacidad biológica de alterar el ciclo de las células y sus mecanismos reparadores, destruyendo así su homeostasis interna e induciendo en ellas cambios premalignos (39); se ha demostrado que lo anterior se agrava por el efecto inmunosupresor de la RUV en la piel y, por ende, estos factores podrían propiciar la activación de la infección viral que puede encontrarse latente en la piel por muchos años (40).
Fotodaño es el término dermatológico utilizado para describir una combinación de hallazgos clínicos e histológicos resultantes de la exposición crónica al sol. Clínicamente se caracteriza por las arrugas, laxitud, pigmentación irregular, elastosis, púrpura actínica y telangiectasias, las cuales se evalúan de manera objetiva, como se hizo en nuestro estudio. Se encontró así que casi la mitad de los pacientes (49,7%) tenían un daño actínico moderado y que en 7% dicho daño era grave. Lo anterior va de la mano con el fototipo y el grado de exposición solar en la infancia, factores de riesgo que no solo han sido informados como relacionados con el desarrollo de QA sino que, adicionalmente, el grado de fotoenvejecimiento o fotodaño se ha considerado como un indicador de la exposición al sol a largo plazo (41,42), y adquiere mayor importancia por su relación con el desarrollo de cáncer de piel (43).
En la literatura se ha descrito el predominio de cuatro tipos histopatológicos de queratosis actínica: acantolítica, bowenoide, pigmentada e hipertrófica (44-47). En nuestro estudio un dermatopatólogo analizó los patrones histopatológicos de 150 biopsias de lesiones cutáneas y encontró una mayor proporción de QA con dos patrones histológicos combinados (50%), seguido por tres o más patrones (25,3%) y luego por un solo patrón (24,6%). Se destaca el hallazgo del tipo histológico hiperqueratósico que se encontró combinado con otros tipos en un número importante de muestras (41,3%) ya que, hasta donde tenemos conocimiento y en lo revisado en la literatura, este subtipo no se ha descrito en otros estudios. Con base en lo anterior, se evidencia que las QA son lesiones dinámicas, polimorfas y que pueden compartir diferentes tipos histológicos. Por otra parte, a pesar de que las variedades histológicas bowenoide y proliferativa, de acuerdo con algunos estudios, parecieran tener un mayor riesgo de progresión a carcinoma escamocelular (CEC) (44- 47) sería necesario evaluar en estudios futuros si verdaderamente existe dicha asociación o alguna otra; esto tendría importancia como predictor del riesgo de desarrollar un CEC.
En conclusión, los hallazgos de nuestro estudio indican que las características sociodemográficas, fenotípicas y de exposición solar de nuestra población con diagnóstico confirmado de QA concuerdan con las informadas en la literatura mundial, por lo que este estudio servirá como base para estudios observacionales analíticos futuros de causalidad con el objetivo de determinar exposiciones que podrían ser susceptibles de ser intervenidas o prevenidas.
AGRADECIMIENTOS
A los pacientes que participaron en el estudio. A Catalina Vasco (Microbióloga y Bioanalista), a Doris Ruiz (Bacterióloga e Histotecnóloga) y a Marcela Barrera (Enfermera profesional), por su invaluable colaboración para el desarrollo de este estudio.
CONFLICTO DE INTERÉS
Los autores declaramos no tener ningún conflicto de interés
FINANCIACIÓN
Universidad de Antioquia, CODI, Fondo Fototerapia IPS Universitaria
REFERENCIAS BIBLIOGRÁFICAS
1. Edwards BK, Brown ML, Wingo PA, Howe HL, Ward E, Ries LAG, et al. Annual report to the nation on the status of cancer, 1975-2002, featuring populationbased trends in cancer treatment. J Natl Cancer Inst. 2005 Oct 5;97(19):1407-27. [ Links ]
2. Marks R. Squamous cell carcinoma. Lancet. 1996 Mar 16;347(9003):735-8. [ Links ]
3. Salasche SJ. Epidemiology of actinic keratoses and squamous cell carcinoma. J Am Acad Dermatol. 2000 Jan;42(1 Pt 2):4-7. [ Links ]
4. Quaedvlieg PJF, Tirsi E, Thissen MRTM, Krekels GA. Actinic keratosis: how to differentiate the good from the bad ones?. Eur J Dermatol. 2006;16(4):335-9. [ Links ]
5. Lebwohl M. Actinic keratosis: epidemiology and progression to squamous cell carcinoma. Br J Dermatol. 2003 Nov;149 Suppl:31-3. [ Links ]
6. Hofbauer GF, Anliker M, Arnold A, Binet I, Hunger R, Kempf W, et al. Swiss clinical practice guidelines for skin cancer in organ transplant recipients. Swiss Med Wkly. 2009 Jul 25;139(29-30):407-15. [ Links ]
7. Röwert-Huber J, Patel MJ, Forschner T, Ulrich C, Eberle J, Kerl H, et al. Actinic keratosis is an early in situ squamous cell carcinoma: a proposal for reclassification. Br J Dermatol. 2007 May;156 Suppl:8-12. [ Links ]
8. Ramos-Ceballos FI, Ounpraseuth ST, Horn TD. Diagnostic concordance among dermatopathologists using a three-tiered keratinocytic intraepithelial neoplasia grading scheme. J Cutan Pathol. 2008 Apr;35(4):386-91. [ Links ]
9. Cockerell CJ, Wharton JR. New histopathological classification of actinic keratosis (incipient intraepidermal squamous cell carcinoma). J Drugs Dermatol. 2005;4(4):462-7. [ Links ]
10. Anwar J, Wrone DA, Kimyai-Asadi A, Alam M. The development of actinic keratosis into invasive squamous cell carcinoma: evidence and evolving classification schemes. Clin Dermatol. 2004;22(3):189-96. [ Links ]
11. Cockerell CJ. Histopathology of incipient intraepidermal squamous cell carcinoma (''actinic keratosis''). J Am Acad Dermatol. 2000 Jan;42(1 Pt 2):11-7. [ Links ]
12. Padilla RS, Sebastian S, Jiang Z, Nindl I, Larson R. Gene expression patterns of normal human skin, actinic keratosis, and squamous cell carcinoma: a spectrum of disease progression. Arch Dermatol. 2010 Mar;146(3):288-93. [ Links ]
13. Vitasa BC, Taylor HR, Strickland PT, Rosenthal FS, West S, Abbey H, et al. Association of nonmelanoma skin cancer and actinic keratosis with cumulative solar ultraviolet exposure in Maryland watermen. Cancer. 1990 Jun 15;65(12):2811-7. [ Links ]
14. Memon AA, Tomenson JA, Bothwell J, Friedmann PS. Prevalence of solar damage and actinic keratosis in a Merseyside population. Br J Dermatol. 2000 Jun;142(6):1154-9. [ Links ]
15. Hensen P, Müller ML, Haschemi R, Ständer H, Luger TA, Sunderkötter C, et al. Predisposing factors of actinic keratosis in a North-West German population. Eur J Dermatol. 2009;19(4):345-54. [ Links ]
16. Rosso S, Zanetti R, Martinez C, Tormo MJ, Schraub S, Sancho-Garnier H, et al. The multicentre south European study ''Helios''. II: Different sun exposure patterns in the aetiology of basal cell and squamous cell carcinomas of the skin. Br J Cancer. 1996 Jun;73(11):1447-54. [ Links ]
17. Mesa GS, Eduardo G, Garzón H. Altos índices de radiación ultravioleta en Medellín y una localidad del oriente antioqueño (COLOMBIA). Iatreia. 2010;23(2):119-126. [ Links ]
18. Sanclemente G, Díaz A. Impact of a sun protection campaign in Medellín (Colombia). Int J Dermatol. 2009 Dec;48(12):1296-300; quiz 1300-2. [ Links ]
19. Marks R. Solar keratoses. Br J Dermatol. 1990 Apr;122 Suppl:49-54. [ Links ]
20. Karagas MR, Nelson HH, Sehr P, Waterboer T, Stukel TA, Andrew A, et al. Human papillomavirus infection and incidence of squamous cell and basal cell carcinomas of the skin. J Natl Cancer Inst. 2006 Mar 15;98(6):389-95. [ Links ]
21. Frost CA, Green AC. Epidemiology of solar keratoses. Br J Dermatol. 1994 Oct;131(4):455-64. [ Links ]
22. Marks R, Jolley D, Lectsas S, Foley P. The role of childhood exposure to sunlight in the development of solar keratoses and non-melanocytic skin cancer. Med J Aust. 1990 Jan 15;152(2):62-6. [ Links ]
23. Green A, Beardmore G, Hart V, Leslie D, Marks R, Staines D. Skin cancer in a Queensland population. J Am Acad Dermatol. 1988 Dec;19(6):1045-52. [ Links ]
24. Memon AA, Tomenson JA, Bothwell J, Friedmann PS. Prevalence of solar damage and actinic keratosis in a Merseyside population. Br J Dermatol. 2000 Jun;142(6):1154-9. [ Links ]
25. Chen GJ, Feldman SR, Williford PM, Hester EJ, Kiang S-H, Gill I, et al. Clinical diagnosis of actinic keratosis identifies an elderly population at high risk of developing skin cancer. Dermatol Surg. 2005 Jan;31(1):43-7. [ Links ]
26. López-Tizón E, Mencía-Gutiérrez E, Garrido-Ruíz M, Gutiérrez-Díaz E, López-Ríos F. Clinicopathological study of 21 cases of eyelid actinic keratosis. Int Ophthalmol. 2009 Oct;29(5):379-84. [ Links ]
27. Schwartz RA, Bridges TM, Butani AK, Ehrlich A. Actinic keratosis: an occupational and environmental disorder. J Eur Acad Dermatol Venereol. 2008 May;22(5):606-15. [ Links ]
28. Holman CD, Armstrong BK, Evans PR, Lumsden GJ, Dallimore KJ, Meehan CJ, et al. Relationship of solar keratosis and history of skin cancer to objective measures of actinic skin damage. Br J Dermatol. 1984 Mar;110(2):129-38. [ Links ]
29. Unna P. Die histopathologie der hautkrankheiten. Berlin: 1894. [ Links ]
30. Budhwar R, Bihari V, Mathur N, Srivastava A, Kumar S. DNA-protein crosslinks as a biomarker of exposure to solar radiation: a preliminary study in brick-kiln workers. Biomarkers. 2003;8(2):162-6. [ Links ]
31. Bouwes Bavinck JN, Euvrard S, Naldi L, Nindl I, Proby CM, Neale R, et al. Keratotic skin lesions and other risk factors are associated with skin cancer in organtransplant recipients: a case-control study in The Netherlands, United Kingdom, Germany, France, and Italy. J Invest Dermatol. 2007 Jul;127(7):1647-56. [ Links ]
32. Harwood CA, Surentheran T, Sasieni P, Proby CM, Bordea C, Leigh IM, et al. Increased risk of skin cancer associated with the presence of epidermodysplasia verruciformis human papillomavirus types in normal skin. Br J Dermatol. 2004 May;150(5):949-57. [ Links ]
33. Araki K, Nagano T, Ueda M, Washio F, Watanabe S, Yamaguchi N, et al. Incidence of skin cancers and precancerous lesions in Japanese--risk factors and prevention. J Epidemiol. 1999 Dec;9(6 Suppl):S14-21. [ Links ]
34. Rigel DS, Rigel EG, Rigel AC. Effects of altitude and latitude on ambient UVB radiation. J Am Acad Dermatol. 1999 Jan;40(1):114-6. [ Links ]
35. Marks R, Jolley D, Dorevitch AP, Selwood TS. The incidence of non-melanocytic skin cancers in an Australian population: results of a five-year prospective study. Med J Aust. 1989 May 1;150(9):475-8. [ Links ]
36. Sanclemente G, Zapata J-F, García J-J, Gaviria A, Gómez L-F, Barrera M. Lack of correlation between minimal erythema dose and skin phototype in a Colombian scholar population. Skin Res Technol. 2008 Nov;14(4):403-9. [ Links ]
37. Majewski S, Jabobska S. Epidermodysplasia verruciformis as a model of human papillomavirusinduced genetic cancer of the skin. Arch Dermatol. 1995 Nov;131(11):1312-8. [ Links ]
38. Majewski S, Jablonska S. Human papillomavirusassociated tumors of the skin and mucosa. J Am Acad Dermatol. 1997 May;36(5 Pt 1):659-85; quiz 686-8. [ Links ]
39. Orth G. Epidermodysplasia verruciformis: a model for understanding the oncogenicity of human papillomaviruses. Ciba Found Symp. 1986 Jan;120:157-74. [ Links ]
40. zur Hausen H. Human papillomaviruses in the pathogenesis of anogenital cancer. Virology. 1991 Sep;184(1):9-13. [ Links ]
41. Yaar M, Gilchrest BA. Photoageing: mechanism, prevention and therapy. Br J Dermatol. 2007 Nov;157(5):874-87. [ Links ]
42. Consalvo L, Dahbar M, Santisteban M. Envejecimiento cutáneo. Arch Argent Dermatol. 2006;56(1):1-15. [ Links ]
43. Malvy J m, Guinot C, Preziosi P, Vaillant L, Tenenhaus M, Galan P, et al. Epidemiologic determinants of skin photoaging: baseline data of the SU.VI.MAX. cohort. J Am Acad Dermatol. 2000 Jan;42(1 Pt 1):47-55. [ Links ]
44. Hood AF, Kwan TH, Mihm MC, Horn TD, Smoller BR. Primer of dermatopathology. 3rd ed. Philadelphia: Lippincott Williams & Wilkins; 2002. [ Links ]
45. Weedon D. Skin pathology. 3rd ed. Philadelphia: Elsevier; 2010. [ Links ]
46. Boyd AS. Tumors of the epidermis. In: Barnhill R, editor. Piepkorn'sDermatopathology. New York: McGraw-Hill Professional; 2010. p. 556-614. [ Links ]
47. Kirkham N. Tumors and cysts of the epidermis. In: Elenitsas R, editor. Lever's histopathology of the skin. Philadelphia: Lippincott Williams and Wilkins; 2009. p. 791-849. [ Links ]