Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.25 no.1 Medellín Jan./Mar. 2012
PRESENTACIÓN DE CASOS
Aspergilosis broncopulmonar alérgica, una complicación del paciente con fibrosis quística: reporte de dos casos y revisión de la literatura
Allergic bronchopulmonary aspergillosis, a complication of patients with cystic fibrosis: Report of two cases and review of the literature
Alicia Lucía Ballesteros Calderón1; Olga Lucía Morales Múnera2; Claudia Liliana Roya Pabón2
1 Residente de Pediatría, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. aliballesteros@hotmail.com
2 Pediatra Neumóloga, Universidad de Antioquia, Fundación Hospitalaria San Vicente de Paúl, Medellín, Colombia.
Recibido: julio 11 de 2011
Aceptado: julio 26 de 2011
RESUMEN
La aspergilosis broncopulmonar alérgica (ABPA) es la enfermedad pulmonar resultante de hipersensibilidad a Aspergillus, que lleva a alteración de la depuración mucociliar, impactación mucosa con obstrucción de la vía aérea e infiltración pulmonar. Se caracteriza clínicamente por disnea, sibilancias, fiebre, malestar general y expectoración de color marrón o negro, y por la mala respuesta clínica al tratamiento habitual instaurado para las exacerbaciones en pacientes con enfermedad pulmonar crónica. En los pacientes con fibrosis quística (FQ) puede ser difícil establecer el diagnóstico de ABPA debido a la superposición de las características clínicas, radiológicas e inmunológicas de las dos enfermedades y a la presencia frecuente de infecciones bacterianas pulmonares. Por ello, se recomienda que en el seguimiento de dichos pacientes se haga medición anual de la inmunoglobulina E (IgE) sérica total y, según su resultado y el contexto clínico, se plantee el diagnóstico de ABPA y se haga el tratamiento oportuno con esteroides con el cual mejoran los síntomas, la función pulmonar, la calidad de vida y el pronóstico. Presentamos dos pacientes pediátricos con diagnóstico de FQ de difícil control, en quienes se hizo el diagnóstico de ABPA y cuya sintomatología pulmonar mejoró con el tratamiento esteroide.
PALABRAS CLAVE
Aspergilosis Broncopulmonar Alérgica, Esteroides, Fibrosis Quística.
SUMMARY
Allergic bronchopulmonary aspergillosis (ABPA) is a lung disease resulting from hypersensitivity to Aspergillus, which leads to impaired mucociliary clearance, mucus impaction with obstruction of the airway, and pulmonary infiltration. Clinically it is characterized by dyspnea, wheezing, fever, malaise, brown or black expectoration, and poor clinical response to the standard therapy for exacerbations in patients with chronic lung disease. In patients with cystic fibrosis (CF) it may be difficult to establish the diagnosis of ABPA due to the overlapping of clinical, radiological and immunological features and to the high frequency of pulmonary bacterial infections. Therefore, annual monitoring of these patients is recommended by measuring the level of total immunoglobulin E (IgE); according to its result and to the clinical context, the diagnosis and treatment of ABPA with steroids should be considered. Such treatment leads to improvement of symptoms, lung function, quality of life and prognosis. We report two pediatric patients diagnosed with CF who were difficult to control; the diagnosis of ABPA was established and their pulmonary symptoms improved with the use of steroids.
KEY WORDS
Allergic Bronchopulmonary Aspergillosis, Cystic Fibrosis, Steroids.
INTRODUCCIÓN
La aspergilosis broncopulmonar alérgica (ABPA) es una enfermedad resultante de la hipersensibilidad al hongo Aspergillus, la cual produce deterioro clínico y funcional en pacientes con enfermedad pulmonar crónica de base, entre ellas la fibrosis quística y el asma (1).
En Colombia no se ha publicado ningún caso de pacientes con FQ y ABPA, lo cual no significa que en el país esta sea una situación infrecuente, sino que tal vez no se la diagnostica a tiempo. Esta revisión nos debe hacer pensar que tal posibilidad diagnóstica está presente en todo paciente con enfermedad pulmonar crónica de difícil control, ya que el tratamiento oportuno mejora los síntomas, la función pulmonar, la calidad de vida y el pronóstico de estos pacientes (2,3).
Presentamos los casos de dos niños con antecedentes de FQ a quienes se les hizo el diagnóstico de ABPA entre noviembre de 2010 y marzo de 2011, y una revisión de la literatura reciente sobre el tema.
Caso 1
Niño de 9 años, natural de Sonsón, Antioquia, y residente en el Carmen de Viboral, municipio de Antioquia, Colombia; producto del tercer embarazo de padres no consanguíneos, sin problemas perinatales; se le hizo diagnóstico de FQ a los 6 meses de vida y tuvo excelente evolución por cuatro años. Después de los 5 años se iniciaron múltiples exacerbaciones del problema pulmonar, con requerimiento de oxígeno suplementario nocturno por hipertensión pulmonar moderada. A los 8 años se aisló Pseudomonas aeruginosa en el cultivo de esputo, por lo que se inició tobramicina nebulizada; tres cultivos posteriores fueron negativos para este germen por lo que se suspendió dicho antibiótico. A los 9 años de edad presentó deterioro clínico, aumento en la cantidad y cambios en la coloración del esputo y aumento en los requerimientos de oxígeno; se lo hospitalizó con diagnóstico de FQ con exacerbación pulmonar moderada. Al examen físico de ingreso estaba en aceptables condiciones generales, alerta, sin fiebre, con saturación de oxígeno de 87% sin oxígeno complementario; en la auscultación pulmonar se halló ventilación simétrica pero con murmullo vesicular muy disminuido, roncus difusos, sibilancias y crépitos finos en ambos campos pulmonares; había, además, leve tiraje subcostal, hipocratismo digital y signos de desnutrición crónica.
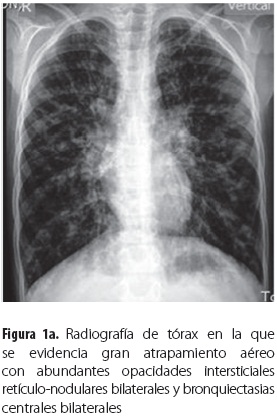
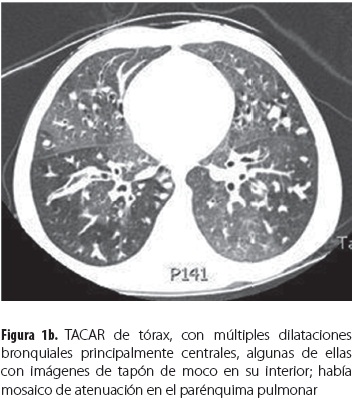
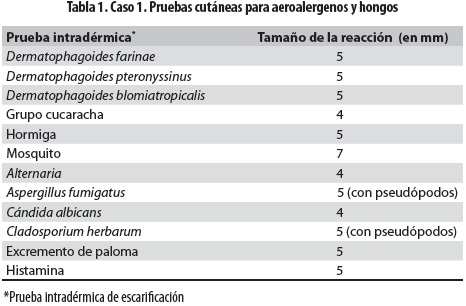
Durante la hospitalización se aislaron del esputo Staphylococcus aureus, Stenotrophomona maltophilia multirresistente y Pseudomonas aeruginosa multisensible, para lo que se trató por 21 días con ceftazidime/amikacina y por 14 días con trimetoprim-sulfa. Persistió el deterioro clínico y se hallaron infiltrados en la radiografía de tórax (figura 1a) y bronquiectasias centrales en la tomografía de alta resolución de tórax (TACAR) (figura 1b); se hicieron medición de la IgE total (1.604 UI/mL) y prueba intradérmica de escarificación para alergias (prick test) para Aspergillus que fue positiva con habón de 5 mm con pseudópodos; se demostraron, además, hipersensibilidad a todos los hongos del medio ambiente probados (tabla 1) y anticuerpos IgE específicos contra el alérgeno de Aspergillus fumigatus con un valor de 63,2 UI/mL clasificado en el rango muy alto (clase 5), por lo que se estableció el diagnóstico de ABPA. No estaba disponible en ese momento la medición de las precipitinas; en el cultivo de esputo no se obtuvo crecimiento de hongos y no se halló eosinofilia en el hemograma. Se inició tratamiento con prednisolona 1 mg/kg/día con disminución gradual cada dos semanas hasta llegar a 0,5 mg/kg/ día y se mantuvo en este valor por tres meses, cuando se inició el desmonte del esteroide. Los controles revelaron descenso de la IgE y muy buena evolución clínica y funcional.
Caso 2
Niña de 11 años, natural y residente en Medellín, Colombia, producto del quinto embarazo de padres no consanguíneos, sin complicaciones perinatales. Tiene antecedentes familiares de un hermano con diagnóstico de FQ y una hermana que murió a los 2 meses de vida por problemas pulmonares sin una causa clara. Ha presentado cuadros respiratorios a repetición desde el primer año de vida, asociados a diarrea crónica, dolor abdominal y retraso en el desarrollo pondoestatural; a los 4 años se estableció el diagnóstico de FQ.
Posteriormente tuvo múltiples hospitalizaciones por exacerbaciones pulmonares, con aislamiento de diferentes gérmenes (Acinetobacter baumani multisensible, Staphylococcus aureus, Pseudomonas aeruginosa y Nocardia), las cuales aumentaron en frecuencia después de los 10 años de edad. A los 11 años presentó pansinusitis que fue tratada quirúrgicamente (antrostomía intranasal maxilar).
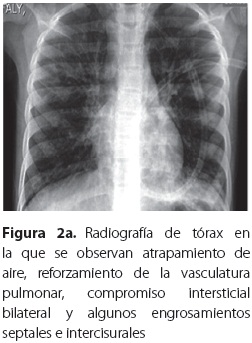
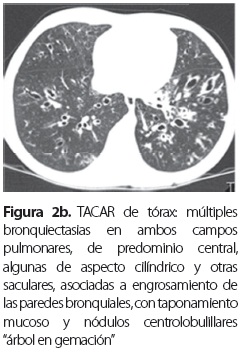
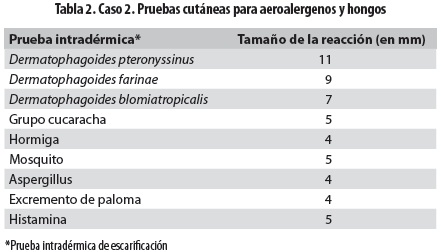
En su última hospitalización consultó por cuadro clínico de un día de evolución de malestar general, fiebre, aumento de la tos, expectoración verdosa con pintas de sangre roja rutilante, dolor torácico súbito y vómito. Al examen físico se la halló en regulares condiciones generales, pálida, taquicárdica, taquipneica, temperatura de 38 °C, con saturación de oxígeno de 88% sin oxígeno complementario y leve trabajo respiratorio. A la auscultación pulmonar se hallaron murmullo vesicular disminuido en ambas bases y roncus escasos en ambos campos pulmonares; en piel se observó una placa redonda descamativa de dos centímetros en el pómulo izquierdo, con borde activo eritematoso, por lo que se hospitalizó con diagnóstico de FQ con exacerbación pulmonar moderada y micosis en la cara; se inició tratamiento antibiótico con cefepime y amikacina por 21 días. Por aumento en la frecuencia y gravedad de las exacerbaciones se hicieron estudios para ABPA en los que se encontraron: IgE total de 750 UI/mL, radiografía de tórax que evidenció atrapamiento de aire, con infiltrados mixtos bilaterales (figura 2a), TACAR de tórax con bronquiectasias principalmente centrales (figura 2b), prueba intradérmica de escarificación (prick test) para aeroalergenos y hongos positiva para Aspergillus, ácaros e insectos (tabla 2), cultivo de esputo del que se aisló Aspergillus fumigatus, anticuerpos IgE específicos contra el alérgeno de Aspergillus fumigatus con un valor de 4,92 clasificado en el rango alto (clase 3); con lo anterior se estableció el diagnóstico de ABPA. Las precipitinas fueron negativas para Aspergillus flavus, A. niger y A. fumigatus. Se inició tratamiento con prednisolona 1 mg/kg/día con disminución gradual hasta llegar a 0,5 mg/kg/día por tres meses; evolucionó clínica y funcionalmente hacia la mejoría y no tuvo nuevas exacerbaciones en un período de tres meses.
DISCUSIÓN
La colonización del aparato respiratorio por A. fumigatus es común en los pacientes con FQ. La prevalencia varía ampliamente dependiendo de la frecuencia de los cultivos, la metodología, la duración del seguimiento y la población de pacientes estudiada. Se ha informado una prevalencia global del 6% al 57% (4). La sola presencia de A. fumigatus en el esputo no hace diagnóstico de ABPA; sin embargo, en un estudio reciente se encontró que los pacientes con infección pulmonar persistente (dos o más cultivos positivos en un año) tuvieron menor función pulmonar basal, mayor tasa de infección por P. aeruginosa, mayor tasa de ABPA y mayor frecuencia de hospitalización, comparados con otros pacientes (5). Otro estudio mostró que los pacientes colonizados por A. fumigatus tienen un estado clínico menos favorable y una mayor carga de tratamiento. Sin embargo, durante un período de cinco años, la colonización por A. fumigatus en ausencia de ABPA no se asoció de forma independiente con una disminución más grave de la función pulmonar (6). Por lo tanto, no está claro el efecto de la colonización por A. fumigatus sobre la función pulmonar de los pacientes con FQ en ausencia de ABPA.
La prevalencia de ABPA en niños con FQ varía del 6% al 25%; la enfermedad ocurre principalmente en niños mayores y adultos (1). Estadísticas de Norteamérica indican una incidencia de esta entidad alrededor del 7% en los pacientes con FQ. Datos de estudios europeos de pacientes con FQ mostraron una prevalencia de ABPA de 7,8% (2,1% a 13,6%). La variación en la prevalencia de ABPA se relaciona probablemente con la falta de criterios uniformes para su diagnóstico, las diferentes técnicas de laboratorio y la falta de reconocimiento clínico (7). En Colombia no hay datos sobre la frecuencia de esta entidad en los pacientes con FQ.
Se ha mencionado como factor de riesgo para la colonización por Aspergillus en niños con FQ el uso a largo plazo de azitromicina. Por otro lado, para el desarrollo de ABPA son factores de riesgo el mal estado nutricional reflejado en un índice de masa corporal (IMC) bajo, como es el caso de los dos pacientes que presentamos, además de la sensibilización a Cándida y Alternaria y el uso de dornasa alfa (8).
Los factores que subyacen al desarrollo de ABPA siguen siendo poco claros. Aún no están plenamente entendidos el papel de los factores genéticos, la calidad del moco, la inflamación de la mucosa bronquial y la medida en que esta inflamación facilita la germinación de las conidias de Aspergillus en hifas, la penetración del hongo y la respuesta inmune (7,9).
Algunos antígenos HLA, especialmente HLA-DR2/DR5 y, posiblemente, DR4/DR7, predisponen a algunas personas a presentar ABPA, mientras que el HLADQ2 parece tener un papel protector. Por lo tanto, la variabilidad genética puede proteger contra la ABPA o aumentar la susceptibilidad a ella (7).
Se cree que las células presentadoras de antígeno que expresan HLA-DR2/DR5 juegan un papel determinante, con síntesis aumentada de IL-10 y aumento de la sensibilidad a IL-4. Además de los factores genéticos, los pacientes con FQ y asma pueden ser más susceptibles a la ABPA por la presencia de moco excesivo en las vías respiratorias (10).
En la ABPA, las esporas de A. fumigatus inhaladas hacia las vías bronquiales son atrapadas por el moco luminal y germinan formando micelios. Los antígenos que estos liberan los procesan y presentan a los linfocitos T las células presentadoras de antígeno. La respuesta de dichos linfocitos a los antígenos de A. fumigatus es de tipo Th2, que se manifiesta por la producción de IL-4, IL-5, IL-10 e IL-13 (11,12). Las células Th2 atraídas a las vías respiratorias responden incrementando tanto la síntesis de IgE por las células B, como la atracción de eosinófilos al tejido (10). La respuesta Th2 también se traduce en aumento de la secreción de moco en las vías respiratorias, inhibición del batido ciliar, infiltrados pulmonares episódicos ricos en eosinófilos y remodelación de las vías respiratorias, perpetuando así el daño de la vía aérea (13); con este tipo de respuesta, también se producen anticuerpos IgG e IgA específicos (11).
Desde el punto de vista patológico, la ABPA se caracteriza por la impactación mucosa y la neumonía eosinofílica, que puede dar lugar a bronquiolitis obliterante, bronquiolitis granulomatosa, bronquiectasias y fibrosis pulmonar (2).
Los síntomas incluyen aumento de la disnea o sibilancias de aparición reciente, fiebre, malestar general y expectoración de tapones mucosos de color marrón o negro. También se debe plantear el diagnóstico si el paciente con enfermedad pulmonar crónica no responde al tratamiento habitual administrado para las exacerbaciones. El examen físico de los pacientes con ABPA y FQ a menudo puede ser normal o inespecífico con presencia de sibilancias y crépitos (1). Nuestros pacientes presentaban un cuadro de exacerbación que no mejoraba a pesar del tratamiento antibiótico establecido, con persistencia de la tos, el malestar general, los hallazgos en el examen físico (crépitos y sibilancias) y el deterioro de la función pulmonar.
Se han propuesto diferentes criterios para hacer el diagnóstico de ABPA en los pacientes con FQ. En la actualidad los más comúnmente utilizados son los propuestos por la Conferencia de Consenso de la Fundación de Fibrosis Quística en 2003 (tabla 3) (14), en la que además se propusieron pautas para la tamización anual; se resaltó que si el valor de IgE es mayor de 500 UI/mL, se debe hacer la prueba intradérmica de escarificación o determinar la IgE específica para Aspergillus. Si los resultados son positivos, se recomienda plantear el diagnóstico basándose en los criterios mínimos. Si el valor de IgE total está entre 200 y 500 UI/mL, se recomienda repetir la medición si hay gran sospecha clínica, y hacer pruebas cutáneas, medición de IgE específica, precipitinas y radiografía de tórax.
En este consenso también se propusieron unos criterios mínimos para este diagnóstico (tabla 4). Otros hallazgos que pueden hacer sospechar el diagnóstico incluyen la detección reiterada de especies de Aspergillus en muestras de esputo, la expectoración de tapones de moco de color marrón o con pintas de sangre y pruebas de hipersensibilidad cutánea tardía positivas para los antígenos de Aspergillus. A pesar de estos criterios, el diagnóstico de ABPA en pacientes con FQ sigue siendo particularmente difícil (15).
El nivel de IgE total se considera una prueba importante y útil para apoyar el diagnóstico y el seguimiento de la ABPA. Se ha establecido que un nivel sérico normal de IgE puede excluir la ABPA como causa de la sintomatología del paciente (15). Sin embargo, hay situaciones en las que el paciente puede tener una ABPA aunque la IgE sérica sea menor de 500 UI/mL, como en la terapia crónica con esteroides. Nuestros pacientes presentaron un nivel de IgE total mayor de 1.000 UI/mL en el primer caso y mayor de 500 UI/mL en el segundo, lo que, aunado con la clínica estableció la posibilidad diagnóstica de ABPA.
Si la sospecha clínica es muy fuerte a pesar de niveles no diagnósticos de IgE, se ha propuesto evaluar otros factores como la reacción inflamatoria pulmonar eosinofílica y la predisposición genética, como alternativas para llegar al diagnóstico (16). El nivel de IgE total fluctúa de acuerdo con la situación clínica del paciente y el tratamiento instaurado, por lo cual es útil como marcador de las exacerbaciones y de la respuesta a la terapia (17). Además, se recomienda como herramienta de tamización, como ya se mencionó, con medición anual en los pacientes con FQ (14).
Los niveles de IgE para A. fumigatus son algo más específicos que la IgE total, pero no diferencian la ABPA de la sensibilización al hongo; además, no muestran la misma correlación que la IgE total con la actividad de la enfermedad y la respuesta al tratamiento y pueden dar resultados discordantes en comparación con las pruebas cutáneas para A. fumigatus (18). No se ha definido un punto de corte para la IgE específica para Aspergillus en el diagnóstico de ABPA en la FQ. Se ha propuesto un valor por encima de 3,5 kU/L, porque se considera que este representa una respuesta alérgica significativa. Sin embargo, otros autores han sugerido utilizar como criterio diagnóstico valores por encima de 0,35 kU/L, el mínimo detectable (19). En ambos pacientes este criterio fue positivo.
La IgG específica contra Aspergillus y las precipitinas pueden indicar tanto sensibilización al antígeno de Aspergillus como ABPA. Estas pruebas tienen un bajo poder discriminativo para el diagnóstico de ABPA (15). En general, la IgG y las precipitinas para A. fumigatus carecen de especificidad, pero casi siempre son positivas en los pacientes con ABPA (19). En nuestro primer paciente no fue posible hacerlas y en la segunda el resultado fue negativo, lo cual no descartó el diagnóstico. La prueba sérica tradicional de precipitinas es semicuantitativa, relativamente insensible y dependiente de extractos antigénicos del hongo no estandarizados; los inmunoensayos en fase sólida son más sensibles y cuantitativos, pero también dependen de reactivos no estandarizados y no cuentan con puntos de corte basados en controles (17). Recientemente se llevó a cabo un estudio para estandarizar la técnica y obtener un punto de corte, facilitando el diagnóstico de ABPA con los criterios mínimos planteados por la Conferencia de Consenso de la Fundación de Fibrosis Quística; en tal estudio se concluyó que niveles por encima de 90 mg/L con el sistema ImmunoCAP son significativos en este grupo de pacientes (14,19).
La caracterización molecular de los antígenos de A. fumigatus ha mejorado el diagnóstico serológico de la ABPA. La identificación y reproducibilidad de las fracciones antigénicas de A. fumigatus han permitido detectar anticuerpos específicos contra cada fracción. Los alérgenos recombinantes Aspf1, Aspf2, Aspf3, Aspf4 y Aspf6 han sido evaluados en el diagnóstico de la ABPA en los pacientes con asma y FQ. Estos estudios han demostrado que la presencia de anticuerpos IgE contra Aspf1 y Aspf3 determina el perfil serológico de las personas sensibilizadas a Aspergillus con el 88% de sensibilidad y el 100% de especificidad (20). También se ha encontrado gran especificidad de la IgE contra Aspf4 y Aspf6 para la detección de ABPA, con valores de 93,7% y 91,6%, respectivamente (15). Algunos estudios indican un mayor valor diagnóstico de la IgE contra Aspf4, como marcador biológico de ABPA (16). Se requieren más estudios al respecto.
En fase de investigación se encuentra la medición de la TARC (por la sigla en inglés de thymus and activation regulated chemokine), que es producida por una reacción de hipersensibilidad Th2 a Aspergillus. Permite diferenciar entre pacientes portadores de FQ con y sin ABPA, colonizados o sensibilizados por Aspergillus. El test de estimulación celular con alérgenos (CAST, por la sigla en inglés de cellular allergens stimulation test) mide la liberación de cisteinil-leucotrienos cuando se estimula al basófilo con alérgenos. Se ha mostrado que puede alcanzar una sensibilidad de 100%, con especificidad de 74% (1,21).
La prueba intradérmica de escarificación es un método rápido y fácil para detectar sensibilización a Aspergillus. Tienen buena sensibilidad, pero su especificidad es moderadamente baja; una reacción positiva no necesariamente indica ABPA. En nuestros pacientes esta prueba fue positiva y, además, se encontró positividad para todos los hongos probados en el primer paciente lo que no se interpretó como reactividad cruzada sino como sensibilidad a cada uno de ellos. En la literatura se ha establecido que la prueba intradérmica de escarificación para Aspergillus es positiva en 23% a 28% en asmáticos y en 29% de los pacientes con FQ sin ABPA, por lo que no se la debe solicitar como prueba de tamización de ABPA (1).
Las radiografías y las tomografías computarizadas de alta resolución (TACAR) de tórax son los principales estudios de imágenes en ABPA. Los infiltrados en la ABPA suelen afectar los lóbulos medio o superior y pueden ser transitorios o permanentes. Se han descrito impactaciones mucosas, nódulos centrolobulares y engrosamiento pleural. En etapas más avanzadas, bronquiectasias centrales o proximales varicosas y quísticas, cavitaciones, bulas y finalmente fibrosis pulmonar. Más específicas son las bronquiectasias con engrosamiento peribronquial visto como imágenes en anillo o de líneas paralelas (22). Las TACAR son más sensibles que las radiografías de tórax para la detección de infiltrados y bronquiectasias (7). Los infiltrados se caracterizan por ceder parcial o completamente con la terapia esteroide (22). Todos estos hallazgos estaban presentes en nuestros pacientes.
El tratamiento de los pacientes con ABPA se centra en el control de la inflamación aguda y la prevención del avance de la lesión pulmonar (2). El uso de corticoides es la terapia más común y efectiva, generalmente prednisona oral a la dosis inicial de 0,5 a 2 mg/kg/día durante 2 a 4 semanas, seguida de reducción lenta en 1 a 3 meses, según la evolución del paciente. A menudo los pacientes con FQ requieren un tratamiento prolongado con corticoides por vía oral, que puede inducir efectos secundarios graves tales como intolerancia a la glucosa, supresión del crecimiento, cataratas, osteoporosis y en algunas ocasiones fracturas patológicas (23). En nuestros dos pacientes se inició la terapia corticoide a la dosis de 1 mg/kg/día con disminución gradual, con buena evolución clínica y funcional.
En 2008, la Sociedad de Enfermedades Infecciosas de América publicó unas guías recomendando una combinación de corticoides e itraconazol para el tratamiento de la ABPA, en caso de no respuesta inicial a los primeros (24). Por lo general, el itraconazol se utiliza a la dosis de 200 a 400 mg/día como agente ahorrador de esteroides para permitir la reducción más rápida de la dosis de los mismos y suprimir los efectos adversos. El mecanismo de este efecto es la disminución del estímulo antigénico para la inflamación bronquial. El itraconazol disminuye la necesidad de esteroides, pero puede interactuar con los corticoides inhalados, produciendo síndrome de Cushing iatrogénico en casos excepcionales. Los beneficios de la adición de itraconazol superan los riesgos de la administración a largo plazo de prednisona en dosis altas (24).
Otra alternativa es el uso de pulsos mensuales de altas dosis de metilprednisolona IV, los cuales han mostrado, en algunos estudios, reducción significativa de los efectos secundarios en comparación con la terapia oral convencional (23).
Se ha informado como promisorio el uso de la anfotericina nebulizada y se la debe considerar en los pacientes que padecen ABPA corticodependiente con múltiples recaídas (25). El factor limitante es que no se han estandarizado la dosis ni la técnica de administración para la anfotericina nebulizada (26). Recientemente, en una serie de tres niños con FQ se demostró mejoría con anfotericina y budesonida nebulizadas. Este nuevo tratamiento es de doble efecto: la budesonida nebulizada disminuye la inflamación y la actividad inmunológica, mientras que la anfotericina nebulizada disminuye la carga antigénica de A. fumigatus. El uso de medicamentos nebulizados limita en gran medida la toxicidad del tratamiento (27).
Otra terapia potencialmente beneficiosa en el tratamiento de la ABPA es el omalizumab, un anticuerpo monoclonal humanizado dirigido contra la IgE, que impide su unión a receptores de alta y baja afinidad en las células efectoras (28). Los informes de casos y series han demostrado resultados exitosos con el uso de este anticuerpo en pacientes con FQ y ABPA con corticodependencia (28) o con efectos adversos graves inducidos por los esteroides (3); sin embargo, hasta la fecha no se ha realizado ningún ensayo clínico definitivo para demostrar verdaderamente la eficacia de este tratamiento.
CONCLUSIONES
La ABPA es una enfermedad que deben sospechar todos los médicos tratantes de pacientes con enfermedades pulmonares crónicas, entre ellas la FQ; es difícil diagnosticarla en pacientes con esta última por el entrecruzamiento de los aspectos clínicos y radiológicos de las dos entidades; por ello la tamización anual con IgE es indispensable para su seguimiento.
Conflicto de intereses y financiación
Certificamos que durante la realización del artículo no se presentaron conflictos de interés, ni se requirió financiación; los cuatro autores estamos de acuerdo con el contenido del texto y este no ha sido publicado anteriormente.
REFERENCIAS BIBLIOGRÁFICAS
1. Thia LP, Balfour Lynn IM. Diagnosing allergic bronchopulmonary aspergillosis in children with cystic fibrosis. Paediatr Respir Rev. 2009 Mar;10(1): 37–42. [ Links ]
2. Hayes D, Murphy BS, Lynch JE, Feola DJ. Aerosolized amphotericin for the treatment of allergic bronchopulmonary aspergillosis. Pediatr Pulmonol. 2010 Nov;45(11):1145–8. [ Links ]
3. Kanu A, Patel K. Treatment of allergic bronchopulmonary aspergillosis (ABPA) in CF with anti-IgE antibody (omalizumab). Pediatr Pulmonol. 2008 Dec;43(12):1249–51. [ Links ]
4. Pihet M, Carrere J, Cimon B, Chabasse D, Delhaes L, Symoens F, et al. Occurrence and relevance of filamentous fungi in respiratory secretions of patients with cystic fibrosis--a review. Med Mycol. 2009 Jun;47(4):387–97. [ Links ]
5. Amin R, Dupuis A, Aaron SD, Ratjen F. The effect of chronic infection with Aspergillus fumigatus on lung function and hospitalization in patients with cystic fibrosis. Chest. 2010 Jan;137(1):171–6. [ Links ]
6. de Vrankrijker AMM, van der Ent CK, van Berkhout FT, Stellato RK, Willems RJL, Bonten MJM, et al. Aspergillus fumigatus colonization in cystic fibrosis: implications for lung function? Clin Microbiol Infect. 2011 Sep;17(9):1381–6. [ Links ]
7. Hatziagorou E, Walsh TJ, Tsanakas JN, Roilides E. Aspergillus and the paediatric lung. Paediatr Respir Rev. 2009 Dec;10(4):178–85. [ Links ]
8. Jubin V, Ranque S, Stremler Le Bel N, Sarles J, Dubus J-C. Risk factors for Aspergillus colonization and allergic bronchopulmonary aspergillosis in children with cystic fibrosis. Pediatr Pulmonol. 2010 Aug;45(8):764–71. [ Links ]
9. Tillie-Leblond I, Tonnel A-B. Allergic bronchopulmonary aspergillosis. Allergy. 2005 Aug;60(8):1004–13. [ Links ]
10. Hartl D, Latzin P, Zissel G, Krane M, Krauss- Etschmann S, Griese M. Chemokines indicate allergic bronchopulmonary aspergillosis in patients with cystic fibrosis. Am J Respir Crit Care Med. 2006 Jun 15;173(12):1370–6. [ Links ]
11. Murali PS, Kurup VP, Bansal NK, Fink JN, Greenberger PA. IgE down regulation and cytokine induction by Aspergillus antigens in human allergic bronchopulmonary aspergillosis. J Lab Clin Med. 1998 Mar;131(3):228–35. [ Links ]
12. Skov M, Poulsen LK, Koch C. Increased antigenspecific Th-2 response in allergic bronchopulmonary aspergillosis (ABPA) in patients with cystic fibrosis. Pediatr Pulmonol. 1999 Feb;27(2):74–9. [ Links ]
13. Knutsen A, Chauhan B, Slavin R. Cell mediated immunology in allergic bronchopulmonary aspergillosis. Immunol Allergy Clin North Am. 1998;18:575–600. [ Links ]
14. Stevens DA, Moss RB, Kurup VP, Knutsen AP, Greenberger P, Judson MA, et al. Allergic bronchopulmonary aspergillosis in cystic fibrosis-- state of the art: Cystic Fibrosis Foundation Consensus Conference. Clin Infect Dis. 2003 Oct 1;37 Suppl 3:S225–64. [ Links ]
15. Fricker-Hidalgo H, Coltey B, Llerena C, Renversez J-C, Grillot R, Pin I, et al. Recombinant allergens combined with biological markers in the diagnosis of allergic bronchopulmonary aspergillosis in cystic fibrosis patients. Clin Vaccine Immunol. 2010 Sep;17(9):1330–6. [ Links ]
16. Knutsen AP, Noyes B, Warrier MR, Consolino J. Allergic bronchopulmonary aspergillosis in a patient with cystic fibrosis: diagnostic criteria when the IgE level is less than 500 IU/mL. Ann Allergy Asthma Immunol. 2005 Nov;95(5):488–93. [ Links ]
17. Moss RB. Allergic bronchopulmonary aspergillosis and Aspergillus infection in cystic fibrosis. Curr Opin Pulm Med. 2010 Nov;16(6):598–603. [ Links ]
18. Agarwal R, Gupta D, Aggarwal AN, Saxena AK, Saikia B, Chakrabarti A, et al. Clinical significance of decline in serum IgE levels in allergic bronchopulmonary aspergillosis. Respir Med. 2010 Feb;104(2):204–10. [ Links ]
19. Barton RC, Hobson RP, Denton M, Peckham D, Brownlee K, Conway S, et al. Serologic diagnosis of allergic bronchopulmonary aspergillosis in patients with cystic fibrosis through the detection of immunoglobulin G to Aspergillus fumigatus. Diagn Microbiol Infect Dis. 2008 Nov;62(3):287–91. [ Links ]
20. Crameri R. Recombinant Aspergillus fumigatus allergens: from the nucleotide sequences to clinical applications. Int Arch Allergy Immunol. 1998 Feb;115(2):99–114. [ Links ]
21. Delhaes L, Frealle E, Pinel C. Serum markers for allergic bronchopulmonary aspergillosis in cystic fibrosis: State of the art and further challenges. Med Mycol. 2010 Nov;48 Suppl 1:S77–87. [ Links ]
22. Mendelson EB, Fisher MR, Mintzer RA, Halwig JM, Greenberger PA. Roentgenographic and clinical staging of allergic bronchopulmonary aspergillosis. Chest. 1985 Mar;87(3):334–9. [ Links ]
23. Cohen-Cymberknoh M, Blau H, Shoseyov D, Mei- Zahav M, Efrati O, Armoni S, et al. Intravenous monthly pulse methylprednisolone treatment for ABPA in patients with cystic fibrosis. J Cyst Fibros. 2009 Jul;8(4):253–7. [ Links ]
24. Walsh TJ, Anaissie EJ, Denning DW, Herbrecht R, Kontoyiannis DP, Marr KA, et al. Treatment of aspergillosis: clinical practice guidelines of the Infectious Diseases Society of America. Clin Infect Dis. 2008 Feb 1;46(3):327–60. [ Links ]
25. Proesmans M, Vermeulen F, Vreys M, De Boeck K. Use of nebulized amphotericin B in the treatment of allergic bronchopulmonary aspergillosis in cystic fibrosis. Int J Pediatr. 2010 Jan;2010:376287. [ Links ]
26. Kuiper L, Ruijgrok EJ. A review on the clinical use of inhaled amphotericin B. J Aerosol Med Pulm Drug Deliv. 2009 Sep;22(3):213–27. [ Links ]
27. Laoudi Y, Paolini J-B, Grimfed A, Just J. Nebulised corticosteroid and amphotericin B: an alternative treatment for ABPA?. Eur Respir J. 2008 Apr;31(4):908–9. [ Links ]
28. Zirbes JM, Milla CE. Steroid-sparing effect of omalizumab for allergic bronchopulmonary. [ Links ]