Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.25 no.2 Medellín Apr./June 2012
INVESTIGACIÓN ORIGINAL
Determinación de los parámetros cinéticos de la plasmina porcina y comparación con la humana
Porcine plasmin: determination of kinetic parameters and comparison with human plasmin
Omaira Cañas1; Alfonso Quijano Parra1; Luis Fernando Arbeláez Ramírez1
1 Facultad de Ciencias Básicas, Grupo de Investigación en Química, Universidad de Pamplona, Pamplona, Colombia. lui.ferar@hotmail.com
Recibido: abril 11 de 2011
Aceptado: julio 21 de 2011
RESUMEN
El plasminógeno es el zimógeno de la plasmina, enzima relacionada con la disolución del coágulo sanguíneo. Estudios con plasminas de diferentes especies animales han demostrado mayor afinidad que la plasmina humana por sustratos análogos hechos exclusivamente para ella. Así lo confirman la activación y cinética del sistema plasminógeno/plasmina porcino, que hasta el presente no se habían determinado ni comparado con el humano. En este trabajo se utilizaron, para la purificación del plasminógeno, cromatografía de afinidad y cambio iónico; se utilizó urocinasa para la activación del plasminógeno a plasmina y se determinaron los parámetros cinéticos con el sustrato cromógeno S-2251. Los terminales-N se determinaron por el método de degradación de Edman. La plasmina porcina demostró mayor afinidad (Km) por el sustrato que la plasmina humana, 1,55 y 5,3 mM respectivamente, mientras que la plasmina humana mostró mayor velocidad de conversión del sustrato a producto (0,1 UA/ seg) que la porcina (0,033 UA/seg). Los terminales-N se diferenciaron en los aminoácidos 1 y 3, DPPDDY (porcino) y EPLDDY (humano).
PALABRAS CLAVE
Coagulación Sanguínea, Cromatografía, Fibrinólisis, Plasminógeno.
SUMMARY
Plasminogen is the zymogen of plasmin, enzyme that is responsible for dissolving blood clots. Studies with plasmins from different animals have demonstrated higher affinity than human plasmin for substrate analogs made exclusively for the latter. This has been confirmed by the activation and kinetics of the porcine plasminogen/plasmin system, which had so far not been determined or compared with the human system. The methods used in this study for purification of plasminogen were affinity and ion exchange chromatographies. Urokinase was used for the activation of plasminogen to plasmin and kinetic parameters were determined with the chromogenic substrate S-2251. The N-terminals were determined by the Edman degradation method. Porcine plasmin showed higher affinity (Km) than human plasmin for the chromogenic substrate, 1.55 mM and 5.3 mM, respectively; contrariwise, human plasmin demonstrated higher velocity in the substrate to product conversion: 0.1 UA/seg) vs. 0.033 UA/seg. The N-terminals differed in the amino acids 1 and 3: DPPDDY (for porcine) and EPLDDY (for human).
KEY WORDS
Blood Coagulation, Chromatography, Fibrinolysis, Plasminogen.
INTRODUCCIÓN
El flujo sanguíneo mantiene el equilibrio propio de la hemostasis y la fibrinólisis; fisiológicamente se incluye en la hemostasis la interacción de la vasoconstricción, la agregación plaquetaria y la coagulación (1). El resultado final de la coagulación son los polímeros de fibrina para formar los coágulos sanguíneos, proceso que es limitado por la fibrinólisis, también llamada trombolisis (2).
Las enzimas que catalizan estas reacciones pertenecen a la familia de las serino-proteasas, que a su vez son controladas por sus inhibidores naturales, las serpinas. En estado normal estos sistemas se encuentran en un equilibrio armonioso. Entre estas enzimas está la trombina, a la que se le han detectado varias funciones fisiológicas, tanto en la coagulación como en la fibrinólisis. El hecho de estar relacionada con diferentes enfermedades como el tromboembolismo y el infarto del miocardio la ha convertido en el objetivo preferido para los medicamentos antitrombóticos (3).
Los factores de la vía de la coagulación generalmente circulan en estado inactivo y se activan mediante proteólisis. El objetivo crucial de la coagulación es generar trombina, que es la responsable de la conversión del fibrinógeno a fibrina, proceso que se inicia cuando el factor tisular (FT) se activa en el subendotelio. El FT forma un complejo con el factor VII activado (FVIIa), complejo que a su vez activa el factor X (FX). Este último, con el factor V activado (FVa), forma el complejo protrombinasa, que luego hidroliza una pequeña cantidad de protrombina (FII) a trombina. Esta última activa las plaquetas, el FV, el factor VIII (FVIII) y el factor XI (FIX); a su vez las plaquetas activan más FX, el cual en complejo con el FVa genera una gran cantidad de trombina, que es crucial para la formación del tapón hemostático (3).
La fibrinólisis es la encargada de la degradación fisiológica de la fibrina para limitar la formación de coágulos y facilitar la fuidez de la sangre (4). La fibrina es degradada principalmente por la serino-proteasa plasmina (pli), que circula como el zimógeno denominado plasminógeno (plg). En una forma de autorregulación, la fibrina sirve como cofactor para la activación del plg a pli por acción del activador tisular del plg (tPA, por la sigla en inglés de tissue plasminogen activator) y además como sustrato para la pli (5-7). Otro activador de tipo urocinasa activa el plg, cuando estos eventos se producen en las superficies de las células, a través de los receptores uPAR (4).
La conversión del plg a pli implica el rompimiento de una sola secuencia (Arg561-Val562); la forma activa está compuesta por dos cadenas unidas por un puente de disulfuro: una pesada (A) de 561 aminoácidos (a.a.) y la otra liviana (B) de 230 a.a. La tríada catalítica está localizada en la cadena B y consta de His603, Asp646 y Ser741.
En la cadena A se encuentran los sitios de unión a la lisina (LBS, por la sigla en inglés de lysine binding sites) que van desde el a.a. Glu1 en el humano o Asp1 en animales, hasta Arg561; las cadenas están unidas, como ya se dijo, por puentes de disulfuro y son los lugares por los cuales se fija la pli a la fibrina específicamente para degradar el coágulo (8). Esta fibrinólisis es controlada predominantemente por la α2-antiplasmina (α2-AP), la cual inhibe la pli que se pueda liberar del complejo trimolecular (9). Por otro lado, los inhibidores del activador del plg (PAI-1 y PAI-2, por la sigla en inglés de plasminogen activator inhibitors) regulan la actividad del tPA y la urocinasa (5,10). La α2-AP se une inicialmente a los LBS de la pli y luego al sitio catalítico de esta, sitios por donde la pli se enlaza a la fibrina o a la superficie de las células, y donde está sustancialmente protegida de la inactivación debido a que sus LBS están ocupados (11). El complejo formado entre la enzima y el sustrato y su cinética enzimática fueron propuestos por Michaelis-Menten (12). La cinética de los plg de varias especies de mamíferos ha sido estudiada por Cañas y colaboradores: bovino (13), bufalino (14), equino (15). Hasta la fecha no hay datos sobre la activación y cinética del plg/pli en porcinos. En este estudio se determinaron y compararon los parámetros cinéticos, la activación y la secuencia del terminal-N de los plg humano y porcino.
MATERIALES Y MÉTODOS
Reactivos
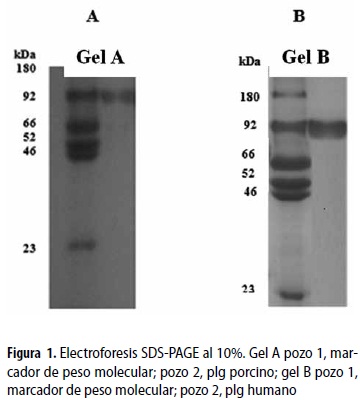
Fenilmetilsulfonilfluoruro (PMSF, por la sigla en inglés de phenylmethylsulphonylfluor), e-amino ácido caprioico (ε-ACA por la sigla en inglés de epsilon amino-caprioic acid), ácido clorhídrico (Fabroquim), cloruro de sodio, dimetil-sulfóxido (DMSO), acetato de sodio anhidro (Riedel-de-Haën), N,N'-metilén-bisacrilamida, persulfato de amonio, β-mercaptoetanol, dodecil sulfato de sodio (SDS por la sigla en inglés de sodium dodecylsulphate), di-hidrógeno fosfato de sodio di-hidratado (NaH2PO4[H2O]) (Merck), lisina-sefarosa-4B (Amersham Biosciences), ácido acético concentrado (Baker), sustrato cromógeno para pli Spectrozyme y Uk (110.000 UI/mL) (Amdiag). El volumen de sustrato utilizado fue el mismo para todas las pruebas (60 µL) a una concentración de 0,3 mM, el estándar de peso molecular usado fue 180 kDa (α2-macroglobulina), 92 kDa (Glu-plg), 66 kDa (cadena-α, fibrinógeno humano), 52 kDa (cadena-β, fibrinógeno humano), 46 kDa (cadena-γ, fibrinógeno humano), 23,8 kDa (tripsina), y el agua tipo 3, ambos de los Laboratorios de Investigaciones en Química (Universidad de Pamplona).
Toma y procesamiento de las muestras
El plasma humano fue suministrado por el banco de sangre del Hospital Erasmo Meoz de la ciudad de Cúcuta, Colombia. La muestra de plasma porcino fue tomada en la Granja Experimental Villa Marina, propiedad de la Universidad de Pamplona, por un médico veterinario; se utilizaron bolsas para extracción sanguínea con solución anticoagulante de citrato, fosfato, dextrosa y adenina (CPDA-1) (Baxter). Tanto a la sangre humana como a la porcina se les añadió PMSF disuelto en DMSO, a una concentración final de 1 mM, con el fin de inhibir la actividad de las serino-proteasas. Ambas muestras se mantuvieron refrigeradas y los plasmas se separaron por centrifugación a 7.000 rpm durante 15 minutos a 4 ºC.
Purificación de los plasminógenos
Los plg de las dos especies se purificaron por cromatografía de afinidad en lisina-sefarosa, en un cromatógrafo Biologic LP (Biorad), según el método de Deutsch and Mertz (16). En una columna de 8 x 2,5 cm (Biorad), equilibrada con tres volúmenes de la solución tampón 0,1 M fosfato 0,15 M de NaCl pH 7,3 (PBS por la sigla en inglés de phospate buffer saline), a una velocidad de flujo de 2 mL/minuto, se aplicaron 200 mL de plasma de cada una de las dos especies; posteriormente la columna se lavó con PBS, hasta que la absorbancia A280 fue ≤ 0,01, se eluyó con 100 mL de PBS que contenían 0,05 M ε-ACA y se colectaron en fracciones de 3 mL en cada tubo; la concentración se determinó utilizando el coeficiente de absorción (ε;1%)1cm = 1,6 Mcm-2 (17). Los plg fueron concentrados en una celda Amicon (Millipore) utilizando membranas de celulosa regenerada de 10 kDa, aproximadamente a 1 mg/mL, luego se dializaron toda la noche a 4 ºC con la solución tampón 0,06 M Tris, 0,06 M NaCl, 0,02 M HCl pH 8,5 (A) en una manguera de diálisis de 25 mm (Fisherbrand).
Posteriormente los plg obtenidos se separaron por cromatografía de cambio iónico, en una columna de 5 x 2,5 cm (Biorad), empacada con 4 mL de DEAE sefarosa y equilibrada con la solución tampón A, según el método de Cañas (13). La muestra adicionada y la columna lavada con la misma solución de equilibrio (A) hasta obtener una absorbancia A280 ≤ 0,01. Se eluyó con un gradiente lineal usando la solución A y 0,07 M Tris, 0,22 M NaCl, 0,06 M HCl pH 7,5 como solución tampón (B). La elusión fue colectada en fracciones de 3 mL a una velocidad de flujo de 1,5 mL/min. Se determinó la concentración del plg y las muestras se concentraron como en la cromatografía de afinidad y se almacenaron a -80 ºC hasta su uso.
Análisis electroforético
Las electroforesis SDS-PAGE se hicieron de acuerdo con el método de Laemmli (18). Las muestras de 5 mg de los plg humano y porcino se mezclaron con la solución tampón de muestra desnaturalizante con un pH 6,8 en un volumen 1:1 (vol/vol), se trataron térmicamente por cinco minutos a 100 ºC y se visualizaron por tinción de Azul brillante de Coomassie. El marcador de peso molecular que se utilizó se describe en materiales y métodos sección reactivos.
Activación de los plasminógenos
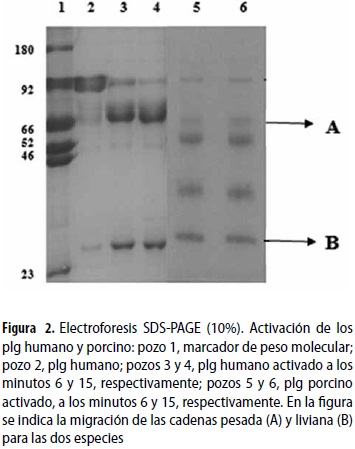
Se utilizó 1 mg para cada uno de los plg (concentración de 1 mg/mL) a una temperatura constante de 37 ºC, a los cuales se les adicionaron 6,72 µL de Uk para una concentración final de 739,2 UI/mL de solución activada. Se monitorizó espectrofotométricamente A405 así: se tomaron 8 tubos con 60 µL de sustrato equivalentes a los diferentes tiempos de incubación (0, 2, 4, 6, 8, 10, 12 y 15 minutos) a los cuales se les adicionaron 3 µL de la solución activada; se dejó reaccionar por 12 segundos y la reacción se detuvo con la adición de 10 µL de solución tampón acetato (BA) 4 M pH 3,8.
Al minuto 15, la activación de los plg se detuvo adicionando a las soluciones de plg activado 323 mL de glicerol al 100%, de tal manera que la concentración final de glicerol fue de 25%. La muestra activada se homogenizó y se marcó con el número de lote correspondiente, se dividió en alícuotas y se almacenó a -20 ºC.
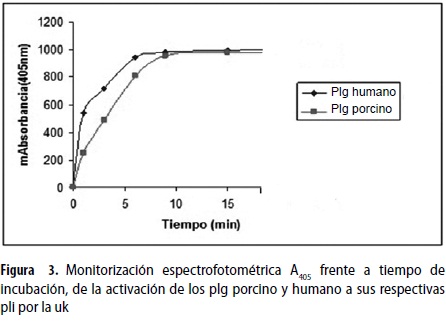
Se determinó la absorbancia A405 de las ocho incubaciones, y se graficó la A405 frente al tiempo de incubación.
Determinación de la concentración de plasmina
De acuerdo con el proveedor del sustrato cromógeno, la hidrolización con 10 mA405 (AU) a 37 ºC corresponde a 1 nM de pli (19). A los tubos con sustrato se les agregaron 3 µL de la solución final activada y se incubaron por 0, 1 y 2 minutos, respectivamente; la reacción se detuvo añadiendo 10 µL de BA, la A405 se determinó para cada tubo y se expresó en mA405/min.
Cinética de la plasmina
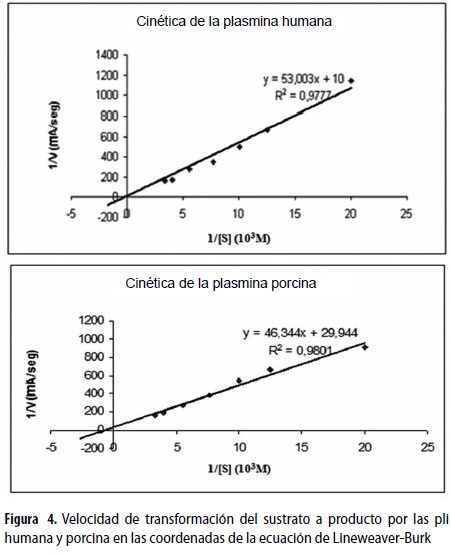
Se estudió la cinética de las dos especies de pli partiendo de una concentración común para ambas de 2,7 µM, a una temperatura de 37 ºC y un pH de 7,3; su actividad se determinó por la velocidad de transformación del sustrato a 405 nm utilizando las siguientes concentraciones de sustrato: 0,05; 0,08; 0,10; 0,13; 0,18; 0,25; 0,30 mM, a los cuales se les agregaron 3 µL de cada pli; la reacción se detuvo con 10 µL de BA. La A405 se determinó y se graficó según la ecuación de Lineweaver-Burk (20).
Secuencia de los terminales-N de los plasminógenos humano y porcino
Para determinar la secuencia de los terminales-N de los dos plg se realizó el método de transferencia como sigue: se tomaron 2 µL de la proteína y se diluyeron en 500 µL de ácido acético (0,1%), en agua destilada tipo I, en un tubo para microcentrífuga. Luego se tomaron varios trozos de membrana PVDF (por la sigla en inglés de polyvinylidene fluoride) de un tamaño no mayor de 3 x 3 mm, y se remojaron con metanol al 99% durante 15 segundos. A la solución proteica diluida se le añadió un trozo de membrana PVDF totalmente húmeda con metanol, se agitó suavemente durante tres minutos y se mantuvo a temperatura de 5-8 ºC agitando de igual manera cada 8-12 horas. Luego de 2 días se sacó la membrana y se secó, se lavó dos veces con metanol en agua destilada al 20%. A la proteína se le determinó la secuencia del terminal-N según el método de Edman (21); este último procedimiento lo llevó a cabo el doctor Per-Invar Ohlsson de la Universidad de Umeå (Suecia).
RESULTADOS
Las bandas presentes en las figuras 1A y 1B, en los pozos 2 se analizaron por densitometría con el software imagen análisis versión 2003 y se determinó que la pureza de los plg porcino y humano era, en ambos casos, mayor del 95%. Las proteínas purificadas (pozo 2 de las figuras 1 A y B) migraron a la misma altura de 92 kDa que la banda del marcador de peso molecular, correspondiente al plg humano (segunda banda del pozo 1, figuras 1 A y B). En la figura 2 se demuestra la forma clásica de activación del plg humano a pli, formando las bandas típicas pesada (A) y liviana (B) a los 6 y 15 minutos de incubación, pozos 3 y 4; se observa además que aún queda plg humano por activar al comparar estos con el pozo 2 del zimógeno humano. La activación del plg porcino a los minutos 6 y 15, pozos 5 y 6 de la figura 2, tampoco alcanza un 100%, al comparar dichos pozos con el pozo 2 del plg humano en la figura 2. Esto a pesar de que la cadena pesada (A) del plg/pli porcino muestra una mayor degradación al compararla con el plg/pli humano, tendiendo esta cadena (A) a desaparecer y formar una serie de bandas de degradación en la figura 2, pozos 3, 4, 5 y 6.
La conversión de los plg porcino y humano a pli por activación con Uk fue monitorizada por la hidrolización del sustrato que se detectó a A405nm como se puede ver en la figura 3; las activaciones de ambos plg son muy similares y al minuto 10 se igualan definitivamente.
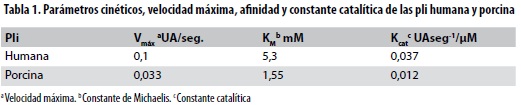
En la figura 4 se observa el comportamiento de las pli humana y porcina. La velocidad de hidrolización del sustrato por las pli se estudió a una concentración de enzima constante y con concentraciones ascendentes de sustrato. Los parámetros de importancia cinética de las dos especies de pli (Km, Vmax, Kcat) demuestran mayor velocidad para la pli humana, mientras que la afinidad es superior para la pli porcina lo que se resume y compara en la tabla 1. Se halló que la secuencia del terminal-N se compone de los siguientes a.a.: para el plg humano E1P2L3D4D5Y6, y para el plg porcino, D1P2P3D4D5Y6; se observa que la diferencia está en el primer y el tercer a.a., marcados en negrilla.
DISCUSIÓN
Se ha purificado por diferentes métodos la molécula de plg de muchos mamíferos (22-27). Nuestro grupo los ha purificado por un método simplificado y unificado (13). A esta serie de plg se le suma la purificación del plg porcino en esta investigación, lo que demuestra una vez más la efectividad del procedimiento (13), el cual facilitará la comparación de los sistemas de coagulación y fibrinólisis entre estos mamíferos. Todo indica que este procedimiento de purificación va a trascender las fronteras de los mamíferos a otras especies y, probablemente, el plg de cualquier especie se pueda purificar por este método. Esto expande el espectro de especies para comparar con el ser humano. A la fecha, las secuencias, estructuras y funciones de los plg aislados y estudiados han demostrado una gran similitud, pero lo importante en estos estudios es la posible diferencia en la afinidad hacia el trombo que puedan tener estos plg, dada la diferencia de afinidad que han demostrado por el sustrato sintético hecho para el plg humano.
El plg porcino tiene un peso molecular idéntico al del plg humano (25) y al de los plg de otros mamíferos estudiados por nuestro grupo como el equino, el bufalino y el bovino (13-15); se halló que su pureza, al igual que la de todos los plg antes estudiados, supera el 95%, como se demuestra en esta investigación, cuyos resultados coinciden con los de otras publicadas por este laboratorio (13-15).
Si bien todos los plg antes mencionados han demostrado una activación muy parecida, en la formación de las cadenas pesada y liviana, así como electroforéticamente, en el caso del plg porcino se pudo evidenciar una degradación extraordinaria de la cadena pesada (A), la cual forma dos péptidos de menor peso molecular; aún se desconocen los motivos de esta degradación extraordinaria, y se podría esperar una posible autodegradación por parte de la pli porcina formada. Esto lo sustentan la alta pureza demostrada y el hecho de que se encontró una sola secuencia en la muestra proteica con la cual se determinó el terminal-N, perteneciente al plg porcino. Esta técnica detecta un nanogramo de proteína y permite descartar otras enzimas que podrían contaminar la muestra.
Estos resultados podrían significar una mayor actividad de la pli porcina con relación a las de los demás mamíferos estudiados; nuestro grupo está investigando este fenómeno, partiendo del tiempo de disolución del coágulo por parte de los plg/pli de los mamíferos hasta la fecha estudiados (13-15). Quizás esta mayor actividad de la pli porcina se confirmará en el futuro, lo cual daría una especial relevancia al plg porcino con relación a los plg de los demás mamíferos estudiados. Estas diferencias estructurales se detectaron, como se dijo antes, electroforéticamente; sin embargo, la activación con Uk de los plg y la relación absorbancia/tiempo de activación no demostró diferencia significativa entre el plg humano y el porcino.
El sustrato sintético utilizado S-2251 para la pli humana es un pequeño péptido (19), que de ninguna manera absorbe la molécula de plg; lo contrario ocurre con el trombo o coágulo que secuestra no solo el plg, sino también el tPA que activa el plg a pli dentro del coágulo y donde esta última enzima funciona biológicamente disolviendo el coágulo (28).
Se demostró en este estudio que otro parámetro de interés, la afinidad, es tres veces superior para la pli porcina que para la pli humana, lo que deja definitivamente a la pli humana como la molécula de menor afinidad por el sustrato cromógeno, al compararla con las pli de las demás especies mamíferas estudiadas.
Con nuestro trabajo se unificó la purificación de los plg de diferentes especies, incluyendo, además del humano, los de otros mamíferos: bovino, equino y bufalino (13-17,22-27). Esto permite el manejo homogéneo de los sistemas de coagulación y fibrinólisis de todas estas especies y proporciona información más precisa sobre las diferencias en dichos sistemas según la especie.
La secuencia del terminal-N del plg porcino demostró ser la misma que la de los plg ovino y equino (29); se diferenciaron de los plg de los demás mamíferos en los a.a. 1 y 3 de dicho terminal. Al comparar las diferencias en la secuencia entre los plg de los mamíferos, estas no son aparentemente significativas, pero sí lo son los efectos que estos pequeños cambios de algunos a.a. tienen en los parámetros cinéticos de estas moléculas, como se demostró en estos resultados. El estudio de la disolución del coágulo humano in vitro con los plg de todas estas especies proporcionará conocimientos valiosos sobre la eficiencia de cada una de ellos, que se podrán utilizar en análisis clínicos.
AGRADECIMIENTOS
Los autores agradecen a la Universidad de Pamplona por su apoyo económico, al doctor Torgny Stigbrand de la Universidad de Umeå por el soporte económico para la determinación de la secuencia del terminal-N de los plasminógenos humano y porcino y agradecen la donación del plasma humano al Hospital Universitario Erasmo Meoz de Cúcuta, Colombia.
REFERENCIAS BIBLIOGRÁFICAS
1. Hoffman M, Monroe DM. Coagulation 2006: a modern view of hemostasis. Hematol Oncol Clin North Am. 2007 Feb;21(1):1-11. [ Links ]
2. Rau JC, Beaulieu LM, Huntington JA, Church FC. Serpins in thrombosis, hemostasis and fibrinolysis. J Thromb Haemost. 2007 Jul;5 Suppl 1:102-15. [ Links ]
3. Bode W. The structure of thrombin: a janus-headed proteinase. Semin Thromb Hemost. 2006 Apr;32 Suppl 1:16-31. [ Links ]
4. Cesarman-Maus G, Hajjar KA. Molecular mechanisms of fibrinolysis. Br J Haematol. 2005 May;129(3):307-21. [ Links ]
5. Wiman B, Collen D. Molecular mechanism of physiological fibrinolysis. Nature. 1978 Apr 6;272(5653):549-50. [ Links ]
6. Loskutoff DJ, Quigley JP. PAI-1, fibrosis, and the elusive provisional fibrin matrix. J Clin Invest. 2000 Dec;106(12):1441-3. [ Links ]
7. Levi M, van der Poll T, Büller HR. Bidirectional relation between inflammation and coagulation. Circulation. 2004 Jun 8;109(22):2698-704. [ Links ]
8. Violand BN, Castellino FJ. Mechanism of the urokinase-catalyzed activation of human plasminogen. J Biol Chem. 1976 Jul 10;251(13):3906- 12. [ Links ]
9. Coughlin PB. Antiplasmin: the forgotten serpin? The FEBS journal. 2005 Oct;272(19):4852-7. [ Links ]
10. Vaughan DE. Angiotensin, fibrinolysis, and vascular homeostasis. Am J Cardiol. 2001 Apr 19;87(8A):18C- 24C. [ Links ]
11. Hoover-Plow J. Does plasmin have anticoagulant activity? Vascular health and risk management. 2010 Jan;6:199-205. [ Links ]
12. Michaelis L, Menten ML. Die kinetik der intertinwerkung. Biochem. 1913;Z(49):333-369. [ Links ]
13. Cañas O, Quijano A, Arbeláez L. Activación y cinética comparativa de dos especies de plasminógenos: humano y bovino. Rev Bistua. 2006;4:3-12. [ Links ]
14. Cañas O, Quijano A, Arbeláez L. Activación y Cinética comparativa de la plasmina bufalina con la humana. Rev Colombiana Ciencias Pecuaria. 2010;23(1):47-54. [ Links ]
15. Cañas O, Quijano A, Arbeláez L. Activación y comparación cinética del plasminógeno equino con el plasminógeno humano. Rev Bistua. 2007;(5):43- 52. [ Links ]
16. Deutsch DG, Mertz ET. Plasminogen: purification from human plasma by affinity chromatography. Science. 1970 Dec 4;170(962):1095-6. [ Links ]
17. Longstaff C, Whitton CM. A proposed reference method for plasminogen activators that enables calculation of enzyme activities in SI units. J Thromb Haemost. 2004 Aug 15;2(8):1416-21. [ Links ]
18. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970 Aug 15;227(5259):680-5. [ Links ]
19. Vinazzer H. Basics and practice in evaluating plasminogen. Haemostasis. 1988 Jan;18 Suppl 1(56):41-5. [ Links ]
20. Lineweaver H, Burk D. The determination of enzyme dissociation constant. J.Am. Chem. Soc. 1934 Jan;(56):658-666. [ Links ]
21. Edman P. Sequence determination. Mol Biol Biochem Biophys. 1970 Jan 3;8(2):211-55. [ Links ]
22. Schaller J, Moser PW, Dannegger-Müller GA, Rösselet SJ, Kämpfer U, Rickli EE. Complete amino acid sequence of bovine plasminogen. Comparison with human plasminogen. Eur J Biochem. 1985 Jun 3;149(2):267-78. [ Links ]
23. Marcum JA, Highsmith RF, Kline DL. Streptokinasedependent delayed activation of horse plasminogen. Biochim Biophys Acta. 1982 Dec 6;709(1):19-27. [ Links ]
24. Leytus SP, Bowles LK, Konisky J, Mangel WF. Activation of plasminogen to plasmin by a protease associated with the outer membrane of Escherichia coli. Proc Natl Acad Sci U S A. 1981 Mar;78(3):1485-9. [ Links ]
25. Brunisholz RA, Rickli EE. Primary structure of porcine plasminogen. Isolation and characterization of CNBr-fragments and their alignment within the polypeptide chain. Eur J Biochem. 1981 Sep 30;119(1):15-22. [ Links ]
26. Wohl RC, Sinio L, Summaria L, Robbins KC. Comparative activation kinetics of mammalian plasminogens. Biochim Biophys Acta. 1983 May 30;745(1):20-31. [ Links ]
27. Paoni NF, Violand BN, Castellino FJ. Isolation and characterization of native and lower molecular weight forms of sheep plasminogen. J Biol Chem. 1977 Nov 10;252(21): 7725-32. [ Links ]
28. Lijnen HR, Collen D. Interaction of plasminogen activators and inhibitors with plasminogen and fibrin. Semin Thromb Hemost. 1982 Jan;8(1):2-10. [ Links ]
29. Cañas B O, Quijano P A, Arbeláez R F. Activación y determinación de parámetros cinéticos de la plasmina humana y Ovis aries. Rev. MVZ Córdoba. 2011;16(12364-12371). [ Links ]