Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.25 no.3 Medellín July/Sept. 2012
INVESTIGACIÓN ORIGINAL
Infección y colonización faríngea asintomática de niños por Streptococcus pyogenes
Streptococcus pyogenes infection and asymptomatic throat carriage in children
Mary Alejandra Restrepo Lozada1; María Isabel Múnera Jaramillo2; Blanca Susana Ramírez Puerta3; Clara Patricia Acuña Ramos4
1 Bacterióloga, Asesora Técnico-Científica del Laboratorio Médico Echavarría, Medellín, Colombia. arestrepo@labechavarria.com
2 Médica y cirujana, Especialista en Gerencia en salud. Directora Médica Nacional del Laboratorio Médico Echavarría, Medellín, Colombia.
3 Odontóloga con Maestría en Epidemiología, docente de la Facultad Nacional de Salud Pública, Universidad de Antioquia, Medellín, Colombia.
4 Odontóloga, Magíster en Educación de la Universidad Nacional de Colombia.
Recibido: mayo 20 de 2011
Aceptado: agosto 01 de 2011
RESUMEN
Objetivo: establecer la frecuencia de estreptococo beta hemolítico del grupo A (Streptococcus pyogenes) en niños, mediante una prueba rápida de inmunoensayo cromatográfico.
Métodos: estudio piloto de tipo transversal en una muestra no probabilística de 144 niños entre 3 y 13 años, asistentes a centros infantiles de Medellín y su área metropolitana y a una institución educativa de Bogotá. Se tomaron muestras de garganta por frotis para la prueba rápida de S. pyogenes y se recolectó información demográfica y de antecedentes personales mediante una encuesta. Se calcularon los promedios con sus desviaciones estándar y los porcentajes de acuerdo con la naturaleza de las variables de interés.
Resultados: la edad promedio del grupo fue 5,5 ± 2,8 años con distribución similar por sexo. Veintiún niños (14,6%) fueron positivos para S. pyogenes, diez de ellos fueron posibles infecciones y 11, portadores asintomáticos. De los 144 niños, 45 (31,3%) tenían síntomas faríngeos, de los cuales 10 (22,2%) tenían S. pyogenes. Un total de 99 (68,8%) niños fueron asintomáticos y 11 de estos (11,1%) presentaron prueba positiva para S. pyogenes.
Discusión: la alta frecuencia de S. pyogenes en este grupo es un llamado de atención sobre la necesidad de implementar protocolos de manejo con pruebas rápidas para la detección del microorganismo.
PALABRAS CLAVE
Amigdalitis, Diagnóstico, Infecciones Estreptocócicas, Prueba de Laboratorio, Salud Pública, Streptococcus pyogenes
SUMMARY
Objective: To establish the frecuency of Streptococcus pyogenes infection or asymptomatic carriage in a group of children, by means of a rapid antigendetection test. Methods: A cross-sectional study was carried out in a non-probabilistic sample of 144 children aged between 3 and 13 years, in two educational institutions in Bogotá and Medellin. A single throat specimen was obtained from each child to carry out the rapid test; demographic data and information on pertinent symptoms and signs were obtained by means of a survey. Mean and standard deviation and percentages were calculated according to the nature of the variables.
Results: Average age was 5.5 ± 2.8 years, with even distribution by gender. Twenty one children (14,6%) were positive for S. pyogenes; out of them, 10 had possible infection and 11 were asymptomatic throat carriers. Forty five children (31.3%) reported pharyngeal symptoms and 10 (22.2%) out of them were positive in the rapid test. Ninety nine children (68.7%) were asymptomatic and of them 11 (11.1%) were also positive.
Discussion: Management protocols for S. pyogenes infection would benefit from the detection based on rapid tests.
KEY WORDS
Diagnosis, Laboratory Test, Public Health, Streptococcus pyogenes, Streptococcal Infections, Tonsillitis
INTRODUCCIÓN
La salud infantil es uno de los Objetivos del Desarrollo del Milenio (ODM) (1) y tema fundamental para el seguimiento por parte de los gobiernos; en consecuencia, el Plan Nacional de Salud Pública (PNSP) 2007-2010 establece que la salud de los niños es la prioridad para definir la política pública en salud; para ello, entre las líneas de política ha establecido como estrategia ''mejorar el acceso y calidad en la prestación de los servicios de prevención y control de los riesgos y atención de las enfermedades que afectan a la niñez'' (2).
Las faringoamigdalitis se encuentran entre las enfermedades infecciosas que más afectan a los niños en edad escolar. Aunque la etiología viral es la más frecuente, se reconoce al Streptococcus pyogenes (estreptococo beta hemolítico del grupo A) como el agente bacteriano responsable de una tercera parte de los casos (3). Además, esta bacteria produce complicaciones supurativas y no supurativas, las primeras por diseminación a otros tejidos, y las segundas, como secuelas de la respuesta inmunológica; entre estas últimas se cuentan la fiebre reumática aguda y la glomerulonefritis postestreptocócica (4).
La infección por S. pyogenes ocurre por contacto cercano con personas infectadas o colonizadas, a partir de saliva o secreciones nasales; por tal razón es más frecuente entre los niños de las escuelas y guarderías; además, el hacinamiento favorece la trasmisión. Asimismo, se ha evidenciado que los niños en edad escolar colonizados por la bacteria se convierten en su reservorio; en efecto: se ha visto coincidencia entre las cepas que causan faringitis en estos niños y las aisladas de casos asociados con la enfermedad invasiva en la comunidad (5,6).
En diferentes estudios se ha informado la alta frecuencia de amigdalitis y/o faringitis por S. pyogenes en niños; en Estados Unidos, por ejemplo, 15% a 36 % de los casos de dolor de garganta en niños son atribuibles a S. pyogenes (7). En Nicaragua, Meza informó una tasa de prevalencia de 8,5% en niños asintomáticos(8), y en Guatemala, Ruiz halló 15% en niños con faringoamigdalitis (9). En el último reporte de indicadores básicos de salud del año 2009 en Medellín la faringitis y amigdalitis aguda representaron un 2,2% de la morbilidad por consulta externa, dos puntos más que el porcentaje reportado en 2008; aunque se desconoce la proporción de S. pyogenes como agente etiológico, es claro que la entidad está aumentando (10).
Con el fin de minimizar sus consecuencias, se deben tener en cuenta diferentes aspectos en el manejo de la faringoamigdalitis. Por un lado, cuando no se la trata pueden desarrollarse complicaciones no supurativas como la fiebre reumática, que afecta articulaciones y válvulas cardíacas, y glomerulonefritis que puede llevar a la falla renal, afectando la calidad de vida de las personas, además de las serias implicaciones económicas para las familias y para los prestadores de servicios de salud (11). Por otro lado, aunque la confirmación del diagnóstico de la enfermedad es crítica para el buen tratamiento del paciente sintomático y para la prevención de las complicaciones, en países en vías de desarrollo el tratamiento se hace, la mayoría de las veces, de manera empírica, lo que implica la prescripción de antibioterapia en muchos casos innecesaria; tal situación tiene efectos en el aumento de la resistencia bacteriana a los antibióticos (12).
En la literatura mundial existe controversia sobre el manejo de la faringoamigdalitis por S. pyogenes; al respecto se observan dos tendencias generales diferentes: la primera es identificar los casos posibles según criterios clínicos y epidemiológicos, confirmar por laboratorio la presencia de S. pyogenes y hacer tratamiento antibiótico en los casos positivos para prevenir las complicaciones (13,14); la segunda es considerar la infección como una enfermedad benigna autolimitada, con baja frecuencia de fiebre reumática y de complicaciones supurativas, esta última es la situación de países desarrollados como Reino Unido, Alemania y Bélgica (15).
Rutinariamente el diagnóstico de faringoamigdalitis se hace con base en los criterios clínicos de Centor, que establecen una escala de puntaje, para definir la necesidad de hacer prueba confirmatoria o de prescribir antibióticos de inmediato (13).
La confirmación de la presencia de S. pyogenes se hace por métodos convencionales como el aislamiento en cultivo y las posteriores pruebas de identificación que demoran el diagnóstico entre 24 y 48 horas. Aunque este es el método de referencia (15), se han desarrollado otros como las pruebas rápidas que permiten la detección cualitativa directa de carbohidratos antigénicos de S. pyogenes en frotis de garganta, con resultados en cinco minutos y altos niveles de sensibilidad y especificidad (4). La sensibilidad de este tipo de pruebas ha mejorado desde las de primera generación basadas en partículas de látex y con sensibilidad del 70% hasta las de enzimoinmunoanálisis (EIA) con sensibilidad superior al 90%. Entre estas últimas se encuentra la Strep A Rapid Test Strip, considerada como una prueba válida para la detección de la presencia de S. pyogenes, aprobada por FDA (Food and Drug Administration) y la Comunidad Europea (CE) y caracterizada por tener sensibilidad relativa del 97% (IC 95%: 91%-99%), especificidad del 95% (IC 95%: 92%-97%) y precisión del 95% (IC 95%: 93%-97%) (16).
Pese a la evidencia científica de la alta frecuencia de infección por S. pyogenes en la población infantil, y a la existencia de guías de manejo que recomiendan utilizar pruebas confirmatorias para definir la necesidad de tratamiento con antibióticos, la solicitud de estas pruebas en Colombia es infrecuente, lo que se explica en parte por el desconocimiento de la frecuencia de infección/colonización por este agente en la población infantil, además de la baja adherencia a las guías de manejo. Este estudio se realizó con el propósito de identificar la frecuencia de S. pyogenes en niños de 3 a 13 años de Centros Infantiles de Medellín y su área metropolitana y de una institución educativa de Bogotá, mediante la prueba rápida de inmunoensayo cromatográfico Strep A Twist Rapid Test.
MATERIALES Y MÉTODOS
Se hizo un estudio piloto, de tipo transversal en una muestra no probabilística de 144 niños de 3 a 13 años, seleccionados en tres centros infantiles de Medellín y su área metropolitana y en una institución educativa de Bogotá, cuyos directores aceptaron participar.
Se envió una encuesta a los adultos responsables de los menores para obtener información demográfica (edad, sexo, número de personas que viven en el hogar, número de adultos, número de niños, número de habitaciones en el hogar), y antecedentes personales de signos y síntomas faríngeos, además de síntomas constitucionales como anorexia, malestar general, dolor óseo, fiebre subjetiva y cefalea. Se indagó por el uso actual de algún medicamento y por la convivencia con un familiar con síntomas de infección respiratoria alta.
En noviembre de 2010 se les tomaron a los niños seleccionados muestras de garganta por frotis, para la detección por prueba rápida de S. pyogenes, procedimiento que se rigió por las Normas Científico- Técnicas de la Resolución 08430/93 del Ministerio de Salud y de la Ley 84 de 1989. Antes de la toma de las muestras se solicitó el consentimiento informado a los acudientes de los menores para su participación en el estudio. Se siguieron normas estrictas de bioseguridad en los procedimientos de recolección de las muestras y se contactó a los padres o acudientes de los niños que tuvieron un resultado positivo en la prueba, para la entrega del resultado y la asesoría pertinente; además, se entregaron todos los resultados a las instituciones participantes.
A todos los niños se les hizo la prueba rápida para S. pyogenes (Strep A Rapid Test Strip).
La muestra se recolectó utilizando un hisopo estéril que provee el estuche; se frotaron la faringe posterior y las amígdalas, evitando tocar la lengua, la parte interna de las mejillas y los dientes. La prueba se hizo inmediatamente después de tomar la muestra; para ello se introdujo el hisopo en un tubo de ensayo que contenía nitrito de sodio y ácido acético, se lo agitó 10 veces en la solución y se puso la tira de inmunocromatografía verticalmente; a los cinco minutos se hizo la lectura según las recomendaciones de la casa fabricante (16).
Los datos se procesaron en los programas Microsoft Excel 2007, SPSS 17.0®. Se calcularon valores promedios con sus desviaciones estándar y porcentajes de acuerdo con la naturaleza de las variables de interés. La definición de sintomático se hizo con base en la presencia de disfagia y/o de amígdalas rojas e inflamadas. Se consideró como posible infección la presencia de síntomas faríngeos con prueba positiva, y como colonización, la prueba positiva sin síntomas faríngeos.
RESULTADOS
Se evaluaron 144 niños, de los cuales 105 (72,9%) fueron de Medellín, con edades de 3 a 5 años, y 39 (27,1%) de Bogotá con edades entre 9 y 13 años. La edad promedio del grupo fue de 5,5 ± 2,8 años, con distribución similar por sexo (48,6% femenino y 51,4% masculino). Se encontró que el número promedio de habitaciones en los hogares era 2,5 ± 0,9 y el número de personas por hogar, 4,4 ± 2,0; fue mayor el promedio de adultos por vivienda (2,6 ± 1,5) que el de niños (1,8 ± 1,0).
La frecuencia de los síntomas y signos se resume en la tabla 1.
El hallazgo más frecuente fue la cefalea (36,1%), seguida de fiebre (33,3%) y de dolor óseo (30,6%). Con frecuencias menores se hallaron malestar general, síntomas faríngeos y anorexia. El antecedente de haber tomado antibióticos formulados por síntomas faríngeos se encontró en 33 niños (22,9%); el antibiótico más utilizado fue amoxicilina (78,8%) seguido de cefalexina (15,2%), azitromicina (3%) y benzetacil (3%).
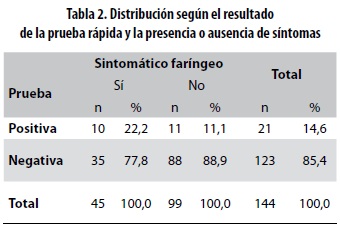
Se detectó S. pyogenes en 21 de las 144 muestras (14,6%). Diez de ellos se consideraron posiblemente infectados y 11, colonizados. En el análisis bivariado de la distribución de los niños según la presencia o no de síntomas faríngeos y el resultado de la prueba rápida, se encontró que 10 de los 45 niños sintomáticos y 11 de los 99 asintomáticos tenían prueba positiva lo que corresponde al 22,2% y el 11,1%, respectivamente (tabla 2).
De los 21 casos positivos en la prueba rápida, 13 (61,9%) eran niñas y 8 (38,1%), niños; la diferencia no fue significativa (p = 0,2). En cuanto a los antecedentes familiares, 117 niños (81,3%) tuvieron algún familiar en casa con síntomas respiratorios altos en el momento del estudio o en el mes anterior; siete niños de un mismo centro infantil tenían varicela, de los cuales uno fue positivo para S. pyogenes.
Cuatro de los 10 niños sintomáticos con prueba positiva (40%) no habían recibido antibióticos, mientras que 16 de los 35 niños sintomáticos con prueba negativa (45,7%), tenían antecedentes de antibioterapia. De los 123 niños con prueba negativa, 88 (71,5%) no tenían síntomas y 11 de estos (12,5%) estaban recibiendo antibióticos.
DISCUSIÓN
La infección por S. pyogenes es la primera causa bacteriana de amigdalofaringitis entre los 5 y 15 años de edad (4,17). En Estados Unidos se atienden anualmente cerca de 7,3 millones de consultas médicas ambulatorias por dolor de garganta en niños (11), y S. pyogenes es responsable de 15% a 36% de los casos (7,11); estos datos son similares a los de otros estudios; según un metanálisis publicado en 2010, luego de la revisión de 266 artículos, la prevalencia de S. pyogenes en individuos sintomáticos fue del 37% y en asintomáticos, del 12% (18).
En Colombia hay pocos estudios sobre la frecuencia de la infección por este agente; en el presente estudio de 144 niños se encontró S. pyogenes en 21 (14,6%). En 10 de los 45 niños sintomáticos faríngeos (22,2%) se detectó este microorganismo, es decir, uno de cada cinco casos se debió probablemente a S. pyogenes; si se considera la gravedad de las complicaciones supurativas y no supurativas de la infección estreptocócica y el papel de la población pediátrica como su reservorio, la alta proporción detectada, incluso superior a la informada previamente, es una alerta para revisar la adherencia a las guías de manejo e incluir pruebas diagnósticas para orientar la necesidad de terapia antibiótica.
Según diferentes autores, es variable la frecuencia de colonización por S. pyogenes; es menor en los países desarrollados y más alta en los que están en vías de desarrollo. En un estudio en Londres (19) hallaron una proporción de niños colonizados del 5,9%, mientras que en Nepal (20) y en Croacia (21) informaron frecuencias del 10,9%, el primero, y 11,7% el segundo. En este estudio con base en la prueba rápida Strep A Rapid Test Strip, se encontró una proporción de posible infección del 7,0% y de colonización de 7,6%. La frecuencia de S. pyogenes en niños sintomáticos y asintomáticos varía según la edad, pero es mayor durante los años escolares; probablemente las diferencias observadas pueden deberse al mayor número de preescolares evaluados en el presente estudio.
Con relación a los síntomas constitucionales, el más frecuente fue la cefalea (36,1%), seguida de fiebre (33,3%); estos datos difieren de los de Pfoh y colaboradores quienes informaron fiebre en 50,0% y cefalea en 21,0% de sus casos (11); tal diferencia probablemente esté relacionada con la edad. La cefalea suele ser más común en niños preescolares que en escolares, en el presente trabajo la edad promedio fue de 5,5 años, en cambio en el de Pfoh fue de 8,8 años.
Por otro lado, 11 de los 99 niños que no presentaban síntomas faríngeos (11,1%) fueron positivos para S. pyogenes; este hallazgo permite llamar la atención hacia la alta proporción de niños que eran reservorios del agente y, por lo tanto, fuente importante de transmisión. Asimismo, 16 de 35 niños sintomáticos (45,7%) con prueba negativa habían recibido antibióticos, hallazgo que sugiere la prescripción innecesaria de antibióticos, con el potencial de generar resistencia. Este resultado es superior al 15,4% reportado por McIsac y colaboradores en Ontario, Canadá, en niños entre 4 y 14 años de edad (13). Por el contrario 4,4% de los sintomáticos con prueba positiva no habían sido tratados con antibióticos.
La amoxicilina fue el antibiótico más frecuentemente utilizado en el presente estudio (78,8%), seguido de cefalexina (15,2%) y en tercer lugar azitromicina (3,0%). La amoxicilina fue también el antibiótico administrado con mayor frecuencia (64,3%) a los pacientes sintomáticos con resultados negativos en la prueba rápida. En Colombia, la frecuencia de resistencia de S. pyogenes a los antibióticos, reportada por Giraldo en 2009 para 351 cepas, fue del 5,7% para clindamicina; 3,8% para eritromicina y 3,1% para azitromicina. Todas las cepas fueron susceptibles a penicilina y ampicilina (22). El uso innecesario de antibióticos en un tercio de los niños sintomáticos con prueba negativa y la utilización de azitromicina son factores de riesgo para el aumento de resistencia a los macrólidos.
En el grupo de preescolares se encontraron siete casos de varicela, uno de los cuales fue positivo para S. pyogenes; algunos autores sugieren que la infección por el virus de la varicela es un factor de riesgo para desarrollar infección estreptocócica invasiva (23), lo que enfatiza la importancia de la detección de este agente y la prescripción oportuna de antibióticos que impidan su diseminación a niños en condiciones de vulnerabilidad.
Este estudio constituye un acercamiento al conocimiento de la frecuencia de la infección/ colonización en niños, pero se requiere avanzar en investigaciones poblacionales con muestreo probabilístico que permitan un mejor conocimiento de la presencia de S. pyogenes en la población colombiana; asimismo, es necesario profundizar en el conocimiento del comportamiento de la prueba rápida para la detección de este microorganismo, en comparación con el cultivo, que aporte bases científicas para implementar la prueba rápida en los protocolos de manejo.
Finalmente, la alta frecuencia del microorganismo en el grupo de estudio debe llamar la atención sobre la necesidad de implementar pruebas rápidas para su detección. Esto aseguraría la prescripción oportuna de antibióticos para interrumpir la cadena de transmisión, reducir el riesgo de complicaciones supurativas y no supurativas que ponen en peligro la vida o afectan su calidad, generan incapacidades y elevan los costos de la atención en salud. Igualmente, el tratamiento apropiado de los cuadros de faringoamigdalitis con antibióticos, solo cuando se comprueba la presencia de S. pyogenes favorece la adherencia al tratamiento y reduce el uso de antibioterapia innecesaria y, por lo tanto, se minimizan sus efectos en la resistencia microbiana (24,25).
La Organización Mundial de la Salud resalta la importancia y necesidad de estudios epidemiológicos de las infecciones estreptocócicas en países en vías de desarrollo con el fin de implementar programas efectivos de prevención (26).
LIMITACIONES DEL ESTUDIO
Debido a que el estudio se llevó a cabo en una muestra no representativa de la población, los hallazgos no permiten generalizar acerca de la prevalencia de S. pyogenes en escolares.
Una de las limitaciones para la comparabilidad de los hallazgos fue la inclusión de todos los niños de las instituciones y su clasificación en sintomáticos faríngeos o asintomáticos con base en una encuesta y no por evaluación médica. Además en la encuesta no se incluyeron posibles hallazgos clínicos más objetivos como adenopatías cervicales, petequias en el velo del paladar, uvulitis y exantema escarlatiniforme, entre otros.
Por último no se hizo cultivo en los sintomáticos faríngeos con resultado negativo, lo que hubiera permitido descartar falsos negativos de la prueba rápida.
AGRADECIMIENTOS
Las autoras del presente manuscrito agradecen a las bacteriólogas Lina María Gómez Bahamón, Mónica María Martínez y Alejandra Villa Córdoba por su asesoría y acompañamiento en el trabajo de campo; a la ingeniera Tatiana Montoya Carvajal por la logística; a la Fundación del Grupo Antioqueño de Apuestas GANA y a la Institución Educativa Distrital República de Colombia por la participación en el estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Naciones Unidas. Objetivos de desarrollo del milenio [Internet]. 2008 [cited 2011 Mar 1]; Available from: http://www.un.org/spanish/millenniumgoals/. [ Links ]
2. Colombia Ministerio de la Protección Social. Decreto número 3039 por el cual se adopta el Plan Nacional de Salud Pública 2007-2010. Diario Oficial. 2010;CXLIII(46716):8–20. [ Links ]
3. Centers for Disease Control and Prevention. Group A Streptococcal (GAS) Disease [Internet]. 2008 [cited 2011 Mar 4];Available from: http://www.cdc.gov/ncidod/dbmd/diseaseinfo/groupastreptococcal_g.htm. [ Links ]
4. Musher DM. Streptococcus, Streptococcus bovis y género leuconostoc. In: Mandell GL, Bennett JE, Dolin R, editors. Enfermedades Infecciosas, principios y práctica. Madrid: Elsevier; 2006. p. 2362–79. [ Links ]
5. Haukness HA, Tanz RR, Thomson RB, Pierry DK, Kaplan EL, Beall B, et al. The heterogeneity of endemic community pediatric group a streptococcal pharyngeal isolates and their relationship to invasive isolates. J Infect Dis. 2002 Apr 1;185(7):915–20. [ Links ]
6. Cockerill FR, MacDonald KL, Thompson RL, Roberson F, Kohner PC, Besser-Wiek J, et al. An outbreak of invasive group A streptococcal disease associated with high carriage rates of the invasive clone among school-aged children. JAMA. 1997 Jan 1;277(1):38–43. [ Links ]
7. Linder JA, Bates DW, Lee GM, Finkelstein JA. Antibiotic treatment of children with sore throat. JAMA. 2005 Nov 9;294(18):2315–22. [ Links ]
8. Meza Rodríguez GE. Comportamiento del estreptoco B hemolitico del grupo A en niños de 5-15 años portadores sanos de la escuela La Salle y determinación de fiebre reumática, agosto-octubre 2003 y marzo 2004. Universidad Nacional Autónoma de Nicaragua; 2005. [ Links ]
9. Ruiz C. Prevalencia de Estreptococcus beta hemolítico del grupo A en niños con faringoamigdalitis aguda bacteriana y niños sanos. Universidad Francisco Marroquín; 2003. [ Links ]
10. Secretaría de Salud de Medellín. Indicadores básicos 2008: situación de salud en Medellín. Medellín: Alcaldía de Medellín; 2009. [ Links ]
11. Pfoh E, Wessels MR, Goldmann D, Lee GM. Burden and economic cost of group A streptococcal pharyngitis. Pediatrics. 2008 Feb;121(2):229–34. [ Links ]
12. Rodríguez RS, Calderón-Jaimes E, Gómez-Barreto D, Espinosa-de los Monteros LE. [Antimicrobial resistance characteristics of clinical isolates of Streptococcus pyogenes]. Salud Publica Mex. 2000;42(3):226–9. [ Links ]
13. McIsaac WJ, White D, Tannenbaum D, Low DE. A clinical score to reduce unnecessary antibiotic use in patients with sore throat. CMAJ. 1998 Jan 13;158(1):75–83. [ Links ]
14. Musher DM. Secuelas postestreptocócicas no superativas: fiebre reumática y glomerulonefritis. In: Mandell GL, Bennett JE, Dolin R, editors. Enfermedades Infecciosas, principios y práctica. Madrid: Elsevier; 2006. p. 2380–91. [ Links ]
15. Regoli M, Chiappini E, Bonsignori F, Galli L, de Martino M. Update on the management of acute pharyngitis in children. Ital J Pediatr. 2011 Jan;37:10. [ Links ]
16. ACON Laboratories I. Prueba rápida de Strep A en tira: ficha técnica. San Diego- CA: ACON Laboratories, Inc; 2005. [ Links ]
17. Peñalba Citores AC, Riaño Méndez B, Marañón Pardillo R, Míguez Navarro C, Vázquez López P, Guerrero Soler MM, et al. [Incidence of streptococcal pharyngitis]. An Pediatr (Barc). 2007 Sep;67(3):220–4. [ Links ]
18. Shaikh N, Leonard E, Martin JM. Prevalence of streptococcal pharyngitis and streptococcal carriage in children: a meta-analysis. Pediatrics. 2010 Sep;126(3):e557–64. [ Links ]
19. Spitzer J, Hennessy E, Neville L. High group A streptococcal carriage in the Orthodox Jewish community of north Hackney. Br J Gen Pract. 2001 Feb;51(463):101–5. [ Links ]
20. Dumre SP, Sapkota K, Adhikari N, Acharya D, Karki M, Bista S, et al. Asymptomatic throat carriage rate and antimicrobial resistance pattern of Streptococcus pyogenes in Nepalese school children. Kathmandu Univ Med J (KUMJ). 2009;7(28):392–6. [ Links ]
21. Begovac J, Bobinac E, Benic B, Desnica B, Maretic T, Basnec A, et al. Asymptomatic pharyngeal carriage of beta-haemolytic streptococci and streptococcal pharyngitis among patients at an urban hospital in Croatia. European journal of epidemiology. 1993 Jul;9(4):405–10. [ Links ]
22. Giraldo R. Susceptibilidad del estreptococo beta hemolítico del grupo A. Revista medicina. 2009;8(1):26–9. [ Links ]
23. Factor SH, Levine OS, Harrison LH, Farley MM, McGeer A, Skoff T, et al. Risk factors for pediatric invasive group A streptococcal disease. Emerg Infect Dis. 2005 Jul;11(7):1062–6. [ Links ]
24. Bisno AL, Gerber MA, Gwaltney JM, Kaplan EL, Schwartz RH. Practice guidelines for the diagnosis and management of group A streptococcal pharyngitis. Infectious Diseases Society of America. Clin Infect Dis. 2002 Jul 15;35(2):113–25. [ Links ]
25. Happy Audit. Guías para el diagnóstico y tratamiento de las infecciones del tracto respiratorio en atención primaria. Odense: Happy Audit; 2008. [ Links ]
26. World Health Organization. Initiative for Vaccine Research (IVR) [Internet]. 2012 [cited 2011 Mar 13];Available from: http://www.who.int/vaccine_research/diseases/soa_bacterial/en/index [ Links ]