Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.25 no.3 Medellín July/Sept. 2012
ACTUALIZACIÓN CRÍTICA
Ronda Clínica y Epidemiológica
Desenlaces sustitutos en investigación médica
Maycos Leandro Zapata1; Fabián Alberto Jaimes2
1 Residente de Medicina Interna, Universidad Pontificia Bolivariana
2 Profesor Asociado, Departamento de Medicina Interna, Universidad de Antioquia, Medellín Colombia. Asesor, Unidad de Investigaciones, Hospital Pablo Tobón Uribe, Medellín, Colombia. fjaimes@udea.edu.co ; fjaimesb@jhsph.edu
Recibido: enero 20 de 2012
Aceptado: febrero 07 de 2012
INTRODUCCIÓN
El éxito de la investigación parte desde su anatomía básica, y esta incluye una adecuada pregunta con un desenlace que represente el fenómeno que se quiere evaluar en la población de interés. La selección de un desenlace relevante está íntimamente ligada al diseño del estudio, es la base para calcular el tamaño de la muestra y determina la variable para la cual se deben maximizar los esfuerzos de evitar la pérdida de datos durante la conducción de la investigación (1). Es usual en los ensayos clínicos (EC) seleccionar varios desenlaces, algunos de los cuales pueden considerarse secundarios o exploratorios, con el fin de no desaprovechar la oportunidad excepcional para medirlos y encontrar resultados importantes que puedan guiar futuras investigaciones.
En forma práctica, los desenlaces en investigación se pueden dividir en los siguientes:
- Clínicamente importantes: son los que aportan mejor información de cómo y cuándo usar un tratamiento. Son desenlaces centrados en el paciente y representan de la mejor forma cómo funciona, subsiste o se siente una persona (2).
- Desenlaces intermedios: están relacionados con el fenómeno biológico y fisiopatológico de interés, y se encuentran dentro del proceso hacia la presentación del desenlace clínico principal. Investigar en ellos es útil para entender la fisiopatología de la enfermedad, aportar información importante sobre la eficacia de una intervención, caracterizar la dosis adecuada y el tiempo de exposición a un tratamiento necesario para un buen resultado, entre otros. Son la fuente principal de desenlaces sustitutos, aunque no todo desenlace intermedio es un adecuado sustituto (1).
Definición de desenlace sustituto
Erróneamente se considera un desenlace sustituto como ''lo mismo que o igual '', pero además de ser un error etimológico se presta para confusión en su interpretación. Según Wittes y colaboradores, la correcta definición del desenlace sustituto (surrogate endpoint) proviene de la raíz latina que significa ''elegir o poner en lugar de'' (3). En español existe el verbo subrogar (del latín subrogāre: 'Sustituir o poner a alguien o algo en lugar de otra persona o cosa'), por lo que se entendería el significado de su participio: ''subrogado''. No obstante, considerando la dudosa sonoridad del término y asumiendo el significado de la raíz latina original, el mejor término para nosotros puede ser ''desenlace sustituto''.
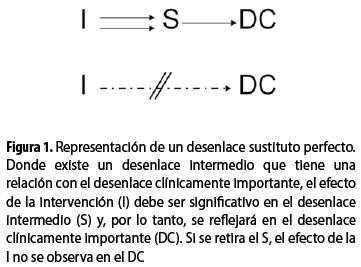
En un afán por promover la investigación, y por lo tanto la aprobación de nuevos medicamentos, la Food And Drug Administration de los Estados Unidos (FDA) acogió la siguiente definición de un desenlace sustituto: ''Es una medida de laboratorio o un signo físico que se usa en los ensayos clínicos como un sustituto para el desenlace clínicamente importante -que es la medida directa de cómo un paciente se siente, funciona o vive- y del cual se espera que prediga el efecto de la terapi'' (4). Mucho antes de esta definición ya se sugería una manera más objetiva para determinar cuándo un desenlace se puede considerar como sustituto, y se puede afirmar que la característica principal es su capacidad para capturar el total de la magnitud del efecto de una intervención en el desenlace clínicamente importante. Dicho efecto neto es, en esencia, el efecto agregado de todos los mecanismos de acción de la intervención (5). Para poder verificar este fenómeno se puede realizar una regresión logística, asumiendo que el desenlace principal es dicótomo, y evaluar de qué manera la inclusión del desenlace sustituto modifica el efecto estimado de la intervención en el desenlace principal. La proporción de cambio que ocurre en el efecto después de ingresar el desenlace sustituto al modelo se denomina la proporción del efecto del tratamiento explicado por el sustituto (figura 1) (6,7). Debe entenderse la esquematización necesaria, para efectos explicativos, del anterior modelo para no hacer interpretaciones erróneas (8). Por ejemplo, considerar proporciones elevadas del efecto del tratamiento explicadas por el sustituto como una relación única y lineal entre la intervención y el desenlace clínicamente importante, cuando en realidad este fenómeno se puede explicar por otras causas (figura 2) (9).
¿Qué justifica usar un desenlace sustituto?
La justificación clásica para usar los desenlaces sustitutos se presenta cuando el investigador se enfrenta a problemas médicos con desenlaces poco comunes, que se miden generalmente como variables dicótomas, y en los que para encontrar diferencias entre los grupos de exposición y control son necesarios un gran tamaño de muestra y/o un seguimiento largo y costoso -por ejemplo, la realización de pruebas diagnósticas periódicas para detectar el desenlace- (10). Una función importante de los desenlaces sustitutos es también la información que pueden brindar sobre el efecto biológico de una intervención y acerca de la misma fisiopatología de una enfermedad. Por estas razones, se usan comúnmente en ensayos piloto en los que se quiere evaluar una terapia potencial en una población de estudio pequeña, antes de acometer una investigación con mayor tamaño de muestra que demande gran cantidad de recursos o incluso que no sea éticamente correcta (11).
En los EC es frecuente que los investigadores intenten encontrar la relación del tratamiento con otros eventos biológicos o biomarcadores, bien sea porque existe una base lógica desde el punto de vista de la fisiopatología o simplemente porque se cree de forma intuitiva que pueda existir un efecto positivo de la intervención. Aunque muchas veces es recomendable usar varias medidas de desenlace, otros autores le apuestan a la realización de EC grandes enfocados a un número pequeño de desenlaces simples pero de impacto clínico indudable (12). Además, si se incrementa el número de medidas para comparar, aumentaría la probabilidad de encontrar una asociación estadística por causa únicamente del azar (13).
Características de un desenlace sustituto
La imprecisión o la vaguedad de las definiciones antes propuestas explican la alta exigencia a la que debe ser sometido un desenlace para ser considerado como sustituto. En términos generales, se pueden extractar las siguientes características que debería tener una variable para cumplir la condición de desenlace sustituto (14):
Fácil de evaluar: debe ser una variable con una frecuencia alta de presentación y de medida continua o discreta. Ser fácil de evaluar también implica que sea fácil de monitorizar, y aunque esta última característica puede que no afecte su validez sí le da puntos extras a su efectividad.
Relación con el desenlace clínicamente importante: esta relación debe ser tanto cuantitativa como cualitativa, debe existir una prueba de relación causal o el desenlace sustituto debe ser acompañante del desenlace clínicamente relevante. La mayoría de los sustitutos se eligen porque se encuentran en el ''camino'' del desarrollo del desenlace clínico, así no tengan que ver fisiopatológicamente con todo el proceso. No obstante, no todo lo que está en el proceso fisiopatológico del desenlace corresponde necesariamente a un buen sustituto (14). Por esto, más que una covariable o un elemento que expresa exposición, el desenlace sustituto debe ser un verdadero predictor de enfermedad.
Homogeneidad de la respuesta: el impacto logrado con una intervención debería ser igual al alcanzado con otras intervenciones del mismo tipo. Por ejemplo, si el desenlace sustituto es el valor de presión arterial media no debería existir diferencia entre la solución de Hartman o la solución salina normal para causar cambios en dicha presión. Si hay alguna diferencia, el efecto general de la intervención se pudiera explicar por sus efectos particulares en otros desenlaces o por otro mecanismo de acción diferente en el desenlace clínicamente importante. La única diferencia potencial solo debería existir entre los efectos adversos de las intervenciones.
Concordancia y efecto paralelo: el valor o la magnitud estimada del beneficio clínico esperado de la intervención, debe a su vez derivarse del valor estimado del efecto del sustituto en el desenlace final (15). Este concepto adiciona el obstáculo de cuantificar exactamente la magnitud de un cambio. También sería ideal que existieran cambios paralelos entre el efecto causado al sustituto y el efecto observado en el desenlace clínicamente importante, situación en la que se podría estimar el verdadero beneficio clínico. Una vez comprobado el efecto de la intervención en el sustituto, es necesario determinar qué tanto se traslada dicho cambio al desenlace clínico. Esta diferencia puede ser de tal magnitud que para poder comprobarla podrían requerirse estudios con tamaño de muestra varias veces más grande que el utilizado para evaluar el efecto inicial de la intervención en el sustituto. El problema es que una vez establecida verazmente la relación entre el efecto y el sustituto, aún existe la dificultad de que dicha relación sea desproporcionada con respecto al desenlace principal (figura 2).
Para ejemplificar lo anterior, vamos a usar un estudio en el que se intentaba aplicar un modelo analítico simulado para estimar el grado de efecto que se traslada de un desenlace sustituto a uno clínicamente importante (16). Se sabe que está indicado el uso de la terapia anticoagulante (intervención) para la prevención de eventos cardioembólicos (desenlace principal) en pacientes con fibrilación auricular. Uno de los grandes obstáculos de esta intervención es que más allá del simple uso de un medicamento también se debe lograr un rango de anticoagulación adecuado para evitar tanto los desenlaces principales como los eventos adversos, con el sangrado mayor como el evento adverso más importante relacionado con esta terapia. Bajo esta premisa se diseñó un modelo de simulación de Monte Carlo, basado en los resultados de siete EC y un metaanálisis, para estimar en qué magnitud los cambios en el porcentaje de tiempo de anticoagulación en rango adecuado (desenlace sustituto) se traducen en cambios en las tasas de eventos tromboembólicos o hemorrágicos (desenlaces principales) (16). Se encontró un efecto importante de la terapia anticoagulante en el desenlace sustituto (incremento promedio en el porcentaje de tiempo de anticoagulación en el rango terapéutico de 8,4%), pero con mínimo efecto al traducirlo a la disminución de eventos clínicamente importantes (disminución promedio de 0,66% por año) y además sin alcanzar significado estadístico.
Cómo evaluar la asociación entre el desenlace sustituto y el clínicamente importante
La primera pregunta que se debe hacer al evaluar un marcador como desenlace potencialmente sustituto es: ¿Cuál es la relación entre el cambio del marcador o marcadores y el cambio en el riesgo natural de presentar el desenlace principal? Con el objetivo de predecir cuál sería el efecto de un tratamiento en un desenlace clínico, basados en el efecto causado en un desenlace sustituto, varios investigadores han intentado construir modelos matemáticos (6,17). Aunque dichos modelos se pueden aplicar en estudios individuales, la mayoría de las veces se requiere hacer revisiones sistemáticas y metaanálisis debido a que no se conoce la fiabilidad de las propiedades estadísticas de los estimados y el tamaño de la muestra en un solo estudio generalmente no es el adecuado para predecir el efecto (11,18). Además, cualquier modelo de estimación es aún más difícil de llevar a cabo cuando se usan variables de medición compleja (9,17). El ejemplo más sencillo de este método es la realización de una regresión simple como la ilustrada en la figura 1. El problema, como se mencionó anteriormente, es que una proporción grande del efecto explicada por el desenlace sustituto no necesariamente permite afirmar que este sea un paso único del tratamiento al efecto (figura 2) (11).
Implicaciones de usar desenlaces sustitutos
En el trascurso de la introducción de un nuevo tratamiento, generalmente en estudios de fase II, se pueden descartar aquellas intervenciones que no serían éticamente adecuadas o que son de alto costo para evaluar en un EC de fase III. Estos estudios ''piloto'' también permiten entender la fisiopatología del problema clínico y pueden ser una buena forma de reflejar la relación intervención-efecto. Una de las características más importantes de los desenlaces sustitutos es que permiten una evaluación más frecuente en la práctica clínica y, por lo tanto, mejoran la oportunidad de tener un tiempo prudente para realizar intervenciones antes de la presentación del desenlace principal. Para el investigador interesado en el desarrollo de nuevos tratamientos las ventajas serían: estudios más cortos y más baratos, con menos pacientes y menos pérdidas y probablemente con menos variables de confusión.
Aun conociendo las características descritas de los desenlaces sustitutos, se han cometido múltiples errores tanto en la práctica clínica como en la investigación. El principal de ellos, por su gravedad, es la anticipación errónea de una equivalencia inexistente entre el beneficio en el desenlace sustituto y el beneficio en el desenlace clínico, en varias ocasiones favoreciendo incluso la presentación de eventos adversos y aun la muerte. Esto comúnmente ocurre en los estudios que solo evalúan desenlaces.
Una condición inherente a los desenlaces sustitutos, que se debe tener en cuenta en el seguimiento de una terapia, es que el tiempo en el que los estudios monitorizan los efectos adversos cuando se evalúan los cambios en un desenlace sustituto no brinda suficiente información acerca de la seguridad de la terapia (19). La mayoría de las veces solo se detectan aquellos efectos idiosincrásicos de la intervención, los cuales incluso no son reportados o se les da la explicación de ser eventos aleatorios o involucrados dentro de la misma fisiopatología de la enfermedad. También es reiterativo el error de no considerar las causas de muerte no atribuidas a la enfermedad en estudio, dejando la responsabilidad de detectarlas en los EC grandes o peor aún en el seguimiento durante su uso en el mercado (estudios fase IV) (20,21). Por esto es válida la frase ''No hay sustituto para la seguridad'' (14).
El desenlace sustituto solo es importante si está asociado claramente con el desenlace clínico, y en muchos casos son necesarios varios desenlaces sustitutos para poder determinar precisamente el efecto (6,7,11). Es muy difícil poder basar una terapia en resultados de estudios con desenlaces sustitutos, debido a que en gran medida deja al clínico la tarea de trasladar intuitivamente el efecto al desenlace principal. (11,22,23).
Guía para el lector de estudios con desenlaces sustitutos Debido al uso frecuente de desenlaces sustitutos en la investigación clínica y en la literatura biomédica, es importante contar con un método sencillo y estandarizado para poder evaluar críticamente este tipo de publicaciones. A continuación se resaltan brevemente los puntos de evaluación propuestos por el grupo de medicina basada en la evidencia para analizar los artículos que proponen tratamientos que modifican un desenlace sustituto (24).
A. Evaluación de la validez de los resultados:
1. ¿Existe una asociación fuerte, independiente y consistente entre el desenlace sustituto y el principal?
En principio, debe existir plausibilidad biológica para la relación entre desenlace principal y desenlace sustituto, y al menos dos estudios observacionales deberían permitir estimar y cuantificar una asociación causal. Esta asociación no solo debiera ser consistente, es decir, repetible entre varios estudios, sino también independiente al ajustarse por otros factores que pueden determinar el desenlace principal. Por ejemplo, es clara y consistente la asociación entre niveles de colesterol total y enfermedad coronaria, o entre valores de carga viral en infección por virus de inmunodeficiencia humana (VIH) y desarrollo de síndrome de inmunodeficiencia adquirida (sida).
2. ¿Hay evidencia en estudios con asignación aleatoria en otros tipos de intervenciones o con otras clases de medicamentos, de que al impactar sobre el desenlace sustituto se produzca de manera consistente alguna modificación del desenlace principal?
Es frecuente encontrar diferencias significativas en los resultados entre estudios donde intentan impactar un desenlace sustituto por medio de diferentes estrategias terapéuticas. Es importante que el lector tenga el conocimiento suficiente sobre la existencia de resultados inconsistentes en estudios previos, y saber de este modo si no existe la certeza sobre la relación entre el cambio en el desenlace sustituto y el principal. Por ejemplo, el recuento de linfocitos T CD4+ es un desenlace sustituto validado en varios ensayos clínicos; y muy diversas clases de medicamentos antirretrovirales han confirmado ejercer un efecto benéfico reflejado inicialmente en el aumento de estos linfocitos y posteriormente en el retardo en la progresión a sida o muerte.
3. ¿Hay evidencia en estudios con asignación aleatoria sobre el mismo tipo de intervención o la misma clase de medicamentos, que demuestre un cambio en el desenlace sustituto compatible con un cambio en el desenlace principal?
El lector debe considerar que pueden existir diferencias entre intervenciones que se consideran aparentemente del mismo tipo. Las intervenciones pueden ser similares al impactar el desenlace sustituto, pero diferir sustancialmente en otras características como blanco molecular, modo de administración o efectos secundarios y, por lo tanto, causar un efecto en el desenlace principal no relacionado con el desenlace sustituto. Las intervenciones o medicamentos de un mismo tipo farmacológico que ya ha sido probado previamente pueden ofrecer más ventajas y tranquilidad en el momento de evaluar su desempeño. Por ejemplo, los beta-bloqueadores tienen un efecto definido en la reducción de la presión arterial y las estatinas, en la reducción del colesterol; por lo tanto, un nuevo medicamento de cualquiera de estos grupos farmacológicos, con eficacia establecida en los desenlaces sustitutos y en los principales puede ser considerado con mayor confianza en términos terapéuticos.
B. Evaluación de los resultados:
4. ¿Cuáles son la magnitud, la precisión y la duración del efecto de la intervención?
Se debe establecer claramente la medida de asociación, relativa o absoluta, entre la intervención y el desenlace sustituto; y esta asociación debe presentarse con su respectivo intervalo de confianza del 95%. Tanto la magnitud de dicha medida de asociación como su precisión, al igual que la duración demostrada del cambio en el desenlace sustituto, son elementos necesarios para juzgar la importancia y la utilidad del medicamento.
5. ¿Me ayudarán los resultados a tratar a mi paciente?
Al igual que se hace con los estudios clínicos que evalúan efectos de tratamientos sobre desenlaces principales, si se cree que con la terapia evaluada se pueden obtener resultados benéficos, el grupo de pacientes en quienes se piensa utilizar la intervención debe ser similar al de los pacientes que participaron en el estudio.
6. ¿Superan los beneficios de la intervención los riesgos potenciales y los costos?
Después de determinar la validez del estudio, la decisión más difícil para el lector es tomar una conducta o una decisión clínica basado únicamente en los resultados de una investigación con un desenlace sustituto. Si bien puede ser polémico, y debe considerarse con mucha precaución, la forma recomendada por la guía es tratar de extrapolar los resultados sobre la base de otros estudios con intervenciones similares que consideren tanto el sustituto como el principal.
CONCLUSIONES
En la literatura médica actual es cada vez más frecuente encontrar la utilización de desenlaces sustitutos, y también se concede un mayor grado de recomendación hacia intervenciones basadas en ellos. Esto justifica conocer su naturaleza, las propuestas para una correcta evaluación y las características que permiten aceptarlos como adecuados. Como siempre, el juicio médico humano y racional para la mejor conducta con los pacientes debe estar orientado por la evaluación crítica de los resultados de investigación y por su utilidad final en la práctica clínica.
REFERENCIAS BIBLIOGRÁFICAS
1. Hulley S, Cummings SR, Browner WS, Grady DG, Newman TB. Designing clinical research. 3rd ed. Philadelphia: Lippincott Williams & Wilkins; 2007. [ Links ]
2. Lassere M, Johnson K, Boers M, Tugwell P, Brooks P, Simon L, et al. Definitions and validation criteria for biomarkers and surrogate endpoints: development and testing of a quantitative hierarchical levels of evidence schema. J Rheumatol. 2007;34(3):607–15. [ Links ]
3. Wittes J, Lakatos E, Probstfield J. Surrogate endpoints in clinical trials: cardiovascular diseases. Stat Med. 1989;8(4):415–25. [ Links ]
4. Temple R. Are surrogate markers adequate to assess cardiovascular disease drugs? JAMA. 1999;282(8):790–5. [ Links ]
5. Prentice R. Surrogate endpoints in clinical trials: definition and operational criteria. Stat Med. 1989;8(4):431–40. [ Links ]
6. Freedman L, Schatzkin A, Schiffman M. Statistical validation of intermediate markers of precancer for use as endpoints in chemoprevention trials. J Cell Biochem Suppl. 1992;16G:27–32. [ Links ]
7. Lin D, Fleming T, De Gruttola V. Estimating the proportion of treatment effect explained by a surrogate marker. Stat Med. 1997;16(13):1515–7. [ Links ]
8. De Gruttola V, Fleming T, Lin D, Coombs R. Perspective: validating surrogate markers--are we being naive? J Infect Dis. 1997;175(2):237–46. [ Links ]
9. De Gruttola V, Clax P, DeMets D, Downing G, Ellenberg S, Friedman L, et al. Considerations in the evaluation of surrogate endpoints in clinical trials. summary of a National Institutes of Health workshop. Control Clin Trials. 2001;22(5):485–502. [ Links ]
10. Ellenberg S, Hamilton J. Surrogate endpoints in clinical trials: cancer. Stat Med. 1989;8(4):405–13. [ Links ]
11. Fleming T, DeMets D. Surrogate end points in clinical trials: are we being misled? Ann Intern Med. 1996;125(1):605–13. [ Links ]
12. Peto R, Collins R, Gray R. Large-scale randomized evidence: large, simple trials and overviews of trials. J Clin Epidemiol. 1995;48(1):23–40. [ Links ]
13. Roland M, Torgerson D. Understanding controlled trials: what outcomes should be measured? BMJ. 1998;317(7165):1075. [ Links ]
14. Lonn E. The use of surrogate endpoints in clinical trials: focus on clinical trials in cardiovascular diseases. Pharmacoepidemiol Drug Saf. 2001;10(6):497–508. [ Links ]
15. Boissel J, Collet J, Moleur P, Haugh M. Surrogate endpoints: a basis for a rational approach. Eur J Clin Pharmacol. 1992;43(3):235–44. [ Links ]
16. van Walraven C, Oake N, Coyle D, Taljaard M, Forster A. Changes in surrogate outcomes can be translated into clinical outcomes using a Monte Carlo model. J Clin Epidemiol. 2009;62(12):1306–16. [ Links ]
17. Daniels M, Hughes M. Meta-analysis for the evaluation of potential surrogate markers. Stat Med. 1997;16(17):1965–82. [ Links ]
18. Buyse M, Molenberghs G, Burzykowski T, Renard D, Geys H. The validation of surrogate endpoints in meta-analyses of randomized experiments. Biostatistics. 2000;1(1):49–67. [ Links ]
19. Anand I, Florea V, Fisher L. Surrogate end points in heart failure. J Am Coll Cardiol. 2002;39(9):1414–21. [ Links ]
20. Califf R, Harrington R, Blazing M. Premature release of data from clinical trials of ezetimibe. N Engl J Med. 2009;361(7):712–7. [ Links ]
21. Echt DS, Liebson PR, Mitchell LB, Peters RW, Obias- Manno D, Barker AH, et al. Mortality and morbidity in patients receiving encainide, flecainide, or placebo. The Cardiac Arrhythmia Suppression Trial. N Engl J Med. 1991 Mar 21;324(12):781–8. [ Links ]
22. D'Agostino RJ. Debate: The slippery slope of surrogate outcomes. Curr Control Trials Cardiovasc Med. 2000;1(2):76–9. [ Links ]
23. Grimes D, Schulz K. Surrogate end points in clinical research: hazardous to your health. Obstet Gynecol. 2005;105(5 pt 1):1114–8. [ Links ]
24. Bucher H, Guyatt G, Cook D, Holbrook A, McAlister F. Users' guides to the medical literature: XIX. Applying clinical trial results. A. How to use an article measuring the effect of an intervention on surrogate end points. Evidence-Based Medicine Working Group. JAMA. 1999;282(8):771–8. [ Links ]