Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.25 no.4 Medellín Oct./Dec. 2012
INVESTIGACIÓN ORIGINAL
Tratamiento de la enfermedad arterial periférica de las extremidades inferiores con células mononucleares de médula ósea autólogas: reporte de seguimiento a un año
Experience of autologous bone marrow mononuclear cells implantation as a treatment in patients with peripheral arterial disease: one year follow-up
Luz Marina Restrepo Múnera1; Nathalie Hernández Cárdenas2; Julieta Henao Pérez3; Luis Gerardo Cadavid Velásquez4; Sergio Jaramillo Velásquez5; Daniel Camilo Aguirre Acevedo6
1 Profesora titular, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. grupoittc@yahoo.es
2 Médica internista, Clínica CES, Clínica Cardiovascular Santa María y Clínica el Rosario, Medellín, Colombia.
3 Investigadora asociada al Grupo Ingeniería de Tejidos y Terapias Celulares (GITTC), Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
4 Jefe del Programa de Posgrado de Cirugía General, Universidad CES. Médico, Clínica Cardiovascular Santa María, Medellín, Colombia.
5 Jefe del Departamento de Laboratorio Clínico y de Patología, Hospital Pablo Tobón Uribe, Medellín, Colombia.
6 Docente, Universidad de Antioquia, Medellín, Colombia.
Recibido: septiembre 06 de 2011
Aceptado: diciembre 06 de 2011
RESUMEN
Introducción: las células mononucleares de la médula ósea son efectivas para el tratamiento de pacientes con enfermedad arterial periférica (EAP). Los factores de crecimiento que ellas sintetizan se usan para inducir angiogénesis.
Objetivo: establecer en Colombia la seguridad, factibilidad y resultado del tratamiento de la EAP utilizando células autólogas, para evitar su progreso a estadios más avanzados.
Métodos: previo consentimiento, se hizo aspirado de médula ósea bajo anestesia local. Las células obtenidas se concentraron y se inyectaron intramuscularmente en los gastrocnemios de las extremidades isquémicas. El grupo control retrospectivo no recibió células. La evaluación clínica incluyó varios parámetros. Las células se analizaron por citometría de flujo.
Resultados: edad media de los pacientes: 69 ± 11 años; viabilidad celular: 99,15% ± 0,76%; número de células inyectadas: 9,2 x 108 ± 6,2 x 108. Los análisis angiográficos postratamiento mostraron formación de vasos colaterales nuevos en las extremidades afectadas, con mínimo engrosamiento. Se observaron aumento en la distancia caminada libre de dolor y mejoría del dolor en reposo. La obtención y aplicación de las células no se asoció con ninguna complicación.
Conclusiones: este estudio preliminar demostró que la terapia celular autóloga es segura, factible y cambia positivamente la historia natural de la EAP. Se sugiere el estudio de un número mayor de pacientes antes de establecer este tratamiento en Colombia.
PALABRAS CLAVE
Enfermedad Arterial Periférica, Médula Ósea, Neovascularización, Terapia Tisular
SUMMARY
Introduction: Autologous bone marrow mononuclear cells have been shown to be safe and effective for treatment of patients with peripheral arterial disease (PAD). Angiogenesis can also be induced by growth factors synthesized by them.
Objective: To determine in Colombia the feasibility, safety and outcome of the afore-mentioned treatment.
Methods: After informed consent, bone marrow was obtained by aspiration under local anesthesia; mononuclear cells were concentrated and their number and viability were established. They were suspended in saline solution and implanted by intramuscular injection into the gastrocnemius muscles of ischemic legs. Control patients were left untreated. Clinical evaluation included several parameters. Flow cytometry was used for cell analysis.
Results: Mean age of patients: 69 ± 11 years; cell viability: 99.15 ± 0.76%; total number of injected cells: 9.2 x 108 ± 6.2 x 108. After treatment, angiographic studies showed the formation of new collateral vessels in all patients, with minimal thickness increase. There were no complications from bone marrow aspiration and intramuscular administration of cells. All treated patients experienced increase in the walking distance and improvement of rest pain.
Conclusions: These preliminary results demonstrate that autologous cell therapy is safe, feasible and positively changes the natural history of patients with advanced peripheral arterial disease. In order to establish this treatment as a current practice in Colombia, we suggest the study of a larger number of patients.
KEY WORDS
Bone Marrow, Neovascularization, Peripheral Arterial Disease, Tissue Therapy
INTRODUCCIÓN
La enfermedad arterial periférica (EAP) incluye diferentes síndromes arteriales no coronarios causados por alteraciones estructurales y funcionales de las arterias que irrigan el cerebro, los órganos viscerales y las extremidades inferiores; su principal causa es la aterosclerosis, pero puede ser ocasionada por otras lesiones como la arteritis, aneurismas y eventos tromboembólicos. Se considera que la EAP es un factor predictor de riesgo coronario y cerebrovascular (1-3), su prevalencia es de 10% a 20% en personas mayores de 55 años y aumenta con la edad (1,4,5). Con respecto al sexo, esta enfermedad afecta por igual a hombres y mujeres, pero en edades avanzadas se ha demostrado predominio del sexo masculino (1). Su verdadera prevalencia permanece sin definir debido a que la mayoría de las personas afectadas son asintomáticas (5-7). La EAP de los miembros inferiores es un síndrome común que afecta a un porcentaje alto de la población adulta mundial, se asocia con disminución de la capacidad funcional y en muchos casos se hace necesaria la amputación de las extremidades inferiores aumentando así el riesgo de muerte (1). Sus signos y síntomas característicos son la disminución de los pulsos periféricos, ulceraciones por isquemia, gangrena, claudicación intermitente y dolor en reposo (3). La historia natural de esta enfermedad demuestra que en la mayoría de los pacientes (70%-80%) los síntomas no se agudizan alrededor de cinco años de haberse iniciado; en 10% a 20% la claudicación empeora y solamente en 1% a 2% se desarrolla isquemia crítica de los miembros inferiores (3).
Los factores de riesgo asociados con la EAP, similares a los de la enfermedad coronaria, incluyen: tabaquismo, diabetes, hiperhomocisteinemia, dislipidemia, hipertensión y aumento en los niveles de proteína C reactiva (3,8). De estos factores, el tabaquismo es el principal determinante del avance de la enfermedad (9). El manejo inicial del paciente con EAP es controlar los factores de riesgo que inducen su progresión y recurrir a enfoques terapéuticos como los siguientes: 1) utilización de fármacos antiplaquetarios, 2) procedimientos como la angioplastia transluminal percutánea y los stents y 3) tratamiento quirúrgico (3,10,11). Se calcula que entre 20% y 30% de los pacientes con isquemia crítica de miembros inferiores requieren la amputación como tratamiento definitivo de su enfermedad. La expectativa de vida dista mucho de ser esperanzadora: solo el 50% de estos pacientes sobreviven cinco años después del procedimiento quirúrgico (amputación por debajo de la rodilla) (12).
Es apremiante el desarrollo de nuevas estrategias de tratamiento para los pacientes que requieren amputación. Desde 1971 Folkman y colaboradores plantearon las bases para la utilización de la angiogénesis (crecimiento de nuevos vasos sanguíneos) como alternativa terapéutica (13).
Existen tres métodos para inducir la angiogénesis terapéutica: 1) administración de factores de crecimiento recombinantes, 2) incorporación de genes que codifican para estos factores y 3) trasplante de células madre (14- 17); este último es un tratamiento promisorio para la EAP, debido a que las células madre de la médula ósea adulta pueden diferenciarse hacia una amplia variedad de estirpes celulares incluidas las células endoteliales progenitoras o angioblastos (18). En modelos experimentales en animales se ha demostrado que estas células participan activamente en la generación de nuevos vasos (vasculogénesis y angiogénesis) en las extremidades o en el miocardio isquémico, favoreciendo la mejoría del flujo sanguíneo regional (19-21). Se han obtenido resultados similares en ensayos clínicos en pacientes que padecen EAP (22-27) en quienes se evidencia mejoría significativa en los siguientes parámetros: dolor en reposo, distancia caminada libre de dolor, índice tobillo brazo, incremento de la presión transcutánea de oxígeno, flujo sanguíneo regional, en algunos casos disminución del tamaño de úlceras y formación de nuevos vasos colaterales demostrada por estudios angiográficos (22,24,28,29). A diferencia de las células madre, los métodos de inducción de angiogénesis con factores de crecimiento producen liberación constante de los mismos, lo que puede conducir al desarrollo de angiogénesis patológica (30).
Aunque se carece de marcadores de superficie únicos para la caracterización precisa de las células endoteliales progenitoras, se usan con frecuencia para su identificación las moléculas de superficie CD34, CD133, el receptor del factor de crecimiento endotelial 2 y el dominio del receptor de quinasa (31,32).
La necesidad de implementar en Colombia alternativas terapéuticas diferentes para el tratamiento de pacientes con EAP de miembros inferiores en estadios avanzados (Fontaine IIb, III y IV), no revascularizables, nos llevó a la aplicación de células madre de médula ósea con el fin de promover la formación de vasos colaterales para evitar el avance de la enfermedad, mejorar la clase funcional y prevenir el riesgo de pérdida de la extremidad.
MATERIALES Y MÉTODOS
Tipo de estudio
Se llevó a cabo un estudio piloto, cuasi-experimental, no aleatorio con seguimiento médico durante 12 meses posteriores a la implantación en los miembros inferiores de células mononucleares de médula ósea autólogas. El estudio se hizo en dos grupos: 1) Intervención, que consistió en siete pacientes (12 extremidades) con diagnóstico de EAP de miembros inferiores, sin opción de tratamiento de revascularización quirúrgico o endovascular; 2) Control, que se conformó con 18 pacientes (24 extremidades), seleccionados mediante una evaluación retrospectiva de las historias clínicas de individuos que consultaron a la institución antes de la ejecución de este estudio. La selección se hizo teniendo en cuenta los mismos criterios de inclusión que para el grupo de intervención.
A los pacientes del grupo de intervención se les hicieron pletismografía y arteriografía previas a la intervención y a los seis meses de la terapia celular. Los del grupo control tuvieron los mismos estudios para el diagnóstico de su enfermedad.
Criterios de inclusión
- Diagnóstico de EAP de miembros inferiores no revascularizable con técnicas percutáneas o quirúrgicas, con clasificación Fontaine IIb, III o IV.
Criterios de exclusión
- Indicación de amputación inmediata como única medida de tratamiento por la presencia de gangrena.
- Antecedente de enfermedad neoplásica en los últimos cinco años o con tratamiento en curso.
- Diabéticos sin control estricto y con hemoglobina glicosilada mayor de 7 mg%.
Parámetros evaluados
En el grupo de intervención se evaluó antes y después del tratamiento lo siguiente:
- Cambios clínicos en el tamaño de la lesión isquémica y/o cierre de la úlcera, determinados mediante observación clínica.
- Distancia caminada libre de dolor: incluyó la medición del índice tobillo/brazo en reposo, así como las ondas de volumen del pulso en la pantorrilla. De forma subjetiva se evaluaron la distancia máxima caminada y la libre de dolor.
- Valoración del dolor isquémico de reposo: se evaluó el dolor presente sin que el paciente realizara ningún tipo de actividad física.
- Arteriografía: el sitio ideal de la punción fue la arteria femoral común (derecha o izquierda); se obtuvieron imágenes de la aorta abdominal, de la bifurcación aorto-ilíaca, de la bifurcación de la ilíaca común de cada lado y de la femoral común de cada extremidad. Posteriormente, se obtuvieron imágenes desde la porción proximal de las arterias femorales comunes hasta los arcos plantares, haciendo énfasis en las zonas donde se iba a hacer el implante celular. En todos los pacientes se conoció, antes de la arteriografía, el resultado de la creatinina y todos recibieron hidratación con solución salina normal, salvo otra indicación. Después del procedimiento los pacientes permanecieron en reposo en decúbito durante un período de cuatro a seis horas; finalmente fueron dados de alta luego de la evaluación médica. Las imágenes se guardaron en placas radiográficas y en sistema digital.
- Pletismografía: el protocolo incluyó la toma de las ondas de volumen del pulso en ambas extremidades (desde el muslo hasta el antepié), el registro doppler en la arteria femoral común y al menos en dos vasos distales a esta, y la medición de presiones segmentarias.
Obtención de células madre de médula ósea
La extracción de médula ósea se hizo en sala de cirugía de la Clínica Cardiovascular Santa María, bajo anestesia conductiva, mediante aspirado en la cresta ilíaca posterosuperior. El volumen de médula ósea extraído no sobrepasó un total de 15 mL/kg de peso. El procesamiento de la muestra se realizó en el laboratorio del Grupo Ingeniería de Tejidos y Terapias Celulares de la Universidad de Antioquia.
Separación de las células mononucleares de médula ósea
Para obtener las células mononucleares totales de médula ósea se suspendió el aspirado con solución salina al 0,9% y la suspensión se depositó en un gradiente de densidad (Ficoll-Biowhittaker). La fracción recuperada se resuspendió en solución salina y se entregó para el implante que se hizo el mismo día. Después de hacer la recuperación de las células por gradiente de densidad, se utilizó una fracción para análisis de marcadores celulares por citometría de flujo.
Citometría de flujo
Se determinó el número y el porcentaje de células CD34/CD45. El procedimiento de marcaje se efectuó bloqueando durante 15 minutos los receptores Fc con una solución de suero bovino fetal (SBF) al 2% en buffer de fosfato salino (PBS) suplementada con 0,1% de NaN3. Posteriormente las células fueron incubadas durante 30 minutos a temperatura ambiente con los anticuerpos para las moléculas CD34/CD45 (Immunotech, Marseille, Fr.), utilizando una concentración de 1 μg/1x106 células mononucleares de médula ósea. Finalmente las células se lavaron con 1 mL de la solución de PBS-SBF 2% -NaN3 0,1%.
La determinación de los marcadores se hizo contabilizando 20.000 eventos mediante el equipo de citometría FACSCalibur (BD Bioscience, Flow Cytometer System, San Jose, CA USA) en el Hospital Pablo Tobón Uribe. Para el análisis de los resultados se utilizó el progama WinmDi 2,8 (Windows Multiple Document Interfase 2,8, WinmDi Scripts Research Institute, La Jolla, CA, USA). Se tomaron las adquisiciones de los gráficos de puntos y se determinó el porcentaje total de cada marcador.
Implante de las células mononucleares de médula ósea
Las células se aplicaron inmediatamente después de la separación, mediante 30 inyecciones intramusculares a lo largo del gastrocnemio, a una profundidad de 1,5 cm, guiadas por una malla con agujeros de un 1 cm2.
Aspectos éticos
El proyecto y los procedimientos planteados en él fueron revisados y aprobados por el Comité de Bioética de la Clínica Cardiovascular Santa María. El proyecto se rigió por los principios establecidos mundialmente sobre la investigación con seres humanos (Declaración de Helsinki, 18ª Asamblea Médica Mundial, Finlandia, 1964, enmendada en la Asamblea Médica Mundial de Edimburgo año 2000) y por lo dispuesto en la Resolución número 008430 de 1993 del Ministerio de Salud de Colombia. Todos los pacientes del grupo de intervención firmaron el consentimiento informado.
Análisis estadístico
Se describieron las características demográficas y clínicas de cada uno de los grupos, utilizando la frecuencia y el porcentaje para las siguientes variables cualitativas: sexo, lado afectado, presencia de úlceras isquémicas, clasificación de Fontaine de las extremidades afectadas, presencia de factores de riesgo y tratamiento farmacológico; para las variables cuantitativas -edad y distancia caminada- se utilizaron la media y la desviación estándar. Al inicio del tratamiento se comparó el grupo de intervención con el grupo control utilizando la prueba chi cuadrado de Pearson o el test exacto de Fisher (frecuencias esperadas menores de 5) en cuanto al sexo, lado afectado, presencia de úlceras isquémicas, clasificación de Fontaine y dolor en reposo; para la edad y la distancia caminada libre de dolor después del tratamiento se utilizó la prueba t para muestras independientes verificando previamente el supuesto de homogeneidad de varianzas con la prueba F de Levene. Se utilizó como nivel de significación α=0,05. Todos los análisis estadísticos se realizaron con el EPIDAT 3,1.
RESULTADOS
El volumen promedio del aspirado de médula ósea fue de 652,9 ± 122,7 mL, del cual se obtuvo un promedio de células totales de 1,3 x 109 ± 1,2 x 109, con una viabilidad de 99,2% ± 0,8%. El número de células mononucleares de médula ósea recuperadas a partir del aspirado fue de 9,2 x 108 ± 6,2 x 108, aplicadas en los gastrocnemios en un volumen de 53,80 ± 13,31 mL. El número promedio de células CD34+ calculado de acuerdo con el peso de los pacientes fue de 2,0 x 106 ± 3,4 x 106/kg y la concentración de células CD34+ determinada por volumen fue de 303,0 ± 245,3/mL.
La aplicación intramuscular de las células mononucleares de médula ósea no se asoció con complicación alguna durante el procedimiento ni en el período posterior al tratamiento (12 meses).
Las características demográficas y clínicas de los grupos de intervención y control se describen en la tabla 1. No se observó diferencia estadísticamente significativa (p > 0,05) entre ambos grupos en cuanto al sexo, el lado afectado y la clasificación de Fontaine inicial (tabla 2).
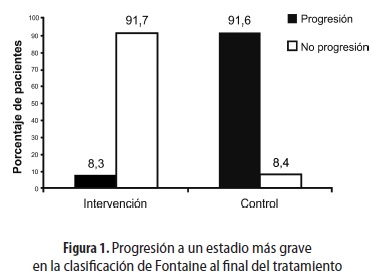
Como se observa en la figura 1, de los pacientes del grupo control 91,6% progresaron a estadios más graves de la enfermedad, a diferencia del grupo de intervención en el que solo 8,3% presentaron una clasificación de Fontaine más grave. En 91,7% de los pacientes intervenidos se observó mejoría o mantenimiento en la clasificación de Fontaine.
La comparación de los cambios en la clasificación de Fontaine al inicio y al final del tratamiento muestra una diferencia estadísticamente significativa (p ≤ 0,001) entre el grupo de intervención y el grupo control a los 12 meses después del tratamiento. Este resultado sugiere que el uso de las células mononucleares de médula ósea cambia el curso de la enfermedad, logrando mejoría de los síntomas en los pacientes intervenidos.
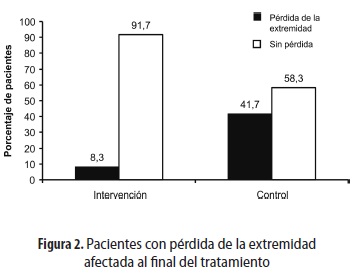
El grupo control presentó mayor número de pacientes con pérdida de la extremidad afectada (figura 2): hubo una diferencia estadísticamente significativa entre el grupo de intervención y el grupo control (test exacto de Fisher, p = 0,043).
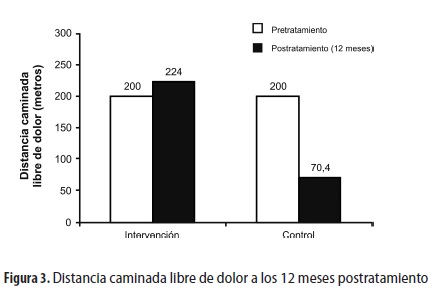
En todos los pacientes del grupo de intervención se observó ausencia de dolor en reposo y mayor distancia caminada libre de dolor después del tratamiento (figura 3). Se observó una diferencia estadísticamente significativa entre el grupo de intervención (224 ± 100 metros) y el grupo control (70,40 ± 59,28 metros) 12 meses después del tratamiento (t = 4,7; 23 gl p ≤ 0,001).
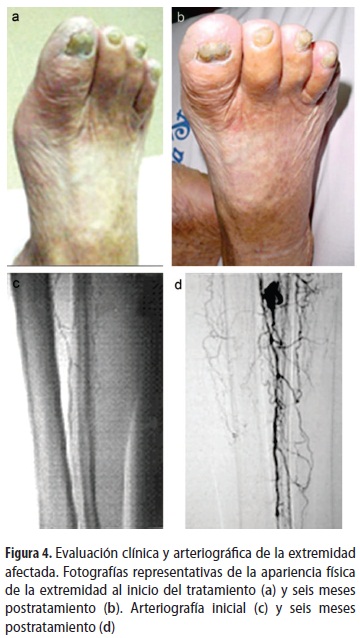
La evaluación clínica de las extremidades afectadas evidenció aumento de la temperatura y disminución de la palidez y de los cambios atróficos de la piel y faneras (figura 4 a-b). Los estudios pletismográficos a los cuatro y seis meses después del tratamiento no mostraron cambios en la morfología de las ondas de volumen o índice tobillo/brazo (datos no mostrados). En las angiografías del grupo de intervención se evidenció la formación de nuevos vasos colaterales a partir de las arterias afectadas, así como un incremento mínimo en el calibre de los vasos nativos (figura 4 c-d).
DISCUSIÓN
Los tratamientos médicos y quirúrgicos son las opciones para el manejo de la EAP. Sin embargo, en algunos pacientes la enfermedad progresa conduciendo finalmente a la pérdida de las extremidades afectadas (1,12,33). En la última década ha surgido la terapia celular como alternativa para pacientes en estadios avanzados de esta enfermedad (Fontaine III-IV) (21,28).
Las características demográficas de los individuos incluidos en este estudio estuvieron acordes con la epidemiología de la enfermedad: la mayoría de ellos se encontraban en la sexta década de la vida y no se presentó diferencia significativa con respecto al sexo.
En ambos grupos de estudio (de intervención y control) la clasificación de Fontaine más frecuente al inicio del tratamiento fueron los estadios IIb y III, con menor porcentaje de individuos en el estadio IV.
A los 12 meses después del tratamiento se demostró que en 66% de las extremidades afectadas del grupo de intervención se detuvo el progreso de la enfermedad y en el 34% restante se presentó mejoría de los signos y síntomas, reflejada en una clasificación de Fontaine menor comparada con su estadio inicial. En el grupo control 75% de las extremidades afectadas empeoraron y en 25% no hubo progresión de la enfermedad. En el grupo de intervención solo a un paciente clasificado inicialmente como Fontaine IIb se le amputó la extremidad, hecho atribuido probablemente a la falta de control de los factores de riesgo. Otros hallazgos significativos en los pacientes tratados con células mononucleares de médula ósea fueron: el cierre completo de las úlceras isquémicas en el transcurso de los seis meses posteriores al tratamiento y el incremento en la distancia caminada libre de dolor con respecto a la inicial del tratamiento.
La evaluación semiológica de las extremidades afectadas después de la terapia con las células mononucleares de médula ósea demostró mejoría en aspectos como temperatura, color y cambios atróficos de la piel; estos hallazgos concuerdan con los estudios arteriográficos, en los que se evidenció aumento del flujo sanguíneo regional y presencia de nuevos vasos. Resultados similares se han descrito en diferentes estudios en los que se han utilizado células mononucleares de médula ósea para el tratamiento de enfermedades isquémicas (28,34,35).
Se ha descrito que la isquemia es el principal factor que estimula la migración de las células madre hacia los tejidos lesionados, debido a que el ambiente hipóxico favorece la angiogénesis por la expresión del factor de transcripción HIF-1a, que participa en la inducción de la expresión de proteínas involucradas en la angiogénesis: el VEGF (vascular endothelial growth factor), la endotelina, la endoglina, la leptina y el TGF-b, y a su vez interviene en otros procesos como el mantenimiento de la homeostasis de los tejidos humanos, las reacciones inmunes y la producción de citocinas que favorecen la migración de las células mononucleares de médula ósea.
Se ha reportado que la inyección de las células mononucleares de médula ósea en tejidos isquémicos no induce la diferenciación a linajes como fibroblastos, osteoblastos y células miogénicas, como lo demuestra la ausencia de formación de hueso o fibrosis intersticial en las extremidades isquémicas (28); en cuanto al incremento de capilares, se ha atribuido a que la hipoxia favorece primordialmente la expresión de factores que promueven la angiogénesis.
Los hallazgos preliminares de este estudio indican que la aplicación de las células mononucleares de médula ósea en estadios avanzados de la EAP, con clasificación Fontaine IIb, III y IV, cambia el curso de la enfermedad, logrando mejoría de los síntomas evidenciada por el cierre de las úlceras isquémicas, la mejoría del dolor en reposo y el aumento de la distancia caminada máxima y libre de dolor. Se demostró además, por métodos objetivos como la arteriografía, el aumento del flujo sanguíneo regional (angiogénesis o vasculogénesis). Este estudio piloto abre la posibilidad de considerar en Colombia esta estrategia terapéutica para pacientes cuya enfermedad no sea susceptible de tratamiento por medios quirúrgicos o endovasculares.
AGRADECIMIENTOS
Los autores agradecen a la doctora Marta Ligia Arango por la revisión y comentarios al manuscrito. A los pacientes por aceptar participar en el estudio. A las instituciones por la financiación del mismo.
Declaración de conflictos de intereses: en este trabajo no hay conflictos de interés por parte de las instituciones ni de los autores.
REFERENCIAS BIBLIOGRÁFICAS
1. Hirsch AT, Haskal ZJ, Hertzer NR, Bakal CW, Creager MA, Halperin JL, et al. ACC/AHA 2005 Practice Guidelines for the management of patients with peripheral arterial disease (lower extremity, renal, mesenteric, and abdominal aortic): a collaborative report from the American Association for Vascular Surgery/Society for Vascular Sur. Circulation. 2006 Mar 21;113(11):e463–654. [ Links ]
2. Burns P, Gough S, Bradbury AW. Management of peripheral arterial disease in primary care. BMJ. 2003 Mar 15;326(7389):584–8. [ Links ]
3. Hirsch AT, Haskal ZJ, Hertzer NR, Bakal CW, Creager MA, Halperin JL, et al. ACC/AHA 2005 guidelines for the management of patients with peripheral arterial disease (lower extremity, renal, mesenteric, and abdominal aortic): executive summary a collaborative report from the American Association for Vascular Surgery/Society for Vas. J Am Coll Cardiol. 2006 Mar 21;47(6):1239–312. [ Links ]
4. Muir RL. Peripheral arterial disease: Pathophysiology, risk factors, diagnosis, treatment, and prevention. J Vasc Nurs. 2009 Jun;27(2):26–30. [ Links ]
5. McDermott MM. The magnitude of the problem of peripheral arterial disease: epidemiology and clinical significance. Cleve Clin J Med. 2006 Oct;73 Suppl 4:S2–7. [ Links ]
6. Tomson J, Lip GYH. Peripheral arterial disease: a high risk - but neglected - disease population. BMC Cardiovasc Disord. 2005 Jan;5(1):15. [ Links ]
7. Hirsch AT, Criqui MH, Treat-Jacobson D, Regensteiner JG, Creager MA, Olin JW, et al. Peripheral arterial disease detection, awareness, and treatment in primary care. JAMA. 2001 Sep 19;286(11):1317–24. [ Links ]
8. Criqui MH. Peripheral arterial disease--epidemiological aspects. Vasc Med. 2001 Jan;6(3 Suppl):3–7. [ Links ]
9. Fish JH, Bartholomew JR. Cigarette smoking and cardiovascular disease. Curr Cardiovasc Risk Rep. 2007;(1):384–90. [ Links ]
10. Burns P, Gough S, Bradbury AW. Management of peripheral arterial disease in primary care. BMJ. 2003 Mar 15;326(7389):584–8. [ Links ]
11. Gey DC, Lesho EP, Manngold J. Management of peripheral arterial disease. Am Fam Physician. 2004 Feb 1;69(3):525–32. [ Links ]
12. Norgren L, Hiatt WR, Dormandy JA, Nehler MR, Harris KA, Fowkes FGR, et al. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II). Eur J Vasc Endovasc Surg. 2007 Jan;33 Suppl 1:S1–75. [ Links ]
13. Folkman J. Tumor angiogenesis: therapeutic implications. N Engl J Med. 1971 Nov 18;285(21):1182–6. [ Links ]
14. Bouïs D, Kusumanto Y, Meijer C, Mulder NH, Hospers GAP. A review on pro- and anti-angiogenic factors as targets of clinical intervention. Pharmacol Res. 2006 Feb;53(2):89–103. [ Links ]
15. Staudacher DL, Preis M, Lewis BS, Grossman PM, Flugelman MY. Cellular and molecular therapeutic modalities for arterial obstructive syndromes. Pharmacol Ther. 2006 Jan;109(1-2):263–73. [ Links ]
16. Eppler SM, Combs DL, Henry TD, Lopez JJ, Ellis SG, Yi J-H, et al. A target-mediated model to describe the pharmacokinetics and hemodynamic effects of recombinant human vascular endothelial growth factor in humans. Clin Pharmacol Ther. 2002 Jul;72(1):20–32. [ Links ]
17. Sun Q, Chen RR, Shen Y, Mooney DJ, Rajagopalan S, Grossman PM. Sustained vascular endothelial growth factor delivery enhances angiogenesis and perfusion in ischemic hind limb. Pharm Res. 2005 Jul;22(7):1110–6. [ Links ]
18. Burt R, Pearce W, Luo K, Oyama Y, Davidson C, Beohar N, et al. Hematopoietic stem cell transplantation for cardiac and peripheral vascular disease. Bone Marrow Transplant. 2003 Aug;32 Suppl 1: S29–31. [ Links ]
19. Napoli C, Williams-Ignarro S, de Nigris F, de Rosa G, Lerman LO, Farzati B, et al. Beneficial effects of concurrent autologous bone marrow cell therapy and metabolic intervention in ischemia-induced angiogenesis in the mouse hindlimb. Proc Natl Acad Sci U S A. 2005 Nov 22;102(47):17202–6. [ Links ]
20. Kamihata H, Matsubara H, Nishiue T, Fujiyama S, Tsutsumi Y, Ozono R, et al. Implantation of bone marrow mononuclear cells into ischemic myocardium enhances collateral perfusion and regional function via side supply of angioblasts, angiogenic ligands, and cytokines. Circulation. 2001 Aug 28;104(9): 1046–52. [ Links ]
21. Shintani S, Murohara T, Ikeda H, Ueno T, Honma T, Katoh A, et al. Mobilization of endothelial progenitor cells in patients with acute myocardial infarction. Circulation. 2001 Jun 12;103(23):2776–9. [ Links ]
22. Bartsch T, Brehm M, Zeus T, Strauer B-E. Autologous mononuclear stem cell transplantation in patients with peripheral occlusive arterial disease. J Cardiovasc Nurs. 2006;21(6):430–2. [ Links ]
23. Hernández P, Cortina L, Artaza H, Pol N, Lam RM, Dorticós E, et al. Autologous bone-marrow mononuclear cell implantation in patients with severe lower limb ischaemia: a comparison of using blood cell separator and Ficoll density gradient centrifugation. Atherosclerosis. 2007 Oct;194(2):e52–6. [ Links ]
24. Higashi Y, Kimura M, Hara K, Noma K, Jitsuiki D, Nakagawa K, et al. Autologous bone-marrow mononuclear cell implantation improves endotheliumdependent vasodilation in patients with limb ischemia. Circulation. 2004 Mar 16;109(10):1215–8. [ Links ]
25. Yamamoto K, Kondo T, Suzuki S, Izawa H, Kobayashi M, Emi N, et al. Molecular evaluation of endothelial progenitor cells in patients with ischemic limbs: therapeutic effect by stem cell transplantation. Arterioscler Thromb Vasc Bio. 2004 Dec;24(12):e192–6. [ Links ]
26. Werner N, Kosiol S, Schiegl T, Ahlers P, Walenta K, Link A, et al. Circulating endothelial progenitor cells and cardiovascular outcomes. N Engl J Med. 2005 Sep 8;353(10):999–1007. [ Links ]
27. Tateishi-Yuyama E, Matsubara H, Murohara T, Ikeda U, Shintani S, Masaki H, et al. Therapeutic angiogenesis for patients with limb ischaemia by autologous transplantation of bone-marrow cells: a pilot study and a randomised controlled trial. Lancet. 2002 Aug 10;360(9331):427–35. [ Links ]
28. Tateishi-Yuyama E, Matsubara H, Murohara T, Ikeda U, Shintani S, Masaki H, et al. Therapeutic angiogenesis for patients with limb ischaemia by autologous transplantation of bone-marrow cells: a pilot study and a randomised controlled trial. Lancet. 2002 Aug 10;360(9331):427–35. [ Links ]
29. Gu Y, Zhang J, Guo L, Qi L, Zhang S, Xu J, et al. Transplantation of autologous bone marrow mononuclear cells for patients with lower limb ischemia. Chin Med J (Engl). 2008 Jun 5;121(11):963–7. [ Links ]
30. Epstein SE, Kornowski R, Fuchs S, Dvorak HF. Angiogenesis therapy: amidst the hype, the neglected potential for serious side effects. Circulation. 2001 Jul 3;104(1):115–9. [ Links ]
31. Hristov M, Erl W, Weber PC. Endothelial progenitor cells: isolation and characterization. Trends Cardiovasc Med. 2003 Jul;13(5):201–6. [ Links ]
32. Brunt KR, Hall SRR, Ward CA, Melo LG. Endothelial progenitor cell and mesenchymal stem cell isolation, characterization, viral transduction. Methods Mol Med. 2007 Jan;139:197–210. [ Links ]
33. Mukherjee D, Cho L. Peripheral arterial disease: considerations in risks, diagnosis, and treatment. J Natl Med Assoc. 2009 Oct;101(10):999–1008. [ Links ]
34. Saigawa T, Kato K, Ozawa T, Toba K, Makiyama Y, Minagawa S, et al. Clinical application of bone marrow implantation in patients with arteriosclerosis obliterans, and the association between efficacy and the number of implanted bone marrow cells. Circ J. 2004 Dec;68(12):1189–93. [ Links ]
35. Soda T, Suzuki H, Iso Y, Kusuyama T, Omori Y, Sato T, et al. Bone marrow cells contribute to neointimal formation after stent implantation in swine. Int J Cardiol. 2007 Sep 14;121(1):44–52. [ Links ]