Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.25 no.4 Medellín Oct./Dec. 2012
ARTÍCULO DE REVISIÓN
Activación y regulación del inflamasoma NLRP3 en las enfermedades infecciosas
Activation and regulation of inflammasome NLRP3 in infectious diseases
Juan Carlos Hernández López1; Silvio Urcuqui Inchima2
1 Grupo Infettare, Universidad Cooperativa de Colombia, Medellín, Colombia. juankhernandez@gmail.com
2 Grupo Inmunovirología, Universidad de Antioquia, Medellín, Colombia.
Recibido: octubre 11 de 2011
Aceptado: enero 17 de 2012
RESUMEN
La inflamación es una respuesta inmune frente a los agentes infecciosos y las señales moleculares de peligro, de estrés celular o que son producto del daño tisular. Muchos receptores de la inmunidad innata participan en la respuesta inflamatoria e inducen la activación transcripcional para la producción de una gran cantidad de citocinas, quimiocinas y otros mediadores inflamatorios. Sin embargo, las citocinas de la familia IL-1β son excepcionales, porque no solo requieren la activación transcripcional, sino también un procesamiento proteolítico para generar las citocinas con actividad biológica. Este paso es la activación mediada por la caspasa-1, que a su vez es controlada por varios complejos multimoleculares citosólicos denominados inflamasomas. El inflamasoma NLRP3 puede ser activado por material agregado o cristalino (partículas) y por varios microorganismos o toxinas derivadas de estos; sin embargo, aún no se entienden completamente sus mecanismos de activación. La importancia de este complejo de señalización innata se manifiesta por la existencia de varios mecanismos que regulan la activación de NLRP3 a diferentes niveles. En este artículo se revisan dichos mecanismos.
PALABRAS CLAVE
Caspasa 1, Inflamasoma NLRP3, Interleucina-1beta
SUMMARY
Inflammation is an immune response to infectious agents and to signals that arise from host molecules in stress situations or after tissue damage. Many innate immune receptors take part in the inflammatory response and induce transcriptional activation leading to the production of a host of cytokines, chemokines and other inflammatory mediators. The IL-1β cytokines are exceptional in that they not only require transcriptional activation but also a proteolytic processing into biologically active cytokines. This activation step is mediated by caspase-1, which in turn is controlled by cytosolic multimolecular complexes named inflammasomes. The NLRP3 inflammasome responds to aggregated or crystalline material, as well as to microbes or pore-forming toxins, but activation mechanisms are not fully understood. The importance of this innate signaling complex is highlighted by the existence of several mechanisms that regulate NLRP3 activation at different levels. In this article we review such mechanisms.
KEY WORDS
Caspase 1, Inflammasome NLRP3, Interleukin-1beta
INTRODUCCIÓN
La inflamación es un proceso fisiológico del sistema inmune para el control de las infecciones y la posterior reparación de los tejidos. Sin embargo, alteraciones en los mecanismos implicados en la inducción de la inflamación se han asociado con fenómenos inmunopatológicos que alteran el desarrollo normal de muchas funciones vitales. Esto indica que el proceso inflamatorio es controlado y que el control incluye la participación de muchos actores, entre los que se encuentran los miembros de la familia IL-1, una serie de citocinas con diversas funciones, cuyo miembro más representativo es IL-1β. A diferencia de las demás citocinas, la producción de IL-1β requiere la maduración proteolítica promovida por complejos multiproteicos citoplasmáticos denominados inflamasomas (1).
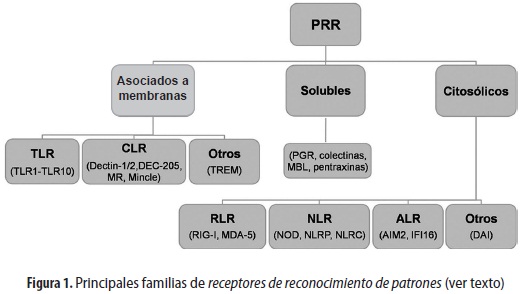
Los inflamasomas hacen parte de los componentes de la inmunidad innata, la cual no solo constituye la primera línea de defensa, sino que también promueve el desarrollo de la respuesta inmune adaptativa. La activación de la respuesta innata involucra una variedad de componentes celulares y solubles que reconocen diferentes patógenos y ejercen funciones efectoras ante ellos (2). Uno de los aspectos más interesantes de la inmunidad innata es su gran capacidad de reconocimiento, dada por una serie de proteínas conocidas como receptores de reconocimiento de patrones o PRR (pattern recognition receptors). Los PRR reconocen diferentes componentes estructurales esenciales para la supervivencia de los microorganismos, conocidos como patrones moleculares asociados a patógenos o PAMP (pathogen associated molecular patterns) (2-5); además, dependiendo de su ubicación, homología estructural y función, los PRR se clasifican según su expresión en membranas celulares (membrana plasmática o membranas endosomales), en el citosol o solubles (como PGR -peptidoglycan recognition proteins-, colectinas, MBL -mannan-binding lectin-, y pentraxinas). Los PRR mejor caracterizados son los TLR (por sus siglas del inglés tall-like receptors), de los cuales se han descrito 10 funcionales en seres humanos (TLR-1 a TLR-10). Los receptores de tipo lectina C (CLR) reconocen carbohidratos complejos presentes en bacterias, virus y hongos, e incluyen miembros como dectina-1 y dectina-2 (también conocidos como CLEC7A (C-type lectin domain family member A) y CLECF4N (C-type lectin domain family member N), respectivamente; DEC-205 (dendritic and epithelial cells, 205 kDa), MR (receptor de manosa) y Mincle. Los receptores citosólicos tipo ANA helicasa (RLR) incluyen los miembros RIG-I (retinoic acid-induced gene I) y MDA-5 (Melanoma differentiation-associated gene-5). Los receptores tipo NOD (NLR), reconocen una amplia variedad de componentes microbianos y productos endógenos que se liberan en respuesta a alteraciones celulares denominados DAMP (damage/ danger associated molecular patterns), e incluyen NOD1 y NOD2 (nucleotide-binding oligomerization domain-containing protein), los NLRP (nucleotidebinding oligomerization domain, leucine rich repeat and pyrin domain containing protein) y los NLRC (nucleotide-binding oligomerization domain, leucine rich repeat and CARD domain containing protein). Recientemente se ha ampliado la lista con nuevas moléculas que reconocen ácidos nucleicos en el citoplasma, cuyos miembros más representativos son IFI16 (IFN-γ-inducible protein Ifi16) y AIM-2 (absent in melanoma-2), que a la vez denomina esta familia como ARL (AIM2-like receptors). Existen además otros receptores que aún no se han clasificado en ninguna familia, como TREM (triggering receptor expressed on myeloid cells) y DAI (DNA-dependent activator of IFN-regulatory factors, también conocido como DLM-1/ZBP1), entre otros (figura 1).
NLR (NOD-like receptors) (nucleotide- binding oligomerization domain-containing protein)
Los NLR son receptores citosólicos que regulan la inflamación y la apoptosis. Estructuralmente están constituidos por tres posibles dominios en la región amino-terminal, responsables de mediar la transducción de la señal y/o la activación de caspasas inflamatorias, a través del inflamasoma. Las opciones son un dominio de reclutamiento y activación de caspasas (CARD, caspase activation and recruitment domain), un dominio pyrin (PYD), y un dominio IAP (inhibitor of apoptosis domain) de baculovirus (BIR, baculovirus inhibitor of apoptosis protein repeat). En la región central presentan un dominio de unión a nucléotidos, responsable de la oligomerización (NOD) dependiente de ATP, y en la región carboxiterminal contiene una secuencia repetitiva rica en leucinas (LRR, leucine rich region), mediante la cual se une a sus ligandos específicos. La familia de NLR está constituida por una gran variedad de miembros descritos en varias especies.
Inflamasoma NLRP3 y las citocinas de la famila IL-1
Las citocinas de la familia IL-1 son principalmente proinflamatorias y, además de la inducción de fiebre, promueven cambios vasculares y alteraciones en la presión y el flujo sanguíneo y favorecen la activación del endotelio (5). Pueden ser producidas por diferentes tipos celulares, incluyendo, entre otros, macrófagos, neutrófilos, células endoteliales, epiteliales y dendríticas (1, 6). Estas citocinas se expresan en el citoplasma como proformas biológicamente inactivas (1,6), y necesitan ser procesadas proteolíticamente por la cisteína-proteasa caspasa-1. Las caspasas participan en diferentes funciones celulares, y se clasifican en tres grupos: las iniciadoras, las verdugo y las inflamatorias, como es el caso de la caspasa-1 (7), que es producida como una proforma inactiva y requiere un paso de activación autocatalítica (8), dependiente del ensamblaje de los inflamasomas, el cual ocurre en respuesta a productos derivados de las infecciones microbianas y a señales exógenas y endógenas de peligro (7-9).
Hasta la fecha se han identificado cuatro inflamasomas (10); tres de ellos contienen proteínas de la familia NLR (NLRP1, NLRP3 y NLRC4), mientras que el cuarto corresponde a AIM-2, que pertenece a la familia de proteínas ALR (AIM-2-like receptors) y que contiene un dominio pyrin y un dominio HIN-200 (hematopoietic expression, interferon inducibility, nuclear localization), por lo que también se han denominado proteínas PYHIN (11-14). Recientemente se han propuesto dos nuevos inflamasomas, denominados NLRP6 y NLRP12, aunque su funcionalidad como tales aún requiere estudio (15-17).
Los cuatro inflamasomas requieren la proteína adaptadora ASC (apoptosis-associated speck-like protein containing a caspase recruitment domain), para reclutar y activar la caspasa-1. Es importante mencionar que la producción de las citocinas de la familia IL (como IL-1β e IL-18) requiere la activación, por lo menos, de uno de los cuatro inflamasomas mencionados. Sin embargo, se han reportado otros mecanismos menos frecuentes, como las serinaproteasas citosólicas de los neutrófilos (proteinasa 3), elastasa y catepsina-G, o las proteasas granzima-A y quimasa, derivadas de mastocitos, que también pueden promover la maduración de ambas citocinas (18-20).
El inflamasoma mejor caracterizado hasta la fecha es NLRP3, cuya activación induce cambios conformacionales que permiten el reclutamiento de la proteína adaptadora ASC, que a su vez interacciona con la procaspasa-1 inactiva, a través del dominio CARD, presente en ambas proteínas (figura 2). Finalmente, la caspasa-1 activada es la responsable de la maduración de pro-IL-1β y pro-IL-18, para obtener las formas biológicamente activas, IL-1β e IL- 18 (figura 2).
Para una activación eficiente del inflamasoma NLRP3, se requiere la activación de dos señales: la primera consiste en lo que se conoce como priming o señal preestimuladora, que ocurre cuando las células son activadas mediante un PRR o un receptor de citocinas, que active a NF-κB, necesario para inducir la expresión de NLPR3, pro-IL-1β y pro-IL-18 (21). Una vez activada la primera señal, se activa la segunda (específica del inflamasoma NLRP3), que lleva al ensamblaje de dicho inflamasoma. Esto puede ocurrir en respuesta a estímulos ocasionados por diversos productos derivados de infecciones virales (adenovirus, influenza virus), protozoos, hongos, bacterias y sus derivados, incluyendo toxinas, lipopolisacáridos (LPS) y ácidos nucleicos (5,21-28). También por señales endógenas de peligro como ATP, β-amiloide y cristales de urato monosódico u oxalato de calcio (22,29,30); también por estímulos químicos como asbesto, sílica y aluminio (utilizado como adyuvante en vacunas) (23,31) y por residuos de los procesos necróticos (32) (figura 2).
Se sabe muy poco acerca del mecanismo de activación del inflamasoma NLRP3 y del efecto particular de la segunda señal después de su inducción. Se han propuesto dos modelos: el primero sugiere que los activadores del inflamasoma NLRP3 inducen daño lisosomal, liberando proteasas como catepsinas B y L, ambas responsables de activar el inflamasoma NLRP3, en una forma dependiente de pH ácido (22,23,31). Esto se determinó en experimentos in vitro con inhibidores farmacológicos de la actividad proteolítica de la catepsina B (CA-074-metil éster) y la acidificación lisosomal (bafilomicina), en los cuales se demostró su necesidad para una inducción eficiente de la producción de IL-1β, en respuesta a la estimulación con activadores específicos del inflamasoma NLRP3 (31). El segundo modelo se basa en el hecho de que las especies reactivas de oxígeno (ROS), inducidas por muchos estímulos de diversa naturaleza química, podrían ser detectadas directa o indirectamente por el inflamasoma NLRP3 (24,28,32-36), en un proceso que involucra la proteína celular TXNIP (proteína de interacción con tiorredoxina) (36) (figura 2). Además, se ha reportado alteración del flujo de potasio y, por ende, modificación de su concentración intracelular, lo que es responsable de inducir la activación del inflamasoma NLRP3 (33-36).
Papel del inflamasoma en las enfermedades infecciosas
Como ya se mencionó, la activación del inflamasoma es crucial para la defensa del hospedero frente a los agentes patógenos; sin embargo, informes recientes resaltan su papel en la fisiopatología de diversas enfermedades, especialmente de aquellas con un componente inflamatorio, como diabetes tipo 2 y aterosclerosis (6,36-39). Además, se han descrito muchos síndromes autoinflamatorios, también conocidos como síndromes asociados a NLPR3, en los que la alteración en los mecanismos de regulación promueve una respuesta inflamatoria crónica y descontrolada (40,41). Lo interesante es que ese hallazgo tiene una conexión funcional con la producción de IL-1β, observación que se confirmó en pacientes tratados con antagonistas de esta interleucina, en los que disminuyeron los signos y síntomas de la enfermedad (42-44).
Con respecto a las enfermedades infecciosas, se ha observado que distintos agentes patógenos inducen la producción de IL-1β. Tal es el caso de la malaria, en la que la producción de esta interleucina se asocia con complicaciones clínicas y con el desarrollo de malaria cerebral (28), por lo cual se ha propuesto que la inhibición de la expresión de IL-1β puede ser una estrategia terapéutica para esta enfermedad (38,45).
Se ha descrito que el inflamasoma NLRP3 puede ser activado directamente por virus o por sus productos (46); por ejemplo, el virus de varicela-zóster (47), un miembro de la familia Herpesviridae, y la proteína de matriz del virus influenza (27,48). Además, la internalización de ADN de adenovirus induce la maduración de pro-IL-1b en macrófagos, en un proceso dependiente de NLRP3 y ASC (49,50). Recientemente se describió la activación del inflamasoma NLRP3 en respuesta a la infección por adenovirus tipo 5, lo que induce la liberación de la IL-1b (51,52); en este caso, los autores muestran que la proteína viral VI es la responsable de inducir la ruptura de la membrana del lisosoma durante la entrada del virus, lo que lleva a la liberación de la proteasa lisosomal catepsina B y de ROS. Igualmente, se ha demostrado que la infección por el virus influenza resulta en la activación del inflamasoma NLRP3 (27), proceso que es mediado por la proteína viral M2, tanto en células dendríticas como en macrófagos (48).
Además de los modelos virales, otros agentes infecciosos han sido asociados con la activación del inflamasoma, como mecanismo de patogénesis; tal es el caso de infecciones bacterianas como las ocasionadas por Aeromonas spp., (53) y Borrelia spp., (54) que inducen la expresión de IL-1β e IL-18 que a su vez regulan la expresión de IL-17 e IFN-γ, alterando el desarrollo de las respuestas inflamatoria y adaptativa, respectivamente. Bacterias intracelulares, como Salmonella typhimurium, Legionella pneumophila y Burkholderia thailandensis pueden ser detectadas por el inflamasoma NLRC4, el cual es activado por la flagelina (55). Chlamydia trachomatis, otra bacteria intracelular, responsable de infecciones en el tracto genital, induce la producción de IL-1β, a través del inflamasoma NLRP3; así proporciona las dos señales para su activación y causa daño tisular para facilitar su diseminación (56). Finalmente, se ha descrito que durante la infección por Listeria spp., se estimulan los inflamasomas NLRP1, NLRP3 y AIM-2 (57), lo que lleva a la producción de IL-1β.
Algunos parásitos también modulan la respuesta inflamatoria mediada por IL-1β. Helmintos, como Schistosoma mansoni, pueden disminuir la señalización a través de los TLR, disminuyendo la activación de la primera señal para el inflamasoma NLRP3 y, por ende, la producción de IL-1β (58). Es interesante que se describió recientemente la presencia de alelos de susceptibilidad a infecciones congénitas por Toxoplasma gondii, en el gen Nlrp1, lo que aumenta la respuesta inflamatoria y complica el cuadro clínico de la toxoplasmosis (59).
Inflamasoma NLRP3 y VIH-1
Existe muy poca evidencia que relacione el inflamasoma NLRP3 con el VIH-1, incluyendo la asociación entre polimorfismos presentes en el extremo 3' no codificante (3'UTR) de NLRP3, con la susceptibilidad a la infección por VIH-1 (60). El genoma del VIH-1 está constituido por dos moléculas de ARN, el cual, gracias a la acción de la transcriptasa reversa, se convierte en una molécula de cADN, generando activadores potenciales del inflamasoma NLRP3 (ARN y ADN), tal como se ha descrito para otros genomas virales (5,27,46,49).
VIH-1 puede ser reconocido por dos tipos de receptores de la inmunidad innata, los TLR (TLR7/8) y los RLR (receptores tipo ARN helicasa) (61,62); aunque varios reportes sugieren que el reconocimiento se puede dar por otros PRR, incluyendo TLR-2, TLR- 3, TLR-4, TLR-9, AIM-2, y algunos NLR (14,63,64), hipótesis que toma fuerza con las alteraciones en varios de estos PRR, observadas en el contexto de las infecciones virales, incluyendo VIH-1 (65-69). Las vías de señalización activadas mediante estos receptores inician una respuesta inflamatoria, con efectos antivirales, principalmente mediados por la producción de interferón tipo I, desde las etapas tempranas de la infección.
Durante la infección por VIH-1 se ha demostrado un aumento persistente en los niveles séricos de IL-1β e IL-18, que alteran el desarrollo normal de muchas funciones vitales, incluyendo la apoptosis, la proliferación y la diferenciación celulares (70- 72). Por ejemplo, recientemente se asoció la alta producción de estas citocinas con lesiones en el miocardio y enfermedad coronaria, en pacientes infectados por VIH-1 (73,74), ampliando el panorama inmunopatogénico de la infección por VIH-1. Sin embargo, no se han descrito el mecanismo de inducción de las citocinas de la familia IL-1 ni el proceso inflamatorio desencadenado, que podría estar asociado con la inmunopatogénesis de la infección por VIH-1, aunque se ha propuesto la participación del inflamasoma NLRP3 en dicho proceso (60). Resultados previos obtenidos en nuestro grupo han mostrado por primera vez que el VIH-1 (independientemente de su envoltura), activa la primera señal necesaria para la activación del inflamasoma NLRP3 en macrófagos humanos derivados de monocitos primarios, e induce la expresión de IL-1β, al estimular la señalización intracelular mediada por NF-kβ (datos sin publicar).
Regulación del inflamasoma NLRP3
Teniendo en cuenta el papel crítico del inflamasoma NLRP3 en el control de las infecciones y la detección del daño tisular estéril, es de esperar la existencia de múltiples mecanismos para la regulación de su actividad, con el fin de evitar enfermedades derivadas de su hiperactivación, pero dichos mecanismos han sido poco explorados. Entre ellos se incluye la regulación negativa mediada por la interacción con CD40L (expresado en los linfocitos T), para inactivar el inflamasoma NLRP3 en macrófagos (75). Por otra parte, se han informado varios mecanismos de inhibición de dicho inflamasoma mediados por microorganismos, que constituyen estrategias para evadir la respuesta inmune. Por ejemplo, la proteína YopK de Yersinia spp., (76), y la metaloproteasa ZMP1 (zinc metallo protease familiy member 1) expresada por Mycobacterium tuberculosis, que bloquea eficientemente la activación del inflamasoma NLRP3, como mecanismos para asegurar su supervivencia en el hospedero (77). Recientemente, se describió la proteína viral Orf63 del KSHV (Kaposi sarcoma herpesvirus), como un homólogo viral de NLRP1, que además bloquea la función de los inflamasomas NLRP1 y NLRP3, disminuyendo la respuesta inflamatoria y favoreciendo la reactivación viral (78).
Una modulación más directa del inflamasoma NLRP3 proviene de un grupo de genes descrito recientemente, cuyos productos contienen un dominio PYD (pyrin) o CARD y actúan como señuelos que impiden la interacción funcional de los componentes del inflamasoma NLRP3, convirtiéndose en supresores endógenos de su actividad (79-81). En este grupo se encuentran proteínas celulares como COP1 (CARD-only protein 1), Iceberg, INCA (inhibitory CARD) y caspasa-12, las cuales poseen dominios CARD; y las proteínas de la familia POP (PYD only proteins), las cuales poseen dominios PYD (79-82). Este modelo también ha sido adaptado por los microorganismos, y especialmente por los virus, los cuales pueden codificar para proteínas homólogas denominadas vPYD (viral PYDs), e incluyen proteínas expresadas por varios poxvirus (83-85). Otro nivel de regulación del inflamasoma NLRP3 es la inhibición de la caspasa-1, incluyendo factores celulares como Flightless-I (86) y el inhibidor de proteasa 9 (Pi9) (87,88); y proteínas virales como CrmA (Cowpox cytokine response modifier A) y p35 (baculovirus) (89, 90). Finalmente, los inhibidores de IL-1β, incluyendo el antagonista del receptor de IL-1 (IL-1RA) y los receptores solubles (6,91).
El amplio rango de proteínas que participan en la regulación del inflamasoma NLRP3 a diferentes niveles, resalta la importancia de mantener esta plataforma molecular estrictamente controlada y demuestra que los microorganismos han desarrollado estrategias eficientes para evadir la detección inmune mediada por los inflamasomas.
AGRADECIMIENTOS
Los autores agradecen a la doctora Gloria Vásquez por la lectura del manuscrito y sus aportes para el mejoramiento del mismo.
Declaración de conflictos de intereses
Los autores manifiestan no incurrir en ningún conflicto de interés mediante la realización de este trabajo.
Fuentes de financiación
Este trabajo fue financiado por Colciencias a través del proyecto No. 111549326099
REFERENCIAS BIBLIOGRÁFICAS
1. Dinarello CA. IL-1: discoveries, controversies and future directions. Eur J Immunol. 2010 Mar;40(3): 599–606. [ Links ]
2. Mortensen ES, Fenton KA, Rekvig OP. Lupus nephritis: the central role of nucleosomes revealed. Am J Pathol. 2008 Feb;172(2):275–83. [ Links ]
3. Medzhitov R, Preston-Hurlburt P, Janeway CA. A human homologue of the Drosophila Toll protein signals activation of adaptive immunity. Nature. 1997 Jul 24;388(6640):394–7. [ Links ]
4. Takeda K, Akira S. Toll-like receptors. Curr Protoc Immunol. 2007 May;Chapter 14:Unit 14.12. [ Links ]
5. Martinon F, Mayor A, Tschopp J. The inflammasomes: guardians of the body. Annu Rev Immunol. 2009 Jan;27:229–65. [ Links ]
6. Dinarello CA. Biologic basis for interleukin-1 in disease. Blood. 1996 Mar 15;87(6):2095–147. [ Links ]
7. Martinon F, Tschopp J. Inflammatory caspases and inflammasomes: master switches of inflammation. Cell Death Differ. 2007 Jan;14(1):10–22. [ Links ]
8. Thornberry NA, Bull HG, Calaycay JR, Chapman KT, Howard AD, Kostura MJ, et al. A novel heterodimeric cysteine protease is required for interleukin-1 beta processing in monocytes. Nature. 1992 Apr 30;356(6372):768–74. [ Links ]
9. Martinon F, Gaide O, Pétrilli V, Mayor A, Tschopp J. NALP inflammasomes: a central role in innate immunity. Semin Immunopathol. 2007 Sep;29(3): 213–29. [ Links ]
10. Stutz A, Golenbock DT, Latz E. Inflammasomes: too big to miss. J Clin Invest. 2009 Dec;119(12):3502–11. [ Links ]
11. Fernandes-Alnemri T, Yu J-W, Datta P, Wu J, Alnemri ES. AIM2 activates the inflammasome and cell death in response to cytoplasmic DNA. Nature. 2009 Mar 26;458(7237):509–13. [ Links ]
12. Hornung V, Ablasser A, Charrel-Dennis M, Bauernfeind F, Horvath G, Caffrey DR, et al. AIM2 recognizes cytosolic dsDNA and forms a caspase-1-activating inflammasome with ASC. Nature. 2009 Mar 26;458(7237):514–8. [ Links ]
13. Roberts TL, Idris A, Dunn JA, Kelly GM, Burnton CM, Hodgson S, et al. HIN-200 proteins regulate caspase activation in response to foreign cytoplasmic DNA. Science (New York, N.Y.). 2009 Feb 20;323(5917):1057–60. [ Links ]
14. Schroder K, Muruve DA, Tschopp J. Innate immunity: cytoplasmic DNA sensing by the AIM2 inflammasome. Current biology : CB. 2009 Mar 24;19(6):R262–5. [ Links ]
15. Jéru I, Duquesnoy P, Fernandes-Alnemri T, Cochet E, Yu JW, Lackmy-Port-Lis M, et al. Mutations in NALP12 cause hereditary periodic fever syndromes. Proceedings of the National Academy of Sciences of the United States of America. 2008 Feb 5;105(5):1614–9. [ Links ]
16. Elinav E, Strowig T, Kau AL, Henao-Mejia J, Thaiss CA, Booth CJ, et al. NLRP6 inflammasome regulates colonic microbial ecology and risk for colitis. Cell. 2011 May 27;145(5):745–57. [ Links ]
17. Kempster SL, Belteki G, Forhead AJ, Fowden AL, Catalano RD, Lam BY, et al. Developmental control of the Nlrp6 inflammasome and a substrate, IL-18, in mammalian intestine. Am J Physiol Gastrointest Liver Physiol. 2011 Feb;300(2):G253–63. [ Links ]
18. Irmler M, Hertig S, MacDonald HR, Sadoul R, Becherer JD, Proudfoot A, et al. Granzyme A is an interleukin 1 beta-converting enzyme. J Exp Med. 1995 May 1;181(5):1917–22. [ Links ]
19. Coeshott C, Ohnemus C, Pilyavskaya A, Ross S, Wieczorek M, Kroona H, et al. Converting enzymeindependent release of tumor necrosis factor alpha and IL-1beta from a stimulated human monocytic cell line in the presence of activated neutrophils or purified proteinase 3. Proc Natl Acad Sci U S A. 1999 May 25;96(11):6261–6. [ Links ]
20. Sugawara S. Immune functions of proteinase 3. Crit Rev Immunol. 2005 Jan;25(5):343–60. [ Links ]
21. Bauernfeind FG, Horvath G, Stutz A, Alnemri ES, MacDonald K, Speert D, et al. Cutting edge: NF-kappaB activating pattern recognition and cytokine receptors license NLRP3 inflammasome activation by regulating NLRP3 expression. J Immunol. 2009 Jul 15;183(2):787–91. [ Links ]
22. Halle A, Hornung V, Petzold GC, Stewart CR, Monks BG, Reinheckel T, et al. The NALP3 inflammasome is involved in the innate immune response to amyloidbeta. Nat Immunol. 2008 Aug;9(8):857–65. [ Links ]
23. Sharp FA, Ruane D, Claass B, Creagh E, Harris J, Malyala P, et al. Uptake of particulate vaccine adjuvants by dendritic cells activates the NALP3 inflammasome. Proc Natl Acad Sci U S A. 2009 Jan 20;106(3): 870–5. [ Links ]
24. Dostert C, Pétrilli V, Van Bruggen R, Steele C, Mossman BT, Tschopp J. Innate immune activation through Nalp3 inflammasome sensing of asbestos and silica. Science. 2008 May 2;320(5876):674–7. [ Links ]
25. González-Benítez JF, Juárez-Verdayes MA, Rodríguez- Martínez S, Cancino-Diaz ME, García-Vázquez F, Cancino- Diaz JC. The NALP3/Cryopyrin-inflammasome complex is expressed in LPS-induced ocular inflammation. Mediators Inflamm. 2008 Jan;2008:614345. [ Links ]
26. Kumar H, Kumagai Y, Tsuchida T, Koenig PA, Satoh T, Guo Z, et al. Involvement of the NLRP3 inflammasome in innate and humoral adaptive immune responses to fungal beta-glucan. J Immunol. 2009 Dec 15;183(12):8061–7. [ Links ]
27. Ichinohe T, Lee HK, Ogura Y, Flavell R, Iwasaki A. Inflammasome recognition of influenza virus is essential for adaptive immune responses. J Exp Med. 2009 Jan 16;206(1):79–87. [ Links ]
28. Dostert C, Guarda G, Romero JF, Menu P, Gross O, Tardivel A, et al. Malarial hemozoin is a Nalp3 inflammasome activating danger signal. PloS one. 2009 Jan;4(8):e6510. [ Links ]
29. Bryant C, Fitzgerald KA. Molecular mechanisms involved in inflammasome activation. Trends Cell Biol. 2009 Sep;19(9):455–64. [ Links ]
30. Willingham SB, Allen IC, Bergstralh DT, Brickey WJ, Huang MT-H, Taxman DJ, et al. NLRP3 (NALP3, Cryopyrin) facilitates in vivo caspase-1 activation, necrosis, and HMGB1 release via inflammasomedependent and -independent pathways. J Immunol. 2009 Aug 1;183(3):2008–15. [ Links ]
31. Hornung V, Bauernfeind F, Halle A, Samstad EO, Kono H, Rock KL, et al. Silica crystals and aluminum salts activate the NALP3 inflammasome through phagosomal destabilization. Nat Immunol. 2008 Aug;9(8):847–56. [ Links ]
32. Li H, Ambade A, Re F. Cutting edge: Necrosis activates the NLRP3 inflammasome. J Immunol. 2009 Aug 1;183(3):1528–32. [ Links ]
33. Cassel SL, Eisenbarth SC, Iyer SS, Sadler JJ, Colegio OR, Tephly LA, et al. The Nalp3 inflammasome is essential for the development of silicosis. Proc Natl Acad Sci U S A. 2008 Jul 1;105(26):9035–40. [ Links ]
34. Gross O, Poeck H, Bscheider M, Dostert C, Hannesschläger N, Endres S, et al. Syk kinase signalling couples to the Nlrp3 inflammasome for anti-fungal host defence. Nature. 2009 May 21;459(7245):433–6. [ Links ]
35. Tassi S, Carta S, Vené R, Delfino L, Ciriolo MR, Rubartelli A. Pathogen-induced interleukin-1beta processing and secretion is regulated by a biphasic redox response. J Immunol. 2009 Jul 15;183(2):1456–62. [ Links ]
36. Zhou R, Tardivel A, Thorens B, Choi I, Tschopp J. Thioredoxin-interacting protein links oxidative stress to inflammasome activation. Nat Immunol. 2010 Feb;11(2):136–40. [ Links ]
37. Xu XH, Shah PK, Faure E, Equils O, Thomas L, Fishbein MC, et al. Toll-like receptor-4 is expressed by macrophages in murine and human lipid-rich atherosclerotic plaques and upregulated by oxidized LDL. Circulation. 2001 Dec 18;104(25):3103–8. [ Links ]
38. Lamkanfi M, Mueller JL, Vitari AC, Misaghi S, Fedorova A, Deshayes K, et al. Glyburide inhibits the Cryopyrin/ Nalp3 inflammasome. J Cell Biol. 2009 Oct 5;187(1):61–70. [ Links ]
39. Duewell P, Kono H, Rayner KJ, Sirois CM, Vladimer G, Bauernfeind FG, et al. NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals. Nature. 2010 Apr 29;464(7293):1357–61. [ Links ]
40. Agostini L, Martinon F, Burns K, McDermott MF, Hawkins PN, Tschopp J. NALP3 forms an IL-1betaprocessing inflammasome with increased activity in Muckle-Wells autoinflammatory disorder. Immunity. 2004 Mar;20(3):319–25. [ Links ]
41. Masters SL, Simon A, Aksentijevich I, Kastner DL. Horror autoinflammaticus: the molecular pathophysiology of autoinflammatory disease (*). Annu Rev Immunol. 2009 Jan;27:621–68. [ Links ]
42. Meinzer U, Quartier P, Alexandra J-F, Hentgen V, Retornaz F, Koné-Paut I. Interleukin-1 targeting drugs in familial Mediterranean fever: a case series and a review of the literature. Semin Arthritis Rheum. 2011 Oct;41(2):265–71. [ Links ]
43. Nigrovic PA, Mannion M, Prince FHM, Zeft A, Rabinovich CE, van Rossum MAJ, et al. Anakinra as firstline disease-modifying therapy in systemic juvenile idiopathic arthritis: report of forty-six patients from an international multicenter series. Arthritis Rheum. 2011 Feb;63(2):545–55. [ Links ]
44. Kuemmerle-Deschner JB, Tyrrell PN, Koetter I, Wittkowski H, Bialkowski A, Tzaribachev N, et al. Efficacy and safety of anakinra therapy in pediatric and adult patients with the autoinflammatory Muckle-Wells syndrome. Arthritis Rheum. 2011 Mar;63(3):840–9. [ Links ]
45. So A, De Smedt T, Revaz S, Tschopp J. A pilot study of IL-1 inhibition by anakinra in acute gout. Arthritis Res Ther. 2007 Jan;9(2):R28. [ Links ]
46. Rajan JV, Rodriguez D, Miao EA, Aderem A. The NLRP3 inflammasome detects encephalomyocarditis virus and vesicular stomatitis virus infection. J Virol. 2011 May;85(9):4167–72. [ Links ]
47. Nour AM, Reichelt M, Ku C-C, Ho M-Y, Heineman TC, Arvin AM. Varicella-zoster virus infection triggers formation of an interleukin-1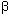 (IL-1
(IL-1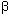 )-processing inflammasome complex. J Biol Chem. 2011 May 20;286(20):17921–33. [ Links ]
)-processing inflammasome complex. J Biol Chem. 2011 May 20;286(20):17921–33. [ Links ]
48. Ichinohe T, Pang IK, Iwasaki A. Influenza virus activates inflammasomes via its intracellular M2 ion channel. Nat Immunol. 2010 May;11(5):404–10. [ Links ]
49. Muruve DA, Pétrilli V, Zaiss AK, White LR, Clark SA, Ross PJ, et al. The inflammasome recognizes cytosolic microbial and host DNA and triggers an innate immune response. Nature. 2008 Mar 6;452(7183):103–7. [ Links ]
50. Juliana C, Fernandes-Alnemri T, Wu J, Datta P, Solorzano L, Yu J-W, et al. Anti-inflammatory compounds parthenolide and Bay 11-7082 are direct inhibitors of the inflammasome. J Biol Chem. 2010 Mar 26;285(13):9792–802. [ Links ]
51. Barlan AU, Griffin TM, McGuire KA, Wiethoff CM. Adenovirus membrane penetration activates the NLRP3 inflammasome. J Virol. 2011 Jan;85(1): 146–55. [ Links ]
52. Barlan AU, Danthi P, Wiethoff CM. Lysosomal localization and mechanism of membrane penetration influence nonenveloped virus activation of the NLRP3 inflammasome. Virology. 2011 Apr 10;412(2):306–14. [ Links ]
53. McCoy AJ, Koizumi Y, Higa N, Suzuki T. Differential regulation of caspase-1 activation via NLRP3/NLRC4 inflammasomes mediated by aerolysin and type III secretion system during Aeromonas veronii infection. J Immunol. 2010 Dec 1;185(11):7077–84. [ Links ]
54. Oosting M, van de Veerdonk FL, Kanneganti T-D, Sturm P, Verschueren I, Berende A, et al. Borrelia species induce inflammasome activation and IL-17 production through a caspase-1-dependent mechanism. Eur J Immunol. 2011 Jan;41(1):172–81. [ Links ]
55. Miao EA, Leaf IA, Treuting PM, Mao DP, Dors M, Sarkar A, et al. Caspase-1-induced pyroptosis is an innate immune effector mechanism against intracellular bacteria. Nat Immunol. 2010 Dec;11(12): 1136–42. [ Links ]
56. Abdul-Sater AA, Saïd-Sadier N, Padilla EV, Ojcius DM. Chlamydial infection of monocytes stimulates IL-1beta secretion through activation of the NLRP3 inflammasome. Microbes Infect. 2010 Aug;12(8- 9):652–61. [ Links ]
57. Wu J, Fernandes-Alnemri T, Alnemri ES. Involvement of the AIM2, NLRC4, and NLRP3 inflammasomes in caspase-1 activation by Listeria monocytogenes. J Clin Immunol. 2010 Sep;30(5):693–702. [ Links ]
58. Ritter M, Gross O, Kays S, Ruland J, Nimmerjahn F, Saijo S, et al. Schistosoma mansoni triggers Dectin- 2, which activates the Nlrp3 inflammasome and alters adaptive immune responses. Proc Natl Acad Sci U S A. 2010 Nov 23;107(47):20459–64. [ Links ]
59. Witola WH, Mui E, Hargrave A, Liu S, Hypolite M, Montpetit A, et al. NALP1 influences susceptibility to human congenital toxoplasmosis, proinflammatory cytokine response, and fate of Toxoplasma gondii-infected monocytic cells. Infect Immun. 2011 Feb;79(2):756–66. [ Links ]
60. Pontillo A, Brandão LA, Guimarães RL, Segat L, Athanasakis E, Crovella S. A 3'UTR SNP in NLRP3 gene is associated with susceptibility to HIV-1 infection. J Acquir Immune Defic Syndr. 2010 Jul;54(3):236–40. [ Links ]
61. Loo Y-M, Fornek J, Crochet N, Bajwa G, Perwitasari O, Martinez-Sobrido L, et al. Distinct RIG-I and MDA5 signaling by RNA viruses in innate immunity. J Virol. 2008 Jan;82(1):335–45. [ Links ]
62. Solis M, Nakhaei P, Jalalirad M, Lacoste J, Douville R, Arguello M, et al. RIG-I-mediated antiviral signaling is inhibited in HIV-1 infection by a protease- mediated sequestration of RIG-I. J Virol. 2011 Feb;85(3):1224–36. [ Links ]
63. Martinson JA, Montoya CJ, Usuga X, Ronquillo R, Landay AL, Desai SN. Chloroquine modulates HIV- 1-induced plasmacytoid dendritic cell alpha interferon: implication for T-cell activation. Antimicrob Agents Chemother. 2010 Feb;54(2):871–81. [ Links ]
64. Thibault S, Fromentin R, Tardif MR, Tremblay MJ. TLR2 and TLR4 triggering exerts contrasting effects with regard to HIV-1 infection of human dendritic cells and subsequent virus transfer to CD4+ T cells. Retrovirology. 2009 Jan;6:42. [ Links ]
65. Hernández JC, Montoya CJ, Urcuqui-Inchima S. [The role of toll-like receptors in viral infections: HIV-1 as a model]. Biomedica. 2007 Jun;27(2):280–93. [ Links ]
66. Monick MM, Yarovinsky TO, Powers LS, Butler NS, Carter AB, Gudmundsson G, et al. Respiratory syncytial virus up-regulates TLR4 and sensitizes airway epithelial cells to endotoxin. J Biol Chem. 2003 Dec 26;278(52):53035–44. [ Links ]
67. Azeredo EL, Neves-Souza PC, Alvarenga AR, Reis SRNI, Torrentes-Carvalho A, Zagne S-MO, et al. Differential regulation of toll-like receptor-2, toll-like receptor- 4, CD16 and human leucocyte antigen-DR on peripheral blood monocytes during mild and severe dengue fever. Immunology. 2010 Jun;130(2):202–16. [ Links ]
68. Stärkel P, De Saeger C, Strain AJ, Leclercq I, Horsmans Y. NFkappaB, cytokines, TLR 3 and 7 expression in human end-stage HCV and alcoholic liver disease. Eur J Clin Invest. 2010 Jul;40(7):575–84. [ Links ]
69. Hernández JC, Arteaga J, Paul S, Kumar A, Latz E, Urcuqui- Inchima S. Up-regulation of TLR2 and TLR4 in dendritic cells in response to HIV type 1 and coinfection with opportunistic pathogens. AIDS Res Hum Retroviruses. 2011 Oct;27(10):1099–109. [ Links ]
70. Thea DM, Porat R, Nagimbi K, Baangi M, St Louis ME, Kaplan G, et al. Plasma cytokines, cytokine antagonists, and disease progression in African women infected with HIV-1. Ann Intern Med. 1996 Apr 15;124(8):757–62. [ Links ]
71. Brabers NACH, Nottet HSLM. Role of the pro-inflammatory cytokines TNF-alpha and IL-1beta in HIV-associated dementia. Eur J Clin Invest. 2006 Jul;36(7):447–58. [ Links ]
72. Xing HQ, Hayakawa H, Izumo K, Kubota R, Gelpi E, Budka H, et al. In vivo expression of proinflammatory cytokines in HIV encephalitis: an analysis of 11 autopsy cases. Neuropathology. 2009 Aug;29(4):433–42. [ Links ]
73. Appay V, Sauce D. Immune activation and inflammation in HIV-1 infection: causes and consequences. J Pathol. 2008 Jan;214(2):231–41. [ Links ]
74. Torre D, Pugliese A. Interleukin 18 and cardiovascular disease in HIV-1 infection: a partner in crime? AIDS Rev. 2010;12(1):31–9. [ Links ]
75. Guarda G, Dostert C, Staehli F, Cabalzar K, Castillo R, Tardivel A, et al. T cells dampen innate immune responses through inhibition of NLRP1 and NLRP3 inflammasomes. Nature. 2009 Jul 9;460(7252):269–73. [ Links ]
76. Brodsky IE, Palm NW, Sadanand S, Ryndak MB, Sutterwala FS, Flavell RA, et al. A Yersinia effector protein promotes virulence by preventing inflammasome recognition of the type III secretion system. Cell Host Microbe. 2010 May 20;7(5):376–87. [ Links ]
77. Master SS, Rampini SK, Davis AS, Keller C, Ehlers S, Springer B, et al. Mycobacterium tuberculosis prevents inflammasome activation. Cell Host Microbe. 2008 Apr 17;3(4):224–32. [ Links ]
78. Gregory SM, Davis BK, West JA, Taxman DJ, Matsuzawa S, Reed JC, et al. Discovery of a viral NLR homolog that inhibits the inflammasome. Science. 2011 Jan 21;331(6015):330–4. [ Links ]
79. Kersse K, Vanden Berghe T, Lamkanfi M, Vandenabeele P. A phylogenetic and functional overview of inflammatory caspases and caspase-1-related CARD-only proteins. Biochem Soc Trans. 2007 Dec;35(Pt 6):1508–11. [ Links ]
80. Stehlik C, Dorfleutner A. COPs and POPs: modulators of inflammasome activity. J Immunol. 2007 Dec 15;179(12):7993–8. [ Links ]
81. da Cunha JPC, Galante PAF, de Souza SJ. Different evolutionary strategies for the origin of caspase-1 inhibitors. J Mol Evol. 2008 Jun;66(6):591–7. [ Links ]
82. Dorfleutner A, Bryan NB, Talbott SJ, Funya KN, Rellick SL, Reed JC, et al. Cellular pyrin domain-only protein 2 is a candidate regulator of inflammasome activation. Infect Immun. 2007 Mar;75(3):1484–92. [ Links ]
83. Johnston JB, Barrett JW, Nazarian SH, Goodwin M, Ricciuto D, Ricuttio D, et al. A poxvirus-encoded pyrin domain protein interacts with ASC-1 to inhibit host inflammatory and apoptotic responses to infection. Immunity. 2005 Dec;23(6):587–98. [ Links ]
84. Dorfleutner A, Talbott SJ, Bryan NB, Funya KN, Rellick SL, Reed JC, et al. A Shope Fibroma virus PYRIN-only protein modulates the host immune response. Virus Genes. 2007 Dec;35(3):685–94. [ Links ]
85. Rahman MM, Mohamed MR, Kim M, Smallwood S, McFadden G. Co-regulation of NF-kappaB and inflammasome-mediated inflammatory responses by myxoma virus pyrin domain-containing protein M013. PLoS Pathog. 2009 Oct;5(10):e1000635. [ Links ]
86. Li J, Yin HL, Yuan J. Flightless-I regulates proinflammatory caspases by selectively modulating intracellular localization and caspase activity. J Cell Biol. 2008 Apr 21;181(2):321–33. [ Links ]
87. Annand RR, Dahlen JR, Sprecher CA, De Dreu P, Foster DC, Mankovich JA, et al. Caspase-1 (interleukin- 1beta-converting enzyme) is inhibited by the human serpin analogue proteinase inhibitor 9. Biochem J. 1999 Sep 15;342 Pt 3:655–65. [ Links ]
88. Young JL, Sukhova GK, Foster D, Kisiel W, Libby P, Schönbeck U. The serpin proteinase inhibitor 9 is an endogenous inhibitor of interleukin 1betaconverting enzyme (caspase-1) activity in human vascular smooth muscle cells. J Exp Med. 2000 May 1;191(9):1535–44. [ Links ]
89. Ray CA, Black RA, Kronheim SR, Greenstreet TA, Sleath PR, Salvesen GS, et al. Viral inhibition of inflammation: cowpox virus encodes an inhibitor of the interleukin-1 beta converting enzyme. Cell. 1992 May 15;69(4):597–604. [ Links ]
90. Zhou Q, Krebs JF, Snipas SJ, Price A, Alnemri ES, Tomaselli KJ, et al. Interaction of the baculovirus anti-apoptotic protein p35 with caspases. Specificity, kinetics, and characterization of the caspase/p35 complex. Biochemistry. 1998 Jul 28;37(30):10757–65. [ Links ]
91. Dinarello CA. Immunological and inflammatory functions of the interleukin-1 family. Annu Rev Immunol. 2009 Jan;27:519–50. [ Links ]