Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.26 no.1 Medellín Jan./Mar. 2013
CONFERENCIA CLÍNICO PATOLÓGICA (CPC)
Conferencia Clínico Patológica (CPC): paciente previamente sana con insuficiencia respiratoria debida a neumonía intersticial
Clinico-pathological conference (CPC): a previously healthy patient with respiratory insuficiency due to intersticial pneumonia
Carlos Andrés Serna Ortiz1; Édison Muñoz Ortiz2; Luis Fernando Arias Restrepo3; Juan Carlos Cataño Correa4
1 Residente de Patología, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
2 Residente de Medicina Interna, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
3 Patólogo PhD, Profesor de la Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
4 Internista Infectólogo, Profesor de la Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. kataju@hotmail.com
Recibido: mayo 30 de 2012
Aceptado: junio 16 de 2012
RESUMEN
Se presenta y discute el caso de una mujer de 40 años, sin antecedentes relevantes, quien ingresó al hospital Universitario San Vicente Fundación, por presentar síntomas respiratorios durante 20 días. Se diagnosticó sida de novo y neumonía intersticial asociada, todo lo cual progresó hasta la falla ventilatoria, que fue refractaria al tratamiento dirigido hacia los oportunistas identificados, debido a lo cual se produjo una falla orgánica múltiple que causó la muerte.
PALABRAS CLAVE
Enfermedades Pulmonares Intersticiales, HIV, Inmunodeficiencia Adquirida, Insuficiencia Respiratoria, Sindrome de Insuficiencia Multioprgánica
SUMMARY
We present the case of a 40-year-old woman, with no remarkable past medical history, who was admitted to San Vicente Foundation University Hospital, in Medellín, Colombia; she complained of respiratory symptoms lasting 20 days. Interstitial pneumonia associated with AIDS was diagnosed, which progressed to respiratory failure that did not respond to therapy directed against the opportunistic infections that were identified. She finally developed multiorgan failure that caused death.
KEY WORDS
Acquired Imnunodeficiency Syndrome, HIV, Interstitial Lung Diseases, Multiple Organ Failure Syndrome, Respiratory Insufficiency
HISTORIA CLÍNICA
Mujer de 40 años, separada, con dos hijos, diestra, estudió la primaria completa, católica, vivía con su madre e hijos en Medellín y trabajaba como camarera. Su pareja, de quien se había separado previamente, falleció en un accidente automovilístico seis años antes del ingreso de la paciente al Hospital. Vivía en una casa con todos los servicios. Consultó el 22 de enero de 2008 al Hospital Universitario San Vicente Fundación por un cuadro de 20 días de evolución de síntomas respiratorios.
Antecedentes
Patológicos: bronquitis en octubre de 2007.
Quirúrgicos: dos cesáreas, osteosíntesis de codo por accidente de tránsito en 2002.
Tóxicos: fumadora de un paquete diario durante 15 años; licor ocasional.
Enfermedad actual
Ingresó al Hospital por 20 días de tos, inicialmente seca, asociada a disnea de medianos esfuerzos que progresó a disnea de pequeños esfuerzos. En los 15 días previos a la consulta presentó además fiebre subjetiva; la tos se volvió productiva de un material de aspecto hialino, y presentó dolor en las zonas escapulares. El día previo a su ingreso presentó además edema de miembros inferiores. Informó que había consultado tres días antes y se le prescribieron enalapril, furosemida y un antibiótico sin mejoría (no recordaba el nombre del antibiótico).
Revisión por sistemas
Astenia, adinamia, hiporexia, no duerme bien, tinitus ocasional. Un mes de prurito en miembros superiores e inferiores. Pérdida de 19 kg de peso en los últimos seis meses. Sin cefalea ni otras alteraciones neurológicas. Disfagia y diarrea ocasionales.
Examen físico
Paciente en regulares condiciones generales, hidratada. Presión arterial: 80/50 mm Hg, frecuencia cardíaca: 90 por minuto; frecuencia respiratoria: 38 por minuto; saturación de oxígeno: 85% con FiO2 del 21%; temperatura: 38,5 °C. Candidiasis oral, pequeños ganglios cervicales posteriores de 0,5 cm. Zonas de alopecia. Leve tiraje costal, ruidos cardíacos rítmicos sin soplos, punto de máximo impulso no desplazado. Murmullo vesicular conservado con roncus en las bases, sin signos de consolidación. Abdomen: hígado de 15 cm por percusión, no tenía esplenomegalia. Tactos vaginal y rectal normales. Extremidades: edema grado 1 de miembros inferiores con fóvea. Neurológico: alerta, orientada, sin focalización, sin signos meníngeos, fondo de ojo normal. Piel con lesiones costrosas y signos de rascado tanto en miembros superiores como inferiores.
Exámenes paraclínicos
Entre los exámenes paraclínicos iniciales llamó la atención el recuento de linfocitos al límite (1.500/µL), sin anemia ni trombocitopenia, elevación del ácido láctico y la DHL (1.143 UI/L), hipoxemia (PO2: 39,4 mm Hg) y acidosis metabólica. Electrocardiograma normal y radiografía de tórax con cardiomegalia e infiltrados intersticiales pericárdicos bilaterales (no se dispone de las imágenes). VDRL no reactivo y hemocultivos para aerobios, hongos y micobacterias negativos. Los demás exámenes de laboratorio se resumen en las tablas 1 y 2.
Evolución
Ingresó inicialmente a una sala general; evaluada por Medicina Interna se consideró la posibilidad de inmunodeficiencia e infecciones oportunistas; se hizo entonces aislamiento por aerosoles y se solicitó ELISA para VIH que fue positivo y se confirmó con Western Blot; por lo tanto, continuó al cuidado de los especialistas del Grupo de Enfermedades Infecciosas quienes solicitaron estudios en busca de oportunistas; fueron negativos los estudios para hepatitis B y C, látex para criptococo y baciloscopias seriadas; el único resultado positivo fue la IgG para toxoplasma. Solicitaron además fibrobroncoscopia y lavado broncoalveolar que se hicieron al cuarto día de hospitalización y revelaron la presencia de Pneumocystis jirovecii; además, en el cultivo se obtuvo crecimiento de Cándida spp., Las restantes coloraciones y los cultivos para piógenos, hongos y micobacterias fueron negativos. Debido a la queja de disfagia referida, se hizo endoscopia digestiva superior que reveló candidiasis esofágica y Cándida spp., en cultivo. Con base en estos resultados se inició tratamiento con trimetoprim/sulfametoxazol (TMP/SMX) venoso durante 21 días dirigido a tratar la neumonía por P. jirovecii (PCP) y fluconazol venoso durante 10 días para tratar la candidiasis esofágica. La carga viral para VIH fue 272.000 copias/mL y los CD4, 23 células/µL.
Se completaron los estudios con la tomografía de alta resolución (TAC-AR) de tórax en la que se reportó infiltrado en vidrio esmerilado con compromiso de ambos campos pulmonares; se sugirió la posibilidad de etiología infecciosa (PCP entre otras). También se hizo TAC contrastada de abdomen que evidenció hepatomegalia y esplenomegalia, líquido y realce en las paredes de la vesícula (no se dispone de las imágenes). El día séptimo de hospitalización se consideró que se había descartado razonablemente la tuberculosis (TB) y se suspendió el aislamiento por aerosoles; sin embargo, la paciente, que estaba con oxígeno suplementario por cánula nasal, presentó desaturación y requirió Ventury al 40%.
El día décimo de hospitalización presentó leucopenia y se consideró la posibilidad de toxicidad medular por antibióticos, por lo cual se suspendió el TMP/SMX y se inició clindamicina para continuar el tratamiento contra la PCP. Al día siguiente seguía con tos, expectoración y fiebre (la fiebre fue persistente durante toda la hospitalización aunque intermitente), por lo que se solicitó TAC de senos paranasales en busca de otros focos infecciosos, pero el resultado fue normal. Continuó el deterioro respiratorio por lo que se aumentó la FIO2 mediante máscara de no reinhalación, y por inestabilidad hemodinámica se inició dopamina.
Ante el deterioro se suspendió la clindamicina y se reinició el TMP/SMX venoso más prednisolona; además, se solicitó carga viral para citomegalovirus (CMV) cuyo resultado fue 1.240 copias/mL, lo que se consideró no significativo.
El día 16 de hospitalización se suspendió el vasopresor por mejoría hemodinámica, pero se deterioró más desde el punto de vista respiratorio por lo que se trasladó a la unidad de cuidados intensivos (UCI) donde hicieron intubación orotraqueal y monitorización invasiva con catéteres arterial y venoso centrales. Consideraron la posibilidad de hacer una nueva fibrobroncoscopia, pero ello no fue posible ante la evolución tórpida y los parámetros ventilatorios persistentemente altos; por la misma razón el servicio de cirugía de tórax no pudo hacer biopsia pulmonar. Debido al deterioro progresivo se inició tratamiento empírico antituberculoso y con anfotericina B, con el objetivo de cubrir otros oportunistas y se suspendió la prednisolona. Se tornó de nuevo hemodinámicamente inestable, por lo que se inició noradrenalina, que se requirió durante el resto de la hospitalización.
El día 24 de la estancia hospitalaria completó los 21 días de TMP/SMX venoso y se continuó con TMP/SMX oral profiláctico. Por la persistencia de la fiebre, se tomaron nuevos cultivos que documentaron infección del tracto urinario (ITU) por un bacilo gramnegativo; se inició tratamiento con piperacilina/ tazobactam que luego se cambió a ciprofloxacina al identificar el microorganismo como Escherichia coli negativo para BLEE (beta lactamasas de espectro extendido).
El día 30, ante el deterioro persistente, se reconsideró la infección por CMV y se solicitó nueva carga viral. Al día siguiente estaba con poca tolerancia a la vía oral y le iniciaron eritromicina como procinético; además, se solicitó ecografía de abdomen que evidenció colecistitis, por lo que se cambió la ciprofloxacina por piperacilina/tazobactam con la idea de cubrir anaerobios y Enterococcus spp. Se suspendió la anfotericina B por no encontrar ninguna respuesta y para prevenir la toxicidad.
La evaluó el servicio de Cirugía General que sugirió y llevó a cabo, por su condición clínica, la colecistostomía percutánea, en la cual no hubo complicaciones; los cultivos del drenaje biliar tanto para piógenos como para hongos y micobacterias fueron negativos. Se recibió el resultado de la nueva carga viral para CMV (6.660 copias) y se decidió iniciar ganciclovir.
El día 35 de hospitalización nuevamente tuvo leucopenia, que fue progresiva. En el día 38 se decidió iniciar terapia antirretroviral con zidovudina, lamivudina y efavirenz. El día 40 se suspendió la piperacilina/tazobactam tras llevar 16 días de tratamiento, lo que se consideró suficiente para la ITU y la colecistitis; se evidenció deterioro de la función renal que siempre había estado normal y por ello se disminuyó la dosis de ganciclovir. Al día siguiente, por aumento de la fiebre, se tomaron muestras para hemocultivos, coprocultivo y urocultivo que fueron negativos, además de ecografía abdominal que descartó una colección.
El día 44 de hospitalización, ante el deterioro progresivo y el mayor compromiso renal, se suspendieron el ganciclovir y el tratamiento antituberculoso y se decidió tomar muestras de médula ósea, en las que se halló crecimiento de un bacilo gramnegativo, por lo que se inició tratamiento empírico con meropenem; posteriormente se identificó el bacilo como Brevundimonas diminuta resistente a carbapenem por lo que se cambió a ciprofloxacina.
La paciente continuó con deterioro progresivo de su estado general, empeoró la función renal, se tornó oligúrica, con leucopenia y trombocitopenia graves; se la consideró en falla multiorgánica y murió en el día 51 de hospitalización.
Las tablas 1 y 2 resumen los exámenes de laboratorio y los estudios para infección más importantes durante los 51 días de hospitalización.
DISCUSIÓN DEL INTERNISTA
Se trata de una mujer de 40 años, sin antecedentes previos de importancia, quien ingresó al hospital por síntomas respiratorios y rápidamente se hizo el diagnóstico de infección por VIH en estadio SIDA C3, debido al bajo recuento de CD4 y a las infecciones oportunistas encontradas (PCP, candidiasis esofágica y CMV), quien presentó falla respiratoria aguda (FRA) por la que se requirió traslado a la UCI y ventilación mecánica con deterioro progresivo hasta presentar falla multiorgánica que la llevó a la muerte.
Con esta presentación clínica y su evolución, es claro que el cuadro clínico predominante fue el compromiso respiratorio y por eso se decide enfocar el caso a partir de las manifestaciones pulmonares del VIH. Esto implica un reto teniendo en cuenta que dichas manifestaciones son muy frecuentes e implican un diagnóstico diferencial muy amplio tanto de causas infecciosas como no infecciosas (tabla 3). Se mencionan las causas más comunes, que serán las primeras para descartar y otras menos frecuentes que de todas maneras se deben tener en cuenta en el diagnóstico diferencial; por ello, a la hora de enfocar estos casos se sugiere tener una historia clínica completa, exámenes paraclínicos que puedan brindar claves diagnósticas y estudios de imágenes que permitan diferenciar los patrones radiológicos para disminuir el espectro de búsqueda. En este caso en particular, para poder reducir las posibles alternativas de la causa de muerte de la paciente, me enfocaré en aquellas causas de afectación pulmonar en el paciente con VIH que producen un infiltrado intersticial en las imágenes, que fue el tipo de manifestación principal en la paciente; de esta forma se reduce la búsqueda a una lista mucho más pequeña (tabla 4) (1).
Como había mencionado antes, el compromiso pulmonar por VIH es muy frecuente; así, Wallace y colaboradores, en su serie de 1.171 pacientes con VIH, durante un seguimiento de 5 años, identificaron una tasa de incidencia de enfermedad pulmonar de 87 por 100 personas año, y cuando evaluaron específicamente el compromiso respiratorio inferior, encontraron que las causas más comunes eran las bronquitis bacterianas, la neumonía por P. carinii (ahora P. jirovecii) y la tuberculosis (TB), y que eran mucho menos frecuentes otras infecciones oportunistas o la afectación pulmonar no infecciosa (2). Lo más grave es que el compromiso pulmonar en pacientes infectados por VIH tiene gran impacto en la morbilidad y la mortalidad, pues se ha visto en diferentes momentos que la falla respiratoria aguda (FRA) es de lejos la primera causa de ingreso a la UCI en los pacientes con VIH (3). Si miramos cuál es la etiología de la FRA de estos pacientes admitidos a la UCI, Barbier y colaboradores muestran como los más importantes los mismos protagonistas mencionados hasta ahora, es decir, la neumonía bacteriana y la PCP, y con menor frecuencia las causas no infecciosas y otras infecciones oportunistas incluyendo la TB, aunque esta última depende en gran medida de la incidencia en cada país y por lo tanto en nuestro medio posiblemente sí tenga mayor importancia. Barbier, además, encontró en su trabajo que había ciertos factores de mal pronóstico en los pacientes con VIH que presentaban FRA, independientemente de la causa; ellos fueron: la necesidad de ventilación mecánica invasiva, el uso de vasopresores, el tener varias causas de FRA y el mayor tiempo entre la admisión hospitalaria y el traslado a la UCI (4); si recordamos su historia, la paciente cumpliría con todos ellos, lo cual nos indica que de entrada e independientemente de la causa del compromiso pulmonar, tenía un mal pronóstico.
Ahora bien, si nos enfocamos en las causas específicas de compromiso pulmonar que producen infiltrados intersticiales, podríamos considerar las siguientes opciones:
Neumonía intersticial linfocítica: es posiblemente la única causa no infecciosa para considerar en este caso. Suele ser secundaria a otros procesos patológicos, principalmente enfermedades autoinmunes, pero también se ha encontrado en estados de inmunodeficiencia, incluyendo el VIH, con o sin infecciones oportunistas (5). Puede tener un cuadro clínico de inicio subagudo a crónico con un patrón radiológico indistinguible de la PCP, lo que está a favor de tal diagnóstico en este caso; sin embargo, en el caso particular del VIH es rara en adultos, pues suele presentarse en población pediátrica. Los valores de la DHL ayudan a diferenciarla de la PCP y encontrarlos elevados debe orientar más al origen infeccioso por el hongo (como en esta paciente); además, la neumonía intersticial linfocítica suele presentarse en pacientes con recuentos de CD4 mayores de 200 células/µL (1,5). El diagnóstico se establece por biopsia pulmonar que en este caso no fue posible por el estado de la paciente.
Tuberculosis: los pacientes con VIH tienen mayor susceptibilidad a esta infección, y en nuestro medio siempre se la debe considerar. En estados de inmunosupresión avanzada suele presentarse con un patrón intersticial y con las imágenes de cavitación típicas (1); sin embargo, también suele acompañarse de adenopatías mediastinales cuando los CD4 son bajos, cosa que no se encontró en la paciente (6). Por otro lado recibió 28 días de terapia antituberculosa sin ningún tipo de respuesta, y lo que considero que está aún más en contra de este diagnóstico fue la negatividad de los directos para bacilos ácido-alcohol resistentes y de los cultivos para M. tuberculosis en múltiples muestras de esputo, lavado broncoalveolar, sangre, bilis y médula ósea.
Criptococo: puede presentarse con un cuadro clínico similar al del presente caso, asociado al patrón intersticial en la radiografía y en un estado tan avanzado de inmunosupresión debe considerarse; sin embargo, justamente la inmunosupresión marcada hace que suela ser una enfermedad diseminada a diferentes órganos, principalmente al sistema nervioso central; además, el compromiso pulmonar aislado se ha encontrado en general en casos cuyo recuento de CD4 aún está cercano a 200 células/µL (1). Por otro lado, no se obtuvo evidencia de infección por criptococo a pesar de que el rendimiento diagnóstico del cultivo en el lavado broncoalveolar es bueno; más en contra aún es el hecho de tener un látex para criptococo negativo en suero porque este examen tiene una sensibilidad cercana al 100% (1).
Histoplasmosis: al igual que el criptococo, puede aparecer en estados de inmunosupresión avanzada, debido a reactivación o a primoinfección; sin embargo, suele caracterizarse por la presencia de adenopatías, que no se evidenciaron en la paciente, y en menos del 5% de los casos hay compromiso pulmonar aislado (7). Por otro lado, tampoco se logró aislamiento de H. capsulatum en las diferentes muestras.
CMV: puede presentarse con fiebre, disnea e hipoxemia como en este caso, además de infiltrados intersticiales (1); sin embargo, no es claro su significado como patógeno pulmonar en pacientes con VIH, pues generalmente hay aislamiento de otros gérmenes con patogenicidad pulmonar más definida, especialmente P. jirovecii, lo cual explica por qué cuando se hace el tratamiento del microorganismo acompañante, con o sin tratamiento para CMV, no hay diferencias en la tasa de mortalidad (1,8). Es por esto por lo que se han considerado como indicación de tratamiento para infección por CMV los pacientes que tienen compromiso pulmonar sin un diagnóstico alternativo y con efecto citopático demostrado por biopsia. Las pruebas moleculares como la carga viral por sí sola no se consideran suficientes para demostrar la infección pulmonar por CMV (8).
Descartando los diagnósticos anteriores, considero que la causa más probable de la muerte de la paciente es la infección por P. jirovecii, lo cual explico a continuación. La PCP suele ser de comienzo lento y poco llamativo, con un cuadro subagudo o crónico, especialmente en pacientes con recuentos de CD4 menores de 200 células/µL, con hipoalbuminemia, la cual es además un factor de mal pronóstico. El comportamiento de los leucocitos puede ser variable: normales en 59% de los casos, leucocitosis en 9% y leucopenia en 32%. La DHL alta, además de ser una clave para el diagnóstico, es un indicador de gravedad y de mal pronóstico. Clínicamente se presenta con fiebre, tos y disnea o en una combinación variable de estos tres síntomas; también se puede presentar en raras ocasiones hemoptisis o incluso ser una infección asintomática (1).
Ahora bien, teniendo en cuenta que el diagnóstico fue temprano y se inició el tratamiento de elección, cabe preguntarse si podría tratarse de un germen resistente a la terapia. Al revisar la literatura se encuentra que se ha intentado asociar la profilaxis con sulfas con la aparición de resistencia, describiendo mutaciones en la dihidropteroato sintetasa (posición 55 cambio de treonina por alanina y posición 57 prolina por serina). Así, en un estudio italiano llevado a cabo por Zingale y colaboradores se halló una prevalencia de estas mutaciones en el 40% de 173 pacientes con VIH y PCP, los cuales habían recibido previamente sulfas profilácticas o por otra causa (9). Sin embargo, varios autores consideran que no está claro el significado de estas mutaciones y su real importancia en la aparición de resistencia, pues con la profilaxis con TMP/SMX ha disminuido la incidencia de PCP y en aquellos pacientes que posteriormente la presentan al suspender la profilaxis, en general se ha evidenciado buena respuesta al tratamiento (10). Además, en este caso en particular, la paciente no tenía diagnóstico previo de VIH y no había historia de exposición previa a sulfas, por lo que considero que no hay que pensar en resistencia en este caso.
Lo que sí considero muy relevante es la tasa alta de mortalidad relacionada con la PCP y los múltiples factores de mal pronóstico que tenía la paciente, demostrados en diferentes estudios como el de Miller y colaboradores en el cual encontraron en pacientes con VIH admitidos a UCI una tasa de mortalidad del 53% y en el análisis multivariado hallaron como factores asociados con mortalidad la edad más avanzada, el tener un diagnóstico previo a 1996, lo cual no se asoció a la terapia antirretroviral sino al mejor cuidado en UCI, y el neumotórax o la necesidad de ventilación mecánica (11); esta última, que es de mal pronóstico, estaba presente en la paciente. Boonsarngsuk y colaboradores encontraron en otro estudio de pacientes con FRA por PCP tanto con VIH (14 pacientes) como por otras causas de inmunosupresión (30 pacientes) admitidos a UCI, una tasa de mortalidad de 63,6%. En el análisis univariado de los pacientes con VIH, encontraron como factores de mal pronóstico el sexo femenino, un puntaje APACHE alto (el promedio de los que murieron era de 22,8 y el de los sobrevivientes, 17), un nivel de presión positiva al final de la espiración (PEEP, positive end espiratory pressure) alto (5,1 cm H2O en quienes sobrevivieron y 6,2 cm H2O en los que murieron) y la coinfección con CMV (12). Si miramos el caso, la paciente tenía todos estos factores de riesgo. En el análisis multivariado persistían como factores de mal pronóstico el puntaje APACHE y la PEEP. Finalmente, es de anotar que se han descrito otros factores de mal pronóstico como la presencia de hipoxemia (cabe recordar que desde las primeras determinaciones de gases se evidenció una PO2 baja), el compromiso pulmonar bilateral extenso, tener otra infección pulmonar concurrente o enfermedad por PCP recurrente, los niveles de DHL altos como ya se había mencionado, un gradiente alvéolo-arterial mayor de 30 mm Hg y el no uso de esteroides cuando están indicados (1). Es evidente que la paciente cumplía con casi todos estos factores de mal pronóstico, lo cual posiblemente influyó de manera notoria en la progresión del síndrome de dificultad respiratoria agudo (SDRA) desde una fase exudativa, posteriormente proliferativa y finalmente fibrótica que la llevó a un punto de no recuperación de su función pulmonar.
Conclusión del internista
Considero entonces que se trataba de una paciente de 40 años, quien ingresó al hospital con síntomas respiratorios a partir de los cuales se llegó al diagnóstico de infección por VIH y posteriormente con el recuento de CD4 y la identificación de oportunistas se estadificó como SIDA C3; presentó una PCP en el contexto de múltiples factores de mal pronóstico descritos, los cuales la llevaron a desarrollar un SDRA que fue progresando hasta llegar a una fase fibrótica; posteriormente presentó una falla multisistémica y finalmente la muerte.
ANATOMÍA PATOLÓGICA
La autopsia se hizo ocho horas después de la muerte. Se encontró el cadáver de una mujer adulta, con edad aparente algo mayor que la edad cronológica; presentaba una cicatriz de traqueostomía reciente, múltiples sitios de venopunción y edema generalizado.
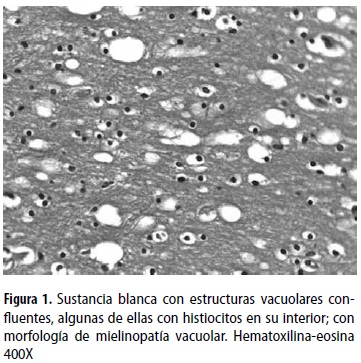
El encéfalo pesó 1.214 gramos, estaba congestivo y con hemorragia subaracnoidea en el lóbulo parietal izquierdo, ventrículos laterales con leve colapso, vasos del polígono de Willis con disposición anatómica normal, sin aneurismas o trombos. En el vérmix cerebelar se encontró un área hemorrágica de 1 cm de diámetro; microscópicamente esta zona correspondía a una hemorragia antigua. En los cortes histológicos se identificaron además nódulos microgliales sin presencia de células gigantes multinucleadas, gliosis reactiva perivascular, alrededor de los vasos había infiltrado inflamatorio de predominio mononuclear con presencia de plasmocitos; en la sustancia blanca se observaron estructuras vacuolares confluentes, algunas de ellas con macrófagos en su interior, correspondientes a zonas de mielinopatía vacuolar (figura 1).
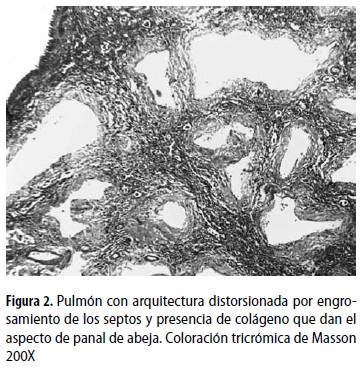
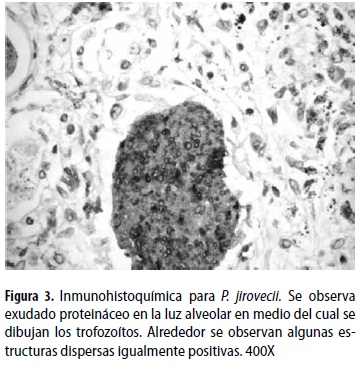
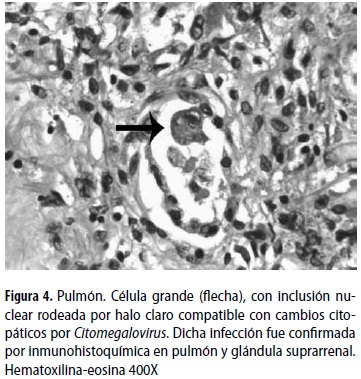
En la cavidad pleural se encontró líquido serohemático. Los pulmones tenían múltiples bulas periféricas de entre 2 y 5 cm de diámetro. El parénquima era de color café claro de aspecto cremoso con áreas grises que formaban un patrón moteado, había además aumento de la consistencia y disminución de la crepitación. En los cortes histológicos se observaron escasas áreas con arquitectura conservada, había zonas de hemorragia, calcificaciones distróficas con células gigantes multinucleadas de tipo cuerpo extraño y daño alveolar difuso con fases tempranas y tardías de organización que daban el aspecto ''en panal de abeja'' (figura 2). Había además proteinosis alveolar. Con la tinción de plata-metenamina se identificaron múltiples estructuras con aspecto ovoide y en forma de copa, que corresponden a Pneumocistis jirovecii; este hallazgo fue confirmado mediante inmunohistoquímica usando un anticuerpo monoclonal específico para Pneumocistis (figura 3). En pulmón se identificaron también algunas células grandes de citoplasma amplio e inclusiones basófilas intranucleares con halo claro, morfológicamente compatibles con Citomegalovirus; este hallazgo fue igualmente confirmado por inmunohistoquímica (figura 4).
En el bazo y en muchos ganglios linfáticos había depleción linfocítica y hemofagocitosis. En la médula ósea había una marcada hipocelularidad, con alteración en la maduración de todas las series y presencia de algunos agregados linfoides sin formación de centros germinales e igualmente presencia de hemofagocitosis.
En el tracto gastrointestinal se identificaron abundantes estructuras micóticas en el esófago distal, correspondientes a Cándida spp. El hígado estaba aumentado de tamaño, pesó 2.478 gramos, sin evidencia de lesiones focales; había expansión de los sinusoides y presencia de infiltrado inflamatorio en los espacios porta sin actividad de interfase; focalmente se observó esteatosis macrovacuolar en las zonas 2 y 3.
Los riñones no tenían alteraciones macroscópicas; en los cortes histológicos se observó descamación de células hacia la luz de los túbulos, con pérdida del borde en cepillo y vacuolización citoplasmática, hallazgos que correspondían a necrosis tubular aguda. Los glomérulos y demás estructuras del riñón eran normales.
Las suprarrenales pesaron en conjunto 16 gramos y no tenían alteraciones macroscópicas. En los cortes histológicos se identificaron múltiples células con inclusiones citomegálicas, que por inmunohistoquímica se demostraron como correspondientes a Citomegalovirus.
Diagnósticos finales
- Neumonía y daño alveolar difuso en fase de organización
- Infección pulmonar por P. jirovecii
- Infección por Citomegalovirus en pulmón y suprarrenales
- Leucoencefalopatía vacuolar
- Hemorragia intraparenquimatosa cerebelar antigua
- Hemorragia subaracnoidea
- Hipoplasia grave de médula ósea y cambios de tipo mielodisplásico asociados a VIH
- Linfadenopatía asociada a VIH en etapa tardía, de tipo depleción linfoide
- Síndrome hemofagocítico sistémico asociado a VIH
- Necrosis tubular aguda renal
- Candidiasis esofágica
DISCUSION DEL PATÓLOGO
Se trata de una paciente con VIH/sida que presentó una neumonía por P. jirovecii, asociada a Citomegalovirus, lo que empeoró el pronóstico (13,14); secundario a esto hizo un daño alveolar difuso que la llevó a hipoxia con afectación renal y del SNC; como resultado, presentó falla orgánica multisistémica y murió.
Presentaba además múltiples alteraciones en el sistema nervioso central secundarias a la infección por VIH: mielinopatía vacuolar, hemorragias y presencia de gliosis reactiva, nódulos microgliales e infiltrado inflamatorio perivascular; estas alteraciones son llamativas pues en la actualidad es infrecuente observarlas, ya que revierten con el uso de la terapia antirretroviral (15,16).
Se plantea la posibilidad de un síndrome hemofagocítico secundario, y aunque la hemofagocitosis era masiva no hay datos en la historia clínica que permitan confirmar este diagnóstico.
REFERENCIAS BIBLIOGRÁFICAS
1. Sax PE. Pulmonary manifestations of human immunodefinency virus infection. Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases. 7th ed. Philadelphia: Churchill Livinstone Elsevier; 2009. p. 1727 – 1735. [ Links ]
2. Wallace JM, Hansen NI, Lavange L, Glassroth J, Browdy BL, Rosen MJ, et al. Respiratory disease trends in the Pulmonary Complications of HIV Infection Study cohort. Pulmonary Complications of HIV Infection Study Group. Am J Respir Crit Care Med. 1997 Jan;155(1):72–80. [ Links ]
3. Huang L, Quartin A, Jones D, Havlir DV. Intensive care of patients with HIV infection. N Engl J Med. 2006 Jul 13;355(2):173–81. [ Links ]
4. Barbier F, Coquet I, Legriel S, Pavie J, Darmon M, Mayaux J, et al. Etiologies and outcome of acute respiratory failure in HIV-infected patients. Intensive Care Med. 2009 Oct;35(10):1678–86. [ Links ]
5. Swigris JJ, Berry GJ, Raffin TA, Kuschner WG. Lymphoid interstitial pneumonia: a narrative review. Chest. 2002 Dec;122(6):2150–64. [ Links ]
6. Blumberg HM, Burman WJ, Chaisson RE, Daley CL, Etkind SC, Friedman LN, et al. American Thoracic Society/Centers for Disease Control and Prevention/ Infectious Diseases Society of America: treatment of tuberculosis. Am J Respir Crit Care Med. 2003 Feb 15;167(4):603–62. [ Links ]
7. Sarosi GA, Johnson PC. Disseminated histoplasmosis in patients infected with human immunodeficiency virus. Clin Infect Dis. 1992 Mar;14 Suppl 1:S60–7. [ Links ]
8. Baughman RP. Cytomegalovirus: the monster in the closet? Am J Respir Crit Care Med. 1997 Jul;156(1): 1–2. [ Links ]
9. Zingale A, Carrera P, Lazzarin A, Scarpellini P. Detection of Pneumocystis carinii and characterization of mutations associated with sulfa resistance in bronchoalveolar lavage samples from human immunodeficiency virus-infected subjects. J Clin Microbiol. 2003 Jun;41(6):2709–12. [ Links ]
10. Lundberg BE, Davidson AJ, Burman WJ. Epidemiology of Pneumocystis carinii pneumonia in an era of effective prophylaxis: the relative contribution of non-adherence and drug failure. AIDS. 2000 Nov 10;14(16):2559–66. [ Links ]
11. Miller RF, Allen E, Copas A, Singer M, Edwards SG. Improved survival for HIV infected patients with severe Pneumocystis jirovecii pneumonia is independent of highly active antiretroviral therapy. Thorax. 2006 Aug;61(8):716–21. [ Links ]
12. Boonsarngsuk V, Sirilak S, Kiatboonsri S. Acute respiratory failure due to Pneumocystis pneumonia: outcome and prognostic factors. Int J Infect Dis. 2009 Jan;13(1):59–66. [ Links ]
13. Bang D, Emborg J, Elkjaer J, Lundgren JD, Benfield TL. Independent risk of mechanical ventilation for AIDS-related Pneumocystis carinii pneumonia associated with bronchoalveolar lavage neutrophilia. Respir Med. 2001 Aug;95(8):661–5. [ Links ]
14. Benfield TL, Helweg-Larsen J, Bang D, Junge J, Lundgren JD. Prognostic markers of short-term mortality in AIDS-associated Pneumocystis carinii pneumonia. Chest. 2001 Mar;119(3):844–51. [ Links ]
15. Budka H. Neuropathology of human immunodeficiency virus infection. Brain Pathol. 1991 Apr;1(3):163–75. [ Links ]
16. Valcour V, Sithinamsuwan P, Letendre S, Ances B. Pathogenesis of HIV in the central nervous system. Curr HIV/AIDS Rep. 2011 Mar;8(1):54–61. [ Links ]