Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.26 no.2 Medellín Apr./June 2013
ARTÍCULO DE REVISIÓN
Nódulo tiroideo, enfoque y manejo. Revisión de la literatura
Approach and management of thyroid nodule. A literature review
Alejandro Román-González1; Lina Restrepo Giraldo2; Catalina Alzate Monsalve3; Alejandro Vélez4; Johnayro Gutiérrez Restrepo5
1 Residente de Medicina Interna, Facultad de Medicina, Universidad de Antioquia. Grupo Endocrinología y Metabolismo, Medellín, Colombia. alejoroman@gmail.com
2 Especialista en Medicina Interna. Residente de Endocrinología, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. linamen20@gmail.com
3 Especialista en Medicina Interna. Residente de Endocrinología, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. dicata81@hotmail.com
4 Médico Universidad Pontificia Bolivariana; Patólogo Universidad de Antioquia. Hospital Pablo Tobón Uribe, Profesor de patología CES. Correspondencia: Alejandro Román-González, Universidad de Antioquia. Grupo Endocrinología y Metabolismo; alejoroman@gmail.com
5 Especialista en Medicina Interna. Endocrinólogo, Hospital Pablo Tobón Uribe. Profesor, Sección de Endocrinología, Departamento de Medicina Interna, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. johnayro@hotmail.com
Recibido: marzo 01 de 2012
Aceptado: septiembre 14 de 2012
RESUMEN
Introducción: el nódulo tiroideo es un hallazgo común en la actualidad, cuya incidencia viene en aumento. El objetivo principal durante la evaluación es distinguir el nódulo benigno del maligno.
Materiales y métodos: se hizo una revisión narrativa de la literatura mediante búsqueda en Ovid, Medline y Lilacs desde 1950 a 2010.
Resultados: la mayoría de los nódulos tiroideos son benignos, solo 4% a 8% de los casos pueden ser malignos. Los nódulos mayores de un centímetro se deben estudiar mediante aspirado con aguja fina; sin embargo, se deben tener en cuenta las características clínicas del paciente y las características ecográficas del nódulo. Entre los factores de riesgo asociados a la presencia de nódulo están la edad por encima de 45 años, el sexo femenino y el tabaquismo. No se recomienda la medición de marcadores tumorales en el estudio de los pacientes con nódulo tiroideo.
Conclusión: la ecografía de tiroides y el aspirado con aguja fina son los métodos diagnósticos más importantes en la evaluación del nódulo tiroideo y han permitido cambiar las conductas terapéuticas disminuyendo el número de tiroidectomías innecesarias. El tratamiento y el pronóstico dependen de los factores de riesgo y de los hallazgos citológicos y patológicos.
PALABRAS CLAVE
Cáncer de Tiroides, Citología, Ecografía de Tiroides, Enfermedades de la Tiroides, Factores de Riesgo, Nódulo Tiroideo
SUMMARY
Introduction: Thyroid nodules are commonly found, and their incidence is increasing. The main objective during the evaluation of these nodules is to determine if they are benign or malignant.
Materials and methods: We made a narrative review of the literature by searching Ovid, Medline and Lilacs from 1950 to 2010.
Results: Most thyroid nodules are benign, but in 4% to 8% of cases they may be malignant, hence the importance of appropriate study and management. Nodules larger than 1 cm should undergo fine needle aspirate; however, the clinical features of the patient and the characteristics of the nodule on ultrasound assessment should always be taken into account. The following are risk factors associated with the presence of thyroid nodules: age over 45 years, female gender and smoking. The measurement of tumor markers in the initial study of patients with thyroid nodule is not recommended.
Conclusion: Ultrasound and thyroid fine needle aspirate are the most important diagnostic methods in the evaluation of thyroid nodules, because they enable to make changes in therapeutic decisions thus decreasing the number of unnecessary thyroidectomies. Treatment and prognosis of thyroid nodules will depend on the patient's risk factors and the cytological and pathological findings.
KEY WORDS
Cytology, Risk Factors, Thyroid Disease, Thyroid Nodule, Thyroid Ultrasound, Thyroid Cancer
INTRODUCCIÓN
Se define el nódulo tiroideo como una lesión intratiroidea radiológicamente distinta al parénquima que la rodea. En la mayoría de los casos es una alteración benigna, pero se debe descartar un proceso neoplásico subyacente en algunos pacientes, según las características clínicas y ecográficas. Usualmente es una lesión asintomática, pero el desarrollo de las nuevas técnicas de ultrasonido ha aumentado la frecuencia de su diagnóstico y por ende su incidencia (1). Por tal razón, es necesario un estudio juicioso en todo paciente con un nódulo tiroideo con el fin de evitar estudios invasivos innecesarios y detectar aquellos con riesgo aumentado de neoplasia.
EPIDEMIOLOGÍA Y CLÍNICA
El nódulo tiroideo es una enfermedad común. La prevalencia en personas sanas depende del método que se use para evaluarla. En 4% a 7% de la población general hay un nódulo palpable (2), pero su detección es menos frecuente por este método cuando mide menos de un centímetro; si se usa el ultrasonido para buscarlo su frecuencia aumenta al 30% (3,4). En estudios posmortem de pacientes sin enfermedad tiroidea previa conocida se ha descrito hasta en 50% de los casos (2). Distintos estudios han evaluado la presencia del nódulo tiroideo mediante ecografía de alta resolución y han encontrado lesiones hasta en 67% de la población (3,5,6), sensibilidad muy superior a la de la palpación que es el método menos sensible (7). Se ha encontrado casualmente un nódulo tiroideo mediante tomografía computarizada en 16,8% de los pacientes (8) y en 2% de aquellos a quienes se les hace tomografía de emisión de positrones (TEP) con 18 fluorodeoxiglucosa (18FDG) por alguna razón no relacionada con enfermedad tiroidea (9). El riesgo de malignidad en este último caso es del 33% si la captación en la tiroides es focal (10,11).
Varios investigadores han tratado de establecer factores de riesgo para el desarrollo del nódulo tiroideo, pero el estudio más importante lo llevaron a cabo Knudsen y colaboradores (12) quienes evaluaron una cohorte de 4.649 daneses y encontraron como más importantes el sexo femenino, la edad avanzada y el tabaquismo; 94% de los casos ocurrieron en mujeres. Se puede presentar en todas las edades, con mayor incidencia entre la tercera y cuarta décadas de la vida. Otras condiciones asociadas por diferentes autores al nódulo tiroideo son la historia de irradiación a la cabeza y el cuello, la deficiencia de yodo, el embarazo y la multiparidad (4). Es muy difícil precisar la prevalencia de malignidad entre los nódulos, porque dependiendo del método diagnóstico la tasa varía entre 4% y 8%. La gran mayoría de los bocios nodulares son asintomáticos, pero pueden tener alteraciones de la función tiroidea (menos del 1% de hipertiroidismo en los adenomas tóxicos y el bocio multinodular tóxico) o síntomas locales compresivos en los casos de bocio de gran tamaño (uninodulares o multinodulares) o en los cánceres invasivos (9).
Tamaño del nódulo tiroideo
Los métodos imaginológicos actuales permiten reportar nódulos tiroideos menores de un centímetro (subcentimétricos). Múltiples sociedades científicas han conceptuado que los nódulos clínicamente significativos que requieren estudio histológico son los mayores de un centímetro, sólidos o con componente mixto sólido-quístico (13,14). A pesar de ello, algunos autores han propuesto estudiar los nódulos menores de un centímetro, los cuales se deben evaluar cuidadosamente porque la frecuencia en ellos de un microcarcinoma papilar va desde 2% hasta 36% de los casos (15-17), por lo que se deduce que no todos los pacientes tienen una lesión maligna subyacente ni requieren cirugía. Además, no se ha establecido que haya un beneficio claro en cuanto a la mortalidad al tratar a los pacientes con microcarcinomas papilares mediante cirugía, y se sabe que el pronóstico de estos pacientes es mucho mejor que el de aquellos con tumores que miden más de un centímetro (18). Por el contrario, otros autores han encontrado que la presencia de malignidad en el nódulo tiroideo es independiente del tamaño (19). Este continúa siendo un asunto controversial en el ámbito mundial. Por todo lo anterior, se deben seguir las recomendaciones de las diferentes guías hasta que se tenga más evidencia en la literatura médica. La guía Recomendaciones de la Sociedad Latinoamericana de Tiroides para el Manejo de Nódulos Tiroideos recomienda al respecto que los nódulos menores de un centímetro sean seguidos anualmente con ecografía (13). Si hay evidencia de crecimiento, invasión extracapsular, ganglios linfáticos cervicales sospechosos, historia familiar de carcinoma medular o neoplasia endocrina múltiple tipo 2, se debe hacer aspirado con aguja fina (ACAF) (13). La guía revisada de la Asociación Americana de Tiroides (ATA) (18) recomienda hacer ACAF en los nódulos subcentimétricos acompañados de ganglios cervicales anormales y en los mayores de cinco milímetros con características ecográficas sospechosas o sin ellas, pero con historia de alto riesgo como lo son las siguientes circunstancias: antecedente de cáncer de tiroides en uno o más familiares en primer grado, historia de radiación en la niñez, radiación ionizante en la niñez o la adolescencia, hemitiroidectomía previa por cáncer, mutación en el protooncogén RET asociada a cáncer medular de tiroides familiar o neoplasia endocrina múltiple, calcitonina por encima de 100 pg/mL y concentración focal de 18FDG en la TEP (18,20,21).
Las características ecográficas sospechosas de malignidad en el nódulo son: microcalcificaciones (principalmente centrales), hipoecogenicidad, aumento de la vascularización (en la zona central más que en la periferia), márgenes infiltrativos y tamaño más alto que ancho en la visión transversa (18,20,21).
Evaluación del nódulo tiroideo
En todo paciente con nódulo tiroideo son esenciales una historia clínica y un examen físico completos; lo mismo es válido para quien consulta por presentar una masa en el cuello o trae un reporte imaginológico en el que se encontró casualmente un nódulo tiroideo. En particular, es de suma importancia identificar la exposición a radiación en la niñez o en la juventud, antecedente de linfoma, historia familiar de carcinoma papilar o medular de tiroides o de otros trastornos familiares como la neoplasia endocrina múltiple tipo 2, el síndrome de Cowden, el síndrome de Werner, el complejo de Carney y la poliposis colónica familiar. Se han encontrado algunas características clínicas que tienen mayor asociación con malignidad en un nódulo tiroideo como la edad menor de 45 años (22) y la disfonía, la disfagia y la disnea que tienen una asociación específica, pero poco sensible (22,23).
En el examen físico se debe hacer una inspección cuidadosa buscando signos de enfermedad tiroidea como oftalmopatía y bocio. La palpación del cuello debe incluir no solo las características de la glándula y del nódulo, sino también una búsqueda sistemática de adenopatías cervicales (24).
El estudio de todo paciente debe incluir como mínimo una determinación del nivel de hormona estimulante de la tiroides (TSH). Se ha encontrado que el hipotiroidismo subclínico o clínico (TSH elevada) es un factor asociado a la presencia de malignidad (25). Si la TSH está suprimida, se debe medir la T4 libre y solicitar un estudio de gammagrafía. Algunos autores proponen hacer además una medición de calcitonina en todos los pacientes con nódulo tiroideo (26-28), pero por la baja frecuencia de cáncer medular de tiroides (29) (prevalencia en nódulo tiroideo de 0,4% a 1,4%), se considera que solo se debe medir en los pacientes con historia familiar de este tumor o de neoplasia endocrina múltiple. La interpretación de la calcitonina sérica elevada es difícil por los múltiples modificadores de su concentración sérica y para mejorar su desempeño diagnóstico se requeriría la confirmación con la prueba de estímulo con pentagastrina o con calcio (27); estos estudios aumentarían mucho los costos y su realización no sería costo-efectiva para una enfermedad tan infrecuente. No se recomiendan las mediciones de tiroglobulina porque no aportan al manejo. La utilidad de este marcador reside en el seguimiento de los pacientes con cáncer diferenciado de tiroides tratado, para detectar recaídas locales o metástasis a distancia (30).
A todo paciente con nódulo tiroideo diagnosticado por métodos clínicos o imaginológicos se le debe hacer una ecografía de tiroides. Los siguientes datos ecográficos se consideran de utilidad para el diagnóstico de malignidad (31,32):
- Microcalcificaciones (sensibilidad 26% a 59%, especificidad 86% a 95%).
- Tamaño mayor de cuatro centímetros; en estos casos se recomienda de entrada la conducta quirúrgica para hacer el diagnóstico histológico de la lesión pues el riesgo de malignidad puede llegar hasta el 20%.
- Vascularización intranodular (sensibilidad 54% a 74%, especificidad 79% a 81%).
- Bordes irregulares o microlobulados (sensibilidad 17% a 78%, especificidad 39% a 85%).
- Hipoecogenicidad (sensibilidad 27% a 87%, especificidad 43% a 94%).
- Componente sólido (sensibilidad 69% a 75%, especificidad 53% a 56%).
- Imágenes vasculares intranodulares (especificidad 80%).
- Nódulo más largo (diámetro AP) que ancho (diámetro transversal): relación longitud/anchura mayor de 1.
La coexistencia de dos o más de estas características aumenta el riesgo de que haya cáncer de tiroides (31). Estos hallazgos no son patognómicos de neoplasia, pero deben alertar al clínico y guiarlo en la decisión de solicitar aspirado del nódulo. Las siguientes son las indicaciones para el estudio citológico (1):
- Todo nódulo mayor de un centímetro.
- Nódulos (de cualquier tamaño) que cumplan con alguna de las siguientes condiciones:
- Características clínicas o historia familiar de alto riesgo (descritas arriba).
- Características ecográficas sospechosas
- Adenopatías ipsilaterales a la lesión
- Parálisis de las cuerdas vocales
- Crecimiento extracapsular
- Historia de irradiación en la infancia
Los nódulos tiroideos autónomos no requieren evaluación citológica debido a la baja probabilidad de que estén asociados con neoplasia; de ahí la importancia de la correlación con el perfil de función tiroidea (33).
El ACAF para estudio citológico se debe hacer idealmente bajo guía ecográfica, porque así tiene mayor sensibilidad y ha demostrado disminuir el número de falsos negativos, principalmente en lesiones con componente mixto o quísticas complejas (34,35); en los casos de enfermedad multinodular se debe hacer biopsia del nódulo dominante (el que presente características sugestivas de malignidad y no necesariamente del nódulo de mayor tamaño). Siempre que se haya hecho el ACAF guiado por palpación con resultados no concluyentes, es obligatorio repetirlo bajo guía ecográfica (34-36).
En la tabla 1 se presentan las recomendaciones de la última guía de la American Thyroid Association para la toma de biopsia de nódulos tiroideos (18).
Hallazgos en la citología
El reporte de la biopsia por aspirado con aguja fina (ACAF) se debe clasificar de la siguiente manera (37,38): Diagnóstico o satisfactorio: mínimo seis grupos celulares con al menos 10 células foliculares tiroideas cada uno; No diagnóstico o no satisfactorio.
Diagnóstico y criterios morfológicos según Bethesda (38)
Comprende seis categorías: 1. Benigno; 2. Atípico/ Indeterminado (ASCUS, atypical squamous cell of undetermined significance); 3. Patrón folicular (Neoplasia/Lesión). 4. Sospechoso de malignidad; 5. Maligno; 6. Insatisfactorio.
Benigno
Bajo este término se agrupan las lesiones con bajo riesgo de neoplasia tiroidea. Para disminuir la tasa de falsos negativos (que normalmente es del 5%), se recomienda el seguimiento clínico con exploración ecográfica y nueva punción si hay crecimiento significativo de la lesión. Se exponen a continuación brevemente los criterios morfológicos de las lesiones que componen el grupo.
Bocio coloide o nodular: abundante coloide. Placas de células foliculares pequeñas, benignas (ausencia de las características nucleares del carcinoma papilar). Macrofolículos, macrófagos, metaplasia oncocítica.
Bocio tirotóxico-hiperfuncional: fondo hemático sin coloide. Celularidad moderada. Grupos dispersos de pequeño tamaño. Núcleos redondos y agrandados (anisocariosis) con nucléolo único. Vacuolización citoplasmática marginal en llamarada.
Tiroiditis linfocítica crónica: mezcla de células linfoides maduras y células foliculares grandes con frecuente cambio oncocítico. Ausencia de coloide. Células gigantes ocasionales.
Tiroiditis subaguda o de células gigantes: fondo inflamatorio mixto linfo-monocitario. Granulomas epitelioides. Células gigantes multinucleadas. Cambios epiteliales regresivos (degeneración gránulovacuolar). Ausencia de coloide.
Atípico/Indeterminado (células atípicas de significado indeterminado, ASCUS)
No se puede excluir la presencia de una neoplasia con base en los datos citológicos. Bethesda recomienda en estos casos (38), si se puede, informar si el cuadro citológico sugiere un proceso hiperplásico o uno neoplásico.
En este grupo, más que en otros, es fundamental analizar conjuntamente la citología, la clínica y la radiología (triple test), así como repetir la punción siempre que se considere necesario. En 80% a 96% de los ASCUS se aclara el diagnóstico después de repetir la punción. El promedio de lesiones malignas de los ASCUS es de 5% a 10%, por lo que inicialmente no está justificada la cirugía. El porcentaje de ASCUS en citologías de tiroides debe ser menor del 7% del total de muestras analizadas.
Ahora bien, el análisis molecular del tejido tiroideo puede tener un papel importante en el futuro (39); en este sentido, Alexander y colaboradores (40) efectuaron un estudio prospectivo en pacientes con citología indeterminada del nódulo tiroideo. Mediante técnicas de biología molecular (micromatrices de ARN) (41) clasificaron el perfil genético del tejido tiroideo indeterminado como sospechoso de malignidad o no con sensibilidad del 9% y especificidad del 52% y valor predictivo negativo entre 85% y 95%.
Patrón folicular (Neoplasia/Lesión)
Bajo este término se agrupan las lesiones con riesgo bajo-medio de neoplasia. Incluye lesiones/neoplasias de patrón folicular, no papilar, y las lesiones/neoplasias de células de Hürthle.
Se sabe bien que los carcinomas foliculares poco diferenciados muestran rasgos citológicos obvios de malignidad; no obstante, esta categoría se fundamenta en la dificultad de diferenciar por citología los adenomas foliculares de los carcinomas foliculares bien diferenciados. Estas lesiones solo se pueden diagnosticar con certeza después de un cuidadoso examen de la cápsula y de los canales vasculares por medio de múltiples secciones del nódulo extirpado. La mayoría de estas lesiones terminan en cirugía (hemitiroidectomía), y se encuentran en la patología final nódulos adenomatoides, adenomas o carcinomas foliculares o de células de Hürthle, con un porcentaje de carcinomas del 20% al 30%. Este porcentaje de malignidad es mayor si se trata de lesiones de células de Hürthle (20% a 45%) y si su tamaño es mayor de 3,5 centímetros.
Patrón Neoplasia folicular: se observa un coloide escaso y denso (en pasta de dientes), o ausente. Hay elevada celularidad y presencia de microfolículos o grupos de aspecto sincitial. Se encuentran núcleos de mayor tamaño que en el bocio coloide y no hay criterios nucleares de carcinoma papilar.
Patrón Neoplasia folicular oncocítica (células de Hürthle): el coloide es escaso y denso o está ausente. Hay una elevada celularidad escasamente cohesiva y las células son grandes de hábito oncocítico con citoplasma granular. Los núcleos son grandes con nucléolos prominentes.
Sospechoso de malignidad
Bajo esta denominación se agrupan las lesiones sugestivas, pero no concluyentes de malignidad. Obviamente, se deben excluir de esta categoría las proliferaciones o neoplasias foliculares. Los patólogos deben tratar de decir cuál es la neoplasia sospechada.
En el caso del carcinoma papilar se ha comprobado que 75% corresponden a la variante folicular de este tumor.
Cuando se sospecha un carcinoma medular conviene hacer pruebas para detectar calcitonina en el material citológico y/o recomendar la comprobación del nivel sérico de calcitonina.
Se debe sospechar el carcinoma anaplásico cuando las células atípicas sean muy escasas o mal conservadas, pero se observa fondo necrótico con polimorfonucleares.
Cuando se sospecha la posibilidad de linfoma se debe recomendar un nuevo ACAF con estudio mediante citometría de flujo.
Maligno
Bajo este término se agrupan las lesiones malignas con posibilidad de diagnóstico citológico: incluye el carcinoma papilar y sus variantes, el carcinoma medular, el carcinoma anaplásico, el linfoma y las metástasis. Constituyen de 3% a 7% del total de citologías de tiroides.
Carcinoma papilar: se observan extendidos muy celulares con placas o grupos tridimensionales. Los núcleos son grandes, pálidos, hendidos y con inclusiones. El citoplasma es denso (escamoide) y el coloide, escaso y viscoso (en chicle). Se observan cuerpos de psammoma y ocasionales células gigantes multinucleadas.
Carcinoma medular: los extendidos son muy celulares, con células sueltas o formando pequeños grupos. Los citoplasmas son globoides, triangulares o fusiformes (en cometa) con granulación metacromática. Se observan núcleos excéntricos, a veces dobles. Hay pseudoinclusiones nucleares, ausencia de coloide y presencia de amiloide.
Carcinoma anaplásico: tiene un fondo necróticoinflamatorio (causa de confusión con tiroiditis aguda) con células grandes, polimorfas, escamoides o fusiformes, muy atípicas. El núcleo es grande e irregular a veces múltiple. Se observan células gigantes multinucleadas de tipo osteoclástico.
Linfoma: los extendidos son muy celulares sin coloide. Se encuentra una población celular monomorfa de hábito linfoide. Las células son siempre aisladas. Hay cuerpos linfoglandulares.
Insatisfactorio
Incluye los casos con celularidad limitada o sin ella, o con fijación defectuosa. Se debe recomendar la repetición de la punción en tres meses.
Como se mencionó previamente, el criterio de adecuación celular propuesto en el consenso de Bethesda es la presencia de seis grupos celulares en dos portaobjetos que contengan al menos 10 a 20 células bien conservadas cada uno (38).
La proporción de muestras inadecuadas oscila, en la mayoría de estudios, entre 5% y 15%. Si se excede esta proporción se debe revisar la técnica (38).
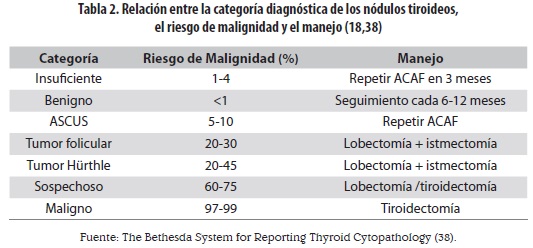
En la tabla 2 se presenta la relación entre los diferentes subtipos de la clasificación de los nódulos tiroideos, el riesgo de malignidad y la conducta adecuada para su manejo.
Conducta según los hallazgos del ACAF
Nódulos con ACAF no diagnóstico: se recomienda repetir el ACAF en tres meses guiado por ecografía (grado B) (42-44). La tasa de malignidad calculada varía entre 2% y 12%. Si el paciente presenta un nódulo sólido y a pesar de repetir el estudio no se logra hacer un citodiagnóstico, debe ser llevado a cirugía (grado C) (37,42-44). Si el nódulo es completamente quístico se puede seguir clínica y ecográficamente. Si presenta una lesión compleja, se debe correlacionar con la historia familiar y los factores de riesgo tanto ecográficos como clínicos y plantear la resección quirúrgica (43).
Nódulos con citodiagnóstico benigno: la probabilidad de malignidad es baja, por lo que no se recomienda repetir el aspirado. Se debe continuar el seguimiento clínico y con ecografía y TSH cada seis a 18 meses; solo se debe hacer nuevo ACAF en caso de hallazgos ecográficos sospechosos de malignidad, aumento del volumen mayor del 50% o de dos milímetros en el tamaño en al menos dos de sus dimensiones. No se recomienda terapia supresora con levotiroxina. Se recomienda hacer la hemitiroidectomía solo si se presentan síntomas por compresión local, hay historia de irradiación previa o por razones cosméticas (grado D) (42-44).
Lesiones foliculares: existe un riesgo de malignidad del 20%; no se recomienda repetir el ACAF (grado C) (42-44). Se deben hacer hemitiroidectomía e istmectomía (grado B) (42- 44). No se recomienda la biopsia por congelación debido a que se requiere evaluar la totalidad de la cápsula de la lesión para poder hacer una diferenciación adecuada entre lesiones benignas y malignas (grado B) (42-44).
Nódulos sospechosos: se recomienda la cirugía (grado B) (42-44) y puede ser útil la biopsia por congelación (grado D) (42-44). Se recomienda, además, hacer ecografía prequirúrgica del cuello con ACAF de las adenopatías sospechosas (grado B) (42-44). En este último escenario, se puede medir la tiroglobulina o la calcitonina en el líquido obtenido por ACAF (grado C) (42-45).
Nódulos con citodiagnóstico de malignidad: tiroidectomía con o sin vaciamiento ganglionar del compartimiento central (42).
PRONÓSTICOS Y DESENLACES
El pronóstico depende de la clasificación citodiagnóstica de la lesión y de la conducta terapéutica adoptada. Se ha informado que dirigir la conducta según el resultado del ACAF ha hecho disminuir en un 50% el número de tiroidectomías innecesarias, disminuyendo en un 25% los costos médicos (46). Hacer un estudio citológico dirigido por ecografía aumenta el rendimiento diagnóstico en casos de cáncer entre 15% y 50% (34,35). En general, los nódulos tiroideos benignos tienden a crecer lentamente; en algunas series se informa que un tercio de ellos permanecen estables y otro tercio pueden disminuir de tamaño o involucionar. Es frecuente que en las mujeres aparezcan nuevos nódulos (47).
El pronóstico de los nódulos malignos tras la cirugía y el tratamiento con yodo radiactivo depende del tipo de carcinoma, el tamaño del nódulo, la amplitud de la resección y si hay extensión metastásica. La frecuencia de complicaciones asociadas al procedimiento quirúrgico varía según la experiencia en los diferentes centros; las complicaciones incluyen hipoparatiroidismo transitorio o definitivo, lesión del nervio laríngeo recurrente, necesidad de traqueostomía y lesión de estructuras vasculares cervicales (48-50).
CONCLUSIONES
La prevalencia de cáncer de tiroides se encuentra en aumento; aunque su tasa de mortalidad es baja, su morbilidad es alta por la frecuencia de recaídas asociados a los estadios más avanzados de la enfermedad en el momento del diagnóstico; por ello, todo paciente con un nódulo tiroideo palpable se debe estudiar inicialmente con una historia clínica adecuada, función tiroidea y ecografía y, según los hallazgos, se debe proceder a investigar si hay neoplasia por medio del ACAF guiado por ecografía. Los hallazgos benignos obligan a hacer seguimiento ecográfico cada seis a 12 meses; los hallazgos no concluyentes obligan a hacer un nuevo ACAF, y los pacientes con hallazgos sugestivos o compatibles con malignidad se deben remitir al endocrinólogo y al cirujano de cabeza y cuello para su tratamiento y seguimiento posterior.
REFERENCIAS BIBLIOGRÁFICAS
1. Maia FFR, Matos PS, Silva BP, Pallone AT, Pavin EJ, Vassallo J, et al. Role of ultrasound, clinical and scintigraphyc parameters to predict malignancy in thyroid nodule. Head Neck Oncol. 2011 Jan;3(6):17. [ Links ]
2. Mortensen JD, Woolner LB, Bennett WA. Gross and microscopic findings in clinically normal thyroid glands. J Clin Endocrinol Metab. 1955 Oct;15(10):1270–80. [ Links ]
3. Ezzat S, Sarti DA, Cain DR, Braunstein GD. Thyroid incidentalomas. Prevalence by palpation and ultrasonography. Arch Intern Med. 1994 Aug 22;154(16):1838–40. [ Links ]
4. Dean DS, Gharib H. Epidemiology of thyroid nodules. Best Pract Res Clin Endocrinol Metab. 2008 Dec;22(6):901–11. [ Links ]
5. Woestyn J, Afschrift M, Schelstraete K, Vermeulen A. Demonstration of nodules in the normal thyroid by echography. Br J Radiol. 1985 Dec;58(696):1179–82. [ Links ]
6. Knudsen N, Bülow I, Jorgensen T, Laurberg P, Ovesen L, Perrild H. Goitre prevalence and thyroid abnormalities at ultrasonography: a comparative epidemiological study in two regions with slightly different iodine status. Clin Endocrinol (Oxf). 2000 Oct;53(4):479–85. [ Links ]
7. Vander JB, Gaston EA, Dawber TR. The significance of nontoxic thyroid nodules. Final report of a 15- year study of the incidence of thyroid malignancy. Ann Intern Med. 1968 Sep;69(3):537–40. [ Links ]
8. Yoon DY, Chang SK, Choi CS, Yun EJ, Seo YL, Nam ES, et al. The prevalence and significance of incidental thyroid nodules identified on computed tomography. J Comput Assist Tomogr. 2008;32(5):810–5. [ Links ]
9. Kang KW, Kim S-K, Kang H-S, Lee ES, Sim JS, Lee IG, et al. Prevalence and risk of cancer of focal thyroid incidentaloma identified by 18F-fluorodeoxyglucose positron emission tomography for metastasis evaluation and cancer screening in healthy subjects. J Clin Endocrinol Metab. 2003 Sep;88(9):4100–4. [ Links ]
10. Are C, Hsu JF, Ghossein RA, Schoder H, Shah JP, Shaha AR. Histological aggressiveness of fluorodeoxyglucose positron-emission tomogram (FDG-PET)-detected incidental thyroid carcinomas. Ann Surg Oncol. 2007 Nov;14(11):3210–5. [ Links ]
11. Bogsrud T V, Karantanis D, Nathan MA, Mullan BP, Wiseman GA, Collins DA, et al. The value of quantifying 18F-FDG uptake in thyroid nodules found incidentally on whole-body PET-CT. Nucl Med Commun. 2007 May;28(5):373–81. [ Links ]
12. Knudsen N, Laurberg P, Perrild H, Bülow I, Ovesen L, Jørgensen T. Risk factors for goiter and thyroid nodules. Thyroid. 2002 Oct;12(10):879–88. [ Links ]
13. Camargo R, Corigliano S, Friguglietti C, Gauna A, Harach R, Munizaga F, et al. Latin American thyroid society recommendations for the management of thyroid nodules. Arq Bras Endocrinol Metabol. 2009 Dec;53(9):1167–75. [ Links ]
14. Cooper DS, Doherty GM, Haugen BR, Hauger BR, Kloos RT, Lee SL, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2009 Nov;19(11):1167–214. [ Links ]
15. Miller MC. The patient with a thyroid nodule. Med Clin North Am. 2010 Sep;94(5):1003–15. [ Links ]
16. Yu X-M, Wan Y, Sippel RS, Chen H. Should all papillary thyroid microcarcinomas be aggressively treated? An analysis of 18,445 cases. Ann Surg. 2011 Oct;254(4):653–60. [ Links ]
17. Kovács GL, Gonda G, Vadász G, Ludmány E, Uhrin K, Görömbey Z, et al. Epidemiology of thyroid microcarcinoma found in autopsy series conducted in areas of different iodine intake. Thyroid. 2005 Feb;15(2):152–7. [ Links ]
18. Cooper DS, Doherty GM, Haugen BR, Hauger BR, Kloos RT, Lee SL, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2009 Nov;19(11):1167–214. [ Links ]
19. Berker D, Aydin Y, Ustun I, Gul K, Tutuncu Y, Isik S, et al. The value of fine-needle aspiration biopsy in subcentimeter thyroid nodules. Thyroid. 2008 Jun;18(6):603–8. [ Links ]
20. Campusano CM, Bello FM, González RE, Lam JE, Liberman CG, Munizaga FC, et al. Consensus report on the diagnosis and management of nonpalpable thyroid nodules]. Rev Med Chil. 2004 Oct;132(10):1249–55. [ Links ]
21. Papini E, Guglielmi R, Bianchini A, Crescenzi A, Taccogna S, Nardi F, et al. Risk of malignancy in nonpalpable thyroid nodules: predictive value of ultrasound and color-Doppler features. J Clin Endocrinol Metab. 2002 May;87(5):1941–6. [ Links ]
22. Raza SN, Shah MD, Palme CE, Hall FT, Eski S, Freeman JL. Risk factors for well-differentiated thyroid carcinoma in patients with thyroid nodular disease. Otolaryngol Head Neck Surg. 2008 Jul;139(1):21–6. [ Links ]
23. Randolph GW, Kamani D. The importance of preoperative laryngoscopy in patients undergoing thyroidectomy: voice, vocal cord function, and the preoperative detection of invasive thyroid malignancy. Surgery. 2006 Mar;139(3):357–62. [ Links ]
24. Bui A, Mazzaferri E. New paradigms in diagnostic and management of thyroid nodules. The Endocrinologist. 2007;17(1):35–45. [ Links ]
25. Boelaert K. The association between serum TSH concentration and thyroid cancer. Endocr Relat Cancer. 2009 Dec;16(4):1065–72. [ Links ]
26. Cheung K, Roman SA, Wang TS, Walker HD, Sosa JA. Calcitonin measurement in the evaluation of thyroid nodules in the United States: a cost-effectiveness and decision analysis. J Clin Endocrinol Metab. 2008 Jun;93(6):2173–80. [ Links ]
27. Herrmann BL, Schmid KW, Goerges R, Kemen M, Mann K. Calcitonin screening and pentagastrin testing: predictive value for the diagnosis of medullary carcinoma in nodular thyroid disease. Eur J Endocrinol. 2010 Jun;162(6):1141–5. [ Links ]
28. Hahm JR, Lee MS, Min YK, Lee MK, Kim KW, Nam SJ, et al. Routine measurement of serum calcitonin is useful for early detection of medullary thyroid carcinoma in patients with nodular thyroid diseases. Thyroid. 2001 Jan;11(1):73–80. [ Links ]
29. Jiménez C, Hu MI-N, Gagel RF. Management of medullary thyroid carcinoma. Endocrinol Metab Clin North Am. 2008 Jun;37(2):481–96, x–xi. [ Links ]
30. Nascimento C, Borget I, Al Ghuzlan A, Deandreis D, Chami L, Travagli JP, et al. Persistent disease and recurrence in differentiated thyroid cancer patients with undetectable postoperative stimulated thyroglobulin level. Endocr Relat Cancer. 2011 Apr;18(2):R29–40. [ Links ]
31. Cohen JI, Salter KD. Thyroid disorders: evaluation and management of thyroid nodules. Oral Maxillofac Surg Clin North Am. 2008 Aug;20(3):431–43. [ Links ]
32. Cox MR, Marshall SG, Spence RA. Solitary thyroid nodule: a prospective evaluation of nuclear scanning and ultrasonography. Br J Surg. 1991 Jan;78(1):90–3. [ Links ]
33. Gabriele R, Letizia C, Borghese M, De Toma G, Celi M, Izzo L, et al. Thyroid cancer in patients with hyperthyroidism. Horm Res. 2003 Jan;60(2):79–83. [ Links ]
34. Kim DW, Lee EJ, Kim SH, Kim TH, Lee SH, Kim DH, et al. Ultrasound-guided fine-needle aspiration biopsy of thyroid nodules: comparison in efficacy according to nodule size. Thyroid. 2009 Jan;19(1):27–31. [ Links ]
35. Izquierdo R, Arekat MR, Knudson PE, Kartun KF, Khurana K, Kort K, et al. Comparison of palpationguided versus ultrasound-guided fine-needle aspiration biopsies of thyroid nodules in an outpatient endocrinology practice. Endocr Pract. 2006;12(6):609–14. [ Links ]
36. Suen KC. Fine-needle aspiration biopsy of the thyroid. CMAJ. 2002 Sep 3;167(5):491–5. [ Links ]
37. Cappelli C, Rosei EA. Fine needle aspiration cytology of thyroid nodule. Thyroid. 2006 Aug;16(8):818. [ Links ]
38. Cibas ES, Ali SZ. The Bethesda System For Reporting Thyroid Cytopathology. Am J Clin Pathol. 2009 Nov;132(5):658–65. [ Links ]
39. Alexander EK. Approach to the patient with a cytologically indeterminate thyroid nodule. J Clin Endocrinol Metab. 2008 Nov;93(11):4175–82. [ Links ]
40. Alexander EK, Kennedy GC, Baloch ZW, Cibas ES, Chudova D, Diggans J, et al. Preoperative diagnosis of benign thyroid nodules with indeterminate cytology. N Engl J Med. 2012 Aug 23;367(8):705–15. [ Links ]
41. Chudova D, Wilde JI, Wang ET, Wang H, Rabbee N, Egidio CM, et al. Molecular classification of thyroid nodules using high-dimensionality genomic data. J Clin Endocrinol Metab. 2010 Dec;95(12):5296–304. [ Links ]
42. Gharib H, Papini E, Paschke R. Thyroid nodules: a review of current guidelines, practices, and prospects. Eur J Endocrinol. 2008 Nov;159(5):493–505. [ Links ]
43. Gharib H, Papini E, Paschke R, Duick DS, Valcavi R, Hegedüs L, et al. American Association of Clinical Endocrinologists, Associazione Medici Endocrinologi, and European Thyroid Association Medical guidelines for clinical practice for the diagnosis and management of thyroid nodules: executive summary of recommendations. Endocr Pract. 2010;16(3):468–75. [ Links ]
44. Ghassi D, Donato A. Evaluation of the thyroid nodule. Postgrad Med J. 2009 Apr;85(1002):190–5. [ Links ]
45. Gharib H, Goellner JR, Zinsmeister AR, Grant CS, Van Heerden JA. Fine-needle aspiration biopsy of the thyroid. The problem of suspicious cytologic findings. Ann Intern Med. 1984 Jul;101(1):25–8. [ Links ]
46. Caplan RH, Kisken WA, Strutt PJ, Wester SM. Fineneedle aspiration biopsy of thyroid nodules. A cost-effective diagnostic plan. Postgrad Med. 1991 Jul;90(1):183–7, 190. [ Links ]
47. McTiernan AM, Weiss NS, Daling JR. Incidence of thyroid cancer in women in relation to reproductive and hormonal factors. Am J Epidemiol. 1984 Sep;120(3):423–35. [ Links ]
48. Sipos JA, Mazzaferri EL. Thyroid cancer epidemiology and prognostic variables. Clin Oncol (R Coll Radiol). 2010 Aug;22(6):395–404. [ Links ]
49. Leboulleux S. Prognostic role of undetectable ablation thyroglobulin and follow-up thyroglobulin in patients with thyroid cancer. Nat Clin Pract Endocrinol Metab. 2008 Aug;4(8):436–7. [ Links ]
50. Vriens MR, Schreinemakers JM, Suh I, Guerrero MA, Clark OH. Diagnostic markers and prognostic factors in thyroid cancer. Future Oncol. 2009 Oct;5(8):1283–93. [ Links ]