Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.26 no.3 Medellín July/Sept. 2013
INVESTIGACIÓN ORIGINAL
Características epidemiológicas y clínicas y hallazgos de laboratorio de los niños menores de 15 años con cetoacidosis diabética atendidos en el Hospital Universitario San Vicente Fundación en Medellín, Colombia, entre enero de 2001 y diciembre de 2010
Epidemiological, clinical and laboratory findings of children younger than 15 years with diabetic ketoacidosis admitted at San Vicente Fundación University Hospital in Medellín, Colombia, between January 2001 and December 2010
Alicia Lucía Ballesteros Calderón1; Ángela Patricia Meneses Muñoz2; David Ríos Patiño3; Iván Darío Flórez4; Augusto Quevedo Vélez5
1 Médica y cirujana, Universidad de Antioquia. Pediatra, Universidad de Antioquia, Medellín, Colombia.
2 Médica y cirujana, Universidad del Cauca, Popayán, Colombia. Pediatra, Universidad de Antioquia, Medellín, Colombia.
3 Estudiante de Medicina, Universidad de Antioquia, Medellín, Colombia.
4 Médico y cirujano, Universidad de Antioquia. Pediatra, Universidad de Antioquia, Medellín, Colombia. Maestría en Ciencias Clínicas (Epidemiología Clínica) , Universidad de Antioquia, Medellín, Colombia.
5 Médico y cirujano, Universidad de Antioquia. Pediatra, Universidad de Antioquia. Maestría en Ciencias Clínicas (Epidemiología Clínica) , Universidad de Antioquia. Jefe, Departamento de Pediatría y Puericultura, Universidad de Antioquia, Medellín, Colombia. quevedoaugusto@gmail.com
Recibido: julio 16 de 2012
Aceptado: febrero 11 de 2013
RESUMEN
Introducción: la cetoacidosis diabética (CAD) es la complicación aguda más importante en los niños con diabetes mellitus. Nuestro objetivo fue determinar las características epidemiológicas y clínicas y los hallazgos de laboratorio de nuestra población pediátrica con CAD.
Metodología: estudio descriptivo retrospectivo, de episodios de CAD en menores de 15 años, admitidos entre 2001 y 2010 al Hospital Universitario San Vicente Fundación (Medellín, Colombia) . Se obtuvo la información en las historias clínicas y se la analizó usando estadística descriptiva.
Resultados: se incluyeron 98 episodios de CAD en 77 pacientes con edad promedio de 8,7 años, 57,1% de ellos, niñas y 23,4% sin afiliación al Sistema de Seguridad Social en Salud; 53,1% debutaron como CAD. De aquellos con diagnóstico previo de DM1, 64,4% no habían tenido adherencia al tratamiento. Al admitirlos, 42,8% tenían infección. El tiempo transcurrido entre el inicio de los síntomas y la consulta fue de 41 horas en los que tenían diagnóstico previo de DM1 y de 120 horas en los diagnosticados de novo. Predominó la CAD grave: 41,8%. El pH al ingreso fue 7,12 (DE: 0,12) . Durante el tratamiento 28,6% desarrollaron hipoglicemia y 5,1%, edema cerebral; la mortalidad fue 2%.
Conclusiones: las características clínicas y de laboratorio de nuestros pacientes con CAD son similares a las reportadas en otros estudios. La falta de adherencia al tratamiento y las infecciones pueden ser una causa importante y evitable de descompensación.
PALABRAS CLAVE
Acidosis Metabólica, Cetoacidosis, Diabetes, Edema Cerebral
SUMMARY
Introduction: Diabetic ketoacidosis (DKA) is the most important acute complication in children with diabetes mellitus. Our objective was to determine the clinical and epidemiological characteristics, and the laboratory findings in the pediatric population with DKA at a third-level hospital in Medellín, Colombia.
Methodology: A descriptive, retrospective study of DKA in children under 15 years. Information was obtained from the clinical records and analyzed with descriptive statistics.
Results: 98 episodes of DKA in 77 patients were included. Average age of patients was 8.7 years, 57.1% were girls, and 23.4% had no health security coverage. In 53.1%, DKA was the presenting manifestation of DM. Out of those with previous DM1 diagnosis, 64.4% had not adhered to treatment. On admission, 42.8% had infections. Time between the onset of symptoms and the consultation was 41 hours in those with previous DM1 diagnosis, and 120 hours in the ones diagnosed de novo. Severe DKA was the predominant one: 41.8%. On admission, pH was 7.1 (SD: 0.12) . During treatment, 28.6% developed hypoglycemia and 5.1%, cerebral edema. Two patients died.
Conclusions: Clinical and laboratory characteristics of our patients with DKA are similar to those reported by other authors. Lack of adherence to treatment and infections may be important and avoidable causes of decompensation.
KEY WORDS
Cerebral Edema, Diabetes Mellitus, Ketoacidosis, Metabolic Acidosis
INTRODUCCIÓN
La diabetes mellitus tipo 1 (DM1) es la enfermedad endocrina crónica más frecuente de la niñez y afecta aproximadamente a 15 millones de personas en todo el mundo (1,2) . En Estados Unidos su incidencia es de 14,9 casos por cada 100.000 habitantes y cerca de 40% de los pacientes son menores de 20 años (1) . En Colombia, según el Diamond Project Group, la incidencia en el año 2000 fue de 3,8 casos por 100.000 habitantes (2,3) . La morbilidad y mortalidad en estos pacientes se deben principalmente a una de sus complicaciones agudas, la cetoacidosis (1,3,4) .
La cetoacidosis diabética (CAD) es un trastorno metabólico agudo caracterizado por la presencia de acidosis metabólica, hiperglicemia, cetonemia y cetonuria y causado por un déficit absoluto o relativo de insulina asociado al aumento de las hormonas contrarreguladoras: catecolaminas, glucagón, corticoides y hormona del crecimiento.
La incidencia anual de la CAD es de 4,8 a 8 episodios por cada 1.000 pacientes con DM1 (4-6) . Wolfsdorf y colaboradores anotan en su publicación que es más común en niños menores de 5 años y con nivel socioeconómico bajo (7) . Alrededor del 40% de los niños con DM1 tienen como manifestación inicial de su enfermedad un evento de CAD (8-10) , pero se observa con mayor frecuencia en países donde no hay fácil acceso a los recursos de salud, ni educación sobre el reconocimiento temprano de los síntomas (8) . En pacientes con DM1 ya diagnosticada la tasa de presentación anual es del 10%, asociada principalmente a omisión o mal uso de la insulina (8-11) . La CAD es la primera causa de hospitalización en pacientes diabéticos menores de 19 años (1) con una tasa de mortalidad alrededor del 10% (12).
Los pacientes presentan poliuria, polidipsia, pérdida de peso, cefalea, dolor abdominal y vómito, y pueden estar letárgicos, taquipneicos, con respiración acidótica y deshidratación (12) . Los criterios bioquímicos determinados por el último consenso ISPAD 2009 para el diagnóstico de la CAD son: hiperglicemia mayor de 200 mg/dL, acidosis metabólica con bicarbonato menor de 15 mmol/L, pH venoso menor de 7,30, cetonuria y/o cetonemia (13,14) . Se clasifica de la siguiente manera: leve: bicarbonato entre 10 y 14,9 mmol/L y pH entre 7,2 y 7,29; moderada: bicarbonato entre 5 y 9,9 mmol/L y pH entre 7,1 y 7,19; grave: bicarbonato menor de 5 mmol/L y pH menor de 7,1 (14) . En los diferentes trabajos la mediana del pH de ingreso a los servicios de urgencia en grupos pediátricos es variable: entre 7,06 y 7,12 para Glaser; 7,11 para Lightner y 7,17-7,18 para Della Manna y colaboradores (15-17) . El pH al ingreso se considera un marcador de gravedad en la presentación de la CAD (18,19).
En los análisis de laboratorio se encuentran acidosis metabólica con brecha aniónica amplia, cetonemia, cetonuria, glucosuria e hiperglicemia (14) . El tratamiento de la cetoacidosis se basa en la administración de fluidos intravenosos, insulina de acción rápida y un control clínico estricto.
En la CAD, la acidosis metabólica es multifactorial: inicialmente se explica por la presencia de cetoácidos, pero en estados más tardíos hay acidosis láctica debido a la deshidratación e hipoperfusión. El tratamiento recomendado para la hidratación en la gran mayoría de las guías es con solución salina al 0,9%, la cual aporta una carga alta de cloro que puede prolongar la acidosis a pesar de la corrección del estado hemodinámico y metabólico. El análisis de la acidosis en los pacientes con CAD, con base en el método de Stewart (18) , ha demostrado la importancia de la diferencia de iones fuertes (DIF) en la fisiopatología de este trastorno y plantea la posibilidad teórica de evitar el uso de solución salina en la reanimación por favorecer la persistencia de la acidosis.
La complicación más temida de la CAD es el edema cerebral (20,21) , presente hasta en 1% de los casos; constituye la principal causa de muerte: 24% del total (22) . Su etiología es aún desconocida, pero se han descrito algunos factores de riesgo, entre ellos: acidosis e hiperglicemia grave, edad menor de 5 años e hiponatremia. Otras complicaciones frecuentes incluyen: hipokalemia, hiperkalemia, hipoglicemia e hipofosfatemia (19).
La gran mayoría de las guías de manejo y consensos publicados sobre el tema se basan en la epidemiología y los recursos de los países desarrollados, con características que pueden ser sustancialmente distintas a las de los pacientes de países en vías de desarrollo como el nuestro, tales como etnia, estado nutricional, dieta, dificultades geográficas, económicas y administrativas para el acceso a los servicios de salud y además falta de educación. En los pocos estudios llevados a cabo en Latinoamérica se ha observado mayor gravedad al ingreso de los pacientes, con tasas más altas de mortalidad (3,6) . Por lo anterior, es probable que los consensos y protocolos no se ajusten adecuadamente a nuestro medio, lo que hace necesario caracterizar mejor nuestra población y ampliar el sustento teórico para facilitar el desarrollo de guías locales de tratamiento.
Dada la escasez de información en nuestro país y considerando la CAD como una causa importante de morbilidad y mortalidad en la niñez, es nuestro interés describir las características epidemiológicas, clínicas y de laboratorio, y las complicaciones de los niños menores de 15 años atendidos en el Hospital Universitario San Vicente Fundación (HUSVF) así como las características de la acidosis metabólica desde el ingreso y su evolución con el tratamiento.
MATERIALES Y MÉTODOS
Se hizo un estudio descriptivo retrospectivo en niños menores de 15 años con diagnóstico de CAD, admitidos al servicio de urgencias pediátricas del HUSVF desde el 1 de enero del 2001 al 31 de diciembre del 2010. La población incluyó todo registro que cumpliera los siguientes criterios: pH menor de 7,30, HCO3 estándar menor de 15 mmol/L, glicemia mayor de 200 mg/dL y cuerpos cetónicos positivos en suero o más de 3+ en orina en caso de tener esta medición. Se excluyeron los pacientes cuya historia clínica no se encontró en el archivo y los que tenían un registro insuficiente de los datos; además, aquellos en que se registró en la historia el diagnóstico de cetoacidosis, pero que al revisarla no cumplieron los criterios para tal diagnóstico. Se hizo la búsqueda mediante la base de datos electrónica del Departamento de Estadística del HUSVF, según la fecha de hospitalización y el código del diagnóstico principal o secundario de CAD, registrado al ingreso o en el momento del alta hospitalaria. Se obtuvo aprobación de los comités de ética de la Facultad de Medicina de la Universidad de Antioquia y el HUSVF. La revisión de historias en el archivo clínico la hicieron dos estudiantes de posgrado en Pediatría y uno de pregrado en Medicina. Los datos obtenidos se consignaron en el formulario de recolección diseñado para tal efecto y se procesaron con el software SPSS versión 17.0.
Se utilizaron las pruebas de chi cuadrado para comparar las variables cualitativas y de t-Student para la comparación de medias de las variables cuantitativas. Se consideraron significativos los valores de p inferiores a 0,05.
Se analizaron los factores de riesgo que se han encontrado en la literatura tales como: pH, exceso de bases (EB) , brecha aniónica (BA) , diferencia de iones fuertes (DIF) , HCO3, pCO2, edad, diabetes de novo y uso de bicarbonato, en busca de probables asociaciones con los desenlaces de muerte, estancia en la unidad de cuidados intensivos pediátricos (UCIP) y edema cerebral.
Se consideraron como hipoglicemia los valores por debajo de 60 mg/dL; hiponatremia los valores séricos de sodio inferiores a 135 mmol/L; hipokalemia los valores séricos de potasio inferiores a 3,5 mmol/L; hipercloremia los valores séricos de cloro por encima de 107 mmol/L (23-25) e hipofosfatemia los valores séricos de fósforo inferiores a los de referencia para la edad: neonatos 4,2-9 mg/dL; 6 semanas a 18 meses 3,8-6,7 mg/dL; 18 meses a 3 años 2,9-5,9 mg/dL y 3 a 15 años 3,6-5,6 mg/dL (23).
La BA se calculó como el resultado de la diferencia entre la concentración sérica de los cationes y la de los aniones; es decir ([Na+] + [K+]) – ([Cl-] + [HCO3 -]) (26) . La DIF, que es la diferencia matemática entre los cationes fuertes y los aniones fuertes, se calculó así: ([Na+] + [K+]) – [Cl-] (26) .
Se definió como infección comprobada cuando el pediatra encargado de la atención del paciente diagnosticó clínicamente (para el caso de infecciones gastrointestinales y respiratorias) o por hallazgos de laboratorio específicos para el caso un proceso infeccioso como infección urinaria (urocultivo positivo con más de 100.000 unidades formadoras de colonia de un microorganismo, en muestras recolectadas por sonda vesical) . No se utilizó la leucocitosis como parámetro para definir la presencia de infección porque es común en estos pacientes debido al importante estado de deshidratación. Se clasificaron como otra enfermedad febril los casos en que había evidencia en la historia clínica de infecciones localizadas tales como en los tejidos blandos y la piel, asociada a la presencia de fiebre, descrita por el médico tratante.
No se pudo analizar el dato de la hemoglobina glicosilada porque no se encontró en la inmensa mayoría de casos.
RESULTADOS
Se revisaron en total 151 historias clínicas, de las cuales cumplieron los criterios de inclusión y se tuvieron en cuenta para el análisis 98 episodios de CAD, que se presentaron en 77 pacientes; algunos de estos tuvieron dos o más episodios, que se analizaron individualmente.
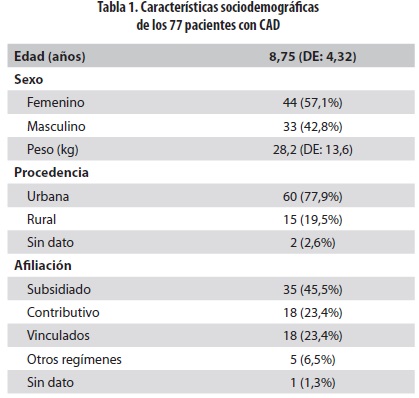
La edad promedio de los 77 pacientes fue de 8,75 años (DE: 4,32) ; 44 (57,1%) fueron niñas y 33 (42,9%) , niños; el peso promedio fue de 28,22 kilogramos (DE: 13,60) . Procedían de zona urbana 60 (77,9%) y de zona rural 15 (19,5%) ; en dos niños no se dispuso de este dato (2,6%) .
La afiliación al Sistema General de Seguridad Social en Salud (SGSSS) fue principalmente mediante el régimen subsidiado: 35 pacientes (45,4%) ; 18 (23,4%) estaban afiliados al régimen contributivo, otros 18 (23,4%) eran vinculados (personas sin capacidad de pago y que no pertenecen al régimen subsidiado, es decir, no están afiliadas a ninguna Entidad Promotora de Salud) y 5 (6,5%) pertenecían a otros regímenes (indígenas, Fuerzas Militares, desplazados, etc.) ; en un niño no se dispuso de este dato (1,3%).
La CAD fue el síntoma inicial de presentación de la DM en 51 de los 96 episodios en que el dato estaba disponible (53,1%).
En los 45 pacientes con diagnóstico previo de DM la mediana de duración de la enfermedad en el momento de la consulta fue de 2,5 años (RIQ: 1,5-6,0) , y de estos, 29 (64,4%) no eran adherentes al tratamiento médico indicado.
En cuanto a la duración de los síntomas, en 77 de 96 episodios (80,2%) habían estado presentes por más de 24 horas en el momento de la consulta y en 41 (42,7%) habían durado más de 96 horas.
La edad de los niños con DM de novo fue de 6,3 años (DE: 2,99) y la de los que tenían diagnóstico previo de DM, de 11,5 años (DE: 3,91) ; esta diferencia fue significativa (p = 0,007) . En los pacientes con DM conocida, la duración de los síntomas antes de la consulta tuvo una mediana de 41 horas (RIQ = 24-96) , mientras que la mediana fue de 120 horas (RIQ = 72-240) entre los ; tal diferencia fue significativa (p <0,001) . No hubo diferencia en el pH al ingreso entre los pacientes con diagnóstico de novo (7,13; DE: 0,13) y los de DM conocida (7,13; DE: 0,2) (tabla 2).
Al ingreso, 15 de los 77 pacientes (19,5%) presentaban algún tipo de déficit neurológico evidenciado por el puntaje menor de 15 en la escala de Glasgow; 62 (80,5%) tenían algún grado de deshidratación y 17 (22,1%) estaban gravemente deshidratados.
El más frecuente de los síntomas fue el vómito (66 casos; 67,3%) , seguido por polidipsia (62 casos; 63,3%) , dolor abdominal (60 casos; 61,2%) , poliuria (52 casos; 53,1%) y polifagia (11 casos; 11,2%) (tabla 3).
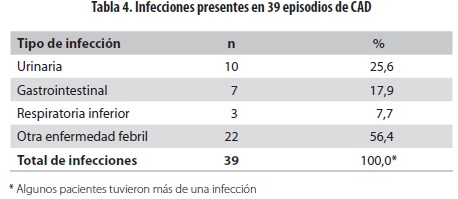
Se diagnosticó alguna infección en 39 de los 91 episodios de CAD en que el dato estuvo disponible (42,8%) : de ellos, 10 fueron infección urinaria, siete infección gastrointestinal, tres infección respiratoria inferior y 22 otras enfermedades febriles. Algunos pacientes tuvieron más de una infección (tabla 4).
En los estudios paraclínicos de ingreso se encontró lo siguiente: en 45 (45,9%) de los 98 episodios se midió la cetonemia, que en todos fue positiva; en 83 (84,7%) se midió la cetonuria y en 59 de ellos (71,1%) fue de 150 mg/dL o más; seis de 54 (11,1%) tenían hipofosfatemia grave por debajo de 1,5 mg/dL; en 70 se midió la magnesemia y en 17 de ellos (24,3%) había hipomagnesemia menor de 1,6 mg/dL; solo en cuatro casos (4,1%) se midió el lactato al ingreso: en uno se halló un valor de 3 mmol/L y en otro fue de 5 mmol/L. El recuento de leucocitos se hizo en 88 de los 98 episodios (89,8%) , de los cuales en 43 (48,9%) se hallaron menos de 15.000/µL, 15 (17%) tenían leucocitosis entre 15.000 y 19.999/µL, en 14 (16%) estaba entre 20.000 y 24.999/µL y 16 (18,2%) presentaron leucocitosis mayor de 25.000/µL.
En el análisis de la primera evaluación gasimétrica hecha en cada uno de los 98 episodios, se encontró lo siguiente: 41 (41,8%) tenían pH menor de 7,1; en 28 (28,6%) estaba entre 7,1 y 7,2; y en 29 (29,6%) , entre 7,2 y 7,3, lo que significa cetoacidosis grave, moderada y leve, respectivamente.
Ochenta y cinco de los 88 casos (96,6%) en que la evaluación gasimétrica se hizo en la primera hora después del ingreso tenían pCO2 menor de 35 mm Hg y 48 (54,4%) la tenían por debajo de 18 mm Hg. De los 91 episodios analizados, 13 (14,3%) tenían el bicarbonato menor de 5 mmol/L en el momento del ingreso, 46 (50,7%) lo tenían entre 5 y 10 mmol/L y 32 (35,2%) , entre 10 y 15 mmol/L. El exceso de bases fue negativo en todos los casos, en promedio -21,93 mmol/L (DE: 5,85) ; la glicemia al ingreso fue de 428 mg/dL (DE: 229) . La evolución de las variables de los gases venosos se presenta en la tabla 5.
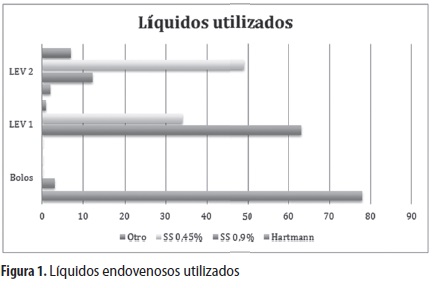
En 17 de los 98 episodios (17,3%) , no se administraron bolos de líquidos endovenosos (LEV) ; en 78 (79,6%) se administraron bolos con solución salina al 0,9% y en tres (3,1%) , con Hartmann. La mediana de volumen aplicado en bolos fue de 23 mL/kg (RIQ: 19-40) . La mediana del volumen de líquidos venosos n° 1 (LEV 1: primer líquido administrado en goteo endovenoso) fue de 1.000 mL (RIQ: 500-1.581) , administrados en 11 horas (RIQ: 4-24) , a razón de 4,18 mL/ kg/hora, para lo cual se utilizó SS 0,9% en 63 casos (64,3%) , SS 0,45% en 34 episodios (34,7%) y otro líquido en un caso (1%).
La mediana del volumen de líquidos venosos n° 2 (LEV 2: segundo líquido administrado en goteo endovenoso) fue de 1.096 mL (RIQ: 651-1.885) administrados en 16 horas (RIQ: 6-23) , a razón de 3,22 mL/kg/hora, para lo cual se utilizaron soluciones dextrosadas en 28 casos (28,6%) , SS 0,45% en 49 casos (50%) , SS 0,9% en 12 casos (12,2%) , solución Hartmann en dos casos (2%) y otros líquidos en siete casos (7,1%) (figura 1).
En 55 (56,1%) de los casos los líquidos con dextrosa se iniciaron en las primeras cuatro horas. En 28 (28,6%) se registraron valores de glucometría menores de 60 mg/dL en las primeras 48 horas; fue más frecuente la presentación de hipoglicemia a las 15 horas desde el ingreso (RIQ: 10- 28) . La mediana de duración de la infusión de insulina intravenosa fue de 15 horas (RIQ: 9-24).
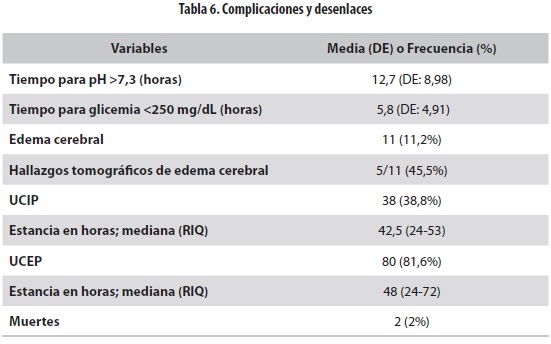
El tiempo que tardaron los pacientes para llegar a tener un pH mayor de 7,3 fue de 12,66 horas (DE: 8,98) y el necesario para alcanzar una glicemia menor de 250 mg/dL fue de 5,8 horas (DE: 4,91) . Se diagnosticó clínicamente edema cerebral en 11 (14,3%) de los 77 pacientes, de los cua- les cinco (45,5%) tenían además hallazgos anormales en la tomografía de cráneo. Los once requirieron un tiempo más prolongado que el promedio para llegar a un pH mayor de 7,3 con una media de 17 horas (RIQ: 3-28 horas) .
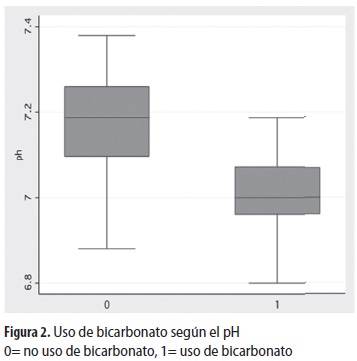
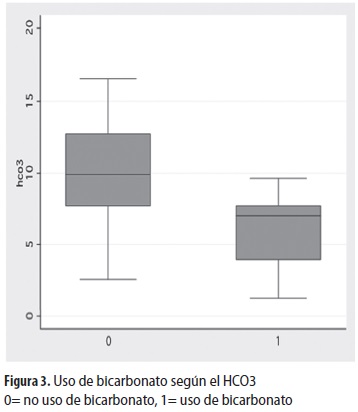
Se utilizó bicarbonato en 25 episodios (25,5%) , en dosis entre 1 y 4 mEq/L; el pH al ingreso de los niños en que se usó bicarbonato fue 7,01 (DE: 0,09) mientras que en quienes no se usó fue 7,16 (DE: 0,11) ; esta diferencia fue significativa (p <0,001) (figura 2) . En cuanto al valor de bicarbonato sérico al ingreso, fue 6,03 (DE: 2,23) en los que se usó el bicarbonato de sodio y 10,1 (DE: 3,22) entre los que no se utilizó; esta diferencia también fue significativa (p <0,001) (figura 3) . En los casos que requirieron bicarbonato fue necesario un tiempo más prolongado para lograr un pH mayor de 7,3 (13,3 horas frente a 7,1 horas; p <0,001).
Treinta y ocho (38,8%) casos requirieron tratamiento en la UCIP y 80 (81,6%) , en la Unidad de Cuidados Especiales (UCE) ; la mediana de la estancia en dichos servicios fue de 42,5 (RIQ: 24-53) y 48 (RIQ; 24-72) horas, respectivamente.
Dos pacientes (2%) murieron, uno al segundo y otro al tercer día de estancia hospitalaria (tabla 6) ; ambos tenían edema cerebral. Uno de ellos, de sexo masculino, tenía 9 meses, síntomas desde 96 horas antes de la consulta y DM1 de novo. Ingresó en estado de choque hipovolémico con alteración del estado de conciencia, hiperosmolaridad de 330 mOsm/L, pH de 6,9, PCO2 de 9 y EB de -28; durante la evolución cursó con hiponatremia. Recibió 9 mL/kg/hora de líquidos endovenosos durante las primeras 12 horas. El segundo era una niña de 14 años, con síntomas de cuatro horas de duración y DM diagnosticada previamente; no había datos acerca de la adherencia al tratamiento. Al ingreso tenía pH de 7,22, EB de -24 y estado de conciencia alterado; cursó con PCO2 de 41,5 a la hora 12 y recibió 3 mL/kg/hr de líquidos durante las primeras 12 horas.
No se encontró ninguna asociación con los factores de riesgo descritos en la literatura en relación con la muerte. En cuanto al edema cerebral, se encontró asociación con el exceso de bases más negativo (-25,8 mmol/L frente a -22,01 mmol/L, p = 0,012) y con la diabetes de novo (p = 0,013) . Por lo que se refiere a la estancia en la UCIP, que requirieron 38 niños, la media de duración fue 17,28 horas (DE: 29,36) . La necesidad de más de 24 horas en la UCIP se asoció con mayor frecuencia a la diabetes de novo (p = 0,002).
DISCUSIÓN
Presentamos los datos clínicos, epidemiológicos y de laboratorio registrados durante el tratamiento de pacientes pediátricos con diagnóstico de CAD en el HUSVF y su relación con la evolución clínica y las complicaciones.
En la literatura encontramos cuatro estudios similares al nuestro realizados en Irán (27) , Argentina (19) , Honduras (12) y Pakistán (28) los cuales incluyeron 63, 111, 30 y 117 episodios de CAD, respectivamente. Solo en el estudio argentino se hizo la diferencia entre casos o episodios de CAD y pacientes: 111 casos en 107 pacientes. Existen otros dos trabajos que caracterizan la población con DM tipo I y sus episodios de CAD, realizados en Alemania (29) y Kuwait (30) ; al parecer, los datos de sus análisis son de pacientes, no de casos de CAD.
Se encontró un leve predominio del sexo femenino, al igual que se ha reportado en múltiples trabajos anteriores (12,19,27-30) . La edad media de presentación fue de 8 años, similar a la descrita en los trabajos de Irán y Alemania (27,29).
La situación socioeconómica de riesgo ha sido considerada por diversos autores como asociada a la mayor frecuencia de CAD en pediatría (7,8) . Se ha reportado que los pacientes sin afiliación a la seguridad social tienen un riesgo significativamente más elevado de que la diabetes se inicie con CAD y de que esta se presente con mayor gravedad que en los pacientes con cobertura adecuada (19) . La nuestra es una población con acceso deficiente a los servicios de salud: encontramos que 23,4% no tienen afiliación al Sistema General de Seguridad Social en Salud (SGSSS) , proporción menor que la informada en el trabajo de Ferraro realizado en Argentina (19).
La mitad de los pacientes debutaron con CAD, lo cual coincide con datos de trabajos previos hechos en Argentina y Pakistán (19,28) . De los pacientes con diagnóstico previo de diabetes en nuestra población, el 57% no tenían adherencia al tratamiento, porcentaje mayor que el encontrado en estudios similares (12,19) ; sin embargo, en muchos trabajos se ha reconocido que la omisión y el mal uso de la insulina son dos de los principales factores de riesgo para la presentación de CAD en diabéticos conocidos (8-11) . Esto se puede explicar por la cobertura deficiente por el sistema de salud y por la ausencia de programas de educación en diabetes con impacto importante en la población infantil.
En cuanto a la duración de los síntomas antes de la consulta inicial al HUSVF, 80% de los pacientes los tuvieron por más de 24 horas y 42,6%, por más de cuatro días. En el estudio de Honduras 50% de los pacientes tardaron más de cinco días en consultar (12) , mientras que en el de Irán 18,8% tardaron más de siete días (27) y en el de Pakistán los diabéticos de novo tardaron en promedio tres semanas mientras que los de diagnóstico previo tuvieron síntomas de solo tres días de evolución (28) . El hecho de no tener diagnóstico previo de diabetes dificulta el reconocimiento de los síntomas de la CAD, retarda la consulta y posiblemente hace que estos niños lleguen en una condición clínica peor que la de los niños con diabetes conocida.
En la muestra estudiada se encontró asociación entre la presentación de CAD y la infección, que se comprobó en 39 de los 91 episodios en que el dato estuvo disponible (42,8%) ; en estudios de otros países se han encontrado porcentajes variables: Honduras 56,6%, Irán 23,8% y Pakistán 22% (12,27,28) . En el estudio de Ferraro y colaboradores (19) , encontraron infección solo en el 3% de los diabéticos conocidos. Esto nos hace pensar que la infección puede ser un factor desencadenante, que se debe tener en cuenta en el tratamiento inicial de estos pacientes.
Al ingreso los pacientes presentaban acidosis metabólica con BA elevada (26,1 mmol/L) y DIFa disminuida (34,9 mmol/L) . El 97% de los pacientes recibieron tratamiento con solución salina al 0,9% o al 0,45% como líquido endovenoso inicial. A las 12 horas de iniciado el tratamiento persistía la acidosis metabólica con pH de 7,29, pero con BA normal (19,5 mmol/L) , DIFa disminuida (32,1 mmol/L) , hipercloremia (111 mmol/L) y EB -13,7 mmol/L. Como han resaltado Taylor y colaboradores (18) , la hipercloremia asociada al uso de líquidos venosos con alto contenido de cloro podría estar relacionada con la persistencia del estado acidótico por el desarrollo de acidosis hiperclorémica, con el mayor tiempo necesario para la resolución de la acidosis y con la necesidad de terapia prolongada con insulina.
El tiempo de corrección de la acidosis fue de 12,66 horas (DE: 8.98) similar al del trabajo de Ferraro y colaboradores (19) ; sin embargo, con el fin de evitar la hipoglicemia es pertinente resaltar la importancia de sostener al paciente con líquidos dextrosados antes de retirar el goteo de insulina puesto que el tiempo para llegar a tener una glicemia menor de 250 mg/dL fue de 5,8 horas (DE: 4,91).
Se utilizó bicarbonato en 25 episodios (25,5%) . Las principales indicaciones para su uso fueron los valores del HCO3 y el pH al ingreso. El uso de bicarbonato se relacionó con un tiempo más prolongado para lograr un pH mayor de 7,3 (13,3 horas frente a 7,1 horas [p <0,001]) , hecho ya reportado en el estudio de Ferraro y colaboradores (19) . Esto resalta lo señalado por algunos autores sobre la restricción del uso de bicarbonato para los casos en que hay colapso circulatorio o riesgo de descompensación cardiovascular (31) , y la importancia de la insulina como pilar del tratamiento y herramienta esencial para la resolución de la acidosis (22,32) . Además, encontramos que el uso del bicarbonato está asociado con el desarrollo de edema cerebral (16) . En nuestro estudio cinco de 11 pacientes con edema cerebral recibieron HCO3. Sin embargo, se debe resaltar que los pacientes en que se indicó el uso del bicarbonato tenían un estado de acidosis más grave definido por el pH y el bicarbonato más bajos, lo cual también podría explicar la mayor frecuencia de complicaciones y la resolución más lenta de su proceso mórbido. La evidencia disponible no justifica la administración de bicarbonato para el tratamiento inicial de los pacientes con CAD en urgencias (33).
En cuanto al uso de líquidos endovenosos (LEV) , el volumen promedio en bolos fue de 25,70 mL/kg; el volumen de líquidos venosos n° 1 fue de 4,18 mL/kg/h y el de líquidos venosos n° 2 fue de 3,22 mL/kg/h. Según Mahoney, una hidratación segura no debería pasar de 20 mL/kg en la primera hora y de 10 mL/kg en la segunda (16) . Otros autores señalan que el volumen que se va a administrar no debe ser mayor de 4.000 mL/m2/día (34) . A pesar de que el volumen de líquidos administrado inicialmente a nuestros pacientes en los bolos fue ligeramente superior al recomendado, el que se utilizó posteriormente fue incluso inferior al indicado por los protocolos (7,14) , lo cual, en relación con la mayor frecuencia de edema cerebral, deja entrever la importancia del estado acidótico y de la deshidratación previos al ingreso como factores importantes en la etiología de dicho edema.
La frecuencia de edema cerebral en niños con CAD ha sido reportada alrededor del 1% al 3% en el mundo (19) , pero en nuestros pacientes fue del 5% lo cual puede estar relacionado con el mayor porcentaje de cetoacidosis grave al ingreso (41,8%) . En un trabajo realizado en Honduras (12) , se lo reportó en 46,6% de los pacientes; el diagnóstico se hizo por la presencia de cefalea, somnolencia o disminución del puntaje en la escala de Glasgow. La diferencia puede ser debida a los distintos criterios utilizados para el diagnóstico y a la no disponibilidad en algunos centros de la tomografía para confirmar la sospecha clínica. Encontramos algunas asociaciones relacionadas con el edema cerebral: EB -22 mmol/L y condición de novo, lo cual puede ser útil en el enfoque inicial de los pacientes en el servicio de urgencias, reconociendo tempranamente a aquellos que con mayor probabilidad pueden desarrollar edema cerebral y beneficiarse de una vigilancia clínica estrecha en la UCIP. A diferencia de lo encontrado en otros trabajos, no hubo relación con la pCO2, el pH al ingreso, los niveles de sodio y potasio y la administración de insulina (35).
Murieron dos de nuestros pacientes (2%) , ambos con edema cerebral; uno de ellos tenía factores de riesgo para desarrollarlo como la edad, la duración prolongada de los síntomas antes de la consulta, la condición de novo, el exceso de bases menor de -22 y el pH de 6,9 al ingreso. El otro tenía diagnóstico previo de diabetes mellitus y síntomas de corta duración y no había en su historia clínica factores claros de riesgo.
CONCLUSIONES
La CAD puede presentarse con síntomas inespecíficos como vómito y dolor abdominal, y es fundamental la sospecha clínica para lograr un diagnóstico temprano. Esto es difícil en los niños sin diagnóstico previo de DM, lo que prolonga la duración de los síntomas antes de la primera consulta y posiblemente aumenta la gravedad, dados el mayor riesgo de presentar edema cerebral y la necesidad de hospitalización en la UCIP en los niños con diagnóstico de novo.
Por la posibilidad ya planteada en anteriores trabajos y nuevamente resaltada en el nuestro respecto a que el uso de líquidos endovenosos con alto contenido de cloro se pudiera asociar a la persistencia de acidosis metabólica con BA normal e hipercloremia, se requieren ensayos clínicos controlados que comparen la administración de solución salina y otros cristaloides para establecer el significado clínico y de laboratorio de la hipercloremia en el tratamiento de la cetoacidosis diabética.
El tiempo de corrección de la acidosis grave en nuestra población fue de 12,3 horas, similar al encontrado en otras poblaciones, con lo cual se puede concluir que se cuenta con una estrategia de tratamiento efectiva; sin embargo, es pertinente resaltar la importancia de sostener al paciente con líquidos dextrosados antes de retirarle el goteo de insulina, con el fin de evitar la hipoglicemia, puesto que el tiempo para lograr una glicemia menor de 250 mg/dL fue de 5,8 horas.
En la muestra evaluada se observó una mayor frecuencia de edema cerebral relacionada con un estado de acidosis más grave y con un tiempo de recuperación más prolongado, por lo cual es importante sensibilizarse para establecer un diagnóstico temprano.
Se requieren estudios profundos posteriores sobre los casos de muerte y/o edema cerebral para establecer las causas y los factores de riesgo.
La falta de adherencia al tratamiento y las infecciones son una causa importante y evitable de descompensación.
REFERENCIAS BIBLIOGRÁFICAS
1. Kliegman R, Behrman R, Jenson H, Stanton B. Nelson textbook of pediatrics. 18th ed. Philadelphia: Saunders; 2007. [ Links ]
2. Karvonen M, Viik-Kajander M, Moltchanova E, Libman I, LaPorte R, Tuomilehto J. Incidence of childhood type 1 diabetes worldwide. Diabetes Mondiale (DiaMond) Project Group. Diabetes Care. 2000 Oct;23(10) :1516–26. [ Links ]
3. Lawrence JM, Mayer-Davis EJ, Reynolds K, Beyer J, Pettitt DJ, D'Agostino RB, et al. Diabetes in Hispanic American youth: prevalence, incidence, demographics, and clinical characteristics: the SEARCH for Diabetes in Youth Study. Diabetes Care. 2009 Mar;32 Suppl 2:S123–32. [ Links ]
4. Faich GA, Fishbein HA, Ellis SE. The epidemiology of diabetic acidosis: a population-based study. Am J Epidemiol. 1983 May;117(5) :551–8. [ Links ]
5. Scibilia J, Finegold D, Dorman J, Becker D, Drash A. Why do children with diabetes die? Acta Endocrinol Suppl (Copenh) . 1986 Jan;279:326–33. [ Links ]
6. Céspedes C. Guía para el manejo inicial de la cetoacidosis diabética en niños y adolescentes. Universitas Médica. 2003;44(2) [ Links ].
7. Wolfsdorf J, Glaser N, Sperling MA. Diabetic ketoacidosis in infants, children, and adolescents: A consensus statement from the American Diabetes Association. Diabetes Care. 2006 May;29(5) :1150–9. [ Links ]
8. Agus MSD, Wolfsdorf JI. Diabetic ketoacidosis in children. Pediatr Clin North Am. 2005 Aug;52(4) :1147–63, ix. [ Links ]
9. Charfen MA, Fernández-Frackelton M. Diabetic ketoacidosis. Emerg Med Clin North Am. 2005 Aug;23(3) :609–28, vii. [ Links ]
10. Glaser N. Pediatric diabetic ketoacidosis and hyperglycemic hyperosmolar state. Pediatr Clin North Am. 2005 Dec;52(6) :1611–35. [ Links ]
11. Orlowski JP, Cramer CL, Fiallos MR. Diabetic ketoacidosis in the pediatric ICU. Pediatr Clin North Am. 2008 Jun;55(3) :577–87. [ Links ]
12. Discua-Flores LJ, Villatoro G, Aguilera R. Perfil epidemiológico y clínico de la cetoacidosis diabética en los pacientes que asisten al servicio de pediatría del Hospital Escuela. Julio 2004 a Junio 2006. Revista Médica de los Post Grados de Medicina UNAH. 2007;10(3) :200–4. [ Links ]
13. Wolfsdorf J, Craig ME, Daneman D, Dunger D, Edge J, Lee W, et al. Diabetic ketoacidosis in children and adolescents with diabetes. Pediatr Diabetes. 2009 Sep;10 Suppl 1:118–33. [ Links ]
14. Dunger DB, Sperling MA, Acerini CL, Bohn DJ, Daneman D, Danne TPA, et al. European Society for Paediatric Endocrinology/Lawson Wilkins Pediatric Endocrine Society consensus statement on diabetic ketoacidosis in children and adolescents. Pediatrics. 2004 Feb;113(2) :e133–40. [ Links ]
15. Lightner ES, Kappy MS, Revsin B. Low-dose intravenous insulin infusion in patients with diabetic ketoacidosis: biochemical effects in children. Pediatrics. 1977 Nov;60(5) :681–8. [ Links ]
16. Glaser N, Barnett P, McCaslin I, Nelson D, Trainor J, Louie J, et al. Risk factors for cerebral edema in children with diabetic ketoacidosis. The Pediatric Emergency Medicine Collaborative Research Committee of the American Academy of Pediatrics. N Engl J Med. 2001 Jan 25;344(4) :264–9. [ Links ]
17. Della Manna T, Steinmetz L, Campos PR, Farhat SCL, Schvartsman C, Kuperman H, et al. Subcutaneous use of a fast-acting insulin analog: an alternative treatment for pediatric patients with diabetic ketoacidosis. Diabetes Care. 2005 Aug;28(8) :1856–61. [ Links ]
18. Taylor D, Durward A, Tibby SM, Thorburn K, Holton F, Johnstone IC, et al. The influence of hyperchloraemia on acid base interpretation in diabetic ketoacidosis. Intensive Care Med. 2006 Feb;32(2) :295–301. [ Links ]
19. Ferraro M, Ozuna B, Mazza C, Ramos O, Evangelista P, Eandi M. Estudio multicéntrico de cetoacidosis diabética en servicios pediátricos de Argentina. Rev Soc Arg De Diabetes. 2009;43:127–36. [ Links ]
20. Felner EI, White PC. Improving management of diabetic ketoacidosis in children. Pediatrics. 2001 Sep;108(3) :735–40. [ Links ]
21. Inward CD, Chambers TL. Fluid management in diabetic ketoacidosis. Arch Dis Child. 2002 Jun;86(6) :443–4. [ Links ]
22. Dunger DB, Edge JA. Predicting cerebral edema during diabetic ketoacidosis. N Engl J Med. 2001 Jan 25;344(4) :302–3. [ Links ]
23. Dunger DB, Sperling MA, Acerini CL, Bohn DJ, Daneman D, Danne TPA, et al. ESPE/LWPES consensus statement on diabetic ketoacidosis in children and adolescents. Arch Dis Child. 2004 Feb;89(2) :188–94. [ Links ]
24. Kitabchi AE, Wall BM. Management of diabetic ketoacidosis. Am Fam Physician. 1999 Aug;60(2) :455–64. [ Links ]
25. Quevedo A. Cetoacidosis diabética en niños. En: Gómez L, Gómez J, Quevedo A, editores. Pautas de tratamiento en pediatría. 4ta ed. Medellín: Universidad de Antioquia; 2008. p. 385–93. [ Links ]
26. Florez I, Betancur L, . Equilibrio ácido base y sus trastornos en la unidad de cuidados intensivos pediátrica. In: Parada Y, Varela R, Vélez A, Duque J, editors. El niño en estado crítico. 2nd ed. Medellín: Panamericana; 2010. [ Links ]
27. Asl AS, Maleknejad S, Kelachaye ME. Diabetic ketoacidosis and its complications among children. Acta Med Iran. 2011 Jan;49(2) :113–4. [ Links ]
28. Lone SW, Siddiqui EU, Muhammed F, Atta I, Ibrahim MN, Raza J. Frequency, clinical characteristics and outcome of diabetic ketoacidosis in children with type-1 diabetes at a tertiary care hospital. J Pak Med Assoc. 2010 Sep;60(9) :725–9. [ Links ]
29. Neu A, Willasch A, Ehehalt S, Hub R, Ranke MB. Ketoacidosis at onset of type 1 diabetes mellitus in children--frequency and clinical presentation. Pediatr Diabetes. 2003 Jun;4(2) :77–81. [ Links ]
30. Abdul-Rasoul M, Al-Mahdi M, Al-Qattan H, Al-Tarkait N, Alkhouly M, Al-Safi R, et al. Ketoacidosis at presentation of type 1 diabetes in children in Kuwait: frequency and clinical characteristics. Pediatr Diabetes. 2010 Aug;11(5) :351–6. [ Links ]
31. Green SM, Rothrock SG, Ho JD, Gallant RD, Borger R, Thomas TL, et al. Failure of adjunctive bicarbonate to improve outcome in severe pediatric diabetic ketoacidosis. Ann Emerg Med. 1998 Jan;31(1) :41–8. [ Links ]
32. Blanco CF, Anzoátegui R, Souza Espínola C de, Rolón MA. Consenso de diagnóstico y Tratamiento de la cetoacidosis diabética en niños y adolescentes. Pediatr. (Asunción) . 2011;38(2) :130–7. [ Links ]
33. Chua HR, Schneider A, Bellomo R. Bicarbonate in diabetic ketoacidosis - a systematic review. Ann Intensive Care. 2011 Jan;1(1) :23. [ Links ]
34. Lawrence SE, Cummings EA, Gaboury I, Daneman D. Population-based study of incidence and risk factors for cerebral edema in pediatric diabetic ketoacidosis. J Pediatr. 2005 May;146(5) :688–92. [ Links ]
35. Edge JA, Jakes RW, Roy Y, Hawkins M, Winter D, Ford-Adams ME, et al. The UK case-control study of cerebral oedema complicating diabetic ketoacidosis in children. Diabetologia. 2006 Sep;49(9) :2002–9. [ Links ]