Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.26 no.3 Medellín July/Sept. 2013
ARTÍCULO DE REVISIÓN
Enfoque diagnóstico y terapéutico de la cetoacidosis diabética en niños y adolescentes en el servicio de urgencias
Diagnostic and therapeutic approach of diabetic ketoacidosis in children and adolescents in the emergency department
Ana María Jiménez Fadul1; Juan Carlos Cortés Millán2
1 Médica pediatra de urgencias, Hospital Universitario San Ignacio, Bogotá, Colombia. Profesora Ad Honorem, Departamento de Pediatría, Pontificia Universidad Javeriana, Bogotá, Colombia. anamitajimenez@gmail.com
2 Residente de Medicina de Urgencias, Pontificia Universidad Javeriana, Hospital San Ignacio, Bogotá, Colombia.
Recibido: junio 09 de 2012
Aceptado: octubre 03 de 2012
RESUMEN
La complicación aguda más frecuente en niños con diabetes mellitus tipo 1 es la cetoacidosis diabética (CAD). Las alteraciones bioquímicas que definen la CAD (hiperglucemia, acidosis metabólica y cetonemia) se deben al déficit relativo o total de insulina asociado al aumento de hormonas contrarreguladoras. La mayoría de las muertes por CAD son prevenibles con un buen manejo inicial: reposición gradual de líquidos, adición oportuna de dextrosa a la hidratación y terapia con insulina. En esta revisión crítica de la literatura se describen la fisiopatología, las manifestaciones clínicas, el tratamiento y las principales complicaciones de la CAD.
PALABRAS CLAVE
Cetoacidosis Diabética, Diabetes Mellitus Tipo1, Niños y Adolescentes
SUMMARY
Diabetic ketoacidosis (DKA) is the most frequent complication in children with type 1 diabetes. DKA is due to a partial or complete insulin deficit, associated with an increase of counter-regulatory hormones, which leads to the biochemical alterations that define the disease: hyperglycemia, metabolic acidosis and ketonemia. Most DKA related deaths are caused by complications associated with the initial treatment. To prevent complications, an adequate assessment in the emergency service is essential; gradual reposition of fluids, dextrose supplementation during hydration, and insulin therapy are necessary. This paper is a critical review of the physiopathology, clinical manifestations, treatment and main complications of DKA.
KEY WORDS
Children and Adolescents, Diabetic Ketoacidosis, Type 1 Diabetes Mellitus
INTRODUCCIÓN
La cetoacidosis diabética (CAD) es un trastorno metabólico generado por el déficit absoluto o relativo de insulina que, asociado a un incremento en la producción de hormonas contrarreguladoras, lleva a los cambios bioquímicos que la definen: hiperglucemia (glucemia de 250 mg/dL o más), acidosis metabólica (pH menor de 7,3 y/o bicarbonato de 15 mEq/L o menos), cetonemia o cetonuria (1,2). Según la gravedad de la acidosis, la CAD se define como leve (pH de 7,3 o menos y/o bicarbonato de 15 mEq/L o menos), moderada (pH menor de 7,2 o bicarbonato menor de 10 mEq/L) y grave (pH menor de 7,1 o bicarbonato menor de 5 mEq/L) (3,4). A pesar de los avances en el tratamiento de la diabetes, la CAD sigue siendo la principal causa de hospitalización, morbilidad y mortalidad en niños con diabetes tipo 1 (DM1) (3). Se calcula que en Estados Unidos hay unas 100.000 hospitalizaciones anuales por CAD, lo que genera costos que exceden los mil millones de dólares (5). La tasa de mortalidad anual de los niños con DM1 en países desarrollados se ha calculado entre 0,15% y 0,31%, y se cree que en los países pobres puede ser mayor (2). La complicación más seria de la CAD es el edema cerebral, que ocurre en 0,5% a 1% de todos los pacientes (3). La disminución de la morbimortalidad por CAD depende del diagnóstico oportuno y del tratamiento adecuado. Esta revisión de la literatura está centrada en la fisiopatología y el enfoque diagnóstico y terapéutico de los pacientes con CAD en el servicio de urgencias.
METODOLOGÍA
La búsqueda de la literatura para esta revisión se hizo en Medline, Embase y LILACS con los siguientes términos: diabetic acidosis [MeSH Terms] o diabetic ketoacidosis [MeSH Terms] o hyperglycemia [MeSH Terms] limitado a ''All Child: 0-18 year''. De los estudios encontrados, se seleccionaron guías de práctica clínica, artículos de revisión, revisiones sistemáticas, ensayos clínicos y otros artículos originales relevantes. Después de la lectura de títulos y resúmenes por dos revisores, se seleccionaron 75 artículos para la revisión del texto completo.
EPIDEMIOLOGÍA
La CAD es la causa más frecuente de hospitalización en niños y adolescentes con DM1 y es el trastorno metabólico que causa más ingresos a las unidades de cuidado intensivo pediátrico con una tasa de hospitalización que se ha mantenido alrededor de 10 por 100.000 niños/año en los últimos 20 años (3,6). Al inicio de la DM1, en países desarrollados, 15% a 70% de los niños presentan CAD (7). Aunque hacen falta estudios para determinar la frecuencia en Colombia, se asume que en países en vías de desarrollo es más frecuente. En pacientes con DM1 ya diagnosticada, el riesgo de CAD es de 1% a 10% paciente/año (3,8,9). La tasa de mortalidad por CAD en Estados Unidos, Canadá y el Reino Unido es de 0,15% a 0,31%, y se supone que en países pobres es mayor. El edema cerebral es responsable de 57% a 87% de estas muertes(10-12). Aunque es menos frecuente que en la DM1, ocurre en 5% a 25% de los niños y adolescentes con diabetes tipo 2. (13).
FISIOPATOLOGÍA
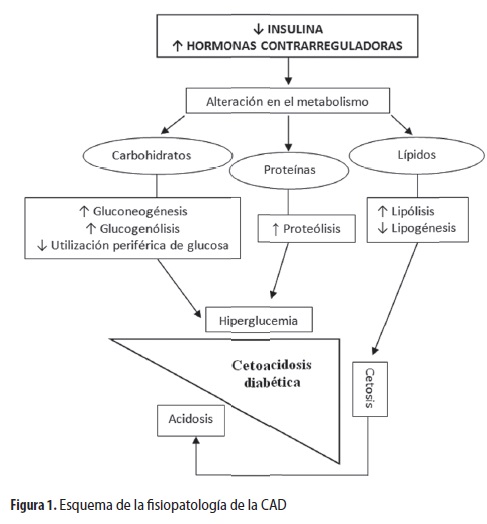
La CAD se produce por una alteración del metabolismo de los carbohidratos, las proteínas y los lípidos, generada por el déficit absoluto o relativo de insulina en combinación con el aumento de las hormonas contrarreguladoras (glucagón, catecolaminas, cortisol y hormona del crecimiento). Todo lo anterior lleva al estado de hiperglucemia, cetogénesis y acidosis metabólica que caracteriza la enfermedad (figura 1).
Hiperglucemia
Ante el déficit de insulina, el cuerpo no puede utilizar la glucosa circulante ni almacenarla en el hígado, lo que genera un aumento del glucagón que a su vez estimula la glucogenólisis hepática y la gluconeogénesis. Además, al no poder captar la glucosa periférica ocurre proteólisis en las células musculares para generar energía a través de sustratos diferentes a la glucosa. La hiperglucemia secundaria a estos procesos sobrepasa el umbral tubular renal provocando glucosuria y diuresis osmótica, por lo cual se pierden grandes cantidades de sodio, cloruro y potasio, dando lugar a deshidratación y alteraciones electrolíticas (5).
Cetogénesis
En la CAD, debido al déficit de insulina hay disminución de la actividad de la lipasa tisular y por lo tanto de la lipogénesis, lo que causa liberación de ácidos grasos libres. Estos, bajo el efecto del glucagón, atraviesan la membrana mitocondrial y luego por β-oxidación se convierten en cuerpos cetónicos, que en la CAD son acetoacetato, β-hidroxibutirato y acetona (12).
Acidosis metabólica
Los cuerpos cetónicos son ácidos débiles, pero a medida que se acumulan superan la capacidad de amortiguación del cuerpo lo que produce la acidosis metabólica (12).
PRESENTACIÓN CLÍNICA
Factores precipitantes
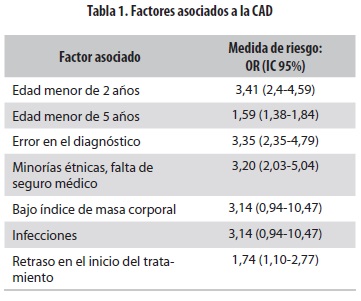
El retraso en el diagnóstico de la DM1 es la causa más frecuente de CAD en niños (20% a 25% de los casos) (10). Con base en una revisión sistemática de estudios de cohortes se identifican algunos factores asociados al aumento del riesgo de presentar CAD al inicio de la DM1: menores de 5 años, errores en el diagnóstico, minorías étnicas, carencia de seguridad social, retraso en el tratamiento, ausencia de familiares con diabe- tes, infecciones e índice de masa corporal bajo. Estos factores con sus respectivas medidas de riesgos (OR) se resumen en la tabla 1 (1,7,14,15).
En los pacientes con diagnóstico ya conocido de DM1, los principales precipitantes de CAD, que re- presentan 15% a 20% de los casos, son la omisión y los errores en el tratamiento con insulina (12). Por otro lado, cualquier evento que cause estrés puede desencadenar la CAD. Las infecciones son los principales generadores de estrés y precipitantes de la CAD; las más frecuentes son la neumonía y la infección urinaria (30% a 40% de los casos) seguidas por gastroenteritis e infecciones del tracto respiratorio superior (16,17). Otros desencadenantes menos frecuentes son: trauma, embarazo (en las adolescentes), medicamentos (antipsicóticos atípicos como clozapina, olanzapina, quetiapina (18); corticosteroides, glucagón, simpaticomiméticos como salbutamol, dopamina, dobutamina, terbutalina; interferón y tacrolimus) (4,18).
Signos y síntomas
La mayoría de los niños que se presentan al servicio de urgencias con CAD consultan por síntomas inespecíficos como vómito, náuseas (50% a 80%) y dolor abdominal (30%) (19). Es frecuente encontrar signos de deshidratación grave como mucosas secas, llanto sin lágrimas, poca turgencia de la piel, alteraciones de la perfusión periférica, taquicardia o hipotensión. En estudios prospectivos, se ha observado que estos signos clínicos no son buenos predictores para calcular la gravedad de la deshidratación, dado que hasta en 67% de los pacientes se sobrevalora el porcentaje de pérdida de agua (20,21). Según estos estudios, los niños con CAD, aunque presenten signos de deshidratación grave, tienen un déficit de agua de 4% a 8% (22-24).
Los síntomas clásicos de la hiperglucemia (poliuria, polidipsia y nicturia) se pueden reconocer en niños mayores, y en algunos casos se presentan signos de acidosis metabólica y cetonemia como aliento cetósico y respiración rápida e irregular (respiración de Kussmaul). La fiebre es un signo raro y cuando se presenta debe hacer sospechar infección (8). Asimismo, las alteraciones del estado de conciencia como letargia, confusión o coma se presentan en menos del 20% de los pacientes, pero si están presentes deben hacer sospechar edema cerebral (12,15,25).
Examen físico
El examen físico se debe encaminar a la identificación del desencadenante de la CAD, partiendo del principio de que las infecciones son la principal causa. Además, es importante identificar y clasificar el estado de deshidratación y el de conciencia (4,17). Otros hallazgos que pueden orientar hacia el diagnóstico de CAD son la respiración de Kussmaul, el aliento cetósico y el dolor abdominal; este último se debe evaluar cuidadosamente pues en algunas ocasiones puede confundirse con el de un abdomen quirúrgico (8,15).
LABORATORIO
La evaluación paraclínica de los niños con sospecha de CAD debe incluir gases sanguíneos, glucemia y cuerpos cetónicos en orina o sangre que definen la enfermedad. De ser posible, se debe medir el β-hidroxibutirato que es el principal cuerpo cetónico en la CAD (26,27). Se recomiendan también la medición de electrólitos, nitrógeno ureico y creatinina y el hemograma en busca de otras alteraciones como hiato aniónico elevado, hiponatremia, hipocalemia o hipercalemia, hipofosfatemia, hiperosmolaridad y leucocitosis (5,28). La leucocitosis es proporcional a la cantidad de cuerpos cetónicos en sangre y tiende a disminuir con la hidratación. Si persiste la elevación de los leucocitos, se debe considerar el diagnóstico de infección y tomar muestras para hemocultivos y urocultivo, y radiografía de tórax si es necesario (9).
El sodio suele estar disminuido por el flujo de agua desde el espacio intracelular al extracelular debido al gradiente osmótico, y es necesario calcular el sodio corregido para definir la gravedad del déficit de sodio y agua. La hipercalemia ocurre por el aumento del potasio extracelular secundario a la deficiencia de insulina y la acidemia. Cuando se identifica hipercalemia o acidosis metabólica grave se debe tomar un electrocardiograma.
En la CAD el hiato aniónico se encuentra alto, entre 20 y 30. Cuando está por encima de 35 se debe sospechar una acidosis láctica por hipoxemia tisular e hipoperfusión periférica y se debe hacer una terapia hídrica cuidadosa (5,12). En todos los niños con CAD se debe hacer el cálculo del hiato aniónico, la osmolaridad sérica y el sodio corregido:
Hiato aniónico = Na – (Cl + HCO3); normal: 12 ± 2 mEq/L.
Na corregido = Na actual + (1,6 x (glucemia–100) x 0,01).
Osmolaridad efectiva: 2 x (Na + K) + glucemia/18.
Existe controversia en cuanto a si es necesario medir los gases arteriales para el diagnóstico de CAD. Algunos estudios muestran que la diferencia que hay en los valores del pH y del bicarbonato en las muestras de sangre arterial y venosa es de 0,02 a 0,15 unidades, y la diferencia del bicarbonato es de 1,88 mmol/L. Tal diferencia no genera cambios significativos para la interpretación del estado ácido básico y por lo tanto el diagnóstico de CAD se puede hacer con gases arteriales o venosos (29,30).
TRATAMIENTO
El enfoque inicial de los pacientes con CAD se basa en que la vía aérea esté permeable y haya una adecuada oxigenación; se debe obtener un acceso vascular para la hidratación y la terapia con insulina. Los niños con CAD los deben tratar especialistas entrenados en el manejo de esta enfermedad (urgenciólogos o pediatras), en un hospital donde se puedan hacer los estudios de laboratorio necesarios para el diagnóstico y la monitorización, y en los casos de CAD moderada o grave se puede requerir tratamiento en la unidad de cuidado intensivo pediátrico (10).
El tratamiento del paciente con CAD tiene como objetivos restaurar el volumen circulatorio y la perfusión tisular, disminuir la glucemia, regular la acidosis metabólica, restaurar la filtración renal, corregir las alteraciones de los electrólitos y, finalmente, identificar y tratar los eventos precipitantes.
Hidratación
La hidratación es la medida inicial y prioritaria en el tratamiento de los niños con CAD, pero debe hacerse lentamente debido a que una disminución rápida de la osmolaridad y del sodio plasmático se relaciona con un aumento en el riesgo de edema cerebral (11,31,32). Solo cuando se identifican signos de choque pueden administrarse uno o dos bolos de solución salina normal (SSN) a dosis de 10 a 20 mL/kg en una a dos horas, y después seguir con hidratación lenta (3). El volumen de líquidos se calcula asumiendo un déficit de 4% a 10%, y la velocidad de reposición del déficit de agua depende de la osmolaridad calculada al ingreso: con una osmolaridad entre 330 y 360 mOsm/L la reposición se debe hacer en 36 horas y si es mayor de 360 mOsm/L, el déficit se corrige en 48 horas (24,33). Para asegurar que la velocidad de la hidratación sea lenta, los líquidos de las primeras 24 horas no deben sobrepasar de 1,5 a 2,5 veces los requerimientos basales diarios (1.500 a 2.500 mL/m2/ día) (20,34).
Los líquidos ideales para la hidratación en pacientes con CAD son los cristaloides isotónicos, y aunque hay controversia sobre la elección del cristaloide (SSN o lactato de Ringer), la SSN es la que más se ha empleado y la más recomendada por la mayoría de autores (21,29). Una vez que la glucemia alcanza un valor por debajo de 250 mg/dL, y con el fin de evitar la hipoglucemia, se debe iniciar dextrosa en agua destilada (DAD) para asegurar un flujo de glucosa de 3 a 5 mg/kg/min, añadiendo cloruro de sodio y cloruro de potasio para obtener una solución con tonicidad semejante a la de la SS al 0,45% (29,35).
Insulina
El bolo inicial de insulina no está indicado en los niños porque, al igual que el inicio de la infusión de insulina antes de una hora de hidratación, aumenta el riesgo de edema cerebral (36). La dosis de insulina que se debe mantener hasta la resolución de la acidosis metabólica es de 0,1 U/kg/h. En menores de 5 años, en pacientes con alto riesgo de edema cerebral y en niños que hayan recibido insulina previamente, se pueden usar dosis menores: 0,025 a 0,05 U/kg/h (35,37,38). La insulina cristalina se administra por vía intravenosa cuando hay CAD, pero de no lograrse un acceso venoso se puede usar la vía intraósea, con base en el reporte de un caso en el que los resultados del tratamiento intraóseo fueron equivalentes a los de la insulina intravenosa (39). Una alternativa terapéutica en pacientes con CAD leve a moderada, estudiada por varios investigadores, es el uso de análogos de insulina de acción rápida (lispro o aspart) por vía subcutánea o intramuscular con una dosis inicial de 0,3 U/kg y 0,1 U/kg cada hora o 0,15 a 0,2 U/kg cada dos horas (40-44).
La reducción de la glucemia en la primera hora de tratamiento con insulina debe ser de 50 mg/dL; si no se alcanza esa meta, se debe reevaluar el estado de hidratación del paciente, y se puede duplicar la dosis de insulina hasta conseguir una disminución de la glucemia de 50 a 75 mg/dL/h (4,35).
La transición de insulina intravenosa a insulina subcutánea está indicada cuando se cumplen los siguientes criterios: pH mayor de 7,3 o bicarbonato mayor de15 mEq/L, glucemia menor de 200 mg/dL, cetonuria mínima o nula y buena tolerancia a la alimentación. El mejor momento para cambiar a la vía subcutánea es antes de una comida; la infusión intravenosa se suspende 30 minutos después de la primera dosis de insulina subcutánea si se emplea insulina regular, o 15 minutos después de dicha dosis si se emplean análogos de insulina de acción rápida. En pacientes con diagnóstico previo de diabetes debe restablecerse su tratamiento habitual con insulina, y en los casos nuevos de diabetes, la dosis de insulina es de 0,75 a 1 U/kg/día (en pacientes púberes la dosis puede ser hasta de 1,2 U/kg/día) (8,28,35).
Potasio
En la mayoría de los casos el potasio se encuentra elevado en el plasma antes de iniciar la insulina por depleción celular. Si el potasio se encuentra normal o ligeramente elevado (hasta 5,5 mEq/L) se debe iniciar reposición con 40 mmol de potasio por cada litro de infusión. Nunca se debe iniciar la reposición de potasio sin haber comprobado la diuresis. En raras ocasiones se puede encontrar hipocalemia, la cual, de ser menor de 3,3 mEq/L se debe corregir antes de iniciar la insulinoterapia con el fin de evitar arritmias y depresión respiratoria (45-47).
Fosfato
Una vez iniciada la terapia con insulina, el fósforo entra a la célula lo que lleva a hipofosfatemia que rara vez es grave y requiere tratamiento. En estos casos, y según lo han mostrado ensayos clínicos con asignación aleatoria en adultos, no hay beneficio en la reposición de fosfato (29,45). En niños con alteraciones cardíacas, inminencia de falla respiratoria, debilidad muscular y concentración de fosfato menor de 1 mg/dL está indicada la reposición de fosfato para evitar complicaciones cardíacas y respiratorias. La reposición se puede hacer de manera segura con sales de fosfato de potasio o en combinación con cloruro o acetato de potasio, con una monitorización del calcio sérico para prevenir la hipocalcemia (35,46).
Bicarbonato
La acidosis es reversible en la mayoría de los casos con hidratación e insulina. La insulina disminuye la producción de cuerpos cetónicos con la consecuente producción de bicarbonato, y la hidratación, por su parte, mejora la perfusión renal con lo que aumenta la excreción de ácidos. La administración de bicarbonato no ha mostrado beneficio, pero en casos especiales como niños con acidosis grave (pH menor de 6,9), con disminución de la contractilidad cardíaca y evidencia de vasodilatación periférica se puede dar una dosis de bicarbonato de 1 a 2 mEq/kg en infusión continua durante una hora (48).
MONITORIZACIÓN
Durante el tratamiento de la CAD se modifican algunos parámetros clínicos y bioquímicos que deben ser monitorizados para adecuar el tratamiento a estos cambios y prevenir complicaciones. Cada hora se deben registrar el control de signos vitales, la presencia o ausencia de signos de alarma neurológicos (por el riesgo de edema cerebral), el balance de líquidos administrados y eliminados y las glucometrías. Cada dos a cuatro horas o con mayor frecuencia si está indicado por la evolución clínica, se deben medir los electrólitos, gases sanguíneos y cetonuria. Una vez corregida la acidosis metabólica se recomienda determinar la cetonuria cada seis a ocho horas hasta su negativización (15,29).
COMPLICACIONES
Las principales complicaciones de la CAD se relacionan, en su mayoría, con el tratamiento. Son frecuentes la hipoglucemia, la hipocalemia y la hipofosfatemia cuyas estrategias de prevención se discutieron en secciones previas de esta revisión. Otras complicaciones son la acidosis hiperclorémica por la hidratación con SSN que contiene una cantidad alta de cloro, la hiperglucemia por la interrupción de la insulina sin haber hecho la transición adecuada a insulina subcutánea, la trombosis venosa que se previene evitando el acceso venoso central por vía femoral, la neumonía secundaria a la aspiración de vómito en niños con alteración del estado de conciencia (para los cuales está indicado el uso de sonda nasogástrica) y, la más frecuente y grave de todas, el edema cerebral (15,46,49-51). En la tabla 2 se enumeran las complicaciones de la CAD, incluyendo las causas más raras.
Edema cerebral
El edema cerebral sintomático ocurre en 0,5% a 1% de los niños con CAD, con una tasa de mortalidad de 20% a 90% y secuelas neurológicas permanentes en 20% a 40% de los casos. Se presenta con mayor frecuencia cuatro a 12 horas después de iniciar el tratamiento de la CAD, aunque en algunos niños se puede presentar antes o incluso 24 a 48 horas después del inicio del mismo (28,63,64).
No se conoce con claridad el mecanismo fisiopatológico del edema cerebral, y los estudios observacionales que evaluaron factores de riesgo dieron resultados variables (65); en algunos de esos estudios se encontró una asociación entre la velocidad de administración de los líquidos y el riesgo de edema cerebral, y en otros solo se encontró relación con el uso de volúmenes altos de líquidos con concentraciones bajas de sodio. En ninguna de las investigaciones se mostró una asociación entre la velocidad del cambio de los valores de la glucosa o de la osmolaridad y el riesgo de edema cerebral. Se ha implicado el uso de bicarbonato como causa de edema cerebral, lo cual tampoco es consistente en todas las investigaciones. Los niños con mayor riesgo de desarrollar edema cerebral sintomático son aquellos con acidosis grave, con deshidratación grave y falla prerrenal reflejadas por altas concentraciones de BUN y potasio antes del inicio del tratamiento, y aquellos que reciben insulina en bolo o en la primera hora de tratamiento (31,65,66).
La sintomatología del edema cerebral es variable, y los niños con esta complicación presentan signos de afectación neurológica con cambios mínimos o sin ellos en la escala de Glasgow. Por esta razón, el edema cerebral se debe sospechar en un niño con deterioro neurológico inesperado tras una mejoría clínica o por la persistencia de alteración del estado de conciencia sin causa clara. De los pacientes en coma con edema cerebral, el 40% no tienen alteraciones en la tomografía inicial por lo que el diagnóstico de esta complicación debe ser clínico. Se han usado algunos criterios diagnósticos con sensibilidad de 92% y falsos positivos de 4% (tabla 3) (67).
Cuando se sospecha clínicamente el edema cerebral se debe trasladar al paciente a la unidad de cuidado intensivo pediátrico, mantener la cabecera elevada a 30°, disminuir la infusión de líquidos a la mitad y asegurar la vía aérea (28). Puede ser necesaria la intubación orotraqueal para asegurar una ventilación adecuada, pero se debe evitar la hiperventilación con pCO2 menor de 22 mm Hg, porque se relaciona con peor pronóstico (68). El tratamiento se hace con manitol, 0,5 a 1 g/kg en infusión de 20 minutos, o con 5 a 10 mL/kg de solución salina al 3% administrada en 30 minutos (15,69).
CONCLUSIONES
La CAD es una condición grave que requiere una intervención oportuna y adecuada en el servicio de urgencias para lograr desenlaces favorables. Incluso con un enfoque correcto, la CAD sigue siendo la causa más frecuente de morbilidad y mortalidad en los niños con diabetes mellitus. Es importante entender la fisiopatología, conocer la gravedad y asegurar un tratamiento oportuno y adecuado de estos niños para mejorar su pronóstico. En el enfoque en urgencias es necesario tener un alto índice de sospecha pues los síntomas con los que se presentan estos pacientes suelen ser inespecíficos. Una vez confirmado el diagnóstico, debe instaurarse de manera precoz el tratamiento que se basa en la hidratación y la insulinoterapia, y asegurar una monitorización estricta para prevenir complicaciones letales como el edema cerebral. Dado que el tratamiento de la CAD es costoso y que el riesgo de mortalidad se mantiene incluso en el mejor de los casos, su prevención sigue siendo fundamental.
REFERENCIAS BIBLIOGRÁFICAS
1. Usher-Smith JA, Thompson MJ, Sharp SJ, Walter FM. Factors associated with the presence of diabetic ketoacidosis at diagnosis of diabetes in children and young adults: a systematic review. BMJ. 2011 Jan;343(6):d4092. [ Links ]
2. Edge JA, Ford-Adams ME, Dunger DB. Causes of death in children with insulin dependent diabetes 1990-96. Arch Dis Child. 1999 Oct;81(4):318–23. [ Links ]
3. Dunger DB, Sperling MA, Acerini CL, Bohn DJ, Daneman D, Danne TPA, et al. European Society for Paediatric Endocrinology/Lawson Wilkins Pediatric Endocrine Society consensus statement on diabetic ketoacidosis in children and adolescents. Pediatrics. 2004 Feb;113(2):e133–40. [ Links ]
4. International Diabetes Federation. The Global IDF/ ISPAD guideline for diabetes in childhood and adolescence. Brussels: International Diabetes Federation; 2011. p. 128. [ Links ]
5. Kitabchi AE, Umpierrez GE, Murphy MB, Barrett EJ, Kreisberg RA, Malone JI, et al. Management of hyperglycemic crises in patients with diabetes. Diabetes Care. 2001 Jan;24(1):131–53. [ Links ]
6. Tiwari LK, Jayashree M, Muralindharan J, Singhi S. Risk factors for cerebral edema in diabetic ketoacidosis in a developing country: role of fluid refractory shock. Pediatr Crit Care Med. 2012 Mar;13(2):e91–6. [ Links ]
7. Rewers A, Klingensmith G, Davis C, Petitti DB, Pihoker C, Rodriguez B, et al. Presence of diabetic ketoacidosis at diagnosis of diabetes mellitus in youth: the Search for Diabetes in Youth Study. Pediatrics. 2008 May;121(5):e1258–66. [ Links ]
8. Céspedes C, Bustos C. Management of diabetic ketoacidosis in children and adolescents. Endocrinol Nutr. 2008 Aug;55(7):289–96. [ Links ]
9. Flood RG, Chiang VW. Rate and prediction of infection in children with diabetic ketoacidosis. Am J Emerg Med. 2001 Jul;19(4):270–3. [ Links ]
10. Wolfsdorf J, Craig ME, Daneman D, Dunger D, Edge J, Lee WRW, et al. Diabetic ketoacidosis. Pediatr Diabetes. 2007 Mar;8(1):28–43. [ Links ]
11. Glaser N, Barnett P, McCaslin I, Nelson D, Trainor J, Louie J, et al. Risk factors for cerebral edema in children with diabetic ketoacidosis. The Pediatric Emergency Medicine Collaborative Research Committee of the American Academy of Pediatrics. N Engl J Med. 2001 Jan 25;344(4):264–9. [ Links ]
12. Wolfsdorf J, Glaser N, Sperling MA. Diabetic ketoacidosis in infants, children, and adolescents: A consensus statement from the American Diabetes Association. Diabetes Care. 2006 May;29(5):1150–9. [ Links ]
13. Lipton R, Keenan H, Onyemere KU, Freels S. Incidence and onset features of diabetes in African-American and Latino children in Chicago, 1985-1994. Diabetes Metab Res Rev. 2002;18(2):135–42. [ Links ]
14. Maniatis AK, Goehrig SH, Gao D, Rewers A, Walravens P, Klingensmith GJ. Increased incidence and severity of diabetic ketoacidosis among uninsured children with newly diagnosed type 1 diabetes mellitus. Pediatr Diabetes. 2005 Jun;6(2):79–83. [ Links ]
15. Rosenbloom AL. The management of diabetic ketoacidosis in children. Diabetes Ther. 2010 Dec;1(2):103–20. [ Links ]
16. Szypowska A, Skórka A. The risk factors of ketoacidosis in children with newly diagnosed type 1 diabetes mellitus. Pediatr Diabetes. 2011 Jun;12(4 Pt 1):302–6. [ Links ]
17. Fritsch M, Rosenbauer J, Schober E, Neu A, Placzek K, Holl RW. Predictors of diabetic ketoacidosis in children and adolescents with type 1 diabetes. Experience from a large multicentre database. Pediatr Diabetes. 2011 Jun;12(4 Pt 1):307–12. [ Links ]
18. Muench J, Carey M. Diabetes mellitus associated with atypical antipsychotic medications: new case report and review of the literature. J Am Board Fam Pract. 2001;14(4):278–82. [ Links ]
19. Vanelli M, Chiarelli F. Treatment of diabetic ketoacidosis in children and adolescents. Acta Biomed. 2003 Aug;74(2):59–68. [ Links ]
20. Fagan MJ, Avner J, Khine H. Initial fluid resuscitation for patients with diabetic ketoacidosis: how dry are they? Clin Pediatr (Phila). 2008 Nov;47(9):851–5. [ Links ]
21. Rewers A. Current controversies in treatment and prevention of diabetic ketoacidosis. Adv Pediatr. 2010 Jan;57(1):247–67. [ Links ]
22. Singhi S, Jayashree M, Muralindharan J. ''De hydration'' assessment and replacement fluid therapy in diabetic ketoacidosis: is there an answer?. Pediatr Crit Care Med. 2012 Mar;13(2):240–1. [ Links ]
23. Koves IH, Neutze J, Donath S, Lee W, Werther GA, Barnett P, et al. The accuracy of clinical assessment of dehydration during diabetic ketoacidosis in childhood. Diabetes Care. 2004 Oct;27(10):2485–7. [ Links ]
24. Ugale J, Mata A, Meert KL, Sarnaik AP. Measured degree of dehydration in children and adolescents with type 1 diabetic ketoacidosis. Pediatr Crit Care Med. 2012 Mar;13(2):e103–7. [ Links ]
25. Rosenbloom AL. Cerebral edema in diabetic ketoacidosis and other acute devastating complications: recent observations. Pediatr Diabetes. 2005 Mar;6(1):41–9. [ Links ]
26. Arora S, Henderson SO, Long T, Menchine M. Diagnostic accuracy of point-of-care testing for diabetic ketoacidosis at emergency-department triage: {beta}-hydroxybutyrate versus the urine dipstick. Diabetes Care. 2011 Apr;34(4):852–4. [ Links ]
27. Vanelli M, Chiari G, Capuano C, Iovane B, Bernardini A, Giacalone T. The direct measurement of 3-beta-hydroxy butyrate enhances the management of diabetic ketoacidosis in children and reduces time and costs of treatment. Diabetes Nutr Metab. 2003;16(5-6):312–6. [ Links ]
28. Orlowski JP, Cramer CL, Fiallos MR. Diabetic ketoacidosis in the pediatric ICU. Pediatr Clin North Am. 2008 Jun;55(3):577–87, x. [ Links ]
29. Savage MW, Dhatariya KK, Kilvert A, Rayman G, Rees JAE, Courtney CH, et al. Joint British Diabetes Societies guideline for the management of diabetic ketoacidosis. Diabet Med. 2011 May;28(5):508–15. [ Links ]
30. Kelly A-M. The case for venous rather than arterial blood gases in diabetic ketoacidosis. Emerg Med Australas. 2006 Feb;18(1):64–7. [ Links ]
31. Glaser N. New perspectives on the pathogenesis of cerebral edema complicating diabetic ketoacidosis in children. Pediatr Endocrinol Rev. 2006 Jun;3(4):379–86. [ Links ]
32. Toledo JD, Modesto V, Peinador M, Alvarez P, López- Prats JL, Sanchis R, et al. Sodium concentration in rehydration fluids for children with ketoacidotic diabetes: effect on serum sodium concentration. J Pediatr. 2009 Jun;154(6):895–900. [ Links ]
33. Sottosanti M, Morrison GC, Singh RN, Sharma AP, Fraser DD, Alawi K, et al. Dehydration in children with diabetic ketoacidosis: a prospective study. Arch Dis Child. 2012 Feb;97(2):96–100. [ Links ]
34. Felner EI, White PC. Improving management of diabetic ketoacidosis in children. Pediatrics. 2001 Sep;108(3):735–40. [ Links ]
35. Hanas R, Donaghue KC, Klingensmith G, Swift PGF. ISPAD clinical practice consensus guidelines 2009 compendium. Introduction. Pediatr Diabetes. 2009 Sep;10 Suppl 1:1–2. [ Links ]
36. Kitabchi AE, Murphy MB, Spencer J, Matteri R, Karas J. Is a priming dose of insulin necessary in a low-dose insulin protocol for the treatment of diabetic ketoacidosis? Diabetes Care. 2008 Nov;31(11):2081–5. [ Links ]
37. Kapellen T, Vogel C, Telleis D, Siekmeyer M, Kiess W. Treatment of diabetic ketoacidosis (DKA) with 2 different regimens regarding fluid substitution and insulin dosage (0.025 vs. 0.1 units/kg/h). Exp Clin Endocrinol Diabetes. 2012 May;120(5):273–6. [ Links ]
38. Puttha R, Cooke D, Subbarayan A, Odeka E, Ariyawansa I, Bone M, et al. Low dose (0.05 units/kg/h) is comparable with standard dose (0.1 units/kg/h) intravenous insulin infusion for the initial treatment of diabetic ketoacidosis in children with type 1 diabetes- an observational study. Pediatr Diabetes. 2010 Feb;11(1):12–7. [ Links ]
39. Alawi KA, Morrison GC, Fraser DD, Al-Farsi S, Collier C, Kornecki A. Insulin infusion via an intraosseous needle in diabetic ketoacidosis. Anaesth Intensive Care. 2008 Jan;36(1):110–2. [ Links ]
40. Della Manna T, Steinmetz L, Campos PR, Farhat SCL, Schvartsman C, Kuperman H, et al. Subcutaneous use of a fast-acting insulin analog: an alternative treatment for pediatric patients with diabetic ketoacidosis. Diabetes Care. 2005 Aug;28(8):1856–61. [ Links ]
41. Umpierrez GE, Latif K, Stoever J, Cuervo R, Park L, Freire AX, et al. Efficacy of subcutaneous insulin lispro versus continuous intravenous regular insulin for the treatment of patients with diabetic ketoacidosis. Am J Med. 2004 Sep 1;117(5):291–6. [ Links ]
42. Al Hanshi S, Shann F. Insulin infused at 0.05 versus 0.1 units/kg/hr in children admitted to intensive care with diabetic ketoacidosis. Pediatr Crit Care Med. 2011 Mar;12(2):137–40. [ Links ]
43. Ersöz HO, Ukinc K, Köse M, Erem C, Gunduz A, Hacihasanoglu AB, et al. Subcutaneous lispro and intravenous regular insulin treatments are equally effective and safe for the treatment of mild and moderate diabetic ketoacidosis in adult patients. Int J Clin Pract. 2006 Apr;60(4):429–33. [ Links ]
44. Mazer M, Chen E. Is subcutaneous administration of rapid-acting insulin as effective as intravenous insulin for treating diabetic ketoacidosis? Ann Emerg Med. 2009 Feb;53(2):259–63. [ Links ]
45. Sherry NA, Levitsky LL. Management of diabetic ketoacidosis in children and adolescents. Paediatr Drugs. 2008 Jan;10(4):209–15. [ Links ]
46. Sivanandan S, Sinha A, Jain V, Lodha R. Management of diabetic ketoacidosis. Indian J Pediatr. 2011 May;78(5):576–84. [ Links ]
47. McFarlane K. An overview of diabetic ketoacidosis in children. Paediatr Nurs. 2011 Feb;23(1):14–9. [ Links ]
48. Chua HR, Schneider A, Bellomo R. Bicarbonate in diabetic ketoacidosis - a systematic review. Ann Intensive Care. 2011 Jan;1(1):23. [ Links ]
49. Wolfsdorf J, Craig ME, Daneman D, Dunger D, Edge J, Lee W, et al. Diabetic ketoacidosis in children and adolescents with diabetes. Pediatr Diabetes. 2009 Sep;10 Suppl 1(2):118–33. [ Links ]
50. Umpierrez GE, Kitabchi AE. Diabetic ketoacidosis: risk factors and management strategies. Treat Endocrinol. 2003 Jan;2(2):95–108. [ Links ]
51. Rosenbloom AL. Hyperglycemic crises and their complications in children. J Pediatr Endocrinol Metab. 2007 Jan;20(1):5–18. [ Links ]
52. Taylor D, Durward A, Tibby SM, Thorburn K, Holton F, Johnstone IC, et al. The influence of hyperchloraemia on acid base interpretation in diabetic ketoacidosis. Intensive Care Med. 2006 Feb;32(2):295–301. [ Links ]
53. Worly JM, Fortenberry JD, Hansen I, Chambliss CR, Stockwell J. Deep venous thrombosis in children with diabetic ketoacidosis and femoral central venous catheters. Pediatrics. 2004 Jan;113(1 Pt 1):e57–60. [ Links ]
54. Carl GF, Hoffman WH, Passmore GG, Truemper EJ, Lightsey AL, Cornwell PE, et al. Diabetic ketoacidosis promotes a prothrombotic state. Endocr Res. 2003 Feb;29(1):73–82. [ Links ]
55. Kuppermann N, Park J, Glatter K, Marcin JP, Glaser NS. Prolonged QT interval corrected for heart rate during diabetic ketoacidosis in children. Arch Pediatr Adolesc Med. 2008 Jun;162(6):544–9. [ Links ]
56. Haddad NG, Croffie JM, Eugster EA. Pancreatic enzyme elevations in children with diabetic ketoacidosis. J Pediatr. 2004 Jul;145(1):122–4. [ Links ]
57. Quiros JA, Marcin JP, Kuppermann N, Nasrollahzadeh F, Rewers A, DiCarlo J, et al. Elevated serum amylase and lipase in pediatric diabetic ketoacidosis. Pediatr Crit Care Med. 2008 Jul;9(4):418–22. [ Links ]
58. Kanwal SK, Bando A, Kumar V. Clinical profile of diabetic ketoacidosis in Indian children. Indian J Pediatr. 2012 Jul;79(7):901–4. [ Links ]
59. Ashrafi M, Hashemipour M, Moadab M-H, Jamshidi M, Hosseinpour M. Ischemic intestinal necrosis in a fiveyear- old girl with diabetic ketoacidosis. Arch Iran Med. 2007 Oct;10(4):529–31. [ Links ]
60. Kutlu AO, Kara C, Cetinkaya S. Rhabdomyolysis without detectable myoglobulinuria due to severe hypophosphatemia in diabetic ketoacidosis. Pediatr Emerg Care. 2011 Jun;27(6):537–8. [ Links ]
61. Hoffman WH, Locksmith JP, Burton EM, Hobbs E, Passmore GG, Pearson-Shaver AL, et al. Interstitial pulmonary edema in children and adolescents with diabetic ketoacidosis. J Diabetes Complications. 1988;12(6):314–20. [ Links ]
62. Moye J, Rosenbloom AL, Silverstein J. Clinical predictors of mucormycosis in children with type 1 diabetes mellitus. J Pediatr Endocrinol Metab. 2002;15(7):1001–4. [ Links ]
63. Glaser N. Cerebral edema in children with diabetic ketoacidosis. Curr Diab Rep. 2001 Aug;1(1):41–6. [ Links ]
64. Shastry RM, Bhatia V. Cerebral edema in diabetic ketoacidosis. Indian Pediatr. 2006 Aug;43(8):701–8. [ Links ]
65. Glaser NS, Wootton-Gorges SL, Marcin JP, Buonocore MH, Dicarlo J, Neely EK, et al. Mechanism of cerebral edema in children with diabetic ketoacidosis. J Pediatr. 2004 Aug;145(2):164–71. [ Links ]
66. Edge JA, Jakes RW, Roy Y, Hawkins M, Winter D, Ford- Adams ME, et al. The UK case-control study of cerebral oedema complicating diabetic ketoacidosis in children. Diabetologia. 2006 Sep;49(9):2002–9. [ Links ]
67. Muir AB, Quisling RG, Yang MCK, Rosenbloom AL. Cerebral edema in childhood diabetic ketoacidosis: natural history, radiographic findings, and early identification. Diabetes Care. 2004 Jul;27(7):1541–6. [ Links ]
68. Marcin JP, Glaser N, Barnett P, McCaslin I, Nelson D, Trainor J, et al. Factors associated with adverse outcomes in children with diabetic ketoacidosis-related cerebral edema. J Pediatr. 2002 Dec;141(6):793–7. [ Links ]
69. Kamat P, Vats A, Gross M, Checchia PA. Use of hypertonic saline for the treatment of altered mental status associated with diabetic ketoacidosis. Pediatr Crit Care Med. 2003 Apr;4(2):239–42. [ Links ]