Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.26 no.3 Medellín July/Sept. 2013
PRESENTACIÓN DE CASOS
Paragonimiasis pulmonar en niños: reporte de dos casos
Lung paragonimiais in children: Report of two cases
Olga Lucía Morales Múnera1; Natalia Giraldo Ardila2; Carlos Arturo Aguirre Muñoz3; Claudia Liliana Roya Pabón4; Libardo Alberto Bustamante Gallego5; Gisela María García Montoya6; Luz Adriana Gómez Grisales7
1 Pediatra neumóloga. Profesora del Departamento de Pediatría y Puericultura, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. Pediatra neumóloga, Hospital Universitario San Vicente Fundación. Medellín, Colombia. olmmunera@yahoo.com
2 Médica. Fellow de Neonatología, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
3 Pediatra y Virólogo. Profesor de la Universidad de Antioquia, Medellín, Colombia.
4 Pediatra neumóloga. Profesora del Departamento de Pediatría y Puericultura, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. Pediatra neumóloga, Hospital Universitario San Vicente Fundación. Medellín, Colombia.
5 Pediatra. Profesor de la Universidad de Antioquia, Medellín, Colombia.
6 Microbióloga, MSc en Medicina Tropical y candidata a PhD, Universidad de Antioquia, Medellín, Colombia.
7 Pediatra de la Universidad de Antioquia, Medellín, Colombia.
Recibido: julio 05 de 2012
Aceptado: septiembre 11 de 2012
RESUMEN
La paragonimiasis es una zoonosis parasitaria, de transmisión alimentaria, causada por especies de tremátodos del género Paragonimus, presente en áreas tropicales y subtropicales de Asia, África y América. El ser humano se infecta mediante la ingestión de crustáceos de agua dulce crudos o mal cocidos. La infección afecta principalmente los pulmones, con desarrollo de múltiples manifestaciones clínicas y radiológicas, dependiendo del momento del ciclo vital del parásito. El diagnóstico diferencial más importante de esta enfermedad es la tuberculosis pulmonar. En este artículo se describe esta enfermedad en dos niñas con diferentes manifestaciones pulmonares. La paragonimiasis se debe sospechar en pacientes con tos crónica, esputo herrumbroso, dolor torácico, con o sin compromiso cerebral, que viven o han residido en una zona endémica y que presentan una eosinofília elevada, con cambios radiológicos sugestivos del síndrome de Loeffler.
PALABRAS CLAVE
Eosinofilia, Paragonimiasis, Praziquantel, Triclabendazol
SUMMARY
Paragonimiasis is a parasitic, food-borne zoonosis, caused by species of trematodes of the genus Paragonimus, found in tropical and subtropical areas of Asia, Africa and America. Human beings become infected by ingestion of raw or undercooked freshwater shellfish. The infection primarily affects the lungs, with the development of multiple clinical and radiological manifestations, depending on the moment in the life cycle of the parasite. The most important differential diagnosis of this disease is pulmonary tuberculosis. We report two cases of lung paragonimiasis in aboriginal Colombian girls with different pulmonary manifestations. Paragonimiasis should be suspected in patients with chronic cough, rusty sputum, chest pain, with or without brain involvement, who live or have lived in endemic areas and have a high-level eosinophilia with radiographic changes suggestive of Loeffler's syndrome.
KEY WORDS
Eosinofilia, Paragonimiasis, Praziquantel, Triclabendazol
INTRODUCCIÓN
La paragonimiasis es una zoonosis presente en las áreas tropicales y subtropicales de Asia, África y América, producida por parásitos del género Paragonimus, los cuales cumplen su ciclo de vida en dos hospederos intermediarios (un molusco o un crustáceo de agua dulce) y un hospedero definitivo (un mamífero, silvestre o doméstico) (1,2). La infección en la especie humana se produce por la ingestión de crustáceos parasitados, crudos o mal cocidos, y por la manipulación de utensilios de cocina contaminados durante la preparación de estos alimentos. Después de cumplir un complejo ciclo en el hospedero definitivo, el parásito adulto se desarrolla en los pulmones, donde puede ocasionar un cuadro clínico parecido a la tuberculosis o a la histoplasmosis, formando quistes con una cápsula fibrosa y contenido purulento desde donde liberan los huevos, que se eliminan por vía bronquial y, si son deglutidos, salen en los excrementos. Excepcionalmente puede haber localizaciones ectópicas del gusano en el intestino, los ganglios linfáticos, el peritoneo, el tejido celular subcutáneo, el hígado, la pleura y el sistema nervioso central (2-15).
En 1879, Ringer describió por primera vez la paragonimiasis pulmonar, al observar el parásito en el tejido pulmonar de un paciente portugués. El parásito observado era idéntico al hallado por Westerman, en 1877, en el pulmón de un tigre fallecido en el zoológico de Amsterdan. Según lo describe Larach, la primera descripción de la enfermedad y de los huevos típicos que aparecen en el esputo de los pacientes la hicieron Manson y Baelz en 1880 (16). En años recientes se ha detectado esta enfermedad en países donde no se reportaba la presencia del parásito, lo cual se ha asociado con las migraciones de personas infectadas con el parásito adulto, los viajes transoceánicos, la difusión de comidas étnicas típicas en los países desarrollados y la expansión del comercio de alimentos (7-12). Esta enfermedad también se ha denominado ''hemoptisis parasítica'', ''hemoptisis endémica'' y ''distomatosis pulmonar'' (10,16).
Se ha establecido que alrededor de 20 millones de individuos están infectados por Paragonimus en el mundo y que cerca de 293 millones de personas viven en zonas de riego para adquirir la paragonimiasis; China es uno de los países endémicos, donde se calcula que entre 5% y 10% de la población está infectada por Paragonimus spp. (11).
El tiempo que transcurre entre la infección oral con las metacercarias, su paso por el sistema digestivo y su migración a través del peritoneo y el diafragma hasta llegar al pulmón, donde se transforman en parásitos adultos, puede ser de hasta tres meses, y el periodo de incubación, que va desde la infección con las metacercarias hasta la presencia de signos y síntomas asociados con los daños causados por el parásito, varía dependiendo de la etapa de la infección y la carga parasitaria, presentándose reportes de hasta un año o más. El Paragonimus adulto generalmente muere después de seis años, pero puede persistir por periodos hasta de 20 años; el compromiso pulmonar es el más frecuente, con manifestaciones clínicas y hallazgos en la radiografía pulmonar que pueden ser indistinguibles de los generados por la tuberculosis (TB) (12).
En un reporte de casos del decenio de 1950 se identificó un aumento endémico de la paragonimiasis en China, en el que la mayoría de los pacientes tenían esputo hemoptoico como la manifestación más importante, seguido por tos, dolor torácico y otros síntomas, como dolor epigástrico. Los hallazgos en la radiografía de tórax fueron muy variables, desde nódulos bien definidos o moderadamente definidos, con centro translúcido, opacidades de tipo alveolar (reversibles completamente o con nódulos residuales), derrame pleural frecuentemente bilateral y en ocasiones acompañado de neumotórax, calcificaciones, aumento y/o irregularidad de las marcas pulmonares y ligeras dilataciones o irregularidades bronquiales. Estos hallazgos implican que para llegar al diagnóstico de paragonimiasis se requiere un alto índice de sospecha clínica (12).
En este artículo se presentan dos niñas con diagnóstico de paragonimiasis pulmonar, ambas procedentes de un área endémica colombiana, atendidas en el Hospital Universitario San Vicente Fundación, una entidad de cuarto nivel en la ciudad de Medellín (Colombia).
Paciente 1
Niña de 7 años de edad, indígena, perteneciente a la etnia embera katío, natural y residente en un asentamiento situado a lo largo de la carretera que comunica a Quibdó con Medellín, a la altura de Carmen de Atrato, en el departamento de Chocó (Colombia), cercano al departamento de Antioquia; fue remitida para la corrección de una hernia inguinal izquierda gigante a un hospital de tercer nivel. La madre informó que la niña tenía episodios de tos hemoptoica (a veces expectoraba moco con pintas de sangre y otras veces ''sangre viva''), de predominio nocturno, acompañados de dolor pleurítico de un año de evolución, además de fiebre intermitente, cefalea ocasional, astenia y adinamia; ocasionalmente tenía episodios de diarrea mucosa, sin sangre, pero con dolor abdominal difuso; todos estos síntomas se exacerbaron 15 días antes de la remisión.
La madre de la paciente era tosedora crónica pero no tenía hemoptisis. Vivían en condiciones de pobreza y hacinamiento, sin agua potable ni servicios sanitarios y en contacto con animales domésticos (perros, gatos y gallinas).
Al examen físico tenía signos de desnutrición crónica (pelo delgado, con discromatotriquia y piel con signos carenciales). El peso era de 17,1 kg y la talla, de 109 cm (ambos por debajo del percentil 3); la presión arterial era de 80/50 mm de Hg y la temperatura, de 38 °C. Estaba consciente, decaída, sin dificultad respiratoria, pero con roncus generalizados y disminución del murmullo vesicular en ambos vértices pulmonares. No tenía masas abdominales palpables ni visceromegalias. En la ingle izquierda tenía una hernia que se extendía hasta el labio mayor de ese lado. El resto del examen físico era normal.
Se hospitalizó con los diagnósticos de tuberculosis pulmonar, desnutrición crónica y parasitosis intestinal. En la radiografía de tórax se identificó opacidad de tipo alveolar que borraba la silueta cardíaca izquierda y la base pulmonar derecha, con hilios reforzados y calcificaciones. Por estos hallazgos le practicaron exámenes complementarios para TB; se encontraron prueba de tuberculina (tipo Mantoux) de 0 mm y tres baciloscopias de jugo gástrico con cultivo, con resultados negativos para micobacterias.
En el examen coprológico se encontraron 39.000 huevos de Ascaris lumbricoides por gramo de materia fecal (infección intensa); 20.000 huevos de Trichiuris trichiura por gramo de materia fecal (infección intensa); trofozoítos de Balantidium coli (++) y huevos de Paragonimus spp. En el análisis de una muestra de esputo se hallaron abundantes huevos de Paragonimus spp. El hemoleucograma mostró 10.300 leucocitos/µL, de los cuales el 11% correspondía a eosinófilos, además de anemia leve (hemoglobina: 10 g/dL; hematocrito: 33%) y plaquetas normales.
Con base en los criterios clínico, epidemiológico y radiográfico se planteó iniciar tratamiento para TB, pero por la clínica, los hallazgos en la radiografía y los exámenes de laboratorio se decidió que el cuadro correspondía a una paragonimiasis pulmonar y se trató con praziquantel vía oral por 3 días. Para las parasitosis restantes se le suministró tratamiento con albendazol en dosis única y metronidazol durante 5 días.
La niña evolucionó satisfactoriamente y permaneció afebril durante toda la estancia hospitalaria. Egresó al cabo de 21 días, con instrucciones y cita por consulta externa. Unas semanas después se le practicó la corrección de la hernia inguinal.
Paciente 2
Niña de 2 años de edad, indígena, natural y residente en un asentamiento ubicado a nueve horas de la cabecera municipal de Dabeiba (Antioquia, Colombia). Fue producto de un embarazo normal, con parto domiciliario, sin complicaciones. Con esquema de vacunación incompleto para la edad según el Plan Ampliado de Inmunización (PAI) colombiano y sin datos acerca del neurodesarrollo. Tenía antecedente de TB pulmonar, diagnosticada por criterios tuberculínico, radiológico, clínico y epidemiológico; además, tenía desnutrición crónica intensa, por lo que ingresó a un centro de recuperación nutricional.
Varios miembros de la comunidad donde vivía la niña eran tosedores crónicos y algunos de ellos tenían diagnóstico de TB y estaban en tratamiento tetraconjugado. En la vivienda indígena dormían 12 personas, en condiciones de pobreza y hacinamiento, sin agua potable ni servicios sanitarios y en contacto con animales domésticos (perros, gatos y gallinas), pero no relataban consumo de cangrejos crudos.
La paciente fue remitida al hospital de cuarto nivel de atención por presentar síndrome de dificultad respiratoria grave. Ingresó en regulares condiciones generales, con signos de desnutrición grave, afebril, taquicárdica, taquipneica, con saturación de oxígeno de 78% en el ambiente; a la auscultación pulmonar se le encontraron crépitos y roncus difusos bilaterales. Tenía ascitis, circulación colateral abdominal, hepatomegalia y esplenomegalia (hallazgos confirmados en la ecografía abdominal, en la cual se documentaron además hígado graso e imágenes intestinales sugestivas de Ascaris). El examen físico restante fue normal.
En la radiografía de tórax (figura 1a) se observó derrame pleural en el hemitórax izquierdo, por lo que se inició tratamiento con antibióticos y se continuó el tratamiento de la TB iniciado semanas antes, con relativa mejoría clínica; además, se le diagnosticaron y trataron las siguientes parasitosis concomitantes: ascariasis (diagnosticada por observación del parásito adulto en las asas intestinales por la ecografía abdominal), giardiasis (+++ de quistes y trofozoítos en materias fecales), malaria (esquizontes, gametocitos y trofozoítos de Plasmodium vivax, en el examen de gota gruesa) y escabiosis. Se remitió de nuevo al centro de recuperación nutricional.
Dos meses después fue remitida nuevamente al hospital de cuarto nivel por cuadro clínico de cuatro días de evolución, consistente en fiebre, palidez y dificultad respiratoria, disminución del murmullo vesicular en ambos campos pulmonares y crépitos bibasales. En la radiografía de tórax se identificó un derrame pleural bilateral (figura 1b), por lo que se inició tratamiento con antibióticos, ante el diagnóstico de neumonía complicada adquirida en la comunidad, con evolución insatisfactoria y deterioro radiológico (figura 1c). Dado que la cantidad de líquido pleural era muy escasa no se le practicó punción pleural. Por los hallazgos radiológicos con derrame pleural que no se resolvían, a pesar de un tratamiento antibiótico adecuado y abandonos previos del tratamiento de la TB, se consideró la posibilidad de TB resistente y se le practicaron una broncoscopia, sin hallazgos anormales, y un lavado broncoalveolar que fue negativo para micobacterias. En un nuevo examen coproscópico se encontró Giardia lamblia (+++ de quistes y + de trofozoítos), para lo cual se le dio nuevamente tratamiento antiparasitario.
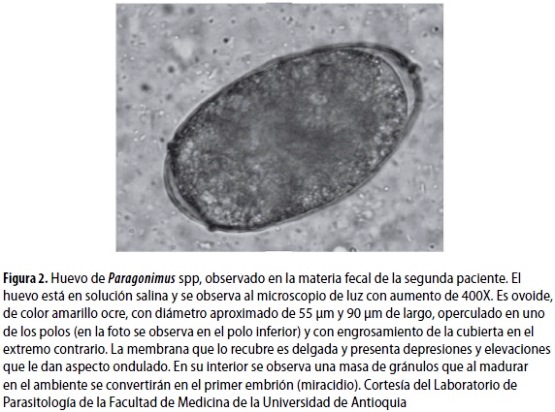
El hemoleucograma (HLG) demostró 22.400 leucocitos/µL, con 48% de eosinófilos. Al repetirlo, se encontraron 27.100 leucocitos/µL, con 52% de eosinófilos. Se solicitó estudio serológico para Toxocara spp., el cual fue negativo, y se buscó Paragonimus spp., en materia fecal, con resultado positivo para huevos de este parásito y +++ de cristales de Charcot Leyden (figura 2).
Se inició tratamiento con triclabendazol, a razón de 20 mg/kg/día repartido en 2 tomas por vía oral, en un día. Evolucionó bien y continuó con la segunda fase de tratamiento para TB. Finalmente se remitió a una unidad de salud local para continuar allí el tratamiento restante.
DISCUSIÓN
La paragonimiasis es una zoonosis reemergente, categorizada por la OMS dentro de las enfermedades desatendidas, causada por el tremátodo Paragonimus spp., del cual se han descrito 50 especies, pero solo 16 de ellas infectan la especie humana. Entre estas se encuentran: Paragonimus westermani, identificado principalmente en el Sureste y Lejano Oriente de Asia (es el que afecta más frecuentemente al hombre); Paragonimus africanus, presente en el oeste de África; Paragonimus mexicanus, prevalente en Centroamérica y Suramérica; Paragonimus kellicotti, ubicado en Norteamérica (14,17-19); Paragonimus vietnamiensis que se describe como una nueva especie, reportada en Vietnam (19,20) y Paragonimus maripurensis, presente en India (21).
Esta enfermedad se presenta de manera endémica y afecta al ser humano como hospedero definitivo, en el que genera compromiso sistémico, principalmente pulmonar, con manifestaciones clínicas y hallazgos radiológicos muy variables, asociados con la especie del parásito, la etapa de la infección, el número de parásitos adultos y factores del hospedero, razón por la cual se requiere un alto índice de sospecha para el diagnóstico de certeza (8-14).
El diagnóstico diferencial más importante de la paragonimiasis es con la TB, con la cual comparte muchos de los hallazgos clínicos y radiológicos (12,13,17), por lo cual se considera que la búsqueda de Paragonimus spp., en zonas endémicas es necesaria en pacientes con diagnóstico clínico de tuberculosis pulmonar y en los que no están respondiendo al tratamiento contra la TB (22,23). Sin embargo, otras enfermedades infecciosas, como la histoplasmosis o enfermedades malignas como el mesotelioma pulmonar (13) pueden producir imágenes que generan confusión (24). También se recomienda tener en cuenta la paragonimiasis en el diagnóstico diferencial de todos los pacientes con imágenes quísticas pulmonares (25).
El ciclo de vida de Paragonimus es complejo e involucra varios hospederos: el ser humano se comporta como hospedero definitivo que elimina huevos, los cuales, al caer al agua dulce, maduran en un período de dos a nueve semanas para generar embriones, dando origen al primer estadio larvario, denominado miracidio, que vive en el agua durante un corto período hasta encontrar el primer hospedero intermediario, un molusco gasterópodo. En este, el miracidio inicia la reproducción vegetativa, originando unas formaciones llamadas redias, que se multiplican para producir cercarias, que perforan el tegumento del molusco y salen a buscar un crustáceo como segundo hospedero intermediario. Las cercarias se convierten en metacercarias en los divertículos intestinales, los músculos, las patas y a veces las branquias del crustáceo (1). Los mamíferos, incluyendo al ser humano, se infectan al consumir los crustáceos crudos o mal cocidos (26). Las metacercarias llegan al intestino, atraviesan la pared intestinal, alcanzan la cavidad peritoneal y se dirigen mediante un tropismo especial hacia el diafragma, el cual atraviesan para llegar hasta el tejido pulmonar, donde se convierten en parásitos adultos; allí persisten durante varios años, en nódulos que contienen gran cantidad de huevos. Cuando los nódulos se rompen hacia los bronquios o los bronquíolos, los huevos son expulsados con la expectoración o deglutidos, en cuyo caso salen con las materias fecales; si caen al agua, encuentran las condiciones adecuadas para generar embriones y reiniciar el ciclo de vida (2-4,18,24).
La enfermedad tiene un comienzo lento y poco llamativo y es de evolución crónica. En la etapa de migración de la larva (metacercaria), los pacientes pueden manifestar dolor abdominal o epigastralgia, debido a la penetración del diafragma o las vísceras para llegar a la pleura y acceder a los pulmones desde la cavidad abdominal; posteriormente aparecen dolor pleurítico y/o hemoptisis. Puede no haber fiebre o esta ser leve. Otros síntomas son: urticaria, disnea y tos (12,14,17). En este período se puede identificar engrosamiento pleural en la radiografía de tórax, con o sin derrame, que puede ser bilateral, como en la segunda paciente reportada; esta característica contrasta con los hallazgos habituales de la TB, en la que el derrame pleural suele ser unilateral. Puede haber infiltrados de tipo alveolar sin derrame pleural; algunos casos pueden estar acompañados de neumotórax espontáneo, que, junto con los infiltrados pulmonares, puede desaparecer rápidamente. Usualmente el líquido pleural es un exudado transparente, con muchos eosinófilos. El intervalo entre la infección y la aparición del primer hallazgo radiológico puede ser de un mes o más (12).
Después de entrar al pulmón, las larvas pueden migrar dentro de él por un período indefinido o establecerse en algún lugar del mismo, hasta convertirse en gusanos adultos, en un lapso de tres meses a un año. En este período, los síntomas principales consisten en tos irritativa, dolor torácico, malestar general con fiebre o sin ella y esputo sanguinolento (12,17). Los hallazgos radiográficos pulmonares pueden ser infiltrados de tipo alveolar, cambiantes y persistentes durante varias semanas o meses; el derrame pleural es menos frecuente en este período, pero cuando está presente suele ser bilateral. En el HLG se puede encontrar leucocitosis, con predomino de eosinófilos, que pueden alcanzar cifras hasta del 80%, y aumento de la velocidad de sedimentación globular (12).
Finalmente, ocurre un período crónico en el cual los parásitos están vivos en el pulmón y el paciente clásicamente tiene expectoración hemoptoica, achocolatada o de color sui géneris, principalmente luego de la actividad física (12,17), como lo presentaba la primera de nuestras pacientes. Suele haber pérdida de peso y malestar general, pero usualmente no hay fiebre. En la radiografía de tórax se pueden ver nódulos con centro más claro, a menudo bilaterales y múltiples, ubicados en cualquier parte del pulmón; ocasionalmente pueden desaparecer y reaparecer, dependiendo del grado de reacción inflamatoria del parénquima pulmonar alrededor de la lesión. Se pueden encontrar piotórax, neumotórax o ambos. Las lesiones quísticas se forman alrededor de los parásitos, y cuando estos espacios se llenan de líquido o sangran se forma una consolidación del parénquima. Los quistes que se comunican con los bronquíolos o bronquios aparecen como imágenes aéreas en el pulmón consolidado; se han reportado imágenes de absceso pulmonar (25). En esta fase, algunos pacientes pueden permanecer asintomáticos, pero en la radiografía de tórax se les encuentran uno o varios nódulos pulmonares (27). El líquido pleural en esta fase es turbio, achocolatado. Raramente se encuentran huevos del parásito en el líquido pleural. Puede ocurrir hemoptisis franca. Si las lesiones están ocultas en el hilio o superpuestas a la imagen del diafragma, o si la inflamación que aparece alrededor de la lesión es tenue, no se encuentran cambios en las radiografías de tórax. Además, las lesiones quísticas pueden ser tan pequeñas que no se observen en la radiografía de tórax (12,13).
En la etapa final los parásitos mueren, ya sea espontáneamente o como consecuencia del tratamiento farmacológico. En esta fase desaparece el esputo recurrente sanguinolento, pero se puede presentar hemoptisis masiva por bronquiectasias (12,17). En el esputo no se encuentran huevos del parásito. Aunque se acepta que la paragonimiasis pulmonar se puede resolver espontáneamente en un plazo de 10 años, se han reportado casos positivos después de este tiempo, sin reinfección conocida. En la radiografía de tórax se pueden identificar reabsorción completa de la lesión o pequeñas áreas de fibrosis o calcificaciones en el sitio donde estaban los nódulos parasitarios (12).
Como se ha mencionado, las manifestaciones más importantes de esta enfermedad son las pulmonares, pero se pueden afectar otros órganos y tejidos: el tejido celular subcutáneo, los ganglios linfáticos, el peritoneo, el pericardio, el mediastino, el intestino, las glándulas suprarrenales, el riñón, los testículos, la columna vertebral, la cavidad peritoneal, el hígado y el cerebro.
La afección cerebral es la segunda forma clínica más común, que puede ser mortal; es más frecuente en niños mayores y en adultos jóvenes y se manifiesta por cefalea, alteraciones visuales y convulsiones; en la forma crónica puede dar origen a un síndrome convulsivo, retardo mental y parálisis (12-14,17,18).
El diagnóstico específico de paragonimiasis se basa en la demostración del tremátodo (adulto o huevos) y/o de sus antígenos. La muestra con la que se puede hacer esta demostración depende de la ubicación anatómica del parásito adulto. La sensibilidad de las técnicas parasitológicas es baja y depende en gran medida de la etapa de la enfermedad y de la carga parasitaria; en contraste, la especificidad es de 100%; por ello se recomiendan estudios seriados para aumentar la probabilidad diagnóstica, así como la implementación de pruebas complementarias no parasitológicas.
Las muestras más comúnmente usadas son:
1. Esputo. Cuando la ubicación del parásito adulto es pulmonar, los quistes que contienen los parásitos adultos pueden comunicarse con los bronquíolos adyacentes o con los bronquios y eliminar cantidades variables de huevos (13,14). En estos casos, la muestra de elección es el esputo obtenido por expectoración espontánea o inducida. Esta muestra se debe analizar lo más pronto posible o, si ello no es factible, preservarla en formol comercial diluido al 1:10 en solución salina normal o almacenarla durante unas horas (máximo un día) a 4 °C. En esta muestra se pueden observar los huevos del parásito, utilizando técnicas directas y de concentración y microscopio de luz o estereomicroscopio. También es posible observar eritrocitos, cristales de Charcot-Leyden (asociados a la eosinofilia característica de esta parasitosis) y material necrótico. Recientemente se ha informado la posibilidad de analizar estas muestras con coloración de Ziehl-Neelsen, la cual también se utiliza para el diagnóstico de TB. Si se recurre a esta técnica, se debe hacer la búsqueda de los huevos con aumento de 100x a 600x, mientras que los bacilos ácido-alcohol resistentes se buscan con aumento de 1.000x. La importancia de utilizar esta técnica radica en poder detectar en una misma muestra y con la misma coloración tanto los huevos de Paragonimus como los bacilos ácido-alcohol resistentes de las micobacterias (15-18,24,28-30).
2. Lavado broncoalveolar. En él se pueden identificar los huevos del parásito mediante examen con técnicas directas y de concentración y, menos a menudo, con coloraciones como la de hematoxilina-eosina (17,18).
3. Materia fecal. Esta muestra se debe analizar lo más pronto posible o preservarla en formol comercial diluido al 1:10 en solución salina normal o almacenarla durante unas horas (máximo un día) a 4 °C.
En la materia fecal se pueden detectar los huevos del parásito, originados en el pulmón, ya que son deglutidos y eliminados sin sufrir ningún cambio. En esta muestra también pueden observarse los cristales de Charcot-Leyden (18).
4. El tejido pulmonar u otros tejidos obtenidos mediante biopsia y analizados por histopatología permite la identificación del parásito adulto, los huevos libres o dentro de granulomas, rodeados de material fibrótico; además, zonas de necrosis, cavitaciones y focos neumónicos, con infiltrados inflamatorios abundantes (27). Entre las pruebas complementarias se encuentran las siguientes:
Hemoleucograma: se observa leucocitosis con eosinofilia intensa (23% a 57%), algunos autores consideran que esta eosinofilia es secundaria a las parasitosis intestinales asociadas (16,27,24,31), como es encontró en las dos pacientes reportadas.
Radiografía de tórax: los hallazgos con esta técnica pueden variar según el estadio de la enfermedad, como se describió en la segunda paciente (16,24).
Técnicas inmunológicas: las técnicas serológicas como el ensayo inmunoenzimático (ELISA) y el inmunoblot, que permiten la detección de anticuerpos de tipo IgG, son muy promisorias, sobre todo para los casos en que no se ha podido hacer el diagnóstico parasitológico y existe una alta sospecha clínica y epidemiológica. Sin embargo, y a pesar de que se vienen perfeccionando con el advenimiento de la ingeniería genética y las técnicas de la biología molecular, aún no existe una técnica validada que se pueda utilizar para un diagnóstico de certeza. Por lo tanto, hasta la fecha solo se utilizan como ''ayuda'' diagnóstica, útil en la diferenciación entre paragonimiasis y otras enfermedades. Estas pruebas también se utilizan como criterio de eficacia terapéutica (18,27).
Intradermorreacción: cada vez se usa menos; sirve para evaluar la situación endémica y también como guía en el diagnóstico diferencial. Esta prueba consiste en la inoculación intradérmica de extractos antigénicos del parásito adulto, en el antebrazo del paciente; el efecto inmunológico se manifiesta por una inflamación (pápula) que se puede ver inmediatamente o hasta 30 minutos después de la aplicación del antígeno, con un tiempo de lectura promedio de 15 minutos después de esta. El tamaño de la pápula que puede considerarse como un resultado positivo varía de acuerdo con la casa comercial que produce el antígeno y con la concentración utilizada del mismo. Una prueba positiva indica contacto con Paragonimus, pero no es diagnóstica y puede permanecer positiva muchos años después de la curación de la enfermedad (32).
Otras técnicas: la tomografía por emisión de positrones (PET) con 18 F-fluorodeoxiglucosa ha sido utilizada tradicionalmente en el diagnóstico de cáncer, debido a su capacidad para diferenciar entre la tasa metabólica de la glucosa en tumores benignos y malignos, especialmente pulmonares. Pero la superposición en la tasa metabólica de las enfermedades inflamatorias (paragonimiasis pulmonar) y neoplásicas puede generar confusión. En el caso de paragonimiasis pulmonar, se ha demostrado alta captación, sugestiva de un tumor, por lo que se debe tener este último como un diagnóstico diferencial (33).
La tomografía da información más específica sobre el contenido de la cápsula parasitaria y los trayectos de migración. En los casos crónicos, es posible encontrar lesiones calcificadas. Esta modalidad imaginológica se considera de gran utilidad en algunas localizaciones ectópicas (27).
Las técnicas de biología molecular como la reacción en cadena de la polimerasa (PCR) se utilizan en investigación, pero no son una herramienta de diagnóstico rutinario.
TRATAMIENTO
En el tratamiento farmacológico de esta enfermedad se han utilizado muchos medicamentos, entre los que se encuentran: sales de antimonio, emetina, sulfas y cloroquina. Con el praziquantel se ha demostrado una alta eficacia, con posibilidad de curar las formas cerebrales; la dosis recomendada es de 25 mg/kg cada 8 horas, durante 2 a 3 días (15-18,34). El triclabendazol es tan eficaz como el praziquantel, en dosis de 20 mg/kg/día, repartido en dos tomas orales, durante 24 horas (18).
DISCUSIÓN
Las pacientes descritas en el presente artículo son casos característicos de paragonimiasis pulmonar. Ambas procedían de la etnia embera, ubicada en cercanías de la costa Pacífica colombiana, reconocida como endémica para esta parasitosis (34). Ambas tenían hallazgos pulmonares sugestivos de la enfermedad (9,12,14-16) que fueron confundidos inicialmente con los de la tuberculosis pulmonar; en ambas se demostró la infección con criterios parasitológicos y se obtuvo mejoría clínica con el tratamiento específico suministrado.
En Colombia, la paragonimiasis es una enfermedad parasitaria desatendida y se carece de datos confiables sobre su prevalencia e incidencia. Sin embargo, se han descritos focos de transmisión, tanto en áreas rurales como urbanas de diferentes regiones. Las comunidades indígenas son las poblaciones con mayor riesgo de infección, dados sus hábitos culturales de consumo de crustáceos crudos y sus deficientes sistemas de acueducto y alcantarillado. En Colombia los casos de paragonimiasis humana solo se comenzaron a registrar a partir de 1981 y el informe sobre el primer foco se publicó en 1995, en un resguardo indígena del municipio de Urrao (Antioquia), con un hallazgo del 10% de paragonimiasis humanas para esa población. Después de esa fecha se encuentran informes de estudios de focos, en los que se describe la presencia de hospederos intermediarios y definitivos infectados, al igual que algunos reportes de casos de paragonimiasis humana. Sin embargo, a la fecha no existe ningún estudio que permita calcular la prevalencia e incidencia de esta parasitosis en el país (1-3,6,10,30,32,35).
En conclusión, consideramos, a la luz de este informe, que esta enfermedad se debe tener en cuenta como diagnóstico diferencial en todos los pacientes con tos crónica, dolor torácico y hemoptisis, y en aquellos con diagnóstico de TB pulmonar, que no evolucionen en la forma esperada con el tratamiento instaurado; también en todos los pacientes sintomáticos respiratorios procedentes de áreas endémicas para Paragonimus (22,23).
REFERENCIAS BIBLIOGRÁFICAS
1. Gálvez A, Hurtado M, Ortega J, Salazar A, Velásquez L, Vélez I, et al. Paragonimiasis: una investigación multidisciplinaria en salud, biología y cultura en Colombia. Medellín: Universidad de Antioquia; 2002. p. 61. [ Links ]
2. Uruburu M, Granada M, Velásquez L. Determinación taxonómica y geográfica en Antioquia de crustáceos hospedadores de Paragonimus sp. Revista CES Medicina. 2007;21(Sup 1):110–1. [ Links ]
3. Vélez I, Ortega J, Hurtado M, Salazar A. Primer foco de paragonimosis humana en Colombia. Acta Médica Colombiana. 1994;19(4s):254. [ Links ]
4. Pérez-Arellano JL, Andrade MA, López-Abán J, Carranza C, Muro A. [Helminths and the respiratory system]. Arch Bronconeumol. 2006 Feb;42(2):81–91. [ Links ]
5. Blair D, Xu ZB, Agatsuma T. Paragonimiasis and the genus Paragonimus. Adv Parasitol. 1999 Jan;42:113–222. [ Links ]
6. Vélez ID, Ortega JE, Velásquez LE. Paragonimiasis: a view from Columbia. Clin Chest Med. 2002 Jun;23(2):421–31, ix–x. [ Links ]
7. Jeon K, Koh W-J, Kim H, Kwon OJ, Kim TS, Lee KS, et al. Clinical features of recently diagnosed pulmonary paragonimiasis in Korea. Chest. 2005 Sep;128(3):1423–30. [ Links ]
8. Alvarado L, Pariona L, Beltrán M. Casos de Paragonimiasis (Paragonimiosis) en el Hospital Nacional Sergio E. Bernales (Lima, Perú). Rev peru med exp salud publica. 2004;21(2):107–10. [ Links ]
9. Mukae H, Taniguchi H, Matsumoto N, Iiboshi H, Ashitani J, Matsukura S, et al. Clinicoradiologic features of pleuropulmonary Paragonimus westermani on Kyusyu Island, Japan. Chest. 2001 Aug;120(2):514–20. [ Links ]
10. Casas E, Gómez C, Valencia E, Salazar L, Velásquez L. Estudio de foco de paragonimiasis en Fuente Clara, Robledo, área periurbana de Medellín, Antioquia. Biomédica. 2008;28(3):396–403. [ Links ]
11. Procop GW. North American paragonimiasis (Caused by Paragonimus kellicotti) in the context of global paragonimiasis. Clin Microbiol Rev. 2009 Jul;22(3):415–46. [ Links ]
12. Yang SP, Huang CT, Cheng CS, Chiang LC. The clinical and roentgenological courses of pulmonary paragonimiasis. Dis Chest. 1959 Nov;36:494–508. [ Links ]
13. Yamazaki M, Ohwada A, Miyaji A, Yamazaki H, Nara T, Hirai S, et al. Pulmonary paragonimiasis with coincidental malignant mesothelioma. Intern Med. 2008 Jan;47(11):1027–31. [ Links ]
14. Zarrin-Khameh N, Citron DR, Stager CE, Laucirica R. Pulmonary paragonimiasis diagnosed by fine-needle aspiration biopsy. J Clin Microbiol. 2008 Jun;46(6):2137–40. [ Links ]
15. Narain K, Rekha Devi K, Mahanta J. A rodent model for pulmonary paragonimiasis. Parasitol Res. 2003 Dec;91(6):517–9. [ Links ]
16. Larach C. Paragonimiasis pulmonar, presentación de un caso. Rev Méd Hondur. 1970;38:74–7. [ Links ]
17. Procop GW, Marty AM, Scheck DN, Mease DR, Maw GM. North American paragonimiasis. A case report. Acta Cytol. 2000;44(1):75–80. [ Links ]
18. Hawn T, Jong E. Update on Hepatobiliary and Pulmonary Flukes. Curr Infect Dis Rep. 1999 Dec;1(5):427–33. [ Links ]
19. Doanh PN, Shinohara A, Horii Y, Habe S, Nawa Y, Le NT. Description of a new lung fluke species, Paragonimus vietnamensis sp. nov. (Trematoda, Paragonimidae), found in northern Vietnam. Parasitol Res. 2007 Nov;101(6):1495–501. [ Links ]
20. Doanh PN, Shinohara A, Horii Y, Habe S, Nawa Y, Le NT. Discovery of Paragonimus proliferus in Northern Vietnam and their molecular phylogenetic status among genus Paragonimus. Parasitol Res. 2008 Mar;102(4):677–83. [ Links ]
21. Singh ST, Singh DL, Sugiyama H. Possible discovery of Chinese lung fluke, Paragonimus skrjabini in Manipur, India. The Southeast Asian journal of tropical medicine and public health. 2006 Jan;37 Suppl 3:53–6. [ Links ]
22. Belizario V, Guan M, Borja L, Ortega A, Tiri R. Pulmonary paragonimiasis in non-responding tuberculosis patients in Irosin, Sorsogon. Phil J Microbiol Infect Dis. 1997;26(1):13–5. [ Links ]
23. Nagakura K, Oouchi M, Abe K, Araki K. Pulmonary paragonimiasis misdiagnosed as tuberculosis: with special references on paragonimiasis. The Tokai journal of experimental and clinical medicine. 2002 Dec;27(4):97–100. [ Links ]
24. Moon WK, Kim WS, Im JG, Kim IO, Yeon KM, Han MC. Pulmonary paragonimiasis simulating lung abscess in a 9-year-old: CT findings. Pediatr Radiol. 1993 Jan;23(8):626–7. [ Links ]
25. Yoo IR, Park HJ, Hyun J, Chung YA, Sohn HS, Chung SK, et al. Two cases of pulmonary paragonimiasis on FDG-PET CT imaging. Ann Nucl Med. 2006 May;20(4):311–5. [ Links ]
26. Human paragonimiasis after eating raw or undercooked crayfish --- Missouri, July 2006-September 2010. MMWR Morb Mortal Wkly Rep. 2010 Dec 10;59(48):1573–6. [ Links ]
27. Komalamisra C. Chromosomes and Chromosome Breakage in the Lung Fluke, Paragonimus heterotremus. The Journal of Tropical Medicine and Parasitology. 2005;28(2):69–72. [ Links ]
28. Davidson R. Lung and liver flukes. Medicine. 2005;33(8):68–9. [ Links ]
29. Slesak G, Inthalad S, Basy P, Keomanivong D, Phoutsavath O, Khampoui S, et al. Ziehl-Neelsen staining technique can diagnose paragonimiasis. PLoS Negl Trop Dis. 2011 May;5(5):e1048. [ Links ]
30. Uriza A, Cuervo C, Valencia A, Echeverri L. Paragonimiasis y afectaciones pulmonar, neurológica y hepática: presentación de caso. Rev Colomb Radiol. 2011;22(4):3357–61. [ Links ]
31. Min D-Y, Lee Y-A, Ryu J-S, Ahn M-H, Chung Y-B, Sim S, et al. Caspase-3-mediated apoptosis of human eosinophils by the tissue-invading helminth Paragonimus westermani. Int Arch Allergy Immunol. 2004 Apr;133(4):357–64. [ Links ]
32. Vélez ID, Ortega J, Hurtado MI, Salazar AL, Robledo SM, Jimenez JN, et al. Epidemiology of paragonimiasis in Colombia. Trans R Soc Trop Med Hyg. 2000;94(6):661–3. [ Links ]
33. Yoshino I, Nawa Y, Yano T, Ichinose Y. Paragonimiasis westermani presenting as an asymptomatic nodular lesion in the lung: report of a case. Surg Today. 1998 Jan;28(1):108–10. [ Links ]
34. Pachucki CT, Levandowski RA, Brown VA, Sonnenkalb BH, Vruno MJ. American paragonimiasis treated with praziquantel. The New England journal of medicine. 1984 Aug 30;311(9):582–3. [ Links ]
35. Merlano R, Santa D, Rada R. Paragonimiasis pleuro pulmonar. Rev. Colomb. Neumol. 2009;21(4):186–91. [ Links ]