Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.26 no.3 Medellín July/Sept. 2013
PRESENTACIÓN DE CASOS
Alcalosis metabólica hipoclorémica como presentación de la fibrosis quística. Informe de dos casos
Hypochloremic metabolic alkalosis as presentation of cystic fibrosis. Report of two cases
Olga Lucía Morales Múnera1; Juan Camilo Villada Valencia2; Iván Darío Flórez3; Nicolás Guillermo Pineda Trujillo4
1 Pediatra neumóloga, Profesora del Departamento de Pediatría y Puericultura, Facultad de Medicina, Universidad de Antioquia, Medellín Colombia. Pediatra neumóloga del Hospital Universitario San Vicente Fundación, Medellín Colombia. olmmunera@yahoo.com
2 Pediatra, Universidad de Antioquia, Medellín Colombia.
3 MD, MSc. Médico pediatra y epidemiólogo clínico. Profesor del Departamento de Pediatría y Puericultura, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. Pediatra UCIP Clínica Las Américas, Medellín Colombia.
4 MSc, PhD en Genética. Profesor, Grupo Mapeo Genético, Departamento de Pediatría y Puericultura, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
Recibido: septiembre 23 de 2012
Aceptado: octubre 16 de 2012
RESUMEN
Introducción: se describen los casos de dos pacientes con fibrosis quística (FQ) con alcalosis metabólica hipoclorémica: uno con diagnóstico de novo y otro con una recaída.
Casos clínicos: pacientes de 6 y 9 meses que consultan por tos, fiebre y disnea. El primero con síndrome bronco-obstructivo recurrente (SBOR), el segundo con FQ conocida. Examen físico: dificultad respiratoria, deshidratación y desnutrición. Gasometría: alcalosis metabólica, hipokalemia e hipocloremia graves. Se tratan con cloruro de sodio y potasio. Hay mejoría del desequilibrio electrolítico y del estado ácido-base. No se documentan pérdidas renales o gastrointestinales de cloro y se diagnostica síndrome pseudo-Bartter. Los electrólitos en sudor de ambos pacientes son elevados. Se diagnostica alcalosis metabólica por FQ.
Conclusión: la alcalosis metabólica puede ser la manifestación inicial en niños con SBOR y talla baja con sospecha de FQ; igualmente puede hacer parte de una exacerbación aguda en pacientes conocidos con FQ. Con su reconocimiento y tratamiento oportunos disminuye la morbilidad.
PALABRAS CLAVE
Alcalosis, Alcalosis Metabólica, Cloruro de Sodio, Fibrosis Quística, Hipocloremia, Hipokalemia, Pseudo-Bartter
SUMMARY
Introduction: We describe the cases of two patients with hypochloremic metabolic alkalosis either as the initial presentation of cystic fibrosis (case 1) or as part of a second cystic fibrosis exacerbation (case 2).
Clinical cases: Two patients, 6 and 9 months old, were brought to the hospital because of cough, fever, and dyspnea. The first had a syndrome of recurrent bronchial obstruction, without the diagnosis of CF on admission. Both presented with difficulty for breathing, dehydration, and malnutrition. Arterial blood gases showed metabolic acidosis, hypokalemia, and severe hypochloremia. Treatment with sodium chloride and potassium improved their electrolyte balance and acid-base status. They did not have renal or gastrointestinal losses of chloride. CF and pseudo-Barter's syndrome were diagnosed.
Conclusion: Metabolic alkalosis can be the initial manifestation of CF in infants with recurrent bronchiolitis and short stature suspicious of having CF. It can also be the expression of an acute exacerbation in patients with known CF. Opportune diagnosis and treatment are important to decrease morbidity.
KEY WORDS
Cystic Fibrosis, Hypochloremia, Hypokalemia, Metabolic Alkalosis, Pseudo Bartter, Sodium Chloride
INTRODUCCIÓN
La fibrosis quística (FQ) es la enfermedad hereditaria autosómica recesiva más frecuente en la raza blanca. Su prevalencia varía entre los diferentes grupos étnicos: es más alta en los caucásicos (1:2.000 a 1:3.000 nacidos vivos) que en la población hispana (1:11.500 nacidos vivos), en los afroamericanos (1:15.000 nacidos vivos) y en los asiáticos (1:31.000 nacidos vivos) (1-3). Se desconoce la incidencia en Colombia. Se han identificado más de 1.604 mutaciones para la presentación de la enfermedad (4,5).
La presentación clínica habitual de los pacientes con FQ se caracteriza por enfermedad pulmonar crónica, deficiencia pancreática, desnutrición y concentraciones altas de electrólitos en el sudor (6). Los pacientes se presentan con todos o algunos de los anteriores rasgos y con menor frecuencia con solo uno de ellos, como las alteraciones en los electrólitos sanguíneos. Las alteraciones del cloro son un ejemplo de estas y en particular la alcalosis metabólica hipoclorémica es una de las manifestaciones posibles, aunque es infrecuente como forma de presentación inicial y por ello puede ser un gran reto diagnóstico para el clínico que se enfrenta a este trastorno del medio interno (7-9). A continuación describimos los casos de dos pacientes con FQ, a saber: uno con falla del medro, deshidratación y desequilibrio hidroelectrolítico (alcalosis metabólica hipoclorémica e hipokalémica); el, otro con diagnóstico reciente de FQ, presentó una descompensación grave por un trastorno electrolítico.
Caso 1
Paciente de 6 meses con antecedente de síndrome broncoobstructivo recurrente desde los 2 meses y medio de vida, que había estado hospitalizado en tres ocasiones por exacerbación de los síntomas bronquiales. Hijo único, residente en el municipio de Segovia, departamento de Antioquia, Colombia (clima cálido y húmedo), alimentado con lactancia materna y con fórmula láctea de primer semestre, sin ingesta de medicamento alguno ni historia de consanguinidad entre los padres.
Fue llevado a consulta por un cuadro clínico de 15 días de evolución de tos productiva, fiebre y disnea progresiva. Al examen físico se hallaron: pulso de 140 por minuto, frecuencia respiratoria de 59 por minuto, presión arterial de 97/68 mm Hg, satO2 de 94% (con oxígeno suplementario a 2 L/min), temperatura 36 °C, peso 4.800 g, talla 62 cm. Valoración nutricional según los estándares de la Organización Mundial de la Salud (OMS): Peso/talla: - 3,4 DE (desnutrición aguda grave), mucosas secas, ojos hundidos y sudoración profusa. Presentaba retracciones intercostales y a la auscultación, sibilancias y crépitos en ambos campos pulmonares. Se decidió hospitalizarlo para corregir la deshidratación, iniciar el protocolo de recuperación nutricional recomendado por la OMS y estudiar y tratar su cuadro broncoobstructivo recurrente. La gasimetría del ingreso (día 1) mostró alcalosis metabólica, hipokalemia e hipocloremia profundas (tabla 1); creatinina de 0,3 mg/dL y nitrógeno ureico en sangre 9 mg/dL. Se inició hidratación con solución de dextrosa al 2,5% y cloruro de sodio al 0,45% a razón de 70 mL/kg/día con reposición de potasio IV 3 mEq/kg/día adicional a los requerimientos diarios; además, alimentación con fórmula láctea F-75 a razón de 80 Kcal/kg/día (según el protocolo de la OMS). Persistieron la alcalosis metabólica, la hipocloremia y la hipokalemia. Los niveles de potasio y cloro en orina ocasional fueron normales (tabla 1, día 2), al igual que los niveles séricos de aldosterona y renina, con lo cual se descartaron las pérdidas de electrólitos por vía renal y el síndrome de Bartter. Al cuarto día de tratamiento tuvo mejoría de su estado de hidratación, buena respuesta al tratamiento broncodilatador y corrección de la alcalosis, por lo cual se redujeron los líquidos endovenosos a 30 mL/ kg/día, se dejaron por dos días más y se aumentaron los aportes calóricos de la fórmula F75. Al octavo día persistía la hipocloremia (tabla 1), por lo que se solicitaron niveles de electrólitos en sudor cuyos resultados fueron, en dos exámenes independientes, 71 y 102 mmol/L. En el estudio genético se encontró una mutación en R334W heterocigoto. Se hizo diagnóstico de FQ y se inició inhaloterapia con dornasa alfa, intensificación de la terapia respiratoria y nebulizaciones con solución salina hipertónica al 3%, con notoria mejoría de los síntomas respiratorios. Se adicionaron enzimas pancreáticas a la dieta con lo que hubo rápida ganancia de peso. Mejoraron los niveles plasmáticos de cloro y potasio con corrección de la alcalosis metabólica inicial, por lo cual se dió de alta con tratamiento ambulatorio para su FQ y seguimiento.
Caso 2
Paciente de 9 meses de edad a quien se le hizo el diagnóstico de FQ en el primer mes de vida (electrólitos en sudor: 117 y 115 mmol/L), con afectación pulmonar, gastrointestinal por malabsorción y falla del medro. En tratamiento con dornasa alfa, enzimas pancreáticas y soporte nutricional. No había recibido tratamiento diurético ambulatorio. Hija única, residente en clima templado en la ciudad de Medellín, alimentada con lactancia materna exclusiva hasta los 3 meses, a partir de esa edad se adicionó fórmula de primer semestre. No hay historia de consanguinidad entre los padres.
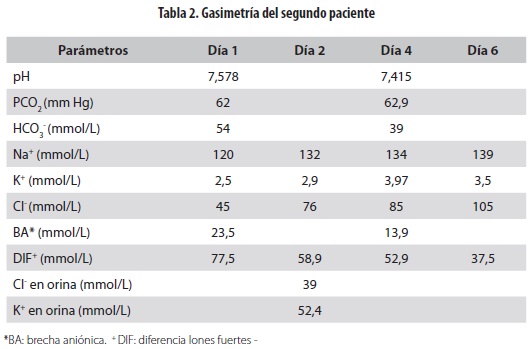
Consultó por cuadro clínico de un día de evolución de dificultad respiratoria progresiva, tos y fiebre cuantificada. Al examen físico se hallaron: frecuencia cardíaca de 150 por minuto, frecuencia respiratoria de 60 por minuto, presión arterial de 85/45 mm Hg, satO2 de 84%, bien perfundida, pero con algún grado de deshidratación y con gran esfuerzo respiratorio, así como movilización de secreciones y sibilancias en ambos campos pulmonares. Se decidió hospitalizar para hidratación venosa, terapia broncodilatadora, control de secreciones y estudio de posible infección intercurrente. En la gasimetría inicial se observó alcalosis metabólica grave, con hiponatremia, hipocloremia e hipokalemia (tabla 2). Su función renal era normal para la edad. Se inició hidratación venosa con solución salina normal al 0,9% a razón de 50 mL/kg/día y reposición de potasio con 30 mmol/L de solución parenteral. Se encontró en la radiografía de tórax una imagen sugestiva de neumonía y se inició tratamiento antibiótico con ampicilina sulbactam. Se descartaron las pérdidas de cloro por vía gastrointestinal (no hubo vómitos ni se usaron sondas gástricas), así como las renales (los niveles de potasio y cloro en orina ocasional estuvieron en los rangos normales). Persistió la hipocloremia en los primeros tres días con mejoría lenta de sus niveles (tabla 2). Se logró mejoría del pH con la reposición progresiva de las pérdidas y al alcanzar una hidratación adecuada. Cumplió 10 días de su esquema antibiótico y se logró controlar las secreciones, por lo cual se dió de alta con el tratamiento ambulatorio habitual.}
DISCUSIÓN
La falla en el medro y los trastornos hidroelectrolíticos de los lactantes se presentan por múltiples causas, pero la deshidratación hipoclorémica con alcalosis metabólica es infrecuente (6,7,10). Se ha descrito principalmente en los casos de vómito recurrente por un síndrome pilórico, vómito persistente de diversa etiología, drenaje del contenido gástrico (por sondas gástricas) con inadecuado reemplazo de las pérdidas, ingesta de álcalis en estados asociados a hipokalemia (hiperaldosteronismo), pérdida excesiva de cloro por la piel en la FQ, pérdida urinaria por diuréticos o por síndrome de Bartter y, menos frecuente aún, diarrea perdedora de cloruros (1,7,11-13).
En la búsqueda de la etiología, las clasificaciones de los pacientes con alcalosis metabólica se han basado precisamente en el comportamiento del cloro y por ello se ha utilizado la brecha aniónica urinaria (BAU), que se determina por la cantidad de cloro eliminado por vía urinaria; también se ha utilizado la medición aislada del cloro en la orina (para el caso de la BAU, si esta positiva, la pérdida de cloro es baja o normal, y si es negativa, la pérdida urinaria es elevada, y para el caso de la medición aislada de cloro urinario, hay pérdida renal de este anión si es mayor de 20 mmol/L) (14,15). Asimismo, se ha utilizado para clasificar la alcalosis la respuesta a la administración de cloro exógeno: cloro-sensible, si el paciente responde a esta administración, y cloro-resistente en caso contrario) (14,15). Por lo general, los pacientes con enfermedades cuya pérdida de cloro tiene etiología renal (por alteración tubular intrínseca o por efecto mineralocorticoide) se caracterizan por BAU negativa y por ser cloro-resistentes. Por el contrario, el resto de las enfermedades (pérdidas extrarrenales como las gastrointestinales o cutáneas o el déficit en la ingesta) se caracterizan por tener BAU positiva y ser cloro-sensibles (16,17).
Los casos que describimos se caracterizaron porque su presentación fue una hipocloremia importante y en consecuencia alcalosis metabólica e hipokalemia. Ambos tenían una pérdida de cloro que se estudió exhaustivamente hasta determinar que no era renal, es decir, fueron casos de BAU positiva y, como se observó en los reportes de los estudios paraclínicos durante su evolución, mejoraron con la administración de cloro mediante solución salina, o sea, que eran cloro-sensibles. Es importante señalar que en estos dos casos no se contó con la posibilidad de determinar el sodio urinario, pero, dado que el valor del cloro urinario era casi normal (28 mmol/L), se asumió que el sodio urinario sería normal, lo que equivaldría a la BAU positiva antes descrita. Ante esta clasificación, las posibilidades para considerar eran la pérdida gastrointestinal, el déficit en la ingesta y la pérdida cutánea. Teniendo en cuenta que no hubo ninguna pérdida gastrointestinal observable pues los pacientes no tenían vómitos incoercibles, ni diarreas de gasto elevado, ni sondas gástricas, la opción restante era la pérdida por la piel. El primer paciente fue un reto porque no se tenía el diagnóstico de FQ y se llegó a él siguiendo los lineamientos del estudio de la alcalosis metabólica. En el segundo paciente existía ya el antecedente de la FQ, yEl
síndrome de postración por calor (12,21). por ello, al descartar las otras enfermedades, la pérdida cutánea fue la causa clara.
Esta forma de presentación del paciente con FQ se denomina pseudo-Bartter (PB) (1,6,10,13,18,19), por su semejanza en cuanto a los parámetros bioquímicos a la profundidad de la alcalosis sin pérdida gastrointestinal demostrada, pero se diferencia del verdadero síndrome de Bartter en que el cloro en la orina es bajo (menos de 20 a 30 mmol/L), la BAU es positiva, no hay poliuria y es cloro-sensible (20). En 1951, Kessler y Anderson describieron una complicación aguda de la FQ causada por la pérdida masiva de electrólitos durante una temporada calurosa y la denominaron El síndrome de postración por calor (12,21).
Sin embargo, se deben considerar otras causas de pseudo-Bartter (PB) porque, como se verá más adelante en los casos asociados a fibrosis quística, las manifestaciones clínicas son escasas, lo cual dificulta el diagnóstico, como ocurrió inicialmente en el caso 1 (tabla 3) (22-26).
Se ha definido la alcalosis metabólica como la presencia de un pH en la sangre de 7,45 o más y el exceso de álcalis en el suero (bicarbonato mayor de 24 mmol/L) en ausencia de insuficiencia respiratoria, por lo que se excluye la compensación metabólica de las alteraciones de las vías respiratorias. Se ha definido la hiponatremia como el sodio en el suero de 135 mmol/L o menos, y la hipocloremia, como el cloruro del suero de 99 mmol/L o menos (6,10).
Esta forma de presentación de la FQ se ha asociado a mutaciones con función parcial, superior al 10%, de la actividad de la proteína transportadora transmembrana de la fibrosis quística (CFTR) en la membrana celular, con lo que podría presentarse suficiencia pancreática con leve compromiso pulmonar (1). Por lo anterior, algunos pacientes se pueden diagnosticar en edades superiores a las habituales, o incluso en la vida adulta, y en algunos casos con pocas manifestaciones pulmonares (1,8,9,21). Cuando el nivel de actividad de la proteína es inferior al 5% se pueden observar manifestaciones más típicas de la enfermedad (1,27).
Como se mencionó, esta forma de presentación es inusual tanto en el momento del diagnóstico como en el seguimiento y la evolución del paciente ya diagnosticado (2,6,13,28). Se puede presentar en ambos sexos y el genotipo implicado con mayor frecuencia es la mutación delta ΔF508 (19,29). Otras mutaciones involucradas son T338I, D110E, F311L y D110H (20,29,30). En una cohorte de niños con FQ y PB en Turquía (6) el diagnóstico se hizo en promedio a los 3 meses (rango 1-8,5 meses) y no se encontró diferencia en el pronóstico según la edad o el sexo, pero identificaron el vómito y la hiporexia como posibles predictores para el diagnóstico temprano de PB en pacientes menores de 4 años. Se ha descrito una incidencia de 12% a 18% de PB en los pacientes con FQ (19,28,31). En un estudio en Qatar (32) describieron las formas de presentación de 45 pacientes con FQ, en un período de 12 años, y hallaron que la alcalosis metabólica con trastornos electrolíticos o sin ellos fue más frecuente de lo que usualmente se cree: 38%. La frecuencia de presentación es igual en los meses de verano y en los de invierno posiblemente por el uso en estos últimos de ropas pesadas y calurosas y por el recalentamiento de las casas, lo que favorece la pérdida de cloro por el sudor (6,33).
El déficit de sodio (Na+) y cloro (Cl-) en el paciente con FQ se debe a la pérdida excesiva de estos electrólitos en el sudor sin suplemento adecuado de sal. Un niño con FQ puede perder diariamente más de 80 mmol/L de sodio, 100 mmol/L de cloro y 40 mmol/L de potasio (11,13,20,21,34). Velde (35) ilustró cómo la sudoración excesiva resultante de la abstinencia de heroína fue la única explicación lógica para la alcalosis metabólica que presentó un niño con FQ en un ambiente no caluroso (35). El cloro también se puede perder en cantidades importantes por la diarrea, en los niños con FQ, como se describió en dos pacientes con íleo meconial e ileostomía (20,36). Estas alteraciones en los electrólitos llevan a disminución del volumen extracelular, estimulando el sistema reninaangiotensina- aldosterona, la hormona antidiurética y el sistema simpático, lo que genera un aldosteronismo secundario y, por lo tanto, aumento de la reabsorción de Na+, Cl- y H2O en el túbulo colector y excreción de K+ e H+, dando lugar a la alcalosis metabólica hipoclorémica hipokalémica. La anorexia y la disminución de la ingesta de líquidos llevan a mayor déficit hídrico y a un aumento secundario en la reabsorción de Na+, Cl-, H2O y HCO3- en el túbulo proximal con disminución de la liberación de Na+ en los segmentos más distales, lo que explica el ahorro de sodio. Además, cuando se presenta hipokalemia el balance intracelular de K+ es negativo, lo que significa entrada de Na+ e H+ a las células para reemplazar este déficit, agravándose aún más la alcalosis metabólica. La hipokalemia mantenida produce una pérdida temporal de la capacidad de concentración renal, con perpetuación del trastorno metabólico (1,5-7,9,11,13,20,27). La hipoalbuminemia también podría contribuir a la alcalosis metabólica porque la albúmina es un ácido débil no volátil; por lo tanto, es probable que la desnutrición crónica ayude a dicho trastorno electrolítico (37,38). En el caso de los pacientes no obtuvimos los niveles de albúmina, que podrían haber influido en el desequilibrio ácido-base.
El PB puede presentarse de forma aguda o crónica. En la primera, el proceso suele ser muy sintomático relacionado con episodios de vómitos y con temperaturas ambientales elevadas, mientras que la segunda, por la clara adaptación, suele ser menos llamativa y sus síntomas bastante inespecíficos. Las pérdidas de cloro y sodio por el sudor en los momentos de exacerbación por episodios importantes de calor pueden llegar a ser hasta de 80-100 mmol/L por día (1).
El PB es muy infrecuente en adolescentes y adultos con FQ. Los afectados más a menudo son los menores de un año alimentados al pecho o con fórmulas bajas en sodio. La deshidratación es usualmente leve y se pueden encontrar anorexia, apatía, irritabilidad, fiebre, deshidratación, pérdida de peso y retardo en el crecimiento. Puede haber antecedentes de episodios similares y de síntomas digestivos o respiratorios y, en las formas más crónicas, a menudo hay retardo del crecimiento (1,10,13,16,19-21).
La displasia broncopulmonar (DBP) puede ser un factor de confusión en el diagnóstico diferencial de los niños con alcalosis metabólica y enfermedad pulmonar crónica, porque estos niños pueden presentar dicho trastorno por recibir de forma crónica diuréticos de asa o tiazídicos, lo que genera pérdida de cloro urinario. Además, los niños con antecedente de prematuridad suelen tener dificultades para una sudación adecuada lo que dificulta en ellos la prueba de sudor para efectuar el diagnóstico. En casos de niños con DBP y alcalosis metabólica en los que se quiere descartar PB y, por ende, FQ, se recomienda la medición del tripsinógeno inmunorreactivo y de la diferencia de potencial nasal (3,38).
El reconocimiento de estos pacientes debe ser temprano porque la alcalosis metabólica disminuye la concentración del calcio ionizado, causando espasmos musculares, tetania y convulsiones; además, puede presentarse hipoventilación por disminución de los impulsos respiratorios, lo que predispone a atelectasias; incluso pueden presentar insuficiencia respiratoria grave (6). En los pacientes con alcalosis metabólica grave el gasto cardíaco disminuye, la resistencia vascular periférica aumenta y las arritmias cardíacas pueden ser refractarias, lo que se suma a trastornos del aprendizaje y el lenguaje (6). Se ha visto que el componente de alcalosis metabólica en adultos con FQ en el momento de la exacerbación respiratoria es importante porque contribuye a la insuficiencia respiratoria hipercápnica (37).
Los pacientes con PB desarrollan una pérdida importante de sodio y de volumen en forma simultánea a la pérdida de cloro y, por ende, al desarrollo de la alcalosis metabólica. En consecuencia, en el tratamiento debe tenerse en cuenta la reposición de cloro con una adecuada cantidad de volumen así como la de potasio (6,20).
Teoría de Stewart, una mirada diferente
La diferencia de iones fuertes (DIF), como su nombre lo indica, es la diferencia matemática entre los cationes fuertes y los aniones fuertes. Un ion fuerte es el que se encuentra completa o casi completamente disociado en la solución (en este caso, los líquidos corporales importantes en el organismo): sodio, potasio, cloro, calcio, magnesio y lactato (39). Algunos autores han considerado que la suma de los cationes de Mg++ y Ca++ se resta del lactato, y el valor resultante es cercano a cero (cuando no hay hiperlactatemia importante), por lo cual proponen una fórmula más abreviada sin incluir estos iones:
DIF = ([Na+] + [K+]) - [Cl-]
El valor normal de la DIF oscila entre 38 y 42 mEq/L. La DIF es una de las tres variables independientes (descritas hace casi 30 años por Peter Stewart, junto con los ácidos débiles totales y la presión parcial de CO2), con efecto directo sobre la disociación del agua corporal. Una alteración en esta variable se relaciona directamente con cambios en la concentración de hidrogeniones y, por lo tanto, en el pH (14,40). La DIF disminuida es causa de acidosis metabólica (porque trae consigo aumento en la liberación de hidrogeniones a partir del agua endógena), y la DIF aumentada lo es de alcalosis metabólica (porque se relaciona con disminución en la concentración de hidrogeniones corporales y aumento de los iones hidroxilos -OH-- a partir del agua). El enfoque del equilibrio ácido-básico (EAB) según Stewart ha ganado popularidad en los últimos años, particularmente en el área del cuidado intensivo, por tener un enfoque basado en la explicación de la etiología del fenómeno, característica que lo hace superior al enfoque tradicional de Hendersson- Hasselbach (14,41,42).
Para el caso de los niños con PB en FQ, el diagnóstico y el enfoque según Stewart parten de la presencia de una DIF alta, debido a la pérdida de cloro por la piel. En los casos clínicos descritos (tablas 1 y 2) se puede identificar los valores de la DIF de ambos al inicio (59 y 77,5 mmol/L). Por su parte, los valores de pCO2 altos se relacionan con la respuesta compensatoria respiratoria de retención de este gas buscando disminuir el pH. Cuando estos niños fueron sometidos al tratamiento de reposición de volumen, sodio y cloro (solución con DIF nula: solución salina normal: 154 mmol/L de Na – 154 mmol/L de Cl = 0 mmol/L), paulatinamente los valores de la DIF fueron disminuyendo (tablas 1 y 2) lo que se relaciona con un aumento progresivo de la concentración de hidrogeniones y con la reducción de la alcalosis metabólica. Esta es una forma más completa de explicar cómo la hidratación temprana de los pacientes con FQ, sumada a la normalización de los niveles de cloro, disminuye el riesgo de alcalosis metabólica grave en el síndrome de PB, mediante el uso de soluciones acidificantes (solución salina normal al 0,9%), por tener una DIF de cero, que facilita la corrección de la DIF aumentada corporal.
TRATAMIENTO
El tratamiento de los pacientes con PB se basa en eliminar el agente causal (tabla 3), controlar la enfermedad e hidratar. Con respecto a la hidratación, el déficit de sodio y la disminución del volumen extracelular generalmente ocurren al mismo tiempo que la alcalosis y el agotamiento de cloruro, por lo que en el paciente con PB se deben corregir tanto el volumen como el déficit de cloruro de sodio y si es necesario el déficit de potasio (6,20). La solución salina normal (gracias a la diferencia nula de iones fuertes) es el líquido de elección para corregir este trastorno hidroelectrolítico, pero en algunas situaciones es necesario ajustar las concentraciones de electrólitos. En los pacientes con deshidratación por diarrea en los que no sea posible la vía venosa, puede estar indicado el uso de sales de rehidratación oral (SRO) (por vía oral o por sonda nasogástrica), para lo cual se han utilizado dos tipos diferentes de soluciones: la primera está constituida por 6 g/L de NaCl + 1,5 g/L de KCl + 111 mmol/L de glucosa, con lo que se administra cloruro de sodio adicional, y no se utiliza ninguna base como el citrato de sodio que contienen las SRO habituales, ya que debido al estado de alcalosis metabólica del paciente, se favorecería la perpetuación de la alcalosis. La segunda solución de SRO descrita se basa en arroz y contiene 6 g/L de NaCl + 1,5 g/L de KCl + 50 g/L de arroz cocido en polvo; estas fórmulas son más fáciles de aplicar y más fisiológicas que las SRO estándar, para su uso en niños con FQ que requieran hidratación oral (20,43). En el tratamiento ambulatorio de los pacientes alimentados al pecho o con leche de fórmula con un contenido de cloruro de sodio menor que el de la leche de vaca, suplementar con 2 a 4 mmol/kg/ día de cloruro de sodio (13), pero se podría presentar PB a pesar del suplemento con sal (6). No solo el suplemento de potasio y sodio hace parte del tratamiento, sino que se debe corregir de forma temprana la hipocalcemia por el riesgo de falla ventilatoria. En los pacientes con enfermedad crónica, la mejoría del estado nutricional favorece la disminución de los requerimientos de electrólitos (44).
CONCLUSIÓN
Sumado a la importancia como herramienta diagnóstica en el enfoque inicial de niños con síndrome bronco-obstructivo persistente (SBOR) o falla del medro, el diagnóstico temprano de la alcalosis metabólica en pacientes con FQ disminuye su morbilidad. Gracias a la teoría de Stewart, se puede explicar la fisiopatología de la alcalosis metabólica en los pacientes con FQ a partir de la presencia de la hipocloremia por la pérdida en mayor proporción de este anión y el impacto directo en la DIF. El análisis del cloro, junto con el cálculo de la DIF, con frecuencia subestimados, debe ser el pilar en el enfoque del niño con un trastorno metabólico del equilibrio ácido base. Para el caso de la alcalosis metabólica en los niños con PB, la estrategia terapéutica para considerar debe ser el uso de soluciones para hidratar con DIF bajas o nulas.
REFERENCIAS BIBLIOGRÁFICAS
1. Aranzamendi RJ, Breitman F, Asciutto C, Delgado N, Castaños C. [Dehydration and metabolic alkalosis: an unusual presentation of cystic fibrosis in an infant]. Arch Argent Pediatr. 2008 Oct;106(5):443–6. [ Links ]
2. Teeratakulpisarn J, Kosuwon P, Srinakarin J, Panthongviriyakul C, Sutra S. Cystic fibrosis in three northeast Thai infants is CF really a rare disease in the Thai population? J Med Assoc Thai. 2006 Oct;89(10):1756–61. [ Links ]
3. Holmgren NL, Faro A, Gondor MI, Orenstein DM. Cystic fibrosis in three children with bronchopulmonary dysplasia. Pediatr Pulmonol. 2001 Jun;31(6):474–7. [ Links ]
4. Human Genoma Variation Society. Cystic fibrosis mutation database [Internet]. 2010 [cited 2011 Nov 10]. p. 5. Available from: www.genet.sickkids.on.ca/cftr/app [ Links ]
5. Lumpaopong A, Thirakhupt P, Srisuwan K, Chulamokha Y. Rare F311L CFTR gene mutation in a child presented with recurrent electrolyte abnormalities and metabolic alkalosis: case report. J Med Assoc Thai. 2009 May;92(5):694–8. [ Links ]
6. Yalçin E, Kiper N, Dogru D, Ozçelik U, Aslan AT. Clinical features and treatment approaches in cystic fibrosis with pseudo-Bartter syndrome. Ann Trop Paediatr. 2005 Jun;25(2):119–24. [ Links ]
7. Campañá Cobas NG, Razón Behar R, Duran Álvarez S, Mañalich Coma R, Valdés Mesa M, Hernández Hernández JS. Fibrosis quística que simula un síndrome de Bartter. Rev Cubana Pediatr. 2008;80(4) [ Links ].
8. Augusto J-F, Sayegh J, Malinge M-C, Illouz F, Subra J-F, Ducluzeau P-H. Severe episodes of extra cellular dehydration: an atypical adult presentation of cystic fibrosis. Clin Nephrol. 2008 Apr;69(4):302–5. [ Links ]
9. Bates CM, Baum M, Quigley R. Cystic fibrosis presenting with hypokalemia and metabolic alkalosis in a previously healthy adolescent. J Am Soc Nephrol. 1997 Feb;8(2):352–5. [ Links ]
10. Ballestero Y, Hernandez MI, Rojo P, Manzanares J, Nebreda V, Carbajosa H, et al. Hyponatremic dehydration as a presentation of cystic fibrosis. Pediatr Emerg Care. 2006 Nov;22(11):725–7. [ Links ]
11. Param T, Aldunate D. [Metabolic alkalosis in cystic fibrosis of the pancreas]. Rev Chil Pediatr. 1988;59(5):322–5. [ Links ]
12. Mathew PM, Hamdan JA, Nazer H. Cystic fibrosis presenting with recurrent vomiting and metabolic alkalosis. Eur J Pediatr. 1991 Feb;150(4):264–6. [ Links ]
13. Gottlieb RP. Metabolic alkalosis in cystic fibrosis. J Pediatr. 1971 Dec;79(6):930–6. [ Links ]
14. Flórez I, Betancur L. Equilibrio ácido Base en UCIP. In: Martínez Parada Y, Lince Varela R, Quevedo Vélez A, Duque Martelo JI, editors. El niño en estado crítico. Bogotá D.C.: Editorial Médica Panamericana; 2011. p. 235–58. [ Links ]
15. Carrillo-Lopez H, Chavez A, Jarillo A, Olivar V. Acidbase disorders. In: Fuhrman B, Zimmerman J, editors. Pediatric critical care. 3rd ed. Philadelphia; 2006. p. 958–89. [ Links ]
16. Mesa Medina O, González JL, García Nieto V, Romero Ramírez S, Marrero Pérez C. [Infant metabolic alkalosis of dietetic origin]. An Pediatr (Barc). 2009 Apr;70(4):370–3. [ Links ]
17. Mota F, Velásquez-Jones L. Trastornos clínicos del agua y los electrolitos. Mexico: McGraw-Hill Interamericana; 2004. p. 100–15. [ Links ]
18. Baird JS, Walker P, Urban A, Berdella M. Metabolic alkalosis and cystic fibrosis. Chest. 2002 Aug;122(2):755–6. [ Links ]
19. Fustik S, Pop-Jordanova N, Slaveska N, Koceva S, Efremov G. Metabolic alkalosis with hypoelectrolytemia in infants with cystic fibrosis. Pediatr Int. 2002 Jun;44(3):289–92. [ Links ]
20. Yalçin SS, Akça T, Genç O, Celik M, Dogru D, Ozçelik U. Modified oral rehydration therapy in a case with cystic fibrosis. Turk J Pediatr. 2007;49(1):102–4. [ Links ]
21. Eigenmann P, Délèze G, Kuchler H. Chronic metabolic alkalosis in an infant with cystic fibrosis. Eur J Pediatr. 1991 Jul;150(9):669–70. [ Links ]
22. Landau D, Kher KK. Gentamicin-induced Bartter-like syndrome. Pediatr Nephrol. 1997 Dec;11(6):737–40. [ Links ]
23. Gunnerson KJ. Clinical review: the meaning of acidbase abnormalities in the intensive care unit part I - epidemiology. Crit Care. 2005 Oct 5;9(5):508–16. [ Links ]
24. González-Rivero MA, Bonet Alcaina M, Vall Combelles O, Cesena Santiago Y, Martínez-Roig A, García Algar O. [Pseudo-Bartter syndrome as a complication of an undiagnosed intestinal malrotation]. An Esp Pediatr. 1998 Nov;49(5):523–4. [ Links ]
25. Vanhaesebrouck S, Van Laere D, Fryns J-P, Theyskens C. Pseudo-Bartter syndrome due to Hirschsprung disease in a neonate with an extra ring chromosome 8. Am J Med Genet A. 2007 Oct 15;143A(20):2469–72. [ Links ]
26. Higuchi R, Sugimoto T, Hiramatsu C, Kumagai T, Okutani T, Yagi S, et al. Neonatal pseudo-Bartter syndrome due to maternal eating disorder. J Perinatol. 2008 Sep;28(9):646–8. [ Links ]
27. Davé S, Honney S, Raymond J, Flume PA. An unusual presentation of cystic fibrosis in an adult. Am J Kidney Dis. 2005 Mar;45(3):e41–4. [ Links ]
28. Fustik S, Pop-Jordanova N, Slaveska N, Koceva S, Efremov G. Metabolic alkalosis with hypoelectrolytemia in infants with cystic fibrosis. Pediatr Int. 2002 Jun;44(3):289–92. [ Links ]
29. Salvatore D, Tomaiuolo R, Abate R, Vanacore B, Manieri S, Mirauda MP, et al. Cystic fibrosis presenting as metabolic alkalosis in a boy with the rare D579G mutation. J Cyst Fibros. 2004 Jun;3(2):135–6. [ Links ]
30. Weller F, Wiebicke W, Tümmler B. [Turkish infant with hypoelectrolytemia and metabolic alkalosis as the sole manifestations of a mild form of cystic fibrosis (mutation D110H)]. Klin Padiatr. 2000;212(1):41–3. [ Links ]
31. Sojo A, Rodriguez-Soriano J, Vitoria JC, Vazquez C, Ariceta G, Villate A. Chloride deficiency as a presentation or complication of cystic fibrosis. Eur J Pediatr. 1994 Nov;153(11):825–8. [ Links ]
32. Abdul Wahab A, Dawod ST, al Thani G. Cystic fibrosis in a large kindred family in Qatar. Ann Trop Paediatr. 2000 Sep;20(3):203–7. [ Links ]
33. Di Sant Agnese PA. Salt depletion in cold weather in infants with cystic fibrosis of the pancreas. J Am Med Assoc. 1960 Apr 30;172:2014–21. [ Links ]
34. Beckerman RC. Metabolic alkalosis in infants with cystic fibrosis. Pediatrics. 1979 Sep;64(3):389. [ Links ]
35. vande Velde S, Verloo P, Van Biervliet S, Robberecht E. Heroin withdrawal leads to metabolic alkalosis in an infant with cystic fibrosis. Eur J Pediatr. 2007 Jan;166(1):75–6. [ Links ]
36. Hochman HI, Feins NR, Rubin R, Gould J. Chloride losing diarrhoea and metabolic alkalosis in an infant with cystic fibrosis. Arch Dis Child. 1976 May;51(5):390–1. [ Links ]
37. Holland AE, Wilson JW, Kotsimbos TC, Naughton MT. Metabolic alkalosis contributes to acute hypercapnic respiratory failure in adult cystic fibrosis. Chest. 2003 Aug;124(2):490–3. [ Links ]
38. Omron EM. Metabolic alkalosis and cystic fibrosis. Chest. 2004 Mar;125(3):1169; author reply 1169–70. [ Links ]
39. Kellum JA. Determinants of blood pH in health and disease. Crit Care. 2000 Jan;4(1):6–14. [ Links ]
40. Figge J, Rossing TH, Fencl V. The role of serum proteins in acid-base equilibria. J Lab Clin Med. 1991 Jun;117(6):453–67. [ Links ]
41. Moviat M, van Haren F, van der Hoeven H. Conventional or physicochemical approach in intensive care unit patients with metabolic acidosis. Crit Care. 2003 Jun;7(3):R41–5. [ Links ]
42. Dubin A, Menises MM, Masevicius FD, Moseinco MC, Kutscherauer DO, Ventrice E, et al. Comparison of three different methods of evaluation of metabolic acid-base disorders. Crit Care Med. 2007 May;35(5):1264–70. [ Links ]
43. Yalçin SS, Akça T, Genç O, Celik M, Dogru D, Ozçelik U. Modified oral rehydration therapy in a case with cystic fibrosis. Turk J Pediatr. 2007;49(1):102–4. [ Links ]
44. Kennedy JD, Dinwiddie R, Daman-Willems C, Dillon MJ, Matthew DJ. Pseudo-Bartter's syndrome in cystic fibrosis. Arch Dis Child. 1990 Jul;65(7):786–7. [ Links ]