Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.26 no.4 Medellín Oct./Dec. 2013
INVESTIGACIÓN ORIGINAL
Inmunoglobulina E anti-Plasmodium en niños de Urabá (Colombia) según la presencia de malaria
Anti-Plasmodium immunoglobulin E in children of Urabá (Colombia) according to the presence of malaria
Jaime Carmona-Fonseca1
1 Grupo Salud y Comunidad-César Uribe Piedrahíta, Universidad de Antioquia Carrera 51D número 62-29, piso 3. Teléfono (574) 219 60 25. Medellín, Colombia. jaimecarmonaf@hotmail.com
Recibido: junio 23 de 2012
Aceptado: octubre 19 de 2012
RESUMEN
Problema: no existen informes en Colombia sobre los niveles de IgE anti-Plasmodium en niños sin malaria y apenas hay uno en niños con malaria no complicada.
Objetivo: medir la IgE anti-Plasmodium en niños sin malaria o con ella en función del sexo, el estado nutricional y la presencia de helmintos intestinales, y las relaciones con variables hematológicas.
Metodología: la IgE anti-Plasmodium se midió en 335 niños sin malaria y en 125 con malaria no complicada (116 P. vivax, 9 P. falciparum). La medición se hizo con la técnica de ELISA, con antígeno de extracto crudo de P. falciparum, cepa FCB-2. Se usó el conjugado anti-anti-IgE de Sigma A3525. La IgE se midió y expresó según la densidad óptica (absorbancia).
Resultados: la IgE anti-Plasmodium fue de 0,808 ± 0,508 en niños sin malaria (punto de corte usado para definir nivel alto: 0,584) y 1,968 ± 1,237 en niños con malaria (p = 0,000000). La IgE anti-Plasmodium no mostró diferencia significativa según la especie plasmodial, pero sí según el sexo y el estado nutricional de los niños. En niños sin malaria, el nivel de IgE anti-Plasmodium fue mayor en aquellos con presencia de áscaris, tricocéfalos y uncinarias, pero la diferencia fue significativa únicamente para áscaris. El nivel de IgE anti-Plasmodium mostró correlación lineal positiva y significativa con la cantidad de huevos de tricocéfalo y de áscaris por gramo de materia fecal.
Conclusiones: los niños sin malaria o con ella de Urabá tienen elevados niveles de IgE anti-Plasmodium, que son más altos en mujeres y en los afectados por paludismo.
PALABRAS CLAVE
Colombia, Desnutrición, Inmunoglobulina E, Malaria, Plasmodium, Sexo.
SUMMARY
Problem: We are not aware of studies in Colombia on levels of specific IgE in children without malaria and only one is available in children with uncomplicated malaria.
Objective: To measure anti-Plasmodium IgE in children with or without malaria according to sex, nutritional status, and the presence of intestinal helminthes, and the relations with hematologic variables.
Methodology: anti-Plasmodium IgE was measured in 335 children without malaria and in 125 with uncomplicated malaria (P. vivax: 116; P. falciparum: 9). Measurement was done with the ELISA technique, with a crude antigen extract of P. falciparum FCB-2 strain. We used Sigma's conjugated anti-anti-IgE A3525. IgE was measured and expressed as optical density (absorbance).
Results: Anti-Plasmodium IgE in children without malaria was 0.808 ± 0.508 (cutoff point used to define high level: 0.584) and 1.968 ± 1.237 in children with malaria (p = 0.000000). Anti-Plasmodium IgE levels showed no significant difference according to plasmodial species but there was significant difference by sex and nutritional status. In children without malaria, the level of anti-Plasmodium IgE was higher in those with the presence of roundworm, whipworm and hookworm, but the difference was significant only for roundworms. The level of anti-Plasmodium IgE showed significant positive linear correlation with the number of eggs of Ascaris and whipworm per gram of stool.
Conclusions: In Urabá, children with or without malaria have elevated levels of anti-Plasmodium IgE, that are higher in women and in those affected by malaria.
KEY WORDS
Colombia, Immunoglobulin E, Malaria, Malnutrition, Plasmodium, Sex.
INTRODUCCIÓN
La inmunoglobulina E (IgE) es un anticuerpo presente únicamente en mamíferos y también la única que se encuentra en la piel; su concentración sérica en sujetos ''normales'' es de 100 a 1.000 ng/mL (es la más escasa de las inmunoglobulinas humanas: 0,004% del total de ellas). No cruza la placenta. Posee actividad hemaglutinante comparable a la de la IgG. Los agregados de IgE no fijan el complemento por la vía clásica, pero sí por la vía alternativa (1).
La IgE está implicada en los procesos de alergia, en especial aquellos asociados con el tipo I o inmediato de hipersensibilidad, así como con la respuesta inmune contra diversos agentes patógenos, especialmente parásitos (2). Las funciones más importantes de la IgE suceden en función de sus extremos: por el segmento Fab se une al antígeno o alérgeno, desencadenando la liberación de diversas sustancias, como leucotrienos e histamina, que facilitan el paso de líquidos al compartimento extravascular y la contracción del músculo liso. Por el extremo Fc se une a un receptor en la membrana de las células cebadas (mastocitos) y basófilos conocido como ''receptor de alta afinidad para el Fc de la IgE'' (FceRI). También puede unirse a eosinófilos y plaquetas por medio de otros receptores expresados en la superficie de estas células (''receptores de baja afinidad'' FceRII) (1). El reconocimiento de un antígeno por la IgE desencadena complejas reacciones inmunitarias, como la degranulación de mastocitos (liberan sustancias vasoactivas como histamina) y la intervención de los eosinófilos en la respuesta inflamatoria.
Su nivel en la sangre está muy elevado en humanos alérgicos o con parasitosis por helmintos como Necator americanus (3), Ascaris lumbricoides (3), Trichuris trichiura (4), Schistosoma mansoni (5), Trichinella spiralis (6), Fasciola hepática (7), y por protozoos como Plasmodium falciparum (8), Plasmodium vivax (9) y Toxoplasma gondi (10).
La producción de IgE es controlada por células T, por medio de la interleucina 4 (IL-4) y la IL-13, con intervención de varios factores de transcripción. Los linfocitos Th2 son la fuente más importante de estas citocinas. Aunque hay células de la inmunidad innata que producen IL-4 e IL-13, los linfocitos son necesarios para la producción de IgE, pues mediante señales por contacto intercelular inducen el cambio de isotipo en los linfocitos B hacia la cadena pesada épsilon (11).
La concentración elevada de IgE en la sangre de pacientes con malaria es el resultado de una producción aumentada de células ayudadoras Th2 sobre las células ayudadoras Th1. Una variedad de factores ambientales y genéticos afecta el control de esa relación. La importancia de los últimos está demostrada por los niveles de IgE que ocurren en gemelos monocigóticos y dicigóticos: esos niveles son indistinguibles en pares de gemelos monocigóticos, pero son muy diferentes en los dicigóticos (12).
La influencia genética también se demuestra con estudios de etnias simpátricas (genéticamente aisladas sin estar geográficamente aisladas). En una de las etnias africanas estudiadas, hay mayores niveles que en otra de IgE total y anti-Plasmodium, IgG total y subclases G1-3; los niveles elevados de IgE total se asociaron a la presencia de alguna infección; cuando los niveles de IgG4 se elevaron, el número de clones de Plasmodium se redujo en las personas infectadas; hay correlación positiva entre los niveles elevados de IgG total e IgG3 y la esplenomegalia en las personas de esa misma etnia, pero no en la otra. Todos esos datos sugieren que la magnitud de la respuesta de anticuerpos contra Plasmodium falciparum puede no ser tan importante como se ha creído (13).
Los basófilos humanos son potentes productores de IL-4 (14) y la IgE induce dicha producción, lo cual indica su efecto sobre el balance Th1-Th2 en la malaria (15). Los basófilos humanos pueden contribuir a la polarización de la respuesta Th2 en hospederos con malaria por la vía de producción de IL-4 inducida por IgE (14).
La asociación de anticuerpos anti-Plasmodium IgE e IgG y el número de células productoras de IL-4 e interferón gamma (IFN-γ) comparada entre tribus simpátricas puede ayudar a explicar la menor susceptibilidad a malaria vista en la etnia con niveles elevados de inmunoglobulinas (16).
El suero de adultos que residen en áreas holoendémicas de malaria contiene anticuerpos de tipo IgE específica anti-Plasmodium (12,17) y hasta 5% del total de IgE es anti-Plasmodium (17). La presencia en la sangre de IgE anti-Plasmodium no implica que todos los individuos tengan simultáneamente IgG anti-Plasmodium. El suero de controles que residen fuera de áreas endémicas carece de esa IgE (17). Además, los residentes en áreas endémicas de paludismo poseen también, con alta frecuencia, títulos altos de IgE total (18).
Las infecciones por P. falciparum inducen niveles elevados de inmunoglobulinas totales y específicas anti-Plasmodium pertenecientes a diferentes isotipos. Además, quienes viven en áreas maláricas desarrollan anticuerpos específicos anti-Plasmodium que están en mayores concentraciones en los pacientes con las formas graves de la enfermedad (19).
En respuesta a antígenos maláricos específicos, se han visto muy pocos cambios en las células productoras de IL-4. Los datos han sugerido que hay un ajuste en el balance entre células Th1 y Th2 en personas que sufren su primera infección por P. falciparum, balance asociado con niveles elevados de IgE plasmática anti-P. falciparum (18). La IL-4 está involucrada en la regulación de la IgE y la IgG4. Al evaluar el efecto de los polimorfismos de IL-4-590 T/C sobre el nivel de IgE específica anti-Plasmodium se halló que el alelo T se asoció con niveles elevados de IgE total y específica anti-Plasmodium. Dijeron los autores que el efecto de las variantes IL-4- 590 sobre los niveles de anticuerpos puede variar entre diferentes etnias y esto puede afectar la distribución de las subclases de inmunoglobulinas (20).
En relación con el papel de la IL-4 y los anticuerpos, cabe anotar que los valores medios de IgM de neonatos con placentas positivas o madres con parasitemia periférica fueron mayores que los relacionados con negatividad parasitaria. El número promedio de células maternas productoras de IFN-γ fue mayor (p = 0,0001) que el de las muestras pareadas del cordón umbilical. El número promedio de células productoras de IL-4 de neonatos hijos de mujeres con Plasmodium (p<0,05) o de placentas parasitadas (p<0,025) fue mayor que el de aquellos negativos para parásitos. Los neonatos hijos de mujeres con Plasmodium o con placentas positivas para Plasmodium montaron predominantemente una respuesta Th2 (21).
Los niveles de IgE total y anti-Plasmodium son muy diferentes en función de estar sano o de tener malaria no complicada o complicada (grave). Esos niveles son significativamente más altos en los casos con enfermedad grave y eso es lo contrario de lo que sucede con la IgG, lo cual sugiere que la IgE juega un papel en incrementar la gravedad de la malaria, mientras que la IgG la reduce (12,22).
Sobre la IgE anti-Plasmodium apenas conocemos un estudio en Colombia, medida junto con la IgE total en niños con malaria no complicada (9). Ese estudio comparó los niveles de la IgE y de dos citocinas (IL-10, TNF-α) en función del nivel de transmisión de dos zonas (Urabá frente a Bajo Cauca). El estudio no incluyó niños sin la enfermedad.
El presente informe se refiere a la medición de la IgE específica en niños sin malaria o con ella, expresada en función del sexo, el estado nutricional y la presencia de helmintos intestinales, y las relaciones con algunas variables hematológicas.
MATERIALES Y MÉTODOS
Sitio de estudio, clase de diseño y diseño muestral
El estudio se hizo en Turbo (8°05'42'' N, 76°44'123''O), en la zona de Urabá del departamento de Antioquia. Las principales características ecoepidemiológicas y sociales de la población y la región de Urabá han sido descritas (23-25). El Índice Parasitario Anual (IPA) por mil expuestos en Turbo entre 1998 y 2009 ha variado entre 10,7 (2009) y 72,8 (2002), con promedio de 41,4 y mediana de 33,5 por mil (datos de la Dirección Seccional de Salud de Antioquia, DSSA).
Los datos aquí presentados son parte de un macroproyecto sobre las relaciones entre desnutrición, parásitos intestinales, malaria y otras infecciones. La parte que ahora se presenta corresponde a los resultados de la medición de inmunoglobulina E específica anti-Plasmodium en el momento de ingreso al estudio (niños sin malaria) y en el momento de presentar un episodio de paludismo (niños con malaria) y son, entonces, mediciones de la prevalencia de IgE anti- Plasmodium.
Los niños se captaron en la casa familiar o la escuela. Se trata, entonces, de población ''aparentemente sana'', que no hacía parte de ningún programa de intervención, y durante el tiempo del estudio no hubo ninguna intervención especial, de ninguna índole.
En el macroproyecto, se calculó una muestra de 1.600 niños, con estos parámetros estadísticos y epidemiológicos: población de menores de 15 años (0,5 a 14) de 2.809 sujetos (26); proporción de prevalencia de 50%; intervalo de confianza de 95%; error de muestreo de 5%. Se llegó, así, a un tamaño de muestra de 338 niños por grupo, que se elevó a 400 para compensar las pérdidas durante el largo seguimiento de 12 meses.
Criterios de inclusión y exclusión; evaluaciones de laboratorio
Los criterios de inclusión fueron: a) ser residente habitual de El Tres; b) tener menos de 15 años de edad; c) aceptar voluntariamente la participación en el estudio y firmar el consentimiento informado.
Los criterios de exclusión fueron: a) ausentarse de El Tres; b) exigir contraprestación de cualquier índole para continuar en el estudio; c) retirar el consentimiento informado.
El hemograma completo se analizó con equipo automático Celltac Auto Nihon Khodan® MEK 8118 (Nihon Khodan Co, Tokio, Japan). La IgE anti-Plasmodium se midió con la técnica de ELISA, usando como antígeno un extracto crudo de P. falciparum, cepa FCB-2, preparado en nuestro laboratorio, con una concentración de 5 mg/mL. Este antígeno detecta tanto P. falciparum como P. vivax. Se siguió el proceso de preparación del antígeno plasmodial descrito por otros autores (27,28). Se usó el conjugado anti-anti-IgE marcado con fosfatasa alcalina (Sigma A3525), en dilución 1/500 y como sustrato, P-nitrofenil fosfato. Se emplearon platos de 96 pozos (Nunc-Immuno™ plates-Maxisorp, fondo redondo). Para obtener el punto de corte se tuvieron en cuenta las absorbancias de los controles negativos con los que se estandarizó la técnica, con cuyo promedio más 2 desviaciones estándar se obtuvo el valor. También se evaluó el coeficiente de variación en la replicabilidad de los resultados de cada muestra (20%). El punto de corte para IgE fue 0,584. La IgE específica se midió y expresó según la densidad óptica (absorbancia). Profesionales del Grupo, con amplia experiencia en esta clase de trabajo (Adriana Correa B., Eliana Arango F., Olga María Agudelo G.) hicieron las mediciones de laboratorio.
Análisis estadístico
Se usó el programa SPSS 10 para calcular medidas estadísticas de resumen y para comparar los niveles de IgE anti-Plasmodium entre grupos. Las decisiones sobre significación estadística se tomaron con probabilidad (p) menor de 5%.
Aspectos éticos
El proyecto fue avalado por el Comité de Ética del Centro de Investigaciones Médicas de la Facultad de Medicina, de la Universidad de Antioquia. Cada acudiente responsable del paciente firmó el consentimiento informado antes de ingresar al estudio.
RESULTADOS
a) Niños sin malaria
La edad varió de 0 a 14 años. La edad promedio fue 6,68 años. La distribución por edad fue estadísticamente similar para ambos sexos, zonas de residencia (urbana, rural) y vereda-barrio. El peso promedio fue 20,88 kg; la talla/estatura promedio fue 110,4 cm.
En el ingreso al estudio, 24,8% (396/1.600) de los niños presentaron desnutrición crónica, según el indicador talla para la edad (T-E), hecha la evaluación con -2 desviaciones estándar respecto a la mediana. La desnutrición siempre afectó más a los hombres que a las mujeres (aproximadamente 28,5% frente a 21%) (pX2)= 0,003).
El examen coprológico se pudo hacer a 1.545 niños (96,6% de 1.600) y resultó con parásitos en 87% (1.344/1.545): protozoos 45,0% (695/1.545), helmintos 69,4% (1.072/1.545), ambos 45% (695/1.545). Hubo protozoos, pero no helmintos en 17,6% (272/1.545) y hubo helmintos, pero no protozoos en 24,3% (375/1.545). No hubo ningún parásito en 13% (201/1.545). Hubo protozoos patógenos en 47% y helmintos patógenos en 67%. Se hallaron uncinarias en 29%, áscaris en 45% y tricocéfalos en 45%.
b) Niños con malaria
El diagnóstico de infección plasmodial se hizo con gota gruesa (microscopía de luz). La edad promedio de los 125 niños con malaria fue de 6,7 años, con variación de 1 a 14; 50,5% fueron hombres y 49,5% fueron mujeres; 67% residía en zona rural (fuera de la cabecera municipal). Los días de evolución del ataque malárico actual fueron 4,5 ± 3,2 (IC95%: 3,94 a 5,06). El número de episodios palúdicos en el último año varió entre uno y cinco (p>0,05). Los meses transcurridos desde el último episodio (desde el previo hasta el actual) fueron de 2,3 (p>0,05). La hemoglobina, el día del diagnóstico palúdico, fue 10,3 ± 1,6 g/dL.
En general, en estos niños con paludismo se obtuvieron igual clase y frecuencia de parásitos intestinales, pues eran los mismos niños y simplemente la malaria les dio luego de entrar al estudio. El examen coprológico se pudo hacer a 60 de los 125 niños (48%) y resultó con parásitos en 83,3% (50/60): protozoos 59%, helmintos 68%, ambos 47%. Hubo protozoos, pero no helmintos, en 17% y helmintos, pero no protozoos, en 39%.
c) Inmunoglobulina E anti- Plasmodium
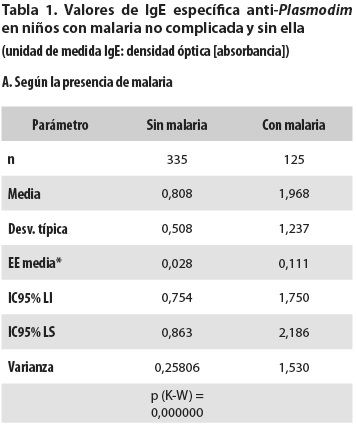
Los valores de la IgE específica anti-Plasmodium en niños sin malaria se consignan en la tabla 1-A, donde también aparecen los valores de los 125 niños que presentaron malaria (116 P. vivax, 9 P. falciparum) y son los niveles en el momento del diagnóstico de paludismo, pero antes del tratamiento de este. En niños sin malaria, los valores (promedio ± desviación estándar) de IgE específica fueron 0,808 ± 0,508 (medidas de absorbancia). Ese promedio supera ampliamente el punto de corte usado para definir el nivel alto (0,584) y 60,3% de los niños tuvieron alta la inmunoglobulina. En niños con malaria, en el momento del diagnóstico y antes de recibir el tratamiento específico antipalúdico, los valores fueron 1,968 ± 1,237 y más de 96% de los niños presentaron nivel por encima de 0,584. Hay diferencia significativa entre esos promedios de niños sin malaria y con ella (p (K-W)= 0,000000). Los niveles de IgE específica no mostraron diferencia significativa según la especie plasmodial, pero los afectados por P. falciparum apenas fueron nueve.
En niños sin malaria, la IgE anti-Plasmodium no presentó correlación con la edad, la hemoglobina, las plaquetas ni los leucocitos (siempre p (rho)>0,165).
En niños sin malaria, la IgE anti-Plasmodium tuvo niveles mayores en las mujeres (p (K-W)= 0,011): 0,861 ± 0,495 frente a 0,750 ± 0,517 y en aquellos sin desnutrición crónica (p (K-W)= 0,003): no desnutridos 0,851 ± 0,524 frente a desnutridos 0,644 ± 0,398 y, por supuesto, hay diferencias en función de los estratos sexo-desnutrición crónica. El título es mayor en mujeres no desnutridas (0,874), seguidas de hombres no desnutridos (0,822), mujeres desnutridas (0,794) y hombres desnutridos (0,542). La influencia es del estado nutricional y no del sexo. Hay diferencia significativa entre los valores (p (K-W)= 0,001) (tabla 1-B).
La tabla 2 presenta los valores de IgE según la presencia de helmintos (A. lumbricoides, T. trichiura, N. americanus) y malaria. Para cada uno de los tres helmintos, los menores valores aparecieron cuando no hubo ni helminto ni malaria, mientras que los mayores se presentaron cuando concurrieron helminto y malaria. La diferencia en los promedios fue estadísticamente significativa solo en el caso de A. lumbricoides (p = 0,000000). En cada grupo con helminto y plasmodio, los mayores niveles sucedieron en áscaris (2,117 ± 1,694), seguido de uncinaria (1,003 ± 0,802) y, por último, tricocéfalos (0,945 ± 0,756), con diferencia significativa (F=7,85; gl= 2; p = 0,000826). Parece mayor la influencia de la malaria que la del helminto en el nivel de IgE específica antiplasmodial: en el caso de áscaris, el nivel fue 1,474 ± 1,155 en presencia del plasmodio y 1,066 ± 0,780 en presencia del helminto; en el caso de uncinarias, el nivel fue 0,912 ± 0,697 en presencia del plasmodio y 0,846 ± 0,607 en presencia del helminto; en el caso de tricocéfalos el nivel fue similar en las dos situaciones: 0,870 ± 0,674 frente a 0,867 ± 0,621.
El nivel de IgE anti-Plasmodium mostró correlación lineal positiva y significativa con la cantidad de huevos de tricocéfalo y de áscaris por gramo de materia fecal, pero esto no sucedió con las uncinarias: tricocéfalos rho = 0,120; n = 320; p = 0,032; áscaris rho = 0,142; n = 328; p = 0,010; uncinarias rho = 0,039; n = 320; p = 0,482. Los huevos/gramo de tricocéfalos y uncinarias se correlacionaron de forma positiva y significativa: rho = 0,310; n = 1.545; p = 0,000). No hubo correlación significativa entre la cantidad de huevos/gramo de áscaris y tricocéfalos ni áscaris y uncinarias.
El análisis de regresión lineal múltiple entre IgE anti- Plasmodium (variable dependiente) y edad y huevos/gramo de áscaris, tricocéfalos y uncinarias (variables independientes) mostró coeficientes de regresión bajos y no significativos para todas las variables excepto para tricocéfalos: b = 0,196; p = 0,000.
DISCUSIÓN
Los niños estudiados en esta investigación corresponden a una muestra de base poblacional, es decir, además de que el tamaño de la muestra se definió con criterios estadísticos y epidemiológicos, los niños se captaron directamente en sus casas y escuelas, nunca en instituciones donde estuvieran recluidos por cualquier motivo de salud-enfermedad ni de otra índole que los convirtiese en ''poblacional especial''. No sobra repetir que se trata, en consecuencia, de población general y aparentemente sana, que no hacía parte de ningún programa de intervención ni durante el tiempo del estudio sucedió ninguna intervención especial, de ninguna índole.
La cantidad de niños a quienes se les evaluó la IgE es elevada (sin malaria: 335 del total de 1.600 de la muestra; con malaria: 60 de 125). En general, las pruebas estadísticas tienen tamaños de grupo suficientes para desempeñarse adecuadamente.
Los hallazgos presentes corroboran informes sobre la existencia de altos niveles de IgE anti-Plasmodium en pacientes residentes en zonas palúdicas (12,17), así como en aquellos con infección plasmodial o malaria (9,12,19,22,29). Hay pocos datos colombianos sobre incremento de la IgE anti-Plasmodium en pacientes con malaria por P. vivax (9). En el presente estudio, entre los pacientes con malaria, 93% la tuvieron por P. vivax y en ellos la IgE específica se halló significativamente elevada, tal como ya se había informado antes en sujetos de la misma zona (9), igualmente sin diferencia entre los niveles de IgE específica según la especie plasmodial.
Sobre los niveles séricos de IgE anti-Plasmodium, debe recordarse que en 480 niños y adultos habitantes de Tailandia, 73% (350/480) mostraron niveles altos de IgE total (160-998 ng/mL) y en 21% (74/350) de aquellos positivos la IgE fue específica contra P. falciparum (78- 353 ng/mL), pero los niveles de IgE total no se correlacionaron con los de IgE específica (r = 0,083) (29), igual a como ha sucedido en niños colombianos (9). Debe recordarse que la IgG4 puede bloquear los receptores Fc de la IgE en pacientes con infecciones por helmintos (30) y que los niños de Urabá están fuertemente parasitados por helmintos intestinales (31).
En cuanto a la correlación entre la IgE total y la específica y al papel de las infecciones en su aumento, se sostiene en general que tales procesos infecciosos las incrementan, pero un informe de 2000 afirma que en humanos no hay elevación de la IgE total en infecciones por protozoarios (giardiasis, amebiasis, tricomoniasis, toxoplasmosis, enfermedad de Chagas, malaria, leishmaniosis tegumentaria). El grupo control fue pareado por sexo, edad y raza y no tenía historia personal o familiar de atopia (asma, rinitis y dermatitis atópica), no había desnutrición, pertenecía al mismo grupo socioeconómico local brasileño y tuvo tres exámenes coproparasitológicos negativos (32).
La elevación de la IgE anti-Plasmodium parece depender de la edad (29) y se dice que se requiere la exposición prolongada o repetida a Plasmodium para inducir la respuesta de IgE específica. En nuestros niños sin malaria no hubo diferencia significativa en los títulos de IgE específica según la edad. En niños africanos (6 meses a 15 años) de una única etnia (Mossi), residentes en iguales condiciones epidemiológicas en la misma zona urbana de Ougadougo, en Burkina Faso, se halló que la concentración de los anticuerpos IgG contra P. falciparum se elevó en los niños muy pequeños y luego permaneció estable en los niños mayores. Los anticuerpos IgE aumentaron con la edad y llegaron a ser más elevados después de los 4 años (14).
Se conoce el efecto protector de las infecciones multiclonales asintomáticas con respecto a nuevos episodios de malaria. Los niveles altos de IgG o de IgE total no se han asociado con este riesgo menor, pero los niveles elevados de IgE específica sí se han asociado con riesgo reducido de malaria aguda en todas las edades, independientemente del nivel de IgE total (15).
Los niveles de IgE total y anti-Plasmodium son muy diferentes en función de estar sano o de tener malaria no complicada o complicada (grave). Esos niveles son significativamente más altos en los casos con enfermedad grave y eso es lo contrario de lo que sucede con la IgG, lo cual sugiere que la IgE juega un papel en incrementar la gravedad de la malaria, mientras que la IgG la reduce (12,22). Entre 74 personas con IgE específica, 27% (20/74) fueron individuos naturalmente expuestos a malaria, pero sin enfermedad y tuvieron títulos altos de IgE total y específica anti-P. falciparum, con promedios de 419 ng/mL y 146 ng/mL, respectivamente (29).
En los niños mayores, aquellos con enfermedad grave tienen títulos significativamente más altos de IgE que los otros cuya malaria no es grave. Esos datos apoyan la idea de que la IgE anti-Plasmodium, aparte de su posible protección, también contribuye a la gravedad de la enfermedad (19), aunque no es claro el papel patogénico (14).
En niños africanos (30 con malaria grave, 30 no grave, 30 sanos) hubo aumento significativo de la IgE total en los maláricos y el nivel fue mayor en aquellos con cuadro grave (660 kUI/L), seguidos de los que tenían malaria no complicada (340 kUI/L) y los controles (65 kUI/L). Hubo correlación negativa entre IgE y hemoglobina y entre IgE y plaquetas. Esos resultados, dijeron, concuerdan con los referidos en la literatura y confirman el uso de la IgE total como indicador de la gravedad de malaria por P. falciparum (33).
Otro estudio halló niveles significativamente menores de IgG1, IgG2 e IgG3 anti-P. falciparum en pacientes con malaria complicada que en aquellos con la forma no complicada (IgG1: p< 0,0001; IgG2: p< 0,0001; IgG3: p< 0,0001), mientras que los de IgE anti-Plasmodium fueron levemente menores pero con diferencia no significativa (34).
En otro informe, los niveles de IgE total se confirmaron aumentados con la infección plasmodial y variaban según el nivel de transmisión, pero no estaban asociados directamente con el fenotipo de la enfermedad (no complicada, grave pero no cerebral, cerebral, grupo control). Los cuatro grupos mostraron IgE funcional específica de Plasmodium capaz de inducir degranulación de los mastocitos in vitro en presencia de antígenos del parásito. Los niveles plasmáticos de IgE se correlacionaron con los de IL-10 en pacientes no complicados de Gabón. En pacientes de India, los niveles plasmáticos de IFN-γ, TNF-α e IL-10 se correlacionaron de forma significativa con los de IgE en los cuatro grupos. Los autores concluyeron que los niveles circulantes de IgE total no parecen correlacionarse con protección ni patología, ni con el patrón de citocinas antiinflamatorias durante la malaria. Al contrario, la IgE anti-P. falciparum parece responder al control parasitario (8).
Se plantea que la IgE contribuye a la producción local de TNF en los capilares y vénulas poscapilares en donde P. falciparum o sus productos se acumulan en la malaria grave (12).
En Colombia, en niños con malaria, las concentraciones de IgE total y anti-Plasmodium y de TNF-α fueron significativamente mayores en los residentes en Bajo Cauca, área de mayor transmisión, comparados con los de Urabá, zona de menor transmisión: en los primeros, los niveles de IgE total fueron dos veces los hallados en los segundos (9). Esos niños tienen muy elevada presencia de protozoos y helmintos parásitos intestinales, alrededor de 80% (31), y están afectados fuertemente por la desnutrición y las inadecuadas condiciones de vida (25,35). Los valores de IgE total y específica anti-Plasmodium fueron estos (medida en unidades/mL según el estuche comercial usado) (9): IgE total 2.264 ± 3.058 en Urabá y 4.526 ± 4.151 en Bajo Cauca (p (Mann-Whitney)= 0,0000); IgE específica 0,180 ± 0,21 en Urabá y 0,218 ± 0,17 (medida en unidades/mL según el estuche comercial usado): en Bajo Cauca (p (Mann-Whitney)= 0,0202). Los niveles más altos de IgE total se observaron en quienes tuvieron desnutrición crónica, similar a otros informes (36); estos autores sugieren que la desnutrición y los helmintos potencian la síntesis policlonal de IgE.
En niños con malaria, se ha informado correlación negativa de la IgE total con la hemoglobina y las plaquetas (33), pero en aquellos sin malaria no hallamos tal asociación entre la IgE específica y la hemoglobina ni con las plaquetas.
Se concluye que los niños de Urabá sin malaria o con ella tienen elevados niveles de IgE específica anti- Plasmodium, que son más altos en las mujeres y en los afectados por el paludismo, que, además, tienen muy elevada frecuencia de parásitos intestinales y desnutrición. Los datos indican que es mayor la influencia de la malaria que la del helminto en el nivel de IgE específica antiplasmodial.
Declaración de conflictos
Ninguno para manifestar.
Financiación
Colciencias (proyecto código 1115-04-16388, contrato 339-2004); Dirección Seccional de Salud de Antioquia DSSA (convenio administrativo CI-021-2004); Estrategia de Sostenibilidad Codi-Universidad de Antioquia 2011-2012; Universidad de Antioquia.
REFERENCIAS BIBLIOGRÁFICAS
1. Devlin T. Bioquímica. 4th ed. Barcelona: Reverté; 2004. [ Links ]
2. Gould HJ, Sutton BJ, Beavil AJ, Beavil RL, McCloskey N, Coker HA, et al. The biology of IGE and the basis of allergic disease. Annu Rev Immunol. 2003 Jan;21:579–628. [ Links ]
3. Geiger SM, Alexander NDE, Fujiwara RT, Brooker S, Cundill B, Diemert DJ, et al. Necator americanus and helminth co-infections: further down-modulation of hookworm-specific type 1 immune responses. PLoS Negl Trop Dis. 2011 Sep;5(9):e1280. [ Links ]
4. Alcântara-Neves NM, Badaró SJ, dos Santos MCA, Pontes-de-Carvalho L, Barreto ML. The presence of serum anti-Ascaris lumbricoides IgE antibodies and of Trichuris trichiura infection are risk factors for wheezing and/or atopy in preschool-aged Brazilian children. Respir Res. 2010 Jan;11:114. [ Links ]
5. Fitzsimmons CM, McBeath R, Joseph S, Jones FM, Walter K, Hoffmann KF, et al. Factors affecting human IgE and IgG responses to allergen-like Schistosoma mansoni antigens: Molecular structure and patterns of in vivo exposure. Int Arch Allergy Immunol. 2007 Jan;142(1):40–50. [ Links ]
6 Watanabe N, Bruschi F, Korenaga M. IgE: a question of protective immunity in Trichinella spiralis infection. Trends Parasitol. 2005 Apr;21(4):175–8. [ Links ]
7. Massoud AMA, El-Kholy NMB, El-Shennawy FA, Farag RE. Study of some immune aspects in patients with fascioliasis before and after Chommiphora molmol (Mirazid) treatment. J Egypt Soc Parasitol. 2004 Apr;34(1):315–32. [ Links ]
8. Duarte J, Deshpande P, Guiyedi V, Mécheri S, Fesel C, Cazenave P-A, et al. Total and functional parasite specific IgE responses in Plasmodium falciparuminfected patients exhibiting different clinical status. Malar J. 2007 Jan;6:1. [ Links ]
9. Blair Trujillo S, Alvarez Sánchez G, Villa Restrepo A, Carmona Fonseca J, Ríos Osorio L. [Nutritional status and immunoglobulin and cytokine concentrations in children with malaria]. An Pediatr (Barc). 2003 May;58(5):418–24. [ Links ]
10. Vouldoukis I, Mazier D, Moynet D, Thiolat D, Malvy D, Mossalayi MD. IgE mediates killing of intracellular Toxoplasma gondii by human macrophages through CD23-dependent, interleukin-10 sensitive pathway. PLoS One. 2011 Jan;6(4):e18289. [ Links ]
11. Caraballo L, Zakzuk J. Consideraciones sobre la evolución de la respuesta inmunitaria Th2 y sus posibles relaciones con parasitosis y alergia. Biomédica. 2012;32(1):145–57. [ Links ]
12. Perlmann P, Perlmann H, ElGhazali G, Blomberg MT. IgE and tumor necrosis factor in malaria infection. Immunol Lett. 1999 Jan;65(1-2):29–33. [ Links ]
13. Vafa M, Israelsson E, Maiga B, Dolo A, Doumbo OK, Troye-Blomberg M. Relationship between immunoglobulin isotype response to Plasmodium falciparum blood stage antigens and parasitological indexes as well as splenomegaly in sympatric ethnic groups living in Mali. Acta Trop. 2009 Jan;109(1):12–6. [ Links ]
14. Nyakeriga MA, Troye-Blomberg M, Bereczky S, Perlmann H, Perlmann P, ElGhazali G. Immunoglobulin E (IgE) containing complexes induce IL-4 production in human basophils: effect on Th1-Th2 balance in malaria. Acta Trop. 2003 Apr;86(1):55–62. [ Links ]
15. Bereczky S, Montgomery SM, Troye-Blomberg M, Rooth I, Shaw M-A, Färnert A. Elevated anti-malarial IgE in asymptomatic individuals is associated with reduced risk for subsequent clinical malaria. Int J Parasitol. 2004 Jul;34(8):935–42. [ Links ]
16. Farouk SE, Dolo A, Bereczky S, Kouriba B, Maiga B, Färnert A, et al. Different antibody- and cytokinemediated responses to Plasmodium falciparum parasite in two sympatric ethnic tribes living in Mali. Microbes Infect. 2005 Jan;7(1):110–7. [ Links ]
17. Desowitz RS. Plasmodium-specific immunoglobulin E in sera from an area of holoendemic malaria. Trans R Soc Trop Med Hyg. 1989;83(4):478–9. [ Links ]
18. Elghazali G, Perlmann H, Rutta AS, Perlmann P, Troye-Blomberg M. Elevated plasma levels of IgE in Plasmodium falciparum-primed individuals reflect an increased ratio of IL-4 to interferon-gamma (IFNgamma)- producing cells. Clin Exp Immunol. 1997 Jul;109(1):84–9. [ Links ]
19. Calissano C, Modiano D, Sirima BS, Konate A, Sanou I, Sawadogo A, et al. IgE antibodies to Plasmodium falciparum and severity of malaria in children of one ethnic group living in Burkina Faso. Am J Trop Med Hyg. 2003 Jul;69(1):31–5. [ Links ]
20. Vafa M, Maiga B, Israelsson E, Dolo A, Doumbo OK, Troye-Blomberg M. Impact of the IL-4 -590 C/T transition on the levels of Plasmodium falciparum specific IgE, IgG, IgG subclasses and total IgE in two sympatric ethnic groups living in Mali. Microbes Infect. 2009;11(8-9):779–84. [ Links ]
21. Achidi EA, Anchang JK, Minang JT, Ahmadou MJ, Troye-Blomberg M. Studies on Plasmodium falciparum isotypic antibodies and numbers of IL-4 and IFNgamma secreting cells in paired maternal cord blood from South West Cameroon. Int J Infect Dis. 2005 May;9(3):159–69. [ Links ]
22. Perlmann P, Perlmann H, Looareesuwan S, Krudsood S, Kano S, Matsumoto Y, et al. Contrasting functions of IgG and IgE antimalarial antibodies in uncomplicated and severe Plasmodium falciparum malaria. Am J Trop Med Hyg. 2000 Mar;62(3):373–7. [ Links ]
23. Carmona Fonseca J. La malaria en Colombia, Antioquia y las zonas de Urabá y Bajo Cauca: panorama para interpretar la falla terapéutica antimalárica. Parte 1. Iatreia. 2003;17(4):299–218. [ Links ]
24. Carmona Fonseca J. La malaria en Colombia, Antioquia y las zonas de Urabá y Bajo Cauca: panorama para interpretar la falla terapéutica antimalárica. Parte 2. Iatreia. 2004;17(1):34–53. [ Links ]
25. Carmona Fonseca J, Uscátegui Peñuela RM, Correa Botero AM. Condiciones de vida en zonas palúdicas de Antioquia (Colombia), 2005. Invest Educ Enferm. 2010;28(2):240–9. [ Links ]
26. Gobernación de Antioquia. Atlas veredal. 2nd ed. Medellín: Gobernación de Antioquia; 2006. p. 253. [ Links ]
27. Voller A, Huldt G, Thors C, Engvall E. New serological test for malaria antibodies. Br Med J. 1975 Mar 22;1(5959):659–61. [ Links ]
28. Biswas S, Saxena Q, Roy A, Kabilan L. Naturally occurring Plasmodium specific IgA Abstract in humans from malaria endemic areas. J Biosci. 1995;20:453–60. [ Links ]
29. Khusmith S, Panitchakorn J, Krudsood S, Wilairatana P, Looareesuwan S. IgE elevation and anti-Plasmodium falciparum IgE antibodies: association of high level with malaria resistance. Southeast Asian. J Trop Med Public Health. 2001 Dec;32(4):696–701. [ Links ]
30. Hussain R, Ottesen EA. IgE responses in human filariasis. IV. Parallel antigen recognition by IgE and IgG4 subclass antibodies. J Immunol. 1986 Mar 1;136(5):1859–63. [ Links ]
31. Carmona Fonseca J, Uscátegui Peñuela RM, Correa Botero AM. Parasitosis intestinal en niños de zonas palúdicas de Antioquia (Colombia). Iatreia. 2009;22(1):27–46. [ Links ]
32. Geller M. Documentaçäo brasileira sobre a ausência de elevaçäo da IgE sérica total em infecçöes por protozoários / Brazilian report about the absence of total serum IgE elevation in protozoan infections. J Bras Med. 2000;78(5):106–8. [ Links ]
33. Seka-Seka J, Brouh Y, Yapo-Crézoit AC, Atseye NH. The role of serum immunoglobulin E in the pathogenesis of Plasmodium falciparum malaria in Ivorian children. Scand J Immunol. 2004 Feb;59(2):228–30. [ Links ]
34. Tangteerawatana P, Montgomery SM, Perlmann H, Looareesuwan S, Troye-Blomberg M, Khusmith S. Differential regulation of IgG subclasses and IgE antimalarial antibody responses in complicated and uncomplicated Plasmodium falciparum malaria. Parasite Immunol. 2007 Sep;29(9):475–83. [ Links ]
35. Carmona Fonseca J. Alimentación y estado nutricional de los niños en zonas palúdicas de Antioquia (Colombia). Food and nutritional status among children of endemic malaria zones of Antioquia (Colombia). MedUNAB. 2011;14(2):94. [ Links ]
36. Hagel I, Lynch NR, Di Prisco MC, Sanchez J, Pérez M. Nutritional status and the IgE response against Ascaris lumbricoides in children from a tropical slum. Trans R Soc Trop Med Hyg. 1995;89(5):562–5. [ Links ]