Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.27 no.2 Medellín Apr./June 2014
INVESTIGACIÓN ORIGINAL
La estimulación de TLR, receptores tipo NOD y dectina-1 en neutrófilos humanos induce la producción de citocinas proinflamatorias
Stimulation of TLRs, Nod-like receptors and Dectin-1 in neutrophils induces the production of proinflammatory cytokines
Jahnnyer Anilio Martínez Moreno1; Juan Carlos Hernández López2; Silvio Urcuqui-Inchima3
1 Joven investigador Colciencias/Universidad de Antioquia, Grupo Inmunovirología, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
2 Profesor Instructor. Investigador, Infettare, Facultad de Medicina, Universidad Cooperativa de Colombia, Medellín.
3 Profesor Asociado, Grupo Inmunovirología, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. silviourcuqui@gmail.com
Recibido: abril 11 de 2013
Aceptado: agosto 21 de 2013
RESUMEN
Objetivo: evaluar la expresión y la función de receptores de reconocimiento de patrones como los de tipo Toll y los de tipo NOD, RIG-I/MDA5, la dectina-1 y moléculas adaptadoras, en neutrófilos humanos.
Métodos: a partir de sangre periférica de individuos sanos se purificaron y cultivaron neutrófilos en el medio RMPI-1640, en presencia o ausencia de los agonistas específicos de los receptores de interés. La expresión de los receptores de reconocimiento de patrones se determinó por RT-PCR y la secreción de citocinas proinflamatorias, por ELISA.
Resultados: los neutrófilos expresan un amplio espectro de receptores de reconocimiento de patrones y de moléculas adaptadoras. La estimulación de TLR4, TLR5, TLR7/8 induce la secreción de IL-1β e IL-6; la activación de la dectina-1 induce una alta producción de TNF-α, pero bajos niveles de IL-1β e IL-6.
Conclusión: los neutrófilos expresan un amplio número de receptores de reconocimiento de patrones y su activación lleva a la expresión de diferentes citocinas proinflamatorias.
PALABRAS CLAVE
Citocinas, Inflamación, Neutrófilos, Proteínas Adaptadoras de Señalización NOD, Receptores de Reconocimiento de Patrones, Receptores Toll-Like
SUMMARY
Objective: To evaluate the expression and function of pattern recognition receptors such as Toll-like receptors, RIG-I/MDA5, NOD-like receptors, Dectin-1 and adaptor proteins, in human neutrophils. Methods: Neutrophils from peripheral blood of healthy individuals were purified and cultured in RPMI-1640, in the presence or absence of specific agonists of the receptor of interest. The expression of pattern recognition receptors was determined by RT-PCR and the secretion of proinflammatory cytokines, by ELISA.
Results: We observed that neutrophils express diverse patterns recognition receptors and adaptor molecules. Stimulation of TLR4, TLR5 and TLR7/8 induces the production of IL-1β and IL-6, and activation of Dectin-1 leads to secretion of high levels of TNF-α, but low levels of IL-1β and IL-6.
Conclusion: Neutrophils express a large number of pattern recognition receptors and their activation leads to the expression of proinflammatory cytokines.
KEY WORDS
C-type Lectin Receptors, Neutrophils, NOD-Like Receptors, Pattern Recognition Receptors, Pro-Inflammatory Cytokines; RIG-I-Like Receptors, Toll-Like Receptors
INTRODUCCIÓN
Las células del sistema inmune innato, como las dendríticas, las NK, los monocitos, los macrófagos y los polimorfonucleares (PMN), entre otras, constituyen la primera línea de defensa efectiva contra agentes patógenos y otros tipos de compuestos xenobióticos (1). Los PMN son células fagocíticas granulares que reciben ese nombre debido a su núcleo multilobulado y citoplasma con abundantes gránulos (2). Constituyen la población celular del sistema inmune más abundante en la sangre periférica del ser humano adulto (3). Los neutrófilos hacen parte de los PMN o granulocitos y se caracterizan por su vida media relativamente corta (4), tanto in vivo como in vitro (5). Se ha descrito que después de pasar de la médula ósea a la sangre periférica, su vida media es de alrededor 8 a 12 horas (2,6), lo que constituye una de las principales dificultades para estudiarlos.
La respuesta del hospedero a las lesiones, la inflamación o las enfermedades infecciosas es muy compleja, pero se sabe que los neutrófilos son los primeros en migrar a esos sitios (7) y participan activamente en la eliminación de los agentes patógenos. Para ello, reconocen los patrones moleculares asociados a patógenos o a daño (PAMP o DAMP, por las siglas en inglés de pathogen-associated molecular patterns y damageassociated molecular patterns, respectivamente), mediante los receptores de reconocimiento de patrones (PRR), lo que activa su respuesta efectora. Los receptores tipo Toll (TLR) constituyen el prototipo de los PRR y son los mejor caracterizados hasta la fecha; en humanos se han descrito 10 TLR funcionales, que estructuralmente se caracterizan por la presencia de un dominio rico en leucinas en la región amino terminal, responsable de reconocer los PAMP. En la región intracelular presentan el dominio TIR (Toll/IL-1 Receptor), responsable de reclutar proteínas adaptadoras e iniciar la vía de señalización, que lleva finalmente a la expresión de citocinas proinflamatorias (8).
Aunque los neutrófilos constituyen una célula prototipo de la respuesta innata y los PRR son los receptores implicados en el reconocimiento de componentes de patógenos y en activar células de la respuesta innata, existen pocos estudios orientados a caracterizar y entender el papel de los PRR en la activación de los neutrófilos. Además, la mayoría de los estudios en neutrófilos se han centrado básicamente en comprender la función de los TLR, pero existen pocos estudios con los otros PRR. Se ha descrito que los neutrófilos expresan todos los TLR, excepto TLR3 (3). Sin embargo, TLR2 y TLR4 fueron los primeros TLR descritos y su funcionalidad se conoce mejor (9). Los neutrófilos y macrófagos pueden reconocer bacterias grampositivas y sus PAMP, así como otros agentes patógenos, mediante el TLR2, pero formando un heterodímero con TLR1 o TLR6 (10). La funcionalidad de TLR4 en neutrófilos no es muy clara; algunos estudios indican que el estímulo con lipopolisacárido (LPS) aumenta su activación, pero otros indican lo contrario (9). TLR2 y TLR4 también están implicados en la regulación de la expresión y función de receptores de quimiocinas (11) y en la secreción de citocinas en respuesta a la infección por Paracoccidioides brasiliensis (12). TLR5 es estimulado por la flagelina, principal proteína estructural del flagelo bacteriano; se ha descrito que en la infección pulmonar por Legionella pneumophila, TLR5 facilita el reclutamiento temprano de neutrófilos (13). Aunque se ha informado la expresión endógena de TLR5 en neutrófilos humanos (14), no está claro si su activación lleva o no a la producción de citocinas proinflamatorias. Por el contrario, la estimulación de PMN con R848, un activador de TLR7/TLR8, lleva a la producción de IL-8 (3), y el tratamiento con CL097, agonista de TLR7/8, induce la producción de especies reactivas de oxígeno (ROS) (15). También se ha descrito que los PMN inducen la biosíntesis de diferentes tipos de lípidos implicados en la inflamación, en respuesta a la activación de TLR8, pero no de TLR7 (16); ello indica que TLR8 es funcional en neutrófilos.
A pesar de la importancia de los neutrófilos en la respuesta inflamatoria o la defensa del organismo, las otras familias de PRR han sido poco estudiadas en ellos hasta los últimos años. Los receptores tipo ARN helicasas inducibles por ácido retinoico (RLR) mejor estudiados son RIG-I y el gen 5 de diferenciación asociado al melanoma (MDA5); estos receptores reconocen el ARN viral presente en el citoplasma (17,18). Recientemente se describió que los neutrófilos expresan diversos receptores que reconocen el ARN, como RIG-I, MDA5 y TLR8, excepto TLR3 y TLR7 (19). Además, se ha descrito que los neutrófilos son activados por la vía del TLR8, pero no por la del TLR7 (20). Estos receptores se encuentran en el citoplasma, pero RIG-I y MDA5 se localizan además en vesículas secretoras de los neutrófilos. Los autores describen que RIG-I y su ligando, 3p-ARN, a pesar de que se co-localizan en la superficie celular, no son capaces de activar los neutrófilos (19). Esos resultados sugieren que la función de los receptores implicados en el reconocimiento del ARN en los neutrófilos no está muy clara, aunque se podría proponer la hipótesis de que posiblemente reconocen el ARN viral y juegan un papel muy importante en la respuesta antiviral. También se ha demostrado que los neutrófilos expresan receptores tipo NOD (dominio de oligomerización de nucleótidos) y componentes del inflamasoma NLRP3. NOD1 reconoce básicamente peptidoglicanos como el ácido γ-D-glutamil-meso diaminopimélico (iE-DAP), presente en bacterias gramnegativas, y NOD2 reconoce el muramildipéptido (MDP), común en bacterias grampositivas y gramnegativas (21,22). Ekman y Cardell demostraron que los neutrófilos expresan NOD2 y el inflamasoma NLRP3, pero no NOD1 (23). La activación de NOD2 con su respectivo ligando induce la producción de IL-8, regulación negativa de CD62L y regulación positiva de la expresión de CD11b. Teniendo en cuenta que aún existe controversia sobre la expresión de los PRR, el presente estudio tuvo como objetivo evaluar la expresión y función de diferentes PRR en neutrófilos primarios humanos. En total se evaluaron por reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) 17 genes, incluyendo TLR, miembros de los NLR (receptores tipo NOD), RLR (receptores tipo RIG-I), CLR (receptores tipo lectina C) y genes cuyos productos actúan como proteínas adaptadoras de los PRR. De los 17 genes evaluados se detectó el ARNm de 16. También se evaluó la funcionalidad de 12 PRR en neutrófilos estimulados con sus respectivos ligandos con base en la secreción de citocinas proinflamatorias, como IL-1β, IL-6 y TNFα. El conjunto de resultados obtenidos sugiere que los neutrófilos presentan un amplio rango de reconocimiento de PAMP y muy posiblemente juegan un papel muy importante en la respuesta antiviral y antibacteriana.
MATERIALES Y MÉTODOS
El Comité de Bioética de la Sede de Investigación Universitaria, de la Universidad de Antioquia, aprobó el presente estudio y todos los participantes firmaron el consentimiento informado.
Purificación y cultivo de neutrófilos
De cada individuo se extrajeron 6 mL de sangre periférica por punción venosa, en tubo con anticoagulante ACD (ácido cítrico, citrato y dextrosa), se les adicionaron 6 mL de dextrán (SIGMA, St. Louis, MO) al 6% en NaCl al 0,9% y se incubó la mezcla por 45 minutos a 4 °C para sedimentar los eritrocitos. El sobrenadante se diluyó en tampón fosfato salino (PBS) 1X y se centrifugó a 515 g por 6 minutos a 4 °C. Los leucocitos se separaron por gradiente de Ficoll 1077 (SIGMA, St. Louis, MO) el cual se centrifugó a 726 g durante 30 minutos a 4 °C. Finalmente se resuspendieron las células en medio RPMI-1640, enriquecido con el 10% de suero fetal bovino (SFB). Se sembraron 7.500.000 neutrófilos/pozo en platos de 6 pozos, y se cultivaron por 3 horas a 37 °C y con 5% de CO2 en presencia de LPS o sin este; por último, se hizo la extracción del ARN total.
Estimulación de TLR y NLR
Se cultivaron 350.000 neutrófilos/pozo en platos de 96 pozos, con fondo plano, en presencia de agonistas específicos de los PRR de interés o sin ellos. Ocho horas después del estímulo los sobrenadantes se recolectaron, se dividieron en alícuotas y se conservaron a -20 °C, hasta el momento de evaluar la producción de citocinas proinflamatorias.
Extracción del ARN total de los neutrófilos y RT-PCR
Después de 3 horas de cultivo se hizo la extracción del ARN total de los neutrófilos estimulados o no con LPS, utilizando el estuche RNesay Mini Kit (Qiagen). La pureza y cantidad del ARN se determinaron por espectrofotometría usando el NanoDrop®-1000 (Technologies, Inc.), con base en la absorbancia A260/A280. El ARN obtenido se usó para sintetizar una copia de ADN (cADN) usando el estuche RevertAid™ H Minus First Strand cDNA Synthesis Kit (Thermo Scientific), mediante una RT-PCR, en un termociclador PTC-100™ (MJ Research, Inc). Se amplificaron los diferentes TLR (TLR1-TLR10), los RLR (RIG-I/MDA5) y los NLR (NOD1, NOD2) usando cebadores específicos (tabla 1), bajo las siguiente condiciones: un paso inicial de 10 minutos a 95 °C y 40 ciclos, así: desnaturalización a 95 °C por 15 segundos, la temperatura de alineamiento depende del PRR de interés (tabla 1) por 25 segundos, y una extensión a 72 °C por 25 segundos. Los amplicones se pusieron a migrar en un gel de agarosa al 2% y se visualizaron en Fotodocumentador Gel Doc 2000 (Bio-Rad, Hercules, CA).
Cuantificación de citocinas
Para evaluar la secreción de IL-6, IL-1β y TNF-α en los sobrenadantes de los cultivos de neutrófilos estimulados o no con agonistas de los PRR de interés, se hizo una ELISA sándwich directa (BD OptEIA, BD, Biosciences, US.), siguiendo las instrucciones del fabricante. Para la construcción de curvas estándar y gráficos se utilizó el programa GraphPad Prism 5.
RESULTADOS
Los neutrófilos expresan TLR, MD2 y CD14
La metodología estandarizada para la extracción y purificación de neutrófilos en tubos de vacío con anticoagulante ACD (BD Biosciences) permitió obtener neutrófilos con una pureza superior al 94% y una viabilidad del 93% al 97%, las cuales se mantuvieron después de 8 horas de cultivo. La expresión y funcionalidad de los diferentes PRR de interés se llevó a cabo con muestras de tres individuos.
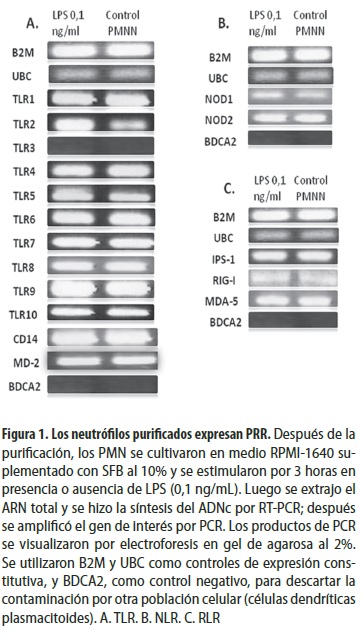
El ARNm de los 10 TLR que se expresan en humanos y de los genes de diferenciación mieloide 2 (MD2) y CD14 se determinó por RT-PCR, en neutrófilos purificados y estimulados o no con 0,1 ng/mL de LPS por 3 horas. Los resultados muestran que los neutrófilos expresan, en el ARNm, todos los TLR, excepto TLR3; igualmente MD-2 y CD14 (figura 1A). El producto de los genes MD2 y CD14 está involucrado en el reconocimiento del LPS. Nuestros resultados muestran que el estímulo con LPS no altera el patrón de transcripción de la mayoría de los TLR, MD2 o CD14, excepto TLR2 y TLR5 (figura 1A). La expresión de BDCA2 (por la sigla en inglés de blood dendritic cell antigen 2) se usó como control interno para validar la pureza de las células, ya que este gen corresponde a un marcador específico de células dendríticas plasmacitoides. Como se observa en la figura 1, no se detectó ARNm de ese gen, lo cual indica la alta pureza de los neutrófilos en los que se hizo la evaluación. Además, la expresión de TLR2 y TLR4 se determinó por citometría de flujo, usando los anticuerpos anti-TLR2 PE y anti-TLR4 PE (datos no mostrados).
Los neutrófilos expresan RLR y la molécula adaptadora IPS-1
En neutrófilos purificados y cultivados en presencia de LPS o sin este también se determinó la tasa transcripcional (ARNm) de dos miembros de la familia RLR, RIG-I y MDA5, y del gen que codifica para la proteína adaptadora IPS-1. Como se observa en la figura 1C, los neutrófilos también expresaron esos tres genes, pero no se observó ninguna diferencia en el nivel de expresión entre los neutrófilos estimulados o no con LPS.
Los neutrófilos expresan NLR
Se determinó por RT-PCR la expresión (ARNm) de NOD1, NOD2 en neutrófilos purificados y cultivados por 3 horas. Los resultados muestran que los neutrófilos expresaron ambos miembros de los NLR (figura 1B), pero no se observaron cambios en el patrón de expresión cuando los neutrófilos fueron estimulados con LPS. Estos resultados muestran que el nivel de expresión de NOD2 fue mayor que el de NOD1.
La activación de los TLR induce la producción de IL-1β e IL-6, en neutrófilos primarios
El conjunto de resultados sugiere que los neutrófilos expresan un amplio número de PRR, pero el nivel de expresión no varió entre neutrófilos estimulados o no con LPS. Con base en esos resultados, el siguiente paso fue determinar la funcionalidad de los TLR. Para ello, los neutrófilos se cultivaron por 8 horas en presencia o ausencia de agonistas de los diferentes TLR y luego se evaluó en los sobrenadantes por ELISA la secreción de las citocinas proinflamatorias, IL-1β e IL-6 (figura 2).
Los resultados muestran que la estimulación con los ligandos para TLR2/1 (Pam3CSK4), TLR4 (LPS), TLR5 (flagelina) y TLR7 y TLR8 (R848 y CL097) induce un incremento en la secreción de IL-1β (figura 2A). Pero la mayor secreción se observó a través de TLR7 y TLR7/8 (~350 y 250 pg/mL con los agonistas CL097 y R848, respectivamente) y TLR4 (~200 pg/mL). A través de TLR2/1 y TLR5, la secreción de IL-1β fue baja (~50 pg/ml) y a través de TLR2/6, casi indetectable (~20pg/ml). Con respecto a IL-6, los neutrófilos la producen en respuesta a la activación de TLR2/1 (~120 pg/mL), TLR2/6 (~140 pg/mL), TLR4 y TLR5 (~270 pg/mL), TLR7 (~310 pg/mL) y TLR7/8 (~250 pg/mL). Estos resultados indican que la IL-6 se produce principalmente a través de TLR4, TLR5 y TLR7/8. Los resultados muestran que TLR9 no es funcional o que los neutrófilos no reconocieron su ligando (motivos CpG-B), ya que no se logró detectar ni IL-1β, ni IL-6, aunque sí se logró detectar altos niveles del ARNm. Tal como han informado otros autores, tampoco fue posible detectar esas dos citocinas en neutrófilos estimulados con poly (I:C) (ligando para TLR3). Esos resultados indican que los neutrófilos producen citocinas proinflamatorias no solo a través de TLR8, sino también a través de TLR7, lo que sugiere que ambos TLR son funcionales, contrario a lo informado por otros autores (15).
La activación de NOD2 y dectina-1 induce la secreción de IL-1β, IL-6 y TNF-α
Teniendo en cuenta que se han publicado estudios con resultados contradictorios sobre la funcionalidad de los receptores tipo NOD y no se ha evaluado la funcionalidad de la dectina-1, el paso siguiente fue evaluar la funcionalidad de NOD1, NOD2 y dectina-1, con base en la expresión de IL-1β, IL-6 y TNF-α. Como se observa en la figura 3, hubo un fuerte aumento en la secreción de IL-6 y TNF-α que se observó al estimular los neutrófilos con 200 y 400 ng/mL de MDP. Contrario a la IL-6, la producción de TNF-α fue dependiente de la concentración del agonista. También se observó un ligero aumento en la secreción de IL-1β en respuesta a MDP.
Se demostró además una alta producción de IL-6 y TNF-α (figura 3B-C) cuando se estimuló a los neutrófilos con zimosán sometido a hidrólisis básica, conocido como zymosan depleted (Invivogen, San Diego, EE. UU.), lo cual indica que la dectina-1 fue activada en respuesta a su agonista específico. La secreción de TNF-α también fue dependiente de la concentración del agonista. El zymosan depleted también indujo la producción de IL-1β, pero, a diferencia de la IL-6 y el TNF-α, la mayor secreción se produjo con bajas concentraciones del agonista (figura 3A). Por el contrario, y como ya se ha informado, NOD1 no es funcional, ya que no se observó producción de ninguna de las tres citocinas en respuesta al estímulo con iE-DAP. Por lo tanto, con estos resultados se sugiere por primera vez que los neutrófilos producen citocinas proinflamatorias no solo en respuesta a la activación de los TLR, sino también a la activación de receptores tipo NOD y dectina-1. La IL-1β y el IL-6 fueron producidos principalmente a través de TLR4, TLR5 y TLR7/8, y el TNF-α, por la vía de la dectina-1. Igualmente, los resultados confirmaron que TLR9 y NOD1, aunque transcritos, aparentemente no son funcionales en este modelo.
DISCUSIÓN
Los neutrófilos hacen parte del sistema inmune innato y cumplen un papel crucial en la eliminación de los patógenos invasores (bacterias, virus y hongos) que afectan la salud de los seres humanos y en el proceso inflamatorio agudo. Por tal razón, es muy importante conocer ampliamente los mecanismos implicados en la regulación de la expresión de moléculas proinflamatorias en estas células. Aunque previamente se ha demostrado la expresión de diferentes PRR (19,24-26), este es el primer estudio en que se evaluaron en un mismo grupo de individuos la expresión y la función de los TLR, RLR, NLR y CLR. En el presente estudio los neutrófilos expresaron constitutivamente todos los TLR (excepto TLR3), RIG-I, MDA5, NOD1 y NOD2 y también las moléculas adaptadoras MD2, CD14 e IPS-1. Sin embargo, el nivel de expresión (ARNm) varió de un individuo a otro y de un PRR a otro (resultados no mostrados). Además, se observó un aumento en el contenido de ARNm de TLR2 y TLR5 cuando se cultivaron los neutrófilos en presencia de LPS.
Otros estudios mostraron que los neutrófilos expresaban todos los TLR, excepto TLR3 (25,27), lo cual concuerda con lo hallado en el presente estudio. Los TLR que menos se expresaron fueron TLR5 y TLR2; O'Mahony y colaboradores también describieron una baja expresión de TLR5 en neutrófilos, comparados con monocitos (28). Esto puede estar de acuerdo con informes en los que se plantea que el reconocimiento puede estar determinado por vías de señalización proinflamatorias, como, por ejemplo, en pacientes con sepsis, en quienes se ha informado un aumento en la expresión de TLR2 y TLR4, pero los ligandos específicos para esos dos TLR no afectaron su expresión (29,30). Otros autores han informado que el tratamiento de neutrófilos con los ligandos de TLR2 (Pam3CSK4 ) y TLR4 (LPS) tampoco induce la producción de la proteína-1 quimioatrayente de monocitos (31). Sin embargo, es claro que el LPS activa al TLR4 e induce la secreción de diferentes citocinas proinflamatorias como IL-1β y TNF-α y la de quimiocinas como IL-8 (32).
Se ha demostrado que la activación de neutrófilos equinos con LPS y flagelina en presencia de polimixina B o sin ella induce la producción de especies reactivas de oxígeno y la transcripción de citocinas proinflamatorias (33), pero los autores observaron bajos niveles de TNF-α. Por el contrario, en este trabajo se destaca que hubo altos niveles de esa citocina en neutrófilos humanos estimulados con flagelina, pero bajos niveles de IL-6 e IL-1β.
Los neutrófilos en este estudio expresaron diferentes receptores de reconocimiento del ARN viral incluyendo TLR7, TLR8, RIG-I y MDA-5, pero el nivel de expresión (ARNm) fue similar en presencia o ausencia de LPS. Los resultados concuerdan con lo publicado recientemente por Berger y colaboradores (19), quienes detectaron ARNm de los cinco receptores que reconocen el ARN, pero no lograron detectar la proteína de TLR3 y TLR7. También se logró determinar la presencia del ARNm de la molécula adaptadora de RIG-I/MDA-5, el interferón beta-promotor estimulador 1 (IPS-1); la activación de esos receptores induce la producción de IFN tipo I (34). Con respecto al TLR7, existe controversia sobre su expresión y función en neutrófilos humanos. Hayashi y colaboradores describieron la expresión de TLR7, (3), pero, según Janke y colaboradores, los neutrófilos no expresan TLR7 (20). En este trabajo mediante la estimulación con LPS se logró detectar por RT-PCR el ARNm de TLR7 y TLR8; lo interesante es que la estimulación con sus dos ligandos, R848 y CL097, llevó a una mayor producción de IL-1β e IL-6, lo que indica que ambos TLR al parecer son funcionales. La secreción de IL-1β también está relacionada con la activación de TLR4, en menor proporción, por el heterodímero TLR2/1. Teniendo en cuenta que el reconocimiento del ARN viral a través de TLR7/8, y de componentes de bacterias a través de TLR4 y TLR2/1 lleva a una fuerte respuesta proinflamatoria, gracias a la activación del factor transcripcional NF-κB, estos resultados indican que los neutrófilos pueden estar implicados en inducir una respuesta antiviral o antibacteriana y muestran que tales células producen IL-6 por la activación de diferentes TLR, pero principalmente a través de TLR7/8 y TLR4. Igualmente se destaca la observación de que los neutrófilos pueden activar la producción de IL-1β e IL-6 en respuesta a la activación de TLR5, y también producen IL-6 por estimulación de TLR2/1, TLR2/6, TLR5 y dectina-1. En conclusión, TLR3 es el único TLR a través del cual los neutrófilos no indujeron la producción de IL-1β e IL-6, como ya se había reportado (25,27), y tampoco a través de TLR9.
Estudios de otros autores muestran que la activación tanto de neutrófilos como de otros tipos de células, por la vía del TLR9, requiere un tratamiento previo con el factor estimulante de colonias de granulocitos y monocitos (GM-CSF) (3) o con leucotrieno B4 (35). La activación de TLR9, por la vía de motivos CpG, que se encuentran principalmente en el ADN de bacterias, aumenta la viabilidad de los neutrófilos y retarda la apoptosis temprana (36).
Según los resultados expuestos, los neutrófilos primarios también podrían expresar constitutivamente NOD1 y NOD2, tal como se demostró previamente (24). Los autores, igualmente, observaron que la transcripción de NOD1 es menor que la de NOD2 en los neutrófilos (24). En los últimos años se ha avanzado mucho en la comprensión de los mecanismos que regulan la expresión y función de los NLR, como NOD1 y NOD2, en diferentes tipos de células del sistema innato, pero aún hacen falta muchos estudios que permitan entender a fondo cada uno de los mecanismos responsables de regular su funcionalidad en neutrófilos. En monocitos, células epiteliales y células dendríticas se han demostrado la expresión y función de NOD1 y NOD2 (21,37-39), pero en neutrófilos los resultados no han sido claros. Estudios recientes muestran la expresión y funcionalidad de NOD2, pero no de NOD1, en neutrófilos humanos (23). Los autores muestran que la activación de NOD2 con MDP induce la secreción de IL-8 y la regulación negativa del ligando CD62 y regula positivamente la producción de CD11b. En el presente estudio también se observó que cuando se activó a NOD1 y NOD2 con sus respectivos ligandos, iE-DAP y MDP, solo NOD2 indujo la secreción de IL-1β, IL-6 y TNF-α. Sin embargo, la secreción de las tres citocinas a través de NOD2 fue muy baja (menos de 50 pg/mL). La secreción de IL-6 y TNF-α a través de este receptor fue dependiente de la concentración del ligando. En células dendríticas derivadas de monocitos se observó una alta producción de citocinas, entre ellas IL-1β, cuando se las coestimuló con los agonistas de NOD1 y NOD2, pero la producción de IL-1β fue mucho mayor cuando además se estimuló a esas células con R848, ligando TLR7/8 (40). En macrófagos derivados de monocitos también se reportó la secreción de IL-1β en respuesta al estímulo con MDP (41). Los autores mostraron que el bloqueo de la IL-1β inhibe la secreción de citocinas mediada por NOD2.
Sin embargo, los resultados obtenidos hasta el momento muestran que la estimulación de NOD1 con su respectivo ligando no induce la secreción de citocinas proinflamatorias (IL-1β, IL-6 y TNF-α), lo que sugiere la necesidad de ensayos posteriores que permitan verificar la funcionalidad de este PRR en neutrófilos. Por otro lado, la estimulación de NOD2 produjo la secreción de IL-6 y en menor cantidad la de IL-1β y TNF-α. Pero en otros miembros del componente granulocítico, como los eosinófilos, se ha informado que la estimulación de dichos receptores induce la secreción de citocinas proinflamatorias en respuesta a concentraciones más bajas del estímulo (10 µg/mL) de agonistas (24), comparado con la concentración usada en este estudio.
Igualmente se demostró la expresión de los miembros de la familia RLR, RIG-I y MDA-5, los cuales se han identificado en células dendríticas derivadas de monocitos (42). Aunque no se evaluó la expresión de la familia de receptores tipo lectina C (CLR), la estimulación de uno de sus miembros, la dectina-1, indujo la producción de altos niveles de TNF-α, y de bajos niveles de IL-1β y IL-6, lo cual sugiere que posiblemente este sea otro receptor que sí se expresa en neutrófilos y contribuye a la fase proinflamatoria de la respuesta inmune innata. Con este trabajo se concluye que en neutrófilos humanos hubo producción de citocinas proinflamatorias a través de distintos PRR (TLR, NLR, CLR).
Los resultados del presente estudio son importantes porque aún es limitado el conocimiento que se tiene de los NLR, RLR y CLR en neutrófilos. En conjunto muestran que los neutrófilos purificados expresan un gran número de miembros de la superfamilia de PRR, los cuales además son funcionales. No obstante, aún hacen falta más estudios sobre la funcionalidad de los genes para los que fue posible la detección de ARNm. Sería muy importante estimular a los neutrófilos con agentes infecciosos como virus para así poder determinar la respuesta o el papel antiviral de dichas células. La expresión de diferentes PRR puede ser el reflejo de su importancia como primera línea efectora en el hospedero. Es decir, no solo contribuye a la eliminación de los patógenos (por fagocitosis), sino que también modula la producción de quimiocinas y citocinas. Los hallazgos también demuestran una vez más que la síntesis del ARNm de un gen determinado no siempre culmina en la traducción de la proteína respectiva. Esto puede ser consecuencia de modificaciones postranscripcionales, diferencias en la vida media del ARNm o agotamiento de proteínas, como se ha informado para NLR y RLR en neutrófilos (23). Por lo tanto, se debe ser muy cuidadoso con respecto a la expresión y funcionalidad de los PRR evaluados.
En conclusión, los resultados el presente estudio muestran que los neutrófilos son activados por un amplio espectro de PRR, lo cual indica que estos son importantes para que tales células puedan cumplir sus funciones, entre ellas el reconocimiento de patógenos infecciosos y la inducción de una respuesta inflamatoria. Por lo tanto, y teniendo en cuenta la rápida respuesta de los neutrófilos para proteger al hospedero de los agentes infecciosos, estas células y los PRR puede ser blancos para ensayos terapéuticos o para explicar mejor la respuesta inmune innata. Sin embargo, se necesitan estudios adicionales para entender mejor la regulación y función de los receptores de reconocimiento de patrones en el contexto de las enfermedades infecciosas. En especial si se tiene en cuenta que la alta producción de citocinas proinflamatorias como el TNF-α, que puede ocasionar daños en el hospedero, es necesario emprender estudios que permitan establecer el balance entre la producción de citocinas proinflamatorias y antiinflamatorias, de tal manera que se produzca una respuesta inmune protectora.
AGRADECIMIENTOS
Los investigadores agradecen a María Patricia García y Diana Giraldo por el apoyo en los aspectos técnicos. Este trabajo fue financiado por Colciencias, proyecto No. 111549326099 y sostenibilidad, Universidad de Antioquia 2013-2014.
CONFLICTO DE INTERESES
Los autores declaran no tener conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Kumar V, Sharma A. Neutrophils: Cinderella of innate immune system. Int Immunopharmacol. 2010 Nov;10(11):1325-34. [ Links ]
2. Rugeles MT, Patiño PJ, Montoya CJ. Inmunología una ciencia activa. 2a ed. Medellín: Editorial Universidad de Antioquia; 2009. [ Links ]
3. Hayashi F, Means TK, Luster AD. Toll-like receptors stimulate human neutrophil function. Blood. 2003 Oct 1;102(7):2660-9. [ Links ]
4. Muller I, Munder M, Kropf P, Hänsch GM. Polymorphonuclear neutrophils and T lymphocytes: strange bedfellows or brothers in arms? Trends Immunol. 2009 Nov;30(11):522-30. [ Links ]
5. Colotta F, Re F, Polentarutti N, Sozzani S, Mantovani A. Modulation of granulocyte survival and programmed cell death by cytokines and bacterial products. Blood. 1992 Oct 15;80(8):2012-20. [ Links ]
6. Abbas AK, Lichtman AH, Pillai S. Inmunología celular y molecular 6a ed. Madrid: Elsevier; 2008. [ Links ]
7. Nathan C. Neutrophils and immunity: challenges and opportunities. Nat Rev Immunol. 2006 Mar;6(3):173-82. [ Links ]
8. Marron TU, Yu JE, Cunningham-Rundles C. Toll-like receptor function in primary B cell defects. Front. Biosci. (Elite Ed). 2012 Jan;4:1853-63. [ Links ]
9. Koller B, Bals R, Roos D, Korting HC, Griese M, Hartl D. Innate immune receptors on neutrophils and their role in chronic lung disease. Eur J Clin Invest. 2009 Jul;39(7):535-47. [ Links ]
10. Ozinsky A, Underhill DM, Fontenot JD, Hajjar AM, Smith KD, Wilson CB, et al. The repertoire for pattern recognition of pathogens by the innate immune system is defined by cooperation between tolllike receptors. Proc Natl Acad Sci USA. 2000 Dec 5;97(25):13766-71. [ Links ]
11. Sabroe I, Jones EC, Whyte MKB, Dower SK. Regulation of human neutrophil chemokine receptor expression and function by activation of Toll-like receptors 2 and 4. Immunology. 2005 May;115(1):90-8. [ Links ]
12. Acorci-Valério MJ, Bordon-Graciani AP, Dias-Melicio LA, de Assis Golim M, Nakaira-Takahagi E, de Campos Soares AM V. Role of TLR2 and TLR4 in human neutrophil functions against. Paracoccidioides brasiliensis Scand J Immunol. 2010 Mar;71(2):99-108. [ Links ]
13. Hawn TR, Berrington WR, Smith IA, Uematsu S, Akira S, Aderem A, et al. Altered inflammatory responses in TLR5-deficient mice infected with Legionella pneumophila. J Immunol. 2007 Nov 15;179(10):6981-7. [ Links ]
14. Koller B, Kappler M, Latzin P, Gaggar A, Schreiner M, Takyar S, et al. TLR expression on neutrophils at the pulmonary site of infection: TLR1/TLR2-mediated up-regulation of TLR5 expression in cystic fibrosis lung disease. J Immunol. 2008 Aug 15;181(4):2753-63. [ Links ]
15. Makni-Maalej K, Boussetta T, Hurtado-Nedelec M, Belambri SA, Gougerot-Pocidalo M-A, El-Benna J. The TLR7/8 agonist CL097 primes N-formyl-methionylleucyl- phenylalanine-stimulated NADPH oxidase activation in human neutrophils: critical role of p47phox phosphorylation and the proline isomerase Pin1. J Immunol. 2012 Nov 1;189(9):4657-65. [ Links ]
16. Hattermann K, Picard S, Borgeat M, Leclerc P, Pouliot M, Borgeat P. The Toll-like receptor 7/8-ligand resiquimod (R-848) primes human neutrophils for leukotriene B4, prostaglandin E2 and platelet-activating factor biosynthesis. FASEB J. 2007 May;21(7):1575-85. [ Links ]
17. Kawai T, Akira S. The roles of TLRs, RLRs and NLRs in pathogen recognition. Int Immunol. 2009 Apr;21(4):317-37. [ Links ]
18. Yoneyama M, Fujita T. RNA recognition and signal transduction by RIG-I-like receptors. Immunol Rev. 2009 Jan;227(1):54-65. [ Links ]
19. Berger M, Hsieh C-Y, Bakele M, Marcos V, Rieber N, Kormann M, et al. Neutrophils express distinct RNA receptors in a non-canonical way. J Biol Chem. 2012 Jun 1;287(23):19409-17. [ Links ]
20. Janke M, Poth J, Wimmenauer V, Giese T, Coch C, Barchet W, et al. Selective and direct activation of human neutrophils but not eosinophils by Toll-like receptor 8. J Allergy Clin Immunol. 2009 May;123(5):1026-33. [ Links ]
21. Fritz JH, Ferrero RL, Philpott DJ, Girardin SE. Nod-like proteins in immunity, inflammation and disease. Nat Immunol.. 2006 Dec;7(12):1250-7. [ Links ]
22. Le Bourhis L, Benko S, Girardin SE. Nod1 and Nod2 in innate immunity and human inflammatory disorders. Biochem Soc Trans. 2007 Dec;35(Pt 6):1479-84. [ Links ]
23. Ekman A-K, Cardell LO. The expression and function of Nod-like receptors in neutrophils. Immunology. 2010 May;130(1):55-63. [ Links ]
24. Kvarnhammar AM, Petterson T, Cardell L-O. NODlike receptors and RIG-I-like receptors in human eosinophils: activation by NOD1 and NOD2 agonists. Immunology. 2011 Nov;134(3):314-25. [ Links ]
25. Parker LC, Whyte MKB, Dower SK, Sabroe I. The expression and roles of Toll-like receptors in the biology of the human neutrophil. J Leukoc Biol. 2005 Jun;77(6):886-92. [ Links ]
26. Mankan AK, Dau T, Jenne D, Hornung V. The NLRP3/ ASC/Caspase-1 axis regulates IL-1β processing in neutrophils. Eur J Immunol. 2012 Mar;42(3):710-5. [ Links ]
27. Prince LR, Whyte MK, Sabroe I, Parker LC. The role of TLRs in neutrophil activation. Curr Opin Pharmacol. 2011 Aug;11(4):397-403. [ Links ]
28. O'Mahony DS, Pham U, Iyer R, Hawn TR, Liles WC. Differential constitutive and cytokine-modulated expression of human Toll-like receptors in primary neutrophils, monocytes, and macrophages. Int J Med Sci. 2008 Jan;5(1):1-8. [ Links ]
29. Armstrong L, Medford ARL, Hunter KJ, Uppington KM, Millar AB. Differential expression of Toll-like receptor (TLR)-2 and TLR-4 on monocytes in human sepsis. Clin Exp Immunol. 2004 May;136(2):312-9. [ Links ] bstract.
30. Härter L, Mica L, Stocker R, Trentz O, Keel M. Increased expression of toll-like receptor-2 and -4 on leukocytes from patients with sepsis. Shock. 2004 Nov;22(5):403-9. [ Links ]
31. Yoshimura T, Takahashi M. IFN-gamma-mediated survival enables human neutrophils to produce MCP-1/ CCL2 in response to activation by TLR ligands. J Immunol. 2007 Aug 1;179(3):1942-9. [ Links ]
32. Cassatella MA. Neutrophil-derived proteins: selling cytokines by the pound. Adv Immunol. 1999 Jan;73:369-509. [ Links ]
33. Kwon S, Gewirtz AT, Hurley DJ, Robertson TP, Moore JN, Vandenplas ML. Disparities in TLR5 expression and responsiveness to flagellin in equine neutrophils and mononuclear phagocytes. J Immunol. 2011 Jun 1;186(11):6263-70. [ Links ]
34. Barral PM, Sarkar D, Su Z, Barber GN, DeSalle R, Racaniello VR, et al. Functions of the cytoplasmic RNA sensors RIG-I and MDA-5: key regulators of innate immunity. Pharmacol Ther. 2009 Nov;124(2):219-34. [ Links ]
35. Gaudreault É, Paquet-Bouchard C, Fiola S, Le Bel M, Lacerte P, Shio MT, et al. TAK1 contributes to the enhanced responsiveness of LTB(4)-treated neutrophils to Toll-like receptor ligands. Int Immunol. 2012 Nov;24(11):693-704. [ Links ]
36. József L, Khreiss T, Filep JG. CpG motifs in bacterial DNA delay apoptosis of neutrophil granulocytes. FASEB J. 2004 Nov;18(14):1776-8. [ Links ]
37. Tada H, Aiba S, Shibata K-I, Ohteki T, Takada H. Synergistic effect of Nod1 and Nod2 agonists with tolllike receptor agonists on human dendritic cells to generate interleukin-12 and T helper type 1 cells. Infect Immun. 2005 Dec;73(12):7967-76. [ Links ]
38. Yang S, Tamai R, Akashi S, Takeuchi O, Akira S, Sugawara S, et al. Synergistic effect of muramyldipeptide with lipopolysaccharide or lipoteichoic acid to induce inflammatory cytokines in human monocytic cells in culture. Infect Immun. 2001 Apr;69(4):2045-53. [ Links ]
39. Uehara A, Fujimoto Y, Fukase K, Takada H. Various human epithelial cells express functional Toll-like receptors, NOD1 and NOD2 to produce anti-microbial peptides, but not proinflammatory cytokines. Mol Immunol. 2007 May;44(12):3100-11. [ Links ]
40. Schwarz H, Posselt G, Wurm P, Ulbing M, Duschl A, Horejs-Hoeck J. TLR8 and NOD signaling synergistically induce the production of IL-1β and IL-23 in monocyte- derived DCs and enhance the expression of the feedback inhibitor SOCS2. Immunobiology. 2013 Apr;218(4):533-42. [ Links ]
41. Hedl M, Abraham C. Distinct roles for Nod2 protein and autocrine interleukin-1beta in muramyl dipeptide- induced mitogen-activated protein kinase activation and cytokine secretion in human macrophages. J Biol Chem. 2011 Jul 29;286(30):26440-9. [ Links ]
42. Harenberg A, Guillaume F, Ryan EJ, Burdin N, Spada F. Gene profiling analysis of ALVAC infected human monocyte derived dendritic cells. Vaccine. 2008 Sep;26(39):5004-13. [ Links ]