Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Iatreia
versión impresa ISSN 0121-0793
Iatreia vol.27 no.2 Medellín abr./jun. 2014
ARTÍCULO DE REVISIÓN
Teratoma retroperitoneal en niños: revisión del tema a propósito de un caso
Retroperitoneal teratoma in children: Report of a case and review of the literature
Carlos Cortés Caballero1; Luis Mauricio Duarte Vergara2; María Fernanda Parada Álvarez3; Jéssica María Vega García4; Julián Andrés Vera Campos5
1 Médico cirujano de la Universidad de Antioquia. Patólogo de The Western Pennsylvania Hospital (Pittsburg, EE. UU.). Gerente de Cortés Buitrago & Cía. Ltda., Bucaramanga, Colombia. cccaballero@gmail.com
2 Médico cirujano de la Universidad Pontificia Javeriana (Bogotá, Colombia). Cirujano pediátrico del Instituto Pediátrico Leningrado, San Petersburgo, Rusia. Cirujano pediátrico en la EPS Saludcoop y el Hospital Universitario de Santander, Bucaramanga, Colombia.
3 Estudiante de Medicina, Universidad Industrial de Santander, Bucaramanga, Colombia.
4 Médica interna de la Universidad Autónoma de Bucaramanga, Colombia. 5 Médico interno de la Universidad Industrial de Santander, Bucaramanga, Colombia.
Recibido: febrero 19 de 2013
Aceptado: mayo 29 de 2013
RESUMEN
Los teratomas retroperitoneales constituyen el 3% del total de tumores en la población pediátrica. Sin embargo, en Colombia no existe un registro que soporte esta cifra, ni consenso sobre su diagnóstico, tratamiento y pronóstico. Se presenta un caso en una recién nacida en la ciudad de Bucaramanga, Colombia, diagnosticado por imágenes y tratado quirúrgicamente. Se revisa la literatura al respecto incluyendo los aspectos generales, el diagnóstico diferencial, las características histológicas y el tratamiento, con el fin de orientar al médico para que considere esta posibilidad diagnóstica.
PALABRAS CLAVE
Espacio Retroperitoneal, Neoplasias Retroperitoneales, Pediatría, Teratoma, Tumor de Células Germinales
SUMMARY
Retroperitoneal teratomas constitute 3% of all pediatric tumors. However, no information is available in Colombia to support this frequency, and there is no consensus on the diagnosis, management and prognosis of this tumor. We report a case in a newborn girl in Bucaramanga, Colombia, diagnosed by means of imaginological studies and treated by surgery. We review the literature, considering general aspects, differential diagnosis, histological features and management, in order to guide physicians to consider this diagnostic possibility.
KEY WORDS
Germ Cells Tumor, Pediatrics, Retroperitoneal Neoplasms, Retroperitoneal Space, Teratoma
INTRODUCCIÓN
Los teratomas retroperitoneales son masas infrecuentes y, en su mayoría, benignas. Son tumores que usualmente cursan con una clínica inespecífica e, incluso, pueden ser asintomáticos. En este artículo se presenta una revisión de la literatura ya que existe poca información sobre estas neoplasias y el médico no suele sospecharlas. Esta revisión se basa en el reporte del caso de una recién nacida en la ciudad de Bucaramanga, Colombia, con diagnóstico tardío, pero sin complicaciones. El propósito de la revisión es brindar herramientas útiles, de tal manera que el profesional se familiarice con el modo de enfocar este tipo de pacientes, al encontrar masas abdominales; orientarlo para que considere esta posibilidad diagnóstica y dirija sus estudios a descartarla o confirmarla. Todo esto teniendo en cuenta las repercusiones favorables del diagnóstico y tratamiento oportunos.
Es importante recordar que al estar frente a un teratoma retroperitoneal, se proceda a un manejo interdisciplinario, con cirugía pediátrica, patología, oncología y otras especialidades encaminadas a buscar el bienestar del paciente y su familia, puesto que esta enfermedad puede generar gran ansiedad; así se busca evitar las secuelas estructurales, funcionales y psicológicas y garantizar un desarrollo normal.
CASO CLÍNICO
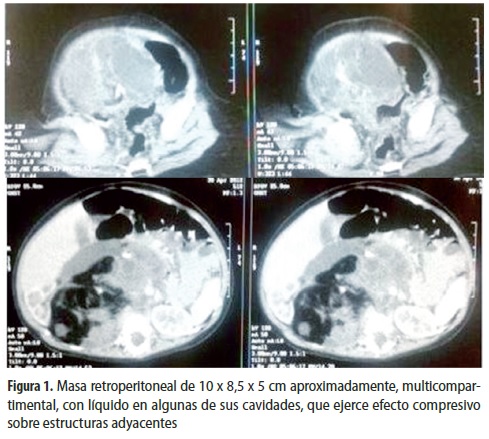
Niña de seis meses de edad con antecedente de estreñimiento desde el nacimiento, tratado con supositorios de glicerina y cuya madre palpaba una masa en el flanco derecho del abdomen, razón por la cual la trajo a consulta. Al examen físico se encontró perímetro abdominal de 54 cm; se palpaba una masa de bordes definidos, indurada, no móvil que se extendía desde dos cm a la izquierda de la región umbilical, pasando por el flanco derecho hasta la región lumbar derecha. Se solicitó ecografía abdominal, que sugirió ''masa intraabdominal difusa de 10 x 8,5 x 5 cm aproximadamente, multicompartimental, con componentes sólido y quístico y calcificaciones, que ejerce efecto compresivo sobre las estructuras adyacentes, con posibilidades diagnósticas de teratoma versus neoplasia de origen mesenquimal y, menos probable, neuroblastoma''. Además, se hizo tomografía que sugirió masa retroperitoneal con cavidades y líquido en algunas de ellas (figura 1). Se solicitaron estudios paraclínicos que se hallaron dentro de límites normales. Se tomó una muestra para cuantificar el nivel de alfa-fetoproteína (AFP) que fue de 33.062 UI/mL. Fue llevada a cirugía y bajo anestesia general se resecó la masa retroperitoneal, procedimiento que finalizó sin complicaciones. La masa estaba localizada en el lado derecho retroperitoneal íntimamente adherida al riñón, a la vena renal y a su desembocadura en la vena cava, lo que dificultó la disección, pero no hubo necesidad de hacer resección vascular. Se envió muestra a patología, que informó teratoma extragonadal retroperitoneal inmaduro grado 2.
METODOLOGÍA
Se hizo una revisión de la literatura publicada en diferentes bases de datos: PubMed, Proquest, Sciencedirect, OVID, SAGE publications, Springer, Hinari, EMBASE, CINAHL y LILACS identificando así todos los estudios relevantes para el tema escritos en inglés, utilizando como palabras clave: ''teratomas'', ''retroperitoneal'', ''infancy'', ''childhood'', ''pediatric'', ''children'' and ''germ cells tumors''. Además se consultaron libros especializados y actualizados en relación con el tema. Se incluyeron los artículos publicados desde enero de 1985 a julio de 2012, pero se excluyeron las cartas al editor.
El estudio fue aprobado por los padres de la paciente, quienes dieron por escrito el consentimiento informado.
DEFINICIÓN
El término ''tumor de células germinales'' es bastante amplio e incluye varios tipos diferentes de presentación histológica. Alrededor de la cuarta o quinta semanas del desarrollo del embrión las células germinales primordiales migran del saco vitelino a lo largo de la línea media y las regiones paraxiales a la cresta genital para diferenciarse en las gónadas. El desarrollo de los órganos genitales masculinos y femeninos de la cresta genital depende de la presencia del gen SRY, localizado en el cromosoma Y. En su ausencia, se desarrolla un ovario, y en su presencia, un testículo. Este patrón de migración a lo largo de la línea media explica por qué los tumores de células germinales en niños ocurren más comúnmente en dicha línea o en las gónadas (1).
La diferenciación incompleta o la migración aberrante de estas células precursoras pueden inducir al desarrollo de teratomas gonadales o extragonadales (2). Los teratomas son neoplasias embrionarias derivadas de las células totipotenciales, que contienen tejidos de al menos dos de las líneas germinales (endodermo, mesodermo o ectodermo) en diferentes proporciones (3-5).
Aunque el 80% de los teratomas son benignos, algunos pueden contener elementos inmaduros o malignos (1,6). Su tasa de malignidad es del 7%, pero aumenta al 25% en aquellos diagnosticados en el primer mes de vida (7). Los maduros o benignos también se llaman quistes dermoides y generalmente contienen cabello, dientes y sebo (8).
EPIDEMIOLOGÍA
Los teratomas constituyen aproximadamente el 3% del total de tumores de la población pediátrica (8) y el 3,5% al 4% de todas las neoplasias de células germinales (9). Son aproximadamente dos veces más frecuentes en el sexo femenino (2). Los sitios más comunes de localización varían con la edad (9,10); de 2% a 5% se ubican en el retroperitoneo, lo que los hace tumores infrecuentes de células germinales en la infancia (11-13), en contraste con su aparición en otros lugares del cuerpo (14) tales como la zona sacrococcígea (57%), las gónadas (29%), el mediastino (7%) y el cérvix (3%) (8). Constituyen el tercer tumor primario retroperitoneal más común en la población pediátrica luego del neuroblastoma y el tumor de Wilms (15), lo cual significa que son aproximadamente del 1% al 11% del total de los tumores primarios de esta localización (16). Se pueden presentar a cualquier edad (17), pero se ha visto una presentación bimodal con picos en los primeros seis meses de vida y al comienzo de la edad adulta (18); en neonatos la proporción de teratomas es mayor para los tumores retroperitoneales que para los de otros sitios (19).
PRESENTACIÓN CLÍNICA
Son generalmente asintomáticos. Cuando hay síntomas, corresponden a la presencia de masas con distensión y dolor abdominal, asociado a náuseas y vómito (20,21). Ocasionalmente, pueden presentarse síntomas urinarios por su proximidad a los riñones y uréteres. Rara vez aparece fiebre como primera manifestación, debido al desarrollo de múltiples abscesos; en el caso de los teratomas malignos, la fiebre se puede deber a liberación de pirógenos directamente del tumor (22). Infrecuentemente, el cuadro se inicia con peritonitis química con sintomatología y hallazgos compatibles con abdomen agudo (23). Este fenómeno se relaciona con diagnósticos realmente tardíos y cursos lentos de la enfermedad.
En el examen físico de rutina se encuentra aumento del perímetro abdominal con presencia de masa a la palpación (15).
DIAGNÓSTICO
El diagnóstico posnatal es clínico y se basa en la presencia de masa palpable en los flancos (17). La radiografía simple de abdomen, la ecografía, la tomografía o la resonancia magnética pueden aclarar su origen; también son útiles los marcadores tumorales como la alfa-fetoproteína y las gonadotropinas (20).
La radiografía simple de abdomen puede mostrar el desplazamiento visceral así como la presencia de calcificaciones o componentes óseos y dientes. Incluso algunos autores han informado que estos hallazgos son los elementos más útiles para poder hacer el diagnóstico, y que su presencia junto con la ecografía es suficiente para definir las relaciones del tumor y programar la cirugía (24).
La ecografía, por ser el primer examen paraclínico, puede delimitar la masa y diferenciar las partes quísticas de las sólidas (25); sin embargo, la experiencia de los últimos estudios confirma que la tomografía es mejor que la ecografía para el diagnóstico de esta neoplasia; es útil para delimitar su extensión y la relación con los grandes vasos del retroperitoneo, pero tiende a sobreestimar el grado de adherencia del tumor a estructuras adyacentes que en realidad se ven en la exploración quirúrgica (21-26).
Hayasaka y colaboradores (27) han reportado en la tomografía hallazgos de homogeneidad interna, densidad grasa, formación de quistes y calcificaciones como predictores importantes de un tumor retroperitoneal benigno. Se ha citado la presencia de niveles de fluidos grasos en el peritoneo como un signo fiable de la ruptura intraperitoneal con una posterior peritonitis de origen químico (28).
La resonancia magnética, al igual que la tomografía, permite una mejor resolución de los tejidos blandos, es útil para evaluar la extensión local y se ha encontrado en algunos estudios como de gran ayuda para diferenciar entre un tumor benigno y uno maligno (28-30).
Otros autores proponen técnicas como la angiografía, la venocavografía inferior y la biopsia con aguja para el diagnóstico preciso de estos tumores, pero tales técnicas no se hacen de forma unificada en ninguno de los estudios revisados (31).
El marcador tumoral más útil en estos casos es la alfafeto proteína (AFP). También es un método fiable para el seguimiento de estos pacientes, porque facilita la detección precoz de una recidiva (32). De igual forma, se pueden expresar otros marcadores como el antígeno carcinoembrionario (ACE) y el CA19-9 (33-35).
PATOLOGÍA
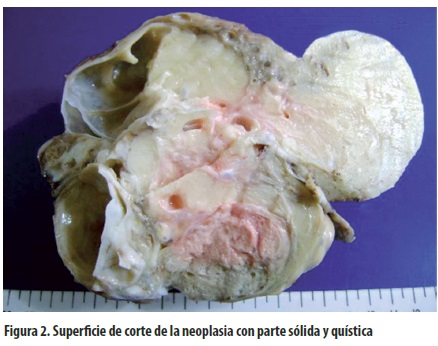
Los teratomas retroperitoneales extragonadales son generalmente unilaterales y sésiles. Se consideran ''típicamente grandes'' (1). En la revisión se encontraron tumores con peso hasta de 1.210 gramos (36), longitud entre 4 y 25 cm (37) y volumen de 88 a 1.765 mL (37). En el caso que se presenta se encontró lo siguiente: peso de 742 gramos y medidas de 14 x 9,5 x 9 cm. Por lo general son levemente lobulados y bien encapsulados, y su vasculatura superficial no es prominente. Macroscópicamente son de color blanco nacarado, rosado o violáceo. Pueden acompañarse de adherencias avasculares y generalmente son sólidos. En este caso, el espécimen era de consistencia firme, violáceo en algunas áreas, amarillo o rosado en otras, con superficie externa lisa y adherencias en su sitio de implantación. Al corte la superficie era irregular, amarilla y blanca; tres cuartas partes del tumor eran sólidas con zonas de calcificación y la cuarta parte restante era quística, con contenido líquido incoloro, tapizada por una membrana blanca brillante (figura 2).
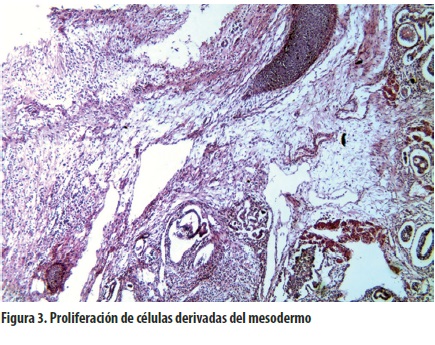
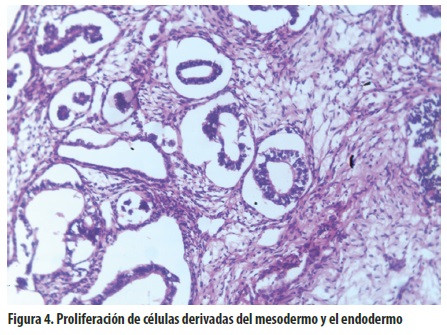
Microscópicamente, estos tumores tienen componentes de dos o de las tres capas: la piel con sus anexos y el tejido nervioso que corresponden al ectodermo; tejidos conectivos con músculo, cartílago y hueso, al mesodermo, y conductos con epitelios columnares o ciliados, al endodermo. Estos tejidos se hallan entremezclados en diferentes estados de maduración y de acuerdo con su predominio se clasifican los teratomas en maduros o inmaduros (22).
En nuestro caso se encontraron componentes de las tres capas; además se halló que en ciertos campos predominaba el tejido embrionario renal, con glomérulos, blastemas y componentes germinales. Las mitosis eran infrecuentes. En la superficie externa no se encontraron células tumorales (figuras 3 y 4).
La gradación histológica es importante para determinar el pronóstico y la terapia complementaria a la cirugía (38). La clasificación de Azizhkan, aunque no es la única, fue la utilizada en el presente estudio; en ella se tiene en cuenta la presencia de tejidos inmaduros por campo de menor aumento (x100). En este caso se clasificó como de grado 2 que equivale a 1-3 tejidos inmaduros por campo. Usualmente el diagnóstico de estos tumores no requiere la inmunohistoquímica ni la microscopía electrónica.
TRATAMIENTO Y PRONÓSTICO
El tratamiento de elección para los teratomas es la extirpación quirúrgica completa y se considera que generalmente es exitosa por tratarse casi siempre de tumores benignos. La recurrencia está relacionada con los tejidos inmaduros, especialmente con focos del saco vitelino, y con las resecciones incompletas por lo cual se recomienda que en pacientes con un alto contenido de estos elementos se recurra a la quimioterapia (25). Se hace énfasis en que el aspecto más importante para la escisión es recordar la estrecha relación de estos tumores con los riñones y los vasos renales; en el estudio de Chaudhary y colaboradores (21), la extirpación del riñón no fue necesaria en ninguno de los pacientes. La resección por vía laparoscópica ha sido informada por otros autores como medio definitivo de tratamiento con resultados generalmente favorables (15). Algunas veces la resecabilidad es limitada debido al tamaño del tumor y a su grado histológico (39). Hansmann y colaboradores (40) presentaron todos sus casos como tumores retroperitoneales sin adherencias a los órganos de esta cavidad o ''tumores retroperitoneales no unidos''. En otras series se han informado complicaciones intraoperatorias debido a la unión de estas masas con órganos y estructuras de la cavidad retroperitoneal, sobre todo con los grandes vasos, que terminó en la ligadura de estos, la cual fue bien tolerada, sin compromiso de los riñones, lo que ha llevado a concluir que con estos tumores es impredecible la distorsión anatómica; ello aumenta el riesgo operatorio a pesar de las imágenes perioperatorias, porque estas resultan insuficientes para la demostración de los grandes vasos, particularmente de las venas (41-43). Esto lo comprobaron Jones y Burns (12), la totalidad de cuyos pacientes tuvieron adherencias a la vena cava inferior y los vasos mesentéricos fueron inseparables y requirieron la ligadura. Por eso la resección es necesaria para obtener la curación, pero los márgenes de resección no son claros en todos los casos.
Las complicaciones tardías son la recurrencia, las adherencias y la hipertensión; la tasa de mortalidad operatoria es de cero a 8%, pero la de complicaciones puede ser de 50% a 100%, lo que plantea un reto para la cirugía como pilar del tratamiento en vista del tamaño, las adherencias y la distorsión vascular (12). Sin embargo, la literatura presenta algunas alternativas para evitar estos problemas, que pueden ser bien toleradas y así reducir los altos riesgos y las complicaciones quirúrgicas. Solari y colaboradores (14) hicieron una cavectomía suprarrenal e infrarrenal electiva como abordaje para resecar con éxito un tumor bilateral masivo en un niño de 4 meses, sin lesión de los vasos ni hemorragia grave.
El pronóstico de los teratomas es generalmente bueno y depende directamente de su grado de diferenciación, sin que exista relación con su tamaño; es mejor el de los tumores maduros y benignos y es reservado el de los malignos (44,45). El sexo y la resección quirúrgica incompleta parecen ser los factores de riesgo más importantes para la recaída y el mal pronóstico (46).
Las lesiones que no se pueden resecar, los teratomas inmaduros, los tumores del seno endodérmico y la no normalización de los marcadores tumorales son indicadores de peor pronóstico y pueden justificar una quimioterapia intensiva debido a la probabilidad de metástasis (47-49).
Entre las pruebas hematológicas, la alfa-fetoproteína es un buen indicador tanto para el diagnóstico como para la evaluación de la recurrencia del tumor (50). En nuestro caso el valor de control a los ocho meses fue de 12,03 mU/mL.
CONCLUSIÓN
Los teratomas retroperitoneales son raros en niños. Sin embargo, es preciso que el médico conozca los aspectos generales de esta enfermedad, para que así pueda incluirla entre las posibilidades diagnósticas frente a las masas abdominales en niños. Esto es importante teniendo en cuenta que, por lo general, el diagnóstico de este tipo de masas se hace de forma tardía, muy probablemente por la falta de sospecha clínica. Una vez sospechada esta neoplasia, es primordial el uso de imágenes para confirmar el diagnóstico. Después de comparar diferentes métodos como la ecografía y la tomografía, la evidencia muestra que esta última es la mejor; la atención de estos pacientes debe ser siempre en un nivel alto de complejidad, donde se disponga de los medios necesarios para estudiarlos integralmente.
La resección quirúrgica oportuna y completa ha sido siempre el tratamiento de elección en niños con teratomas maduros o inmaduros y se la debe hacer inmediatamente después de establecido el diagnóstico. El pronóstico de estos tumores, una vez resecados totalmente, es bueno. Aun así, se continúa el seguimiento del paciente haciendo mediciones periódicas de alfa-fetoproteína para controlar su disminución en el tiempo.
REFERENCIAS BIBLIOGRÁFICAS
1. Amies Oelschlager A-ME, Sawin R. Teratomas and ovarian lesions in children. Surg Clin North Am. 2012 Jun;92(3):599–613, viii. [ Links ]
2. Barksdale EM, Obokhare I. Teratomas in infants and children. Curr Opin Pediatr. 2009 Jun;21(3):344–9. [ Links ]
3. Rowe MI, O'Neill JA, Grosfeld JL. Teratomas and germ cell tumors. In: Rowe MI, O'Neill JA, Grosfeld JL, editors. Essentials of Pediatric Surgery. St. Louis: CV Mosby; 1995. p. 296–305. [ Links ]
4. Laberge J, Shaw K, Nguyen L. Teratomas dermoids and other soft tissue tumors. In: Ashcraft KW, Holcomb IGW, Murphy JP, editors. Pediatric surgery. Philadelphia: Saunders; 2005. p. 972–96. [ Links ]
5. Harms D, Zahn S, Göbel U, Schneider DT. Pathology and molecular biology of teratomas in childhood and adolescence. Klin Padiatr. 2006;218(6):296–302. [ Links ]
6. Tröbs R, Geyer C, Hirsch W, Tannapfel A. Surgical anatomy of large retroperitoneal teratomas in infants: Report of two cases. Clin Med Case Rep. 2008;1:107–11. [ Links ]
7. Azizkhan R. Teratomas and other germ cells tumors. In: Grosfeld J, Fonkalsrud E, editors. Pediatric surgery. 6th ed. Philadelphia: Mosby; 2006. p. 554–74. [ Links ]
8. Grosfeld JL, Billmire DF. Teratomas in infancy and childhood. Curr Probl Cancer. 1985 Sep;9(9):1–53. [ Links ]
9. Grosfeld JL, Ballantine T V, Lowe D, Baehner RL. Benign and malignant teratomas in children: analysis of 85 patients. Surgery. 1976 Sep;80(3):297–305. [ Links ]
10. De Backer A, Madern GC, Pieters R, Haentjens P, Hakvoort-Cammel FGAJ, Oosterhuis JW, et al. Influence of tumor site and histology on long-term survival in 193 children with extracranial germ cell tumors. Eur J Pediatr Surg. 2008 Feb;18(1):1–6. [ Links ]
11. Hunter CJ, Ford HR, Estrada JJ, Stein JE. Alpha-fetoprotein levels correlate with the pathologic grade and surgical outcomes of pediatric retroperitoneal teratomas. Pediatr Surg Int. 2009 Apr;25(4):331–6. [ Links ]
12. Jones VS, Burns CR. Operative considerations in pediatric retroperitoneal teratomas--a review. Eur J Pediatr Surg. 2013 Aug;23(4):265–9. [ Links ]
13. Paulenz E, Knöpfle G, Schlolaut KH, Brühl P. [Retroperitoneal teratoma. A problem in pediatric urology]. Urol A. 1987 Mar;26(2):63–6. [ Links ]
14. Solari V, Jawaid W, Jesudason E. Elective suprarenal and infrarenal cavectomy for excision of giant retroperitoneal teratoma in infancy. J Pediatr Surg. 2011 Mar;46(3):e37–40. [ Links ]
15. Gatcombe HG, Assikis V, Kooby D, Johnstone PAS. Primary retroperitoneal teratomas: a review of the literature. J Surg Oncol. 2004 May 1;86(2):107–13. [ Links ]
16. Nguyen CT, Kratovil T, Edwards MJ. Retroperitoneal teratoma presenting as an abscess in childhood. J Pediatr Surg. 2007 Nov;42(11):E21–3. [ Links ]
17. Schey WL, Vesely JJ, Radkowski MA. Shard-like calcifications in retroperitoneal teratomas. Pediatr Radiol. 1986 Jan;16(1):82–4. [ Links ]
18. Davidson AJ, Hartman DS, Goldman SM. Mature teratoma of the retroperitoneum: radiologic, pathologic, and clinical correlation. Radiology. 1989 Aug;172(2):421–5. [ Links ]
19. Augé B, Satgé D, Sauvage P, Lutz P, Chenard MP, Levy JM. [Retroperitoneal teratomas in the perinatal period. Review of the literature concerning a neonatal, immature, aggressive teratoma]. Ann Pediatr (Paris). 1993 Dec;40(10):613–21. [ Links ]
20. Lakhoo K. Neonatal teratomas. Early Hum Dev. 2010 Oct;86(10):643–7. [ Links ]
21. Chaudhary A, Misra S, Wakhlu A, Tandon RK, Wakhlu AK. Retroperitoneal teratomas in children. Indian J Pediatr. 2006 Mar;73(3):221–3. [ Links ]
22. Gonzalez-Crussi F. Extragonadal teratomas. Washington, D.C.: Armed Forces Institute of Pathology (U.S.); 1982. [ Links ]
23. Sarin YK. Peritonitis caused by rupture of infected retroperitoneal teratoma. APSP J Case Rep. 2012 Jan;3(1):2. [ Links ]
24. Lack EE, Travis WD, Welch KJ. Retroperitoneal germ cell tumors in childhood. A clinical and pathologic study of 11 cases. Cancer. 1985 Aug 1;56(3):602–8. [ Links ]
25. Restrepo F, Arango M, Serna F. Cirugía pediátrica. Medellín: Editorial Universidad de Antioquia; 2006. [ Links ]
26. Jeffrey RB. Imaging of the peritoneal cavity. Curr Opin Radiol. 1991 Jun;3(3):471–3. [ Links ]
27. Hayasaka K, Yamada T, Saitoh Y, Yoshikawa D, Aburano T, Hashimoto H, et al. CT evaluation of primary benign retroperitoneal tumor. Radiat Med. 1994;12(3):115–20. [ Links ]
28. Ferrero A, Céspedes M, Cantarero JM, Arenas A, Pamplona M. Peritonitis due to rupture of retroperitoneal teratoma: computed tomography diagnosis. Gastrointest Radiol. 1990 Jan;15(3):251–2. [ Links ]
29. Bellin MF, Duron JJ, Curet P, Dion-Voirin E, Grellet J. Primary retroperitoneal teratoma in the adult: correlation of MRI features with CT and pathology. Magn Reson Imaging. 1991 Jan;9(2):263–6. [ Links ]
30. Rajiah P, Sinha R, Cuevas C, Dubinsky TJ, Bush WH, Kolokythas O. Imaging of uncommon retroperitoneal masses. Radiographics. 2011;31(4):949–76. [ Links ]
31. Papanicolaou N, Yoder IC, Lee MJ. Primary retroperitoneal neoplasms: how close can we come in making the correct diagnosis?. Urol Radiol. 1992 Jan;14(3):221–8. [ Links ]
32. Cushing B, Perlman EJ, Marina N, Castleberry RP. Germ cell tumors. In: Pizzo PA, Poplack DG, editors. Principles and practice of pediatric oncology. Philadelphia: J.B. Lippincott; 2002. p. 1091–113. [ Links ]
33. McKenney JK, Heerema-McKenney A, Rouse R V. Extragonadal germ cell tumors: a review with emphasis on pathologic features, clinical prognostic variables, and differential diagnostic considerations. Adv Anat Pathol. 2007 Mar;14(2):69–92. [ Links ]
34. Ueno T, Tanaka YO, Nagata M, Tsunoda H, Anno I, Ishikawa S, et al. Spectrum of germ cell tumors: from head to toe. Radiographics. 2004;24(2):387–404. [ Links ]
35. Schmoll H-J. Extragonadal germ cell tumors. Ann Oncol. 2002 Jan;13 Suppl 4:265–72. [ Links ]
36. Ohno Y, Kanematsu T. An endodermal sinus tumor arising from a mature cystic teratoma in the retroperitoneum in a child: is a mature teratoma a premalignant condition? Hum Pathol. 1998 Oct;29(10):1167–9. [ Links ]
37. De Backer A, Madern GC, Hazebroek FWJ. Retroperitoneal germ cell tumors: a clinical study of 12 patients. J Pediatr Surg. 2005 Sep;40(9):1475–81. [ Links ]
38. Kurman RJ, Hedrick Ellenson L, Ronnett BM. Blaustein's pathology of the female genital tract. New York: Sprbger-Verlac; 2001. [ Links ]
39. Tapper D, Lack EE. Teratomas in infancy and childhood. A 54-year experience at the Children's Hospital Medical Center. Ann Surg. 1983 Sep;198(3):398–410. [ Links ]
40. Hansmann GH, Budd JW. Massive unattached retroperitoneal tumors : an explanation of unattached retroperitonel tumors based on remnants of the embryonic urogenital apparatus. Am J Pathol. 1931 Jun;7(6):631–674.19. [ Links ]
41. Jones NM, Kiely EM. Retroperitoneal teratomas--potential for surgical misadventure. J Pediatr Surg. 2008 Jan;43(1):184–6; discussion 187. [ Links ]
42. Hart J, Mazrani W, Jones N, Kiely EM, Sebire NJ, McHugh K. Upper abdominal teratomas in infants: radiological findings and importance of the vascular anatomy. Pediatr Radiol. 2008 Jul;38(7):750–5. [ Links ]
43. Luo C-C, Huang C-S, Chu S-M, Chao H-C, Yang C-P, Hsueh C. Retroperitoneal teratomas in infancy and childhood. Pediatr Surg Int. 2005 Jul;21(7):536–40. [ Links ]
44. Nakashima J, Ueno M, Nakamura K, Tachibana M, Baba S, Deguchi N, et al. Differential diagnosis of primary benign and malignant retroperitoneal tumors. Int J Urol. 1997 Sep;4(5):441–6. [ Links ]
45. Lo Curto M, D'Angelo P, Cecchetto G, Klersy C, Dall'Igna P, Federico A, et al. Mature and immature teratomas: results of the first paediatric Italian study. Pediatr Surg Int. 2007 Apr;23(4):315–22. [ Links ]
46. El Mesbahi O, Terrier-Lacombe M-J, Rebischung C, Theodore C, Vanel D, Fizazi K. Chemotherapy in patients with teratoma with malignant transformation. Eur Urol. 2007 May;51(5):1306–11; discussion 1311–2. [ Links ]
47. Mann JR, Gray ES, Thornton C, Raafat F, Robinson K, Collins GS, et al. Mature and immature extracranial teratomas in children: the UK Children's Cancer Study Group Experience. J Clin Oncol. 2008 Jul 20;26(21):3590–7. [ Links ]
48. Donadio AC, Motzer RJ, Bajorin DF, Kantoff PW, Sheinfeld J, Houldsworth J, et al. Chemotherapy for teratoma with malignant transformation. J Clin Oncol. 2003 Dec 1;21(23):4285–91. [ Links ]
49. Rattan KN, Kadian YS, Nair VJ, Kaushal V, Duhan N, Aggarwal S. Primary retroperitoneal teratomas in children: a single institution experience. Afr J Paediatr Surg. 2010;7(1):5–8. [ Links ]
50. Marina NM, Cushing B, Giller R, Cohen L, Lauer SJ, Ablin A, et al. Complete surgical excision is effective treatment for children with immature teratomas with or without malignant elements: A Pediatric Oncology Group/Children's Cancer Group Intergroup Study. J Clin Oncol. 1999 Jul;17(7):2137–43. [ Links ]