Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.27 no.3 Medellín July/Sept. 2014
INVESTIGACIÓN ORIGINAL
Detección de casos submicroscópicos de Plasmodium spp., utilizando técnicas clásicas y moleculares en pacientes gestantes de Córdoba, Colombia
Detection of submicroscopic infection with Plasmodium spp., using classical and molecular techniques in pregnant patients from Córdoba, Colombia
Yurany Patricia Blanquiceth1; Óscar Murillo Gómez2; Amanda Elena Maestre3; Mauricio Corredor1,4
1 Grupo Genética y Bioquímica de Microorganismos (GEBIOMIC), Instituto de Biología, Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia, Medellín, Colombia.
2 Grupo Genética y Sociedad, Facultad de Medicina, Universidad Cooperativa de Colombia, sede Medellín.
3 Grupo Salud y Comunidad, Departamento de Parasitología, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
4 Grupo Genética Regeneración y Cáncer (GRC), Instituto de Biología, Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia, Medellín, Colombia. mauricio.corredor@udea.edu.co
Recibido: noviembre 19 de 2012
Aceptado: octubre 18 de 2013
RESUMEN
Introducción: la malaria gestacional afecta a las madres y al embrión o feto en desarrollo; requiere diagnóstico rápido y tratamiento oportuno y efectivo para evitar las complicaciones y muertes.
Objetivo: comparar las técnicas de gota gruesa, PCR anidada y PCR en tiempo real (qRT-PCR), para diagnosticar infecciones submicroscópicas por Plasmodium falciparum y P. vivax.
Metodología: se estudiaron 21 mujeres con manifestaciones clínicas de malaria, incluyendo gestantes y no gestantes, en Puerto Libertador, Córdoba, Colombia; de todas se obtuvieron muestras de sangre periférica y, en las gestantes, de placenta y cordón umbilical. Se extrajo el ADN y se lo amplificó por PCR anidada y cuantitativa (qRT-PCR). Para el análisis estadístico se usaron los programas Graphpad PRISM y EPIDAT.
Resultados: las tres técnicas diagnosticaron satisfactoriamente la presencia de P. falciparum y P. vivax en sangre periférica, cordón y placenta. Las pruebas moleculares presentaron sensibilidad y especificidad del 100%; dos casos de infección por P. falciparum no identificados por gota gruesa (submicroscópicos) se diagnosticaron con las dos técnicas de PCR.
Conclusión: la qRT-PCR es ventajosa en comparación con la PCR anidada porque su estandarización es más corta, requiere menos infraestructura y permite cuantificar el ADN.
PALABRAS CLAVE
Embarazo, Gota Gruesa, Malaria, PCR en tiempo real y cuantitativa (qRT-PCR), Plasmodium falciparum, Plasmodium vivax
SUMMARY
Introduction: Gestational malaria affects both the mother and the development of her embryo or fetus. Rapid diagnosis and timely and effective treatment are required to prevent complications and deaths.
Objective: To compare thick blood smear with nested PCR and real-time PCR (qRT-PCR) for the diagnosis of submicroscopic infections with Plasmodium falciparum and P. vivax.
Methodology: 21 women with clinical manifestations of malaria, including both pregnant and non-pregnant, were studied in Puerto Libertador, Córdoba, Colombia. Peripheral blood specimens were obtained from all of them; umbilical cord and placenta blood specimens were taken in the pregnant ones. DNA was extracted and amplified for nested PCR or qRT-PCR. Statistical analysis was done using Graphpad PRISM and EPIDAT softwares.
Results: The three techniques were satisfactory for the detection of Plasmodium falciparum and P. vivax in peripheral blood and in the umbilical cord and placenta specimens. Molecular tests were 100% sensitive and specific. Two submicroscopic cases of P. falciparum infection were detected with the two PCR techniques. Conclusion: qRT-PCR is advantageous over nested PCR because its standardization is shorter, it requires lesser infrastructure and it allows the quantification of DNA.
KEY WORDS
Gestational Malaria, Malaria, Plasmodium falciparum, Plasmodium vivax, Thick Blood Smear, Real-Time and Quantitative PCR (qRT-PCR)
INTRODUCCIÓN
La malaria es causada por especies del género Plasmodium. Representa un gran problema mundial de salud pública (1) debido a que es una de las enfermedades transmitidas por vectores que causa mayor morbilidad y mortalidad. La imperiosa necesidad, en vista de la creciente mortalidad global y la falta general de progresos en el control de la malaria, es la investigación sobre los mejores métodos para el despliegue y el uso de los enfoques existentes, métodos rápidos de diagnóstico y los tratamientos combinados con artemisinina (2).
Las condiciones ideales para la proliferación del mosquito del género Anopheles que transmite el parásito por medio de su picadura son los territorios ubicados hasta los 1.600 metros sobre el nivel del mar con temperatura media de 25 °C, los climas cálidos y húmedos y las zonas con abundante vegetación selvática (3). El 85% del territorio colombiano reúne las condiciones ambientales que favorecen el desarrollo del vector y por ende la transmisión de la enfermedad (1).
La malaria en humanos puede ser causada por cinco especies: Plasmodium falciparum, P. vivax, P. malariae, P. ovale y P. knowlesi (4). Según el Informe mundial sobre el paludismo 2011 (5), en 2010 hubo 216 millones de casos y se produjeron unas 655.000 defunciones. En Colombia los casos de malaria son causados principalmente por P. falciparum y P. vivax; en el 2011 se notificaron 62.716 casos de malaria, de los cuales 46.188 (73,6%) correspondieron a P. vivax, 15.662 (25,0%) a P. falciparum, 841 (1,3%) a infecciones mixtas y 25 (0,04%) a P. malariae (6). Las regiones colombianas con mayor riesgo de transmisión de malaria son: Antioquia (43,3% de los casos), Córdoba (9,8%), Chocó (15,7%) Nariño (12,2%) y Bolívar (6,7%) (6), que representan más del 50% del territorio del país (7).
Una preocupación mundial importante sobre esta enfermedad es la transmisión de las madres a los fetos, dado que el parásito se puede alojar en la placenta (8). Las complicaciones asociadas a la malaria en el embarazo afectan tanto a la gestante como al crecimiento y desarrollo del embrión y el feto (9). Una vez infectada con el parásito, la gestante puede desarrollar malaria placentaria (10) porque los eritrocitos infectados por P. falciparum se pueden unir al sincitiotrofoblasto, lo que lleva al secuestro de parásitos en el espacio intervelloso y produce otras complicaciones como la presencia de pigmento malárico en dicho sincitio, el depósito fibrinoide intervelloso, la concentración de macrófagos en el espacio intervelloso y el engrosamiento de la lámina basal. El parásito se adhiere específicamente al receptor (condroitín-sulfato A, CSA) que se expresa en el sincitiotrofoblasto (11).
En Colombia, las infecciones por P. falciparum y P. vivax son altamente endémicas y no se tiene información oficial de la prevalencia de la infección en las mujeres gestantes (12); sin embargo, los efectos de esta infección son bien conocidos: la malaria en las embarazadas no inmunes produce tasas elevadas de aborto, hasta del 60% en el caso de la infección por P. falciparum, y tasas de mortalidad materna entre 10% y 50%, mientras que en las gestantes previamente inmunizadas la malaria puede producir abortos y bajo peso del niño al nacer (5).
La malaria en el embarazo plantea un reto diagnóstico por la baja especificidad de los signos y síntomas y por las infecciones submicroscópicas que son comunes durante él. Durante años se han utilizado métodos clásicos de microscopía como la gota gruesa, que es una técnica sencilla, económica y rápida, que permite la identificación de la especie del parásito. En condiciones óptimas, el límite de detección de la gota gruesa está entre 10 y 30 parásitos por µL de sangre, equivalentes a 0,001% de glóbulos rojos infectados (13). Por otra parte, requiere personal capacitado, en particular cuando las parasitemias son bajas en cuyo caso los resultados pueden ser falsos negativos (14).
Entre las alternativas diagnósticas para las especies de Plasmodium se han venido empleando métodos serológicos y de identificación de ácidos nucleicos (PCR); la técnica más usada es la PCR anidada. Su importancia radica en la alta sensibilidad (100%) y especificidad (97,1%) (15). Sin embargo, con ella no se obtienen resultados cuantitativos, es poco práctica cuando se requieren diagnósticos de urgencia y puede dar falsos positivos (14). Una variante de esta técnica es la PCR en tiempo real (RT-PCR) y su subvariante la PCR cuantitativa (qRT-PCR) que tiene el potencial de superar las restricciones de otras técnicas de PCR con mayores sensibilidad (entre 99,1% y 100%) y especificidad (entre 94,1% y 100%), mejor detección de niveles bajos de parasitemia y que, además, permite diferenciar entre especies cuando se presentan infecciones mixtas (16). Todas estas ventajas son esenciales para el tratamiento adecuado y el seguimiento del paciente. A esta técnica se le atribuyen otras ventajas sobre las demás como, por ejemplo: la qRT-PCR requiere un solo proceso técnico, mientras que la PCR anidada requiere por lo menos dos, uno de los cuales es la electroforesis en gel de agarosa; y la qRT-PCR se hace en un sistema cerrado lo que disminuye el riesgo de contaminación.
En algunos estudios, la qRT-PCR ha demostrado sensibilidad del 93,9% y especificidad del 100%. Otros autores han reportado valores más altos de sensibilidad: 96,6% (17), 98,5% (18) y 99,41% (19). Lo más promisorio de la técnica es la identificación de parásitos no detectados por la gota gruesa ni por la PCR anidada.
En zonas endémicas de malaria, la qRT-PCR permite identificar una alta proporción de las mujeres embarazadas con nivel de parasitemia por debajo del umbral de la microscopía, por lo que es útil para un diagnóstico correcto y sensible y mejora el tratamiento y el control de la enfermedad (20).
El objetivo del presente estudio fue comparar las ventajas de las técnicas de gota gruesa, PCR anidada y qRT-PCR, para diagnosticar infecciones submicroscópicas con Plasmodium falciparum y P. vivax, en mujeres embarazadas de una región endémica de alta transmisión de malaria en Colombia.
MATERIALES Y MÉTODOS
Tipo de estudio y ubicación geográfica
Estudio transversal y descriptivo en Puerto Libertador (09°14'17'' N y 75°43'33'' O), Córdoba, Colombia. Situado a 170 km de la capital departamental, Montería, con las siguientes características: extensión de 2.062 km2, altura 66 msnm, temperatura promedio de 27 °C y humedad relativa entre 80% y 86%. Este municipio se considera de alto riesgo para malaria porque concentra la mayoría de los casos que se presentan en el departamento de Córdoba (21).
Población
En el año 2011 se analizaron 21 mujeres provenientes de Puerto Libertador, incluyendo gestantes y no gestantes con signos y síntomas indicativos de la enfermedad, que consultaron a los puestos de salud de la zona y que dieron su consentimiento para participar en el estudio. Se utilizaron las siguientes muestras: sangre periférica y, en el caso de las gestantes, sangre de placenta y de cordón umbilical.
Recolección de las muestras
Las muestras para la gota gruesa se obtuvieron por punción con lanceta del pulpejo del dedo medio de la mano; posteriormente fueron fijadas en papel filtro (Whatman®) para extraer el ADN. Las muestras de sangre de la placenta y del cordón se tomaron igualmente impregnando papel de filtro a partir del cual se hizo posteriormente la extracción de ADN. Dicho papel se conservó a temperatura ambiente (28 °C a 32 °C), en gradillas separadas, en el sitio de toma de la muestra hasta su traslado al laboratorio.
Análisis de gota gruesa
La lectura de la gota gruesa la hizo, tan pronto como se obtuvo la muestra, una persona debidamente capacitada. El recuento de parásitos se hizo con base en 200 leucocitos y para informar la parasitemia por µL se empleó como valor de referencia 8.000 leucocitos. La muestra se consideró negativa cuando no se observaron formas del parásito en más de 200 campos microscópicos. Se repitió la lectura de la gota gruesa en el laboratorio del Grupo Salud y Comunidad de la Facultad de Medicina de la Universidad de Antioquia.
Extracción de ADN
La extracción del ADN se llevó a cabo con el protocolo de Sakihama y colaboradores (22), a partir de medio círculo de papel filtro impregnado con sangre total, equivalente a un volumen aproximado de 50 µL. Para la extracción se utilizó la resina de intercambio iónico Chelex al 20% (Chelex® 100-BioRad), de acuerdo con protocolos previamente publicados.
PCR anidada
Como blanco de amplificación, tanto para la PCR anidada como para la qRT-PCR, se seleccionó el gen de la subunidad 18S del ARN ribosomal puesto que contiene tanto regiones altamente conservadas como variantes y porque al menos cinco copias de este gen están distribuidas en diferentes cromosomas del genoma de Plasmodium (16).
La PCR convencional para la identificación de género se llevó a cabo de la siguiente manera: la mezcla máster contenía un tampón 1X, MgCl2 mM, dNTPs 125 µM, Taq ADN polimerasa 0,02 UI (Taq DNA Polymerase, QIAGEN®) y (0,1-10 ng) de ADN. Se utilizaron los oligonucleótidos PLU 5 y PLU 6 (tabla 1).
Después de preparar la mezcla patrón, se la llevó al termociclador con las siguientes condiciones: desnaturalización inicial a 95 °C por 5 minutos, seguida de 24 ciclos de 94 °C por 1 minuto, 58 °C por 2 minutos, 72 °C por 2 minutos, seguido de hibridación final de 58 °C por 2 minutos y extensión final de 72 °C por 2 minutos. Posteriormente, con los productos de esta PCR, se hizo una PCR múltiplex para la identificación de las especies P. vivax y P. falciparum; esta se llevó a cabo en las siguientes condiciones: tampón 1X, MgCl2 mM, dNTPs 125 µM, Taq ADN polimerasa 0,02 UI (Taq DNA Polymerase, QIAGEN®) y 3 µL de la reacción anterior. Se utilizaron los siguientes oligonucleótidos: FAL 1 y FAL 2 para P. falciparum, y VIV 1 y VIV 2 para P. vivax (tabla 1).
Las condiciones de la PCR fueron las siguientes: 95 °C por 5 minutos, seguido de 30 ciclos de 94 °C por 1 minuto, 58 °C por 2 minutos, 72 °C por 2 minutos, por último una hibridación final de 58 °C por 2 minutos y una extensión final de 72 °C por 5 minutos (23,24).
A continuación se hizo una electroforesis en gel de agarosa al 1% con el fluorocromo SYBR Green (SYBR® Green-Invitrogen) a una concentración de 535x/mL, para la identificación de los productos de la PCR. En esta se visualizaron los fragmentos de ácidos nucleicos mediante luz UV, lo que permite observar la presencia o ausencia de bandas de amplificación de los parásitos de malaria y de la especie correspondiente: P. falciparum y P. vivax.
PCR en tiempo real (RT-PCR)
El ADN se amplificó en un termociclador (Biorad CFX 96). Cada reacción se preparó en un volumen de 7,5 µL de Maxima SYBR Green/ROX qPCR Master Mix (2X) de Fermentas, 1 µL (0,1-10 ng) de ADN y 1,2 µL (0,4 µM) de cada cebador según el caso. Para la amplificación del género Plasmodium se emplearon los cebadores Plasmo F y Plasmo R. Para la de especies se utilizaron los siguientes: FAL F y FAL R para P. falciparum y VIV F y VIV R para P. vivax (tabla 1).
Las condiciones de la PCR consistieron en una desnaturalización inicial a 95 °C por 10 minutos, seguida de una amplificación de 40 ciclos de 94 °C por 30 segundos, 58 °C por 30 segundos y 72 °C por 30 segundos, con detección de la fluorescencia al final de cada ciclo. La amplificación fue seguida de una curva de temperatura media con un aumento gradual de la temperatura de 0,2 °C por dos segundos desde 65 °C hasta 90 °C.
Se estableció un corte de 35 ciclos para definir las muestras positivas para Plasmodium spp. Los análisis de las curvas de temperatura media (Tm) fueron útiles para verificar la especificidad de los oligonucleótidos (16).
Análisis estadístico
Se hizo un análisis estadístico con el programa EPIDAT (25) con una significancia estadística p <0,05 y un intervalo de confiabilidad de 95%, con el que se determinaron la sensibilidad y especificidad de la gota gruesa respecto a la PCR convencional y la RT-PCR. Posteriormente los resultados de la amplificación por RT-PCR se cuantificaron por qRT-PCR y se compararon las parasitemias entre gestantes y no gestantes, además de la carga parasitaria entre especies: P. falciparum y P. vivax, utilizando el programa Graphpad PRISM. La especificidad y sensibilidad se determinaron con EPIDAT, la prueba de referencia fue la PCR anidada.
En el programa GraphPad PRISM (versión 5,03) se aplicó la prueba de Mann-Whitney para determinar si existían diferencias entre muestras independientes. Para calcular el valor estadístico se obtuvieron los valores de U para cada una de las dos muestras Mann- Whitney. El programa estadístico asigna un nivel de significación para los valores de U, de acuerdo con este valor se rechaza o acepta la hipótesis nula con punto de corte p < 0,05 (26).
Consideraciones éticas
Este protocolo de investigación se rigió por lo dispuesto por el Ministerio de Salud Pública en la Resolución 8430 de 1993. Se informó a las pacientes acerca de las características generales del estudio y solo se incluyó en él a las que aceptaron participar voluntariamente. En todos los casos se obtuvo el consentimiento informado por escrito.
A las pacientes participantes en el estudio se les hizo diagnóstico gratuito de la infección por P. falciparum o P. vivax. Los tratamientos o exámenes adicionales fueron costeados por la EPS o el régimen de salud al que pertenecía la paciente.
RESULTADOS
Diagnóstico de malaria por gota gruesa
De las 21 muestras analizadas, 14 fueron positivas y 7 negativas para malaria. De las muestras positivas, 6 lo fueron para P. falciparum (P. f) y 8 para P. vivax (P. v) (tabla 2). El desarrollo de la prueba no presentó ninguna inconsistencia entre todas las muestras analizadas, tanto positivas como negativas.
PCR anidada
De las 21 muestras analizadas (gel no mostrado), 16 fueron positivas y 5 negativas para malaria (tabla 2). De las muestras positivas, 8 lo fueron para P. falciparum y 8 para P. vivax.
Dos muestras que fueron negativas por gota gruesa dieron positivas para P. falciparum por PCR anidada.
qRT-PCR
De 21 muestras analizadas por qRT-PCR, 16 fueron positivas y 5 negativas para malaria. De las muestras positivas, 8 lo fueron para P. falciparum y 8 para P. vivax (tabla 3).
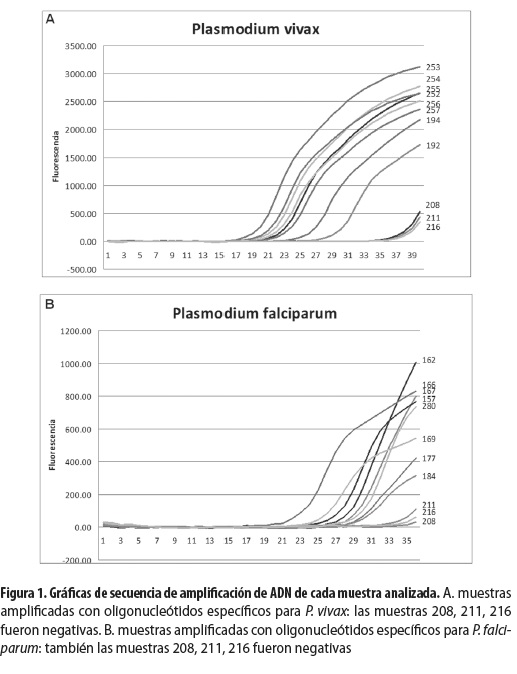
Además, dos de las muestras (de placenta y de sangre periférica de las pacientes 162 y 167, respectivamente), que fueron negativas por gota gruesa dieron positivas para P. falciparum por qRT-PCR. En las figuras 1 A y B se muestran los perfiles de amplificación del ADN tanto de P. vivax (A), como de P. falciparum (B). Se puede observar que las muestras de P. vivax (A) presentaron mayor amplificación en general, y que la gran mayoría en el ciclo 23 presentaban buena señal, mientras que las muestras de P. falciparum (B) fueron más tardías para amplificar, dado que la gran mayoría presentó buena señal en el ciclo 29. Las muestras 208, 211 y 216 probadas con los oligonucleótidos de P. vivax presentaron una señal débil después del ciclo 36 y se las consideró negativas (figura 1A). Las mismas muestras, 208, 211 y 216, probadas con los oligonucleótidos de P. falciparum presentaron una señal débil después del ciclo 34 y se las consideró negativas (figura 1B).
Análisis estadístico
Se cuantificó el ADN amplificado utilizando como gen interno de referencia uno de expresión constitutiva que codifica para la β-actina. Como se observó en los perfiles de la figura 1 de los qRT-PCR, se pudo cuantificar estos ADN, lo que permitió evidenciar la presencia de P. vivax y P. falciparum. Los valores promedio indican que la concentración (ng/ µL) de ADN es mayor en las muestras de P. vivax que en las de P. falciparum (gráfica y tabla de la figura 2A). La prueba estadística U de Mann-Whitney (GraphPad PRISM, versión 5.03) da un valor de probabilidad p = 0,003, que muestra una diferencia significativa entre las dos especies. Comparando la concentración de ADN de las pacientes con malaria comprobada (cinco muestras de gestantes y once de no gestantes), se observó en promedio mayor concentración en las muestras de las no gestantes. En este caso la prueba estadística de Mann-Whitney dio un valor de p = 0,0127, que revela una diferencia significativa entre los dos grupos de muestras, pero el número de muestras no fue equivalente (gráfica de la figura 2B). El bajo nivel de concentración de ADN de las gestantes con malaria se asoció a parasitemias muy bajas (2 ng/µL o menos) después de 40 ciclos de amplificación.
Como se observa en la tabla de la figura 2B, las dos muestras de placenta y de sangre periférica que no se detectaron por gota gruesa de las pacientes 162 y 167 permitieron amplificar 1,2 y 1,4 ng/µL después de 40 ciclos. La concentración de ADN obtenida para la amplificación de estas dos muestras se determinó en un orden de magnitud de fentogramos (fg/µL), lo que correspondería a concentraciones de mínimo un parásito o ''menos'' (ADN remanente sin parásito detectables).
Se evaluaron por EPIDAT la sensibilidad y especificidad de la gota gruesa respecto a la PCR anidada y la qRT-PCR, teniendo estas dos últimas como pruebas de referencia. Según el análisis, la sensibilidad de la gota gruesa para detectar la presencia de P. vivax fue del 100%. Igualmente, en la especificidad se obtuvo un 100% para todas las técnicas. Por otra parte, para la detección de P. falciparum la gota gruesa tuvo un 75% de sensibilidad.
DISCUSIÓN
Durante el embarazo, la mayoría de las infecciones maláricas (parasitemias periféricas) llevan a que la placenta contenga una gran cantidad de glóbulos rojos parasitados (27); esto, sumado a las manifestaciones y consecuencias dependientes de las variables epidemiológicas, al grado de exposición al parásito, a la paridad y la respuesta inmune de la madre, puede generar cambios en la integridad de la placenta, reducción del transporte de nutrientes y oxígeno, retardo en el crecimiento intrauterino, abortos y bajo peso al nacer (28,29); por tal motivo, para reducir el riesgo para el embrión y el feto es prioritario diagnosticar precozmente la malaria por técnicas rápidas como las microscópicas e inmunológicas o por otras modernas y eficaces, como las moleculares (PCR).
Algunos de estos métodos para la detección del parásito en pacientes con malaria gestacional ya han sido estandarizados con buena fidelidad, pero usarlos es muy costoso por la necesidad de una infraestructura bastante compleja, por ejemplo, del antígeno HRP2; además, se precisa el conocimiento cabal de la técnica (30). Lo mismo sucede con la prueba de PCR anidada, que ha demostrado ser exitosa en todo el mundo (31) incluida Colombia (14). Algunos estudios han establecido con PCR anidada un límite de detección de 3 a 4 parásitos por µL de sangre (0,0005% a 0,0015% de glóbulos rojos infectados), con sensibilidad de 100% y especificidad entre 94,1% y 100% (14). Sin embargo, con esta técnica no se obtienen resultados cuantitativos, es poco práctica cuando se requieren diagnósticos de urgencia y puede dar falsos positivos (32). Además, un estudio llevado a cabo en el 2008 en diferentes regiones endémicas de Colombia determinó que la PCR anidada podía mostrar sensibilidad del 100% (IC95%: 99,2%-100%) y especificidad del 97,1% (IC95%: 90,2%-100%) comparada con la gota gruesa (14). Para el caso particular del diagnóstico de malaria gestacional, Campos y colaboradores (12) demostraron que la PCR anidada tenía sensibilidad del 47% y especificidad del 77%. En este estudio la PCR anidada resultó ser eficiente para la detección de dos muestras no diagnosticadas por gota gruesa. Salvo la positividad o negatividad, no se puede obtener mayor información de la PCR anidada comparada con la gota gruesa que permite calcular la parasitemia del paciente.
La RT-PCR permite cuantificar el ADN, por lo que se la llama PCR cuantitativa (qRT-PCR). Esta técnica ya es convencional para el diagnóstico de varios agentes infecciosos (33), empleando sondas y oligonucleótidos específicos. Ya se ha estandarizado el uso de la qRT-PCR en el diagnóstico de malaria, especialmente para P. falciparum, P. vivax y P. ovale (16) y se ha demostrado su alta eficiencia frente a la gota gruesa (34). En algunos estudios de alcance mundial la qRT-PCR ha mostrado sensibilidad del 93,9% y especificidad del 100%. Otros autores han informado valores de sensibilidad del 96,6% (17), 98,5% (18) y 99,4% (19). Igualmente, se ha evidenciado que la qRT-PCR es más sensible que la gota gruesa para el diagnóstico de la malaria convencional (35). En un estudio reciente hecho en Córdoba, Colombia, se halló sensibilidad de la qRTPCR del 93% y especificidad del 100% (36). En el presente trabajo la sensibilidad de la qRT-PCR fue mayor que la de la gota gruesa y permitió la cuantificación del ADN gracias al uso de un gen de expresión constitutiva (β-actina), que posibilitó efectuar la RT-PCR y la qRT-PCR; básicamente, las dos técnicas son una sola cuando se puede hacer la cuantificación. Abundan las terminologías de abreviación usadas por otros autores como RT-qPCR (37) o qRT-PCR (34) y esto solo para el caso de malaria. Para evitar la confusión es necesario unificar las abreviaciones que hacen referencia a estas técnicas.
La qRT-PCR mostró que la parasitemia de las gestantes es muchísimo más baja, sea con P. vivax o con P. falciparum, que la de mujeres no gestantes (figura 2B). En el caso de las pacientes 162 y 167, la concentración de parásitos fue muy baja por lo que se requirió una observación más exhaustiva de la gota gruesa (más allá de 200 campos), para encontrar por lo menos un microorganismo; si hubiera sido menor de un parásito por µL, o cuando no se encuentran células del parásito (ADN remanente) (16), la única forma de detectarlo habría sido la qRT-PCR, como sucedió en el presente estudio.
El diagnóstico de malaria en dos muestras (162 y 167) negativas por gota gruesa pone de presente la importancia de usar métodos diagnósticos más sensibles, debido a que las técnicas convencionales pueden no detectar estas infecciones submicroscópicas; un estudio hecho en África halló que la parasitemia en sangre periférica identificada por gota gruesa varió entre 7,3% y 29% y por PCR, entre 6,7% y 85% (10). Además, en este mismo estudio la parasitemia en placenta varió entre 1,7% y 35% con microscopía y entre 41,7% y 59% con PCR (10). Estudios similares en Colombia han descrito una prevalencia de malaria gestacional del 10,4%, con persistencia de la infección en el momento del parto en 19% (gota gruesa) y en 30% (PCR anidada) de las gestantes infectadas (38), lo que evidencia la importancia de precisar la frecuencia de las infecciones microscópicas, que se calcula entre 20% y 58%, y submicroscópicas que es aproximadamente del 36% por gota gruesa y el 52% por PCR anidada (38).
Lo anterior evidencia que la infección por Plasmodium con parasitemias por debajo del nivel de detección microscópica (submicroscópica: negativo por microscopía y positivo por PCR u otra técnica) es muy frecuente en las gestantes de regiones endémicas no solo en África, sino también en Suramérica. Estas infecciones durante la gestación pueden jugar un papel crucial en la estimulación del sistema inmune contra la malaria y favorecer los efectos adversos sobre el feto en gestación, tal como lo indican Arango y colaboradores (38). Se observa además que los niveles de parasitemia en las infecciones por P. falciparum son más bajos que los de aquellas por P. vivax, un factor que puede estar influyendo en la capacidad de la gota gruesa para detectar la primera de estas especies, y que se debe considerar en futuros estudios.
La qRT-PCR puede ser una técnica complementaria de la gota gruesa para el diagnóstico de malaria (39), pero para los casos submicroscópicos de malaria gestacional es una técnica esencial para el diagnóstico correcto y oportuno más que una técnica confirmatoria. Al comparar la prueba microscópica con las pruebas moleculares, se observa un mayor grado de sensibilidad de estas últimas para la detección de P. falciparum (40).
Con los datos obtenidos en este estudio no es posible afirmar que la gota gruesa sea menos sensible o específica que las pruebas moleculares, pero sí es claro que con estas últimas se logra una excelente detección de las especies de Plasmodium. Igualmente, la qRT-PCR se muestra bastante sensible para detectar bajas concentraciones de P. falciparum. Sin ser concluyente, esta información coincide con la obtenida de datos epidemiológicos y clínicos en la región de Córdoba, Colombia, en donde la parasitemia por P. vivax es mayor que la debida a P. falciparum.
Teniendo en cuenta este panorama (alta frecuencia de infección submicroscópica), las pruebas más sensibles serían complementarias y útiles para el diagnóstico eficiente y más aún para el tratamiento y la prevención de los efectos adversos que puede sufrir el feto en su desarrollo en presencia de Plasmodium spp.
AGRADECIMIENTOS
Al Hospital Regional de Puerto Libertador y a su personal médico y asistencial. Al proyecto Gametocitos, financiado por Colciencias (N° 1115-493-26134), que permitió la recolección de muestras. Al CONADI de la Universidad Cooperativa por la financiación del proyecto de PCR cuantitativa (N° J76); al doctor Jaime Carmona por su asesoría en la parte estadística. A Eliana Arango y Olga Agudelo, por la capacitación del personal de los hospitales en la toma de las muestras, y su participación durante el proceso recolección de las mismas; al grupo de Inmunovirología de la Universidad de Antioquia por el procesamiento de ellas; a la Vicerrectoría de Investigación de la Universidad de Antioquia por el apoyo Estrategia para Sostenibilidad 2013-2014, consecutivo 01740.
REFERENCIAS BIBLIOGRÁFICAS
1. Organización Panamericana de la Salud OPS/ OMS, Convenio de Cooperación Técnica con el Ministerio de la Protección Social Nro. 256 de 2009 y Nro. 237 de 2010. Guía para Atención Clínica Integral del paciente con malaria. Bogotá: Ministerio de Protección Social; 2010. [ Links ]
2. Guerin PJ, Olliaro P, Nosten F, Druilhe P, Laxminarayan R, Binka F, et al. Malaria: current status of control, diagnosis, treatment, and a proposed agenda for research and development. Lancet Infect Dis. 2002 Sep;2(9):564–73. [ Links ]
3. World Health Organization. World Malaria Report. Geneva: WHO Press; 2008. [ Links ]
4. Cox-Singh J, Davis TME, Lee K-S, Shamsul SSG, Matusop A, Ratnam S, et al. Plasmodium knowlesi malaria in humans is widely distributed and potentially life threatening. Clin Infect Dis. 2008;46(2):165–71. [ Links ]
5. Organización Mundial de la Salud. Informe Mundial sobre el Paludismo [Internet]. Paludismo. 2011 [Consultado en septiembre 2012]. Tomado de: http://www.who.int/malaria/world_malaria_report_2011/es/ [ Links ]
6. Instituto Nacional de Salud. Boletín vigilancia de la malaria en Colombia 2-2012. Boletín Paludismo. Bogotá; 2012 ene. [ Links ]
7. Carmona Fonseca J. La malaria en Colombia, Antioquia y las zonas de Urabá y Bajo Cauca: panorama para interpretar la falla terapéutica antimalárica. Parte 2. Iatreia. 2004;17(1):34–53. [ Links ]
8. Elbashir HM, Salih MM, Elhassan EM, Mohmmed AA, Elbashir MI, Adam I. Polymerase chain reaction and histology in diagnosis of placental malaria in an area of unstable malaria transmission in Central Sudan. Diagn Pathol. 2011;6:128. [ Links ]
9. Matteelli A, Caligaris S, Castelli F, Carosi G. The placenta and malaria. Ann Trop Med Parasitol. 1997;91(7):803–10. [ Links ]
10. Uneke CJ. Impact of placental Plasmodium falciparum malaria on pregnancy and perinatal outcome in sub-Saharan Africa: I: introduction to placental malaria. Yale J Biol Med. 2007;80(2):39–50. [ Links ]
11. Ho M, White NJ. Molecular mechanisms of cytoadherence in malaria. Am J Physiol. 1999;276(6 Pt 1):C1231–42. [ Links ]
12. Campos IM, Uribe ML, Cuesta C, Franco-Gallego A, Carmona-Fonseca J, Maestre A. Diagnosis of gestational, congenital, and placental malaria in Colombia: comparison of the efficacy of microscopy, nested polymerase chain reaction, and histopathology. Am J Trop Med Hyg. 2011;84(6):929–35. [ Links ]
13. Perandin F, Manca N, Piccolo G, Calderaro A, Galati L, Ricci L, et al. Identification of Plasmodium falciparum, P. vivax, P. ovale and P. malariae and detection of mixed infection in patients with imported malaria in Italy. New Microbiol. 2003;26(1):91–100. [ Links ]
14. Lima GFMC, Levi JE, Geraldi MP, Sanchez MCA, Segurado AAC, Hristov AD, et al. Malaria diagnosis from pooled blood samples: comparative analysis of realtime PCR, nested PCR and immunoassay as a platform for the molecular and serological diagnosis of malaria on a large-scale. Mem Inst Oswaldo Cruz. 2011 Sep;106(6):691–700. [ Links ]
15. Montoya AE, Menco J, Osorio N, Zuluaga MA, Duque J, Torres G, et al. Concordance between thick blood smear, immunochromatography and polymerase chain reaction for malaria diagnosis. Biomedica. 2008;28(2):252–61. [ Links ]
16. Mangold KA, Manson RU, Koay ESC, Stephens L, Regner M, Thomson RB, et al. Real-time PCR for detection and identification of Plasmodium spp. J Clin Microbiol. 2005;43(5):2435–40. [ Links ]
17. Boonma P, Christensen PR, Suwanarusk R, Price RN, Russell B, Lek-Uthai U. Comparison of three molecular methods for the detection and speciation of Plasmodium vivax and Plasmodium falciparum. Malar J. 2007;6:124. [ Links ]
18. Han E-T, Watanabe R, Sattabongkot J, Khuntirat B, Sirichaisinthop J, Iriko H, et al. Detection of four Plasmodium species by genus- and species-specific loop-mediated isothermal amplification for clinical diagnosis. J Clin Microbiol. 2007;45(8):2521–8. [ Links ]
19. Khairnar K, Martin D, Lau R, Ralevski F, Pillai DR. Multiplex real-time quantitative PCR, microscopy and rapid diagnostic immuno-chromatographic tests for the detection of Plasmodium spp: performance, limit of detection analysis and quality assurance. Malar J. 2009;8:284. [ Links ]
20. Mayor A, Serra-Casas E, Bardají A, Sanz S, Puyol L, Cisteró P, et al. Sub-microscopic infections and long-term recrudescence of Plasmodium falciparum in Mozambican pregnant women. Malar J. 2009;8:9. [ Links ]
21. Aristizabal D, Mejía I, Pedroza CE, Cárdenas M, Bolaños C, Ballesteros VL. Reporte de la situación de malaria en los 45 municipios priorizados del proyecto ''Malaria Colombia'' Años 2010 – 2011 – 2012. Bogotá: Mecanismo Coordinador de País (MCP); 2013. [ Links ]
22. Sakihama N, Mitamura T, Kaneko A, Horii T, Tanabe K. Long PCR amplification of Plasmodium falciparum DNA extracted from filter paper blots. Exp Parasitol. 2001;97(1):50–4. [ Links ]
23. Ausubel FM, Brent R, Kingston RE, Moore DD, Seidman JG, Smith JA, et al., editors. Current Protocols in Molecular Biology. Hoboken: John Wiley & Sons, Inc.; 2001. [ Links ]
24. Ljungström I, Perlmann H, Schlichtherle M, Scherf A, Wahlgren M. Methods in malaria research. 4th ed. Virginia: Manassas;2004. [ Links ]
25. Hervada-Vidal X, Santiago-Pérez MI, Vázquez- Fernández E, Castillo-Salgado C, Loyola-Elizondo E, Silva-Ayçaguer LC. Epidat 3.0 programa para análisis epidemiológico de datos tabulados. Rev Esp Salud Pública. 2004; 78(2):277-80. [ Links ]
26. Barrios Zamudio E, García Pérez JÁ. Formulario y Tablas de Probabilidad para el Curso de Estadística I. México D.F: Instituto Tecnológico Autónomo de México; 2009. [ Links ]
27. Brutus L. El paludismo en mujeres embarazadas. En: Consultoría '' Malaria y Embarazo ''. Tegucigalpa; 2006. p. 4. [ Links ]
28. Nosten F, McGready R, Simpson JA, Thwai KL, Balkan S, Cho T, et al. Effects of Plasmodium vivax malaria in pregnancy. Lancet. 1999;354(9178):546–9. [ Links ]
29. Singh N, Shukla MM, Sharma VP. Epidemiology of malaria in pregnancy in central India. Bull World Health Organ. 1999;77(7):567–72. [ Links ]
30. Gobernación de Córdoba. Reporte Epidemiológico de Córdoba (RECORD): Unidad de Vigilancia en Salud Pública. Boletín Epidemiológico de Córdoba, n° 393, (03 de mayo 2010) [ Links ].
31. Kyabayinze DJ, Tibenderana JK, Nassali M, Tumwine LK, Riches C, Montague M, et al. Placental Plasmodium falciparum malaria infection: operational accuracy of HRP2 rapid diagnostic tests in a malaria endemic setting. Malar J. 2011;10:306. [ Links ]
32. Kolaczinski J, Mohammed N, Ali I, Ali M, Khan N, Ezard N, et al. Comparison of the OptiMAL rapid antigen test with field microscopy for the detection of Plasmodium vivax and P. falciparum: considerations for the application of the rapid test in Afghanistan. Ann Trop Med Parasitol. 2004;98(1):15–20. [ Links ]
33. Lima GFMC, Levi JE, Geraldi MP, Sanchez MCA, Segurado AAC, Hristov AD, et al. Malaria diagnosis from pooled blood samples: comparative analysis of real-time PCR, nested PCR and immunoassay as a platform for the molecular and serological diagnosis of malaria on a large-scale. Mem Inst Oswaldo Cruz. 2011;106(6):691–700. [ Links ]
34. Espy MJ, Uhl JR, Sloan LM, Buckwalter SP, Jones MF, Vetter EA, et al. Real-time PCR in clinical microbiology: applications for routine laboratory testing. Clin Microbiol Rev. 2006;19(1):165–256. [ Links ]
35. Bourgeois N, Boutet A, Bousquet P-J, Basset D, Douard-Enault C, Charachon S, et al. Comparison of three real-time PCR methods with blood smears and rapid diagnostic test in Plasmodium sp. infection. Clin Microbiol Infect. 2010;16(8):1305–11. [ Links ]
36. Taylor BJ, Martin KA, Arango E, Agudelo OM, Maestre A, Yanow SK. Real-time PCR detection of Plasmodium directly from whole blood and filter paper samples. Malar J. 2011;10:244. [ Links ]
37. Runsewe-Abiodun IT, Efunsile M, Ghebremedhin B, Sotimehin AS, Ajewole J, Akinleye J, et al. Malaria diagnostics: a comparative study of blood microscopy, a rapid diagnostic test and polymerase chain reaction in the diagnosis of malaria. J Trop Pediatr. 2012;58(2):163–4. [ Links ]
38. Arango E, Maestre A, Carmona-Fonseca J. Effect of submicroscopic or polyclonal Plasmodium falciparum infection on mother and gestation product: systematic review. Rev Bras Epidemiol. 2010; 13(3):373–86. [ Links ]
39. Khairnar K, Martin D, Lau R, Ralevski F, Pillai DR. Multiplex real-time quantitative PCR, microscopy and rapid diagnostic immuno-chromatographic tests for the detection of Plasmodium spp: performance, limit of detection analysis and quality assurance. Malar J. 2009;8:284. [ Links ]
40. Fuehrer H-P, Fally MA, Habler VE, Starzengruber P, Swoboda P, Noedl H. Novel nested direct PCR technique for malaria diagnosis using filter paper samples. J Clin Microbiol. 2011;49(4):1628–30. [ Links ]