Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.27 no.3 Medellín July/Sept. 2014
ARTÍCULO DE REVISIÓN
Desensibilización al ácido acetil-salicílico como tratamiento para la enfermedad respiratoria exacerbada por antiinflamatorios no esteroides
Desensitization to acetyl-salicylic acid as a treatment for non-steroid anti-inflammatory drugs (NSAIDs)-exacerbated respiratory disease
Ricardo Cardona Villa1; Libia Susana Díez Zuluaga2; Ruth Elena Ramírez Giraldo3; Jorge Mario Sánchez Caraballo4
1 Alergólogo Clínico, Magíster en Inmunología. Grupo de Alergología Clínica y Experimental. Universidad de Antioquia, Medellín, Colombia. ricardona@une.net.co
2 Alergóloga Clínica, Grupo de Alergología Clínica y Experimental. Universidad de Antioquia, Medellín, Colombia.
3 Alergóloga Clínica, Pediatra, Grupo de Alergología Clínica y Experimental. Universidad de Antioquia, Medellín, Colombia.
4 Alergólogo Clínico, Magíster en Inmunología. Grupo de Alergología Clínica y Experimental. Universidad de Antioquia, Medellín, Colombia. jotamsc@yahoo.com
Recibido: septiembre 06 de 2013
Aceptado: diciembre 02 de 2013
RESUMEN
La coexistencia de hipersensibilidad al ácido acetil salicílico (ASA) y a otros antiinflamatorios no esteroides (AINE) con enfermedad de la vía aérea superior (rinosinusitis/poliposis nasosinusal) o inferior (asma) se denomina enfermedad respiratoria exacerbada por ASA (EREA). Las opciones de tratamiento incluyen la evitación de todos los analgésicos inhibidores de la ciclooxigenasa 1 (COX-1) o la desensibilización a ASA, continuando su consumo diario. Esta última opción terapéutica ha demostrado mejorar la calidad de vida, reducir la formación de pólipos nasosinusales, los episodios de sinusitis infecciosa, la frecuencia de las hospitalizaciones y de las cirugías para resección de pólipos; también mejora la hiposmia y reduce la necesidad de tratamiento con esteroides sistémicos. Se han usado múltiples esquemas de desensibilización, tratando de reducir el riesgo asociado con el procedimiento y los efectos adversos derivados del consumo crónico de ASA. En este artículo se presentan una revisión de los diferentes esquemas de desensibilización y dos casos clínicos ilustrativos que sirven de ejemplo para comprender mejor los factores que influyen en la elección del tratamiento para los pacientes con esta enfermedad.
PALABRAS CLAVE
Alérgeno, Inmunoterapia, Medicamentos, Reacción Adversa al Medicamento
SUMMARY
The coexistence of hypersensitivity to acetylsalicylic acid (ASA) and other NSAIDs with disease of the upper or the lower airways (rhinosinusitis/sinonasal polyposis, or asthma) is defined as NSAIDs-exacerbated respiratory disease. Treatment options include the avoidance of all analgesics that inhibit COX-1 or ASA desensitization, continuing its daily consumption. The latter treatment has shown to improve quality of life, reduce the formation of sinonasal polyps, the episodes of sinus infection, the frequency of hospitalizations and surgeries for resection of polyps and the need for systemic steroid treatment. Multiple desensitization schedules have been used, trying to reduce the risk associated with the procedure and the adverse effects of chronic use of ASA. In this paper we present a review of the different methods of desensitization and two illustrative clinical cases to help understand the factors that influence the choice of treatment for these patients.
KEY WORDS
Allergen, Immunotherapy, Drugs, Drug Adverse Reaction
INTRODUCCIÓN
Las propiedades médicas de los salicilatos se conocen desde hace aproximadamente 2.400 años, cuando Hipócrates los obtuvo de la corteza de los sauces y los usó por sus propiedades analgésicas y antipiréticas. Los reportes de los efectos adversos empezaron en 1902, solo tres años después de que la aspirina fuera lanzada al mercado por Bayer; en 1902 Hirschberg describió el primer caso de angioedema y urticaria grave después de la ingestión de aspirina (1).
La enfermedad respiratoria exacerbada por antiinflamatorios no esteroides (EREA) se conoció previamente como la tríada de la aspirina, la tríada del asma, el síndrome de Samter Widal o el asma intolerante al ácido acetil-salicílico (ASA) (2-5). Algunos estudios han determinado que la EREA afecta del 0,3 al 0,9% de la población general y que este porcentaje es más alto dependiendo de la enfermedad subyacente; es del 3% al 11% en adultos asmáticos y alrededor del 25% en los pacientes con asma y poliposis nasosinusal (6). En otros estudios la prevalencia varía de acuerdo con la metodología utilizada: entre 11% y 20% mediante cuestionarios, 3% en las historias clínicas y 21% si se hacen pruebas de provocación (7).
Esta enfermedad rara vez afecta a adolescentes y niños; los síntomas comienzan generalmente entre la tercera y cuarta décadas de la vida y tienen predilección por el sexo femenino (3 mujeres por 2 hombres), pero no predilección racial. No es frecuente que los pacientes tengan un antecedente familiar (8).
El diagnóstico de la EREA se confirma mediante un reto oral controlado con ASA, que se considera el estándar de oro, pero encierra el riesgo de exacerbar los síntomas respiratorios o inducir anafilaxia por lo que se han propuesto alternativas diferentes (9-12).
Las opciones de tratamiento para la EREA son: la evitación de todos los analgésicos inhibidores de la COX-1 y la desensibilización al ASA mediante su consumo diario a largo plazo (5). Muchos estudios han demostrado que en los pacientes con EREA la desensibilización y el tratamiento diario con ASA pueden mejorar la calidad de vida y reducir la formación de pólipos nasales, la frecuencia de infecciones sinusales y la de hospitalizaciones, el número de cirugías para la resección de los pólipos, el consumo de esteroides sistémicos y, además, mejorar la hiposmia (8,13-15).
Desde hace varios años nuestro grupo ha venido trabajando en la desensibilización con ASA (16) y a continuación presentaremos una revisión del tema y discutiremos dos casos clínicos ilustrativos en los que se presentaron situaciones complejas en el momento de decidir si la desensibilización era necesaria o no.
FISIOPATOLOGÍA
Se ha propuesto que el factor central en la EREA es la infiltración eosinofílica tisular de las vías aéreas superior e inferior. Se han demostrado niveles séricos aumentados de interleucina 5 (IL-5) y factor estimulante de colonias de granulocitos y macrófagos (GM-CSF) en biopsias bronquiales de estos pacientes (17,18). También se ha visto en estas muestras un número aumentado de eosinófilos y mastocitos cuando se comparan con biopsias de pacientes asmáticos que toleran el ASA. Están elevados los niveles de citocinas proinflamatorias sintetizadas por células epiteliales y linfocitos Th2 activados. Estas incluyen IL-2, IL-3, IL-4, IL-5, IL-13, GM-CSF y eotaxina. Las citocinas IL-3, IL-4, IL-5, IL-13 y GM-CSF reclutan eosinófilos y les aumentan la supervivencia al inhibir la apoptosis (19).
Los AINE bloquean la vía de la ciclooxigenasa y hacen que los sustratos del ácido araquidónico se deriven la vía de la 5-lipooxigenasa en la que se producen leucotrienos (LT) como LT-A4, LT-B4 y cisteinil leucotrienos (Cys-LT) como LT-C4/D4/E4. La LTC4 sintetasa es la enzima terminal en la producción de Cys-LT y está marcadamente sobreexpresada en eosinófilos y mastocitos de la mucosa de la vía aérea de pacientes con EREA, y los eosinófilos circulantes contienen más mARN (ARN mensajero) para LTC4 sintetasa. Las biopsias bronquiales revelan un aumento cuádruple de los LT en comparación con pacientes asmáticos tolerantes a ASA y las concentraciones basales de Cys-LT medidas en el lavado broncoalveolar de pacientes con EREA se correlacionan bien con el recuento de células productoras de LTC4 sintetasa en la mucosa bronquial (20).
Las manifestaciones clínicas producidas por el aumento de los Cys-LT incluyen broncoconstricción, aumento de la permeabilidad vascular y de la secreción de moco, reclutamiento de eosinófilos, hipertrofia del músculo liso y depósito de colágeno. Las acciones biológicas de los Cys-LT se llevan a cabo a través de sus receptores, CysLTR1 y CysLTR2, localizados sobre la superficie de las células inflamatorias. Se demostró que el número de células que expresan CysLTR1 en la mucosa nasal fue significativamente más alto en pacientes con EREA que en aquellos tolerantes a ASA sugiriendo que el aumento en la respuesta de las células inflamatorias a los Cys-LT se debe a la sobreexpresión de CysLTR1. También se ha sugerido que el efecto de los Cys-LT sobre las glándulas y el epitelio puede ser mediado por los CysLTR2 (17,21).
La enzima ciclooxigenasa (COX) existe en al menos dos isoformas: COX 1 y COX 2. En pacientes con EREA se ha identificado una gran disminución en la expresión de la COX 2 en tejido de pólipos nasales sugiriendo pérdida de la regulación de dicha enzima en estos pacientes. La producción basal de prostaglandina E2 (PGE2) por células epiteliales de la nariz es más baja en pacientes con EREA lo cual se observó después de la exposición a ASA; ello sugiere que el epitelio de los pólipos nasales de estos pacientes tiene un defecto intrínseco en su capacidad de generar PGE2 (22). También se ha visto una baja producción de PGE2 en células sanguíneas periféricas y en cultivos de fibroblastos de pacientes con rinitis intolerantes a ASA. Más aún, una baja producción de PGE2 en el músculo de la vía aérea se acompañó de una baja regulación en la expresión de mARN para COX 2. Lo anterior sugiere que los AINE pueden agotar esta prostaglandina protectora en asociación con la pérdida de la regulación de la COX-2 (23,24).
Otra vía estudiada en pacientes con EREA es la producción del ácido 15 hidroxieicosatetraenoico (15-HETE), por la vía de la 15 lipooxigenasa, y se ha informado que la producción de este ácido por leucocitos de sangre periférica es 3,6 veces más alta en pacientes con EREA después de la exposición a ASA. Las actividades proinflamatorias del 15-HETE son la estimulación de mediadores inflamatorios de mastocitos, la inducción de la secreción de moco en la vía aérea y la contracción del músculo liso bronquial (25). Sin embargo, también tiene actividades antiinflamatorias incluyendo la inhibición de la actividad de la 5 lipooxigenasa, la generación de LT-B4 en leucocitos y la producción de lipoxinas que inhiben la quimiotaxis de eosinófilos (26).
Las lipoxinas, derivados antiinflamatorios del ácido araquidónico, se producen por la vía de la 15 lipooxigenasa, y se comportan como antagonistas funcionales de leucotrienos. La producción de lipoxinas está disminuida en pacientes con EREA comparados con aquellos tolerantes a ASA. La acción incrementada de los Cys-LT se puede atribuir a la disminución de la capacidad para la síntesis de lipoxinas como un factor que contribuye al curso clínico de la enfermedad (27).
Se han relacionado alelos específicos del HLA con la intolerancia a ASA. El HLA-DPB1 0301 se ha relacionado con el asma inducida por ASA y el HLA-DRB1 1302 o el HLA-DQB1 0609 se han asociado con urticaria inducida por ASA (28). Polimorfismos simples de nucleótidos en genes que codifican para enzimas del metabolismo del ácido araquidónico se han asociado con EREA y urticaria inducida por ASA (29,30).
PRUEBAS DE PROVOCACIÓN CON ASA
Es muy importante establecer el diagnóstico de hipersensibilidad a AINE debido a que así se puede proveer al paciente de una lista de medicamentos que pueden ser de alto riesgo para una reacción potencialmente grave o amenazante de la vida y para poder continuar con el estudio de analgésicos de uso más seguro (31,32).
Las provocaciones con ASA están indicadas en personas con una historia previa de reacciones de hipersensibilidad a este medicamento o a otro AINE o cuando se sospecha asma, rinitis o urticaria inducidas por estos medicamentos (33).
Para el diagnóstico de la intolerancia o alergia a AINE no hay estudios in vitro fácilmente disponibles en todos los centros de alergia y las pruebas cutáneas no están validadas para la mayoría de estos medicamentos; por ello, el diagnóstico se debe establecer por la historia clínica y por pruebas de provocación controladas que constituyen el estándar de oro.
Se han informado cuatro vías diferentes de provocación con ASA: oral, bronquial, nasal e intravenosa (34,35). La historia de estos procedimientos se remonta a principios de los años 70 cuando se introdujo en la práctica clínica el reto oral con ASA (36,37), que se validó y usó con mayor frecuencia en los años siguientes (38).
Las provocaciones nasales se introdujeron a finales de los años 80 (9,39) y su uso se ha popularizado, pese a su menor sensibilidad, por su mayor seguridad ya que usualmente no producen reacciones sistémicas y por la facilidad para hacerlas. Esta modalidad se recomienda principalmente para los pacientes con síntomas nasales predominantes y para aquellos en quienes los retos orales o inhalatorios están contraindicados por la gravedad del asma. Dado que el valor predictivo negativo es más bajo que el de las otras pruebas, un reto nasal negativo debe ser seguido por un reto oral cuando sea posible. La sensibilidad y especificidad del reto oral con ASA son del 89% y 93%, respectivamente (40). Los retos nasales con Lisina- ASA (L-ASA) tienen sensibilidad del 80%, especificidad del 92,5%, valor predictivo positivo del 84,2% y valor predictivo negativo del 78,6 al 89,2% (41,42).
Desde el año 2006 se iniciaron estudios para la validación de un test de provocación nasal con ketorolaco en reemplazo de la L-ASA dado que esta última no está ampliamente disponible en América; esta prueba ha demostrado sensibilidad del 78% y especificidad del 64% (12); ha sido aplicada para modificar los procedimientos de desensibilización iniciando con retos intranasales con ketorolaco y continuando con la administración oral de ASA; ha demostrado ser un procedimiento más seguro por disminuir el porcentaje de reducción del volumen espiratorio forzado en el primer segundo (VEF1) y las reacciones extrapulmonares; además, es más práctica y requiere menos tiempo que los retos orales convencionales (11).
Antes de hacer un reto con ASA es importante discutir con el paciente los riesgos y beneficios del procedimiento y documentar dicha discusión en la historia clínica. Además, obtener el consentimiento informado.
Un reto se considera positivo cuando hay disminución del VEF1 de 15% con respecto al nivel basal o reacciones nasooculares o dermatológicas significativas, en cuyo caso se suspende el procedimiento o se continúa tras estabilizar el paciente si la intención es hacerle una desensibilización consecutiva (43).
El reto controlado con ASA debe estar a cargo de un médico entrenado en alergología, en condiciones que garanticen la seguridad del paciente, a saber: equipo de monitorización, dispositivos que permitan evaluar las reacciones, equipo de resucitación y todos los elementos indicados para el manejo de las posibles reacciones.
La condición clínica del paciente antes de la provocación debe ser estable, con una espirometría previa que demuestre más del 70% del VEF1 predicho y más de 1,5 L; se debe tener la precaución de suspender los medicamentos que puedan llevar a un falso negativo. En cuanto a los antagonistas de los leucotrienos, las guías europeas sugieren suspenderlos una semana antes del procedimiento, pero las guías americanas desaconsejan la suspensión argumentando que no interfieren con el resultado de la prueba y evitan reacciones graves (33,43). Nosotros aconsejamos suspender estos medicamentos, pero consideramos que la condición clínica de algunos pacientes hace necesario continuarlos.
Las contraindicaciones para un reto con ASA son: las comorbilidades graves, las infecciones respiratorias recientes, el embarazo y la historia de una reacción anafiláctica con AINE, en cuyo caso se puede hacer una modalidad más segura de provocación como es la nasal.
La modalidad oral para el reto con ASA está recomendada para el diagnóstico de asma, rinosinusitis o urticaria inducidas por ASA o para el de enfermedad respiratoria después de un reto nasal negativo cuando persista la sospecha de la enfermedad. El reto nasal para el diagnóstico de enfermedad respiratoria exacerbada por AINE está indicado cuando no se pueda hacer el reto oral a causa de asma no controlada o baja función pulmonar (33).
DESENSIBILIZACIÓN
El manejo inicial de los pacientes con hipersensibilidad al ASA es la evitación de este y de otros AINE inhibidores de la COX-1 (44). En segundo lugar se le deben ofrecer al paciente alternativas seguras con efecto analgésico y antiinflamatorio. En el caso particular de los pacientes con EREA, junto con el manejo sintomático de las comorbilidades una alternativa útil es la desensibilización, que consiste en la administración controlada de dosis crecientes de ASA y la continuación con dosis de mantenimiento para que el paciente pueda tolerar el ASA y otros AINE sin presentar síntomas. No está claro el mecanismo por el cual ocurre este proceso, pero se ha propuesto que mediante el consumo de ASA en dosis crecientes ocurre una degranulación progresiva de los mastocitos, que quedan anérgicos mientras continúe el consumo de ASA ya que no pueden repolarizar su membrana y formar nuevos mediadores proinflamatorios (45). Junto con este proceso ocurre una modulación del metabolismo del ácido araquidónico con disminución del tromboxano B2 (46) y de los leucotrienos B2 y E4 (47).
Existen varios protocolos de desensibilización que abarcan desde algunas horas hasta varios días. La elección del protocolo debe tener en cuenta la historia clínica del paciente y la disponibilidad de tiempo y de un centro de salud adecuado ya que todo protocolo de desensibilización, especialmente con esquemas acortados, tiene el riesgo de reacciones adversas graves como exacerbación severa del asma, anafilaxia y muerte.
Se debe plantear la desensibilización en los pacientes con EREA que no han logrado el control de los síntomas respiratorios a pesar de un tratamiento farmacológico óptimo y en los pacientes con polipectomías recurrentes (48); algunos pacientes con EREA pueden tener un buen control con el uso de esteroides tópicos y antileucotrienos; Sousa (49) ha observado una disminución del número de células inflamatorias que expresan cisteinil-leucotrieno LT1 en pacientes con EREA que consumen antileucotrienos; esto explicaría por qué algunos estudios han observado reducción en el número de episodios de broncoespasmo y otros síntomas respiratorios luego del consumo de este medicamento (50-53). Sin embargo, estos cambios no se observan en todos los pacientes.
El procedimiento lo debe realizar personal entrenado en alergología en una institución de salud que cuente con equipos de reanimación. El requerimiento de una unidad de cuidados intensivos y la disponibilidad de un anestesiólogo dependerán del esquema seleccionado y de la historia clínica del paciente.
Los elementos básicos con los que se debe contar para el procedimiento son:
1. Evaluación de la función pulmonar, idealmente mediante espirometría o con flujo espiratorio pico antes y durante el procedimiento.
2. Continuar o iniciar el consumo de antileucotrienos 7 días antes del procedimiento.
3. Disponer de equipo de reanimación y de personal entrenado para hacerla.
Se han propuesto varios esquemas de desensibilización utilizando L-ASA por vía intranasal (15) y bronquial (54), con resultados alentadores; sin embargo, la modalidad más frecuente en la actualidad y la que tiene mayor número de estudios es la administración de ASA por vía oral.
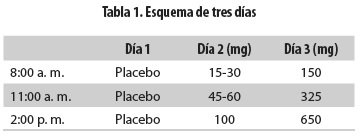
Los esquemas convencionales de desensibilización toman dos o tres días y consisten en el consumo de pequeñas dosis espaciadas de ASA hasta alcanzar una dosis final de 650 mg (tabla 1) y en adelante el paciente debe consumir diariamente 325 a 650 mg dos veces al día (6,55). La dosis final varía de acuerdo con el motivo de la desensibilización: en el caso de la EREA se recomienda la dosis ya mencionada, pero puede ser menor en el paciente con hipersensibilidad a ASA que requiera su consumo diario por el efecto cardioprotector. El esquema de tres días es seguro y permite identificar con pequeñas dosis síntomas en el paciente que requieran modificaciones en el procedimiento; sin embargo, requiere más tiempo y más recursos tanto del paciente como del médico. Se ha propuesto un esquema de 7 horas buscando solucionar el problema del tiempo y ha mostrado ser tan efectivo como el de tres días (56,57). Este esquema propone iniciar con una dosis de 4 mg hasta alcanzar la dosis final de650 mg (tabla 2). Debido a la mayor frecuencia de reacciones durante este esquema es recomendable hacerlo en una unidad de cuidados intensivos.
Durante el procedimiento, el paciente debe tener una vena canalizada y antes de cada dosis se deben vigilar los síntomas y signos con especial énfasis en la función respiratoria. Es frecuente que los pacientes con hipersensibilidad a ASA presenten durante el procedimiento molestias como prurito, disnea leve, urticaria y congestión nasoconjuntival porque se está induciendo de manera controlada la degranulación de los mastocitos y la liberación de mediadores proinflamatorios. Los síntomas leves no contraindican la continuación del procedimiento, pero cambios significativos en la espirometría y disminución mayor del 20% del flujo espiratorio pico deben alertar al médico tratante para prolongar el período de observación antes de la siguiente dosis (incluso a 24 horas), la cual en este caso debe tener la misma concentración que la dosis previamente tolerada. Si los síntomas persisten o aumentan el médico debe considerar la detención del procedimiento.
Una vez terminado el procedimiento, el paciente podrá tolerar el consumo de ASA y otros AINE sin presentar síntomas mientras continúe consumiendo diariamente ASA a la dosis de mantenimiento. Si lo suspende, la desensibilización persiste dos a cinco días luego de la última dosis; por ello, si lo suspende por un día, puede tomarlo nuevamente al día siguiente con relativa seguridad de no presentar una nueva reacción.
Con la desensibilización el paciente obtiene varios beneficios: mejor control del asma y de la rinosinusitis con menos cuadros de broncoespasmo (55) y menos requerimiento de esteroides o antibióticos (58); en los pacientes con polipectomías recurrentes el número promedio de cirugías pasa de una vez al año a una vez cada diez años con mejoría de la calidad de vida y menor gasto económico y de tiempo tanto para el paciente como para los servicios de salud (59). También se ha observado mejoría de la hiposmia (57).
Aun con estos beneficios, la desensibilización se utiliza poco en la mayoría de los países debido a la carencia de centros de salud con personal entrenado para hacerla y a la falta de divulgación entre otros especialistas que tratan a los pacientes con EREA.
El uso prolongado de ASA a dosis altas puede tener serios efectos gastrointestinales adversos como gastritis, hemorragias, úlceras y perforación, por lo que la selección de los pacientes y la evaluación del riesgo beneficio debe ser minuciosa. Los síntomas gastrointestinales son la principal causa de suspensión del tratamiento durante el primer año (24% de los pacientes) por lo que para evitarlos es recomendable iniciar el uso de inhibidores de la bomba de protones, misoprostol o antagonistas del receptor de histamina H2 (60). Para reducir la frecuencia de síntomas gastrointestinales se han propuesto esquemas de desensibilización con una dosis menor de mantenimiento (300 mg/día) (61), pero se requieren más estudios para confirmar su efectividad. Luego de alcanzar la dosis final, se debe continuar la administración de ASA 650 mg dos veces al día.
CASO CLÍNICO CONVENCIONAL
(n° 1) Mujer de 35 años de edad con cuadro clínico de rinitis y asma de 9 años de evolución. Asiste a consulta de alergología porque desde 6 años antes ha notado exacerbación del asma y de los cuadros rinosinusales luego del consumo de ASA, ibuprofeno o naproxeno para el dolor. Ha requerido en los últimos 4 años tres polipectomías y ha notado pérdida del olfato. Ha recibido múltiples tratamiento controladores; en la actualidad está con esteroides nasales a altas dosis, montelukast e inhalador bronquial de esteroide y beta-agonista de acción larga. Durante el estudio alergológico se le hace provocación nasal con ASA que resulta positiva; se hace diagnóstico de EREA y debido a la mala respuesta al tratamiento farmacológico se programa para desensibilización con ASA oral en esquema de tres días. Un año después de la desensibilización no ha requerido nuevas polipectomías, manifiesta haber recuperado el olfato y tener mejor control del asma y la rinosinusitis.
CASO CLÍNICO NO CONVENCIONAL (n° 2)
Hombre de 49 años de edad con historia de sinusitis crónica de 1 año de evolución, poliposis nasosinusal que requirió una polipectomía previa e historia personal de hipersensibilidad a AINE consistente en tos y disnea leve con el consumo de naproxeno, ibuprofeno y diclofenaco, sin historia personal de asma y con espirometría previa normal. Para confirmar el diagnóstico de hipersensibilidad a AINE y continuar una posible desensibilización se hizo un reto oral con ASA en una unidad de cuidados especiales. Con la dosis de 81 mg (dosis acumulativa de 125 mg) presentó tos y exacerbación de los síntomas nasales, pero sin caída significativa del flujo espiratorio pico. Se trató con antihistamínicos y beta 2 agonistas inhalados con mejoría de los síntomas. Se continuó con el esquema de desensibilización (7 horas) con una dosis final de 650 mg y tras un período de vigilancia se lo dio de alta con la indicación de continuar una dosis de 325 mg de ASA cada 12 horas. El procedimiento fue bien tolerado y el tratamiento con las dosis mencionadas de ASA ha sido continuado por 4 meses con mejoría en los síntomas nasales y buena tolerancia gástrica.
DISCUSIÓN DE LOS CASOS
Los pacientes convencionalmente sometidos a desensibilización con ASA tienen complicaciones derivadas de un asma de difícil control o han sido sometidos a múltiples intervenciones quirúrgicas para la resección de pólipos, con toda la morbilidad y riesgos que esto implica como la paciente del caso clínico n° 1. En estos pacientes está clara la indicación de la desensibilización y el retraso en el tratamiento repercute de manera negativa en la calidad de vida. Contrario al caso anterior, al paciente n° 2 se le hizo una intervención temprana.
Si bien es cierto que el paciente tenía una EREA, solo había requerido una polipectomía y no tenía un asma persistente, por lo que tal vez se hubiera beneficiado del tratamiento farmacológico convencional. Sin embargo, como mencionamos anteriormente, no todos los pacientes responden con este manejo y el requerimiento de múltiples polipectomías tiene riesgos graves tales como fístulas con salida de líquido cefalorraquídeo a la cavidad nasal, daño de la arteria carótida interna, meningitis y penetración orbitaria (62).
Como presentamos en el paciente n° 2, la provocación puede servir como primer paso para la desensibilización, con el consecuente ahorro de tiempo tanto para el médico como para el paciente, pero en este caso se debe efectuar en una institución de salud con equipo y personal entrenado. En conclusión, la EREA es una enfermedad compleja que afecta varios órganos y sistemas, tiene un gran impacto en la calidad de vida de los pacientes y su tratamiento es costoso para el sistema de salud. La desensibilización con ASA es un procedimiento seguro cuando lo lleva a cabo personal entrenado en condiciones óptimas de monitorización; sin embargo, la decisión de hacerla es compleja. A pesar de los beneficios conocidos de la desensibilización la terapia continua con ASA representa un reto para el médico a cargo del paciente debido a los efectos adversos del consumo crónico de este medicamento. Teniendo en cuenta lo anteriormente mencionado, se han propuesto otros protocolos de desensibilización con reducción de la dosis diaria de ASA.
REFERENCIAS BIBLIOGRÁFICAS
1. Samter M, Beers RF. Intolerance to aspirin. Clinical studies and consideration of its pathogenesis. Ann Intern Med. 1968;68(5):975–83. [ Links ]
2. Kowalski ML, Makowska JS, Blanca M, Bavbek S, Bochenek G, Bousquet J, et al. Hypersensitivity to nonsteroidal anti-inflammatory drugs (NSAIDs) - classification, diagnosis and management: review of the EAACI/ENDA(#) and GA2LEN/HANNA*. Allergy. 2011;66(7):818–29. [ Links ]
3. Sánchez-Borges M. NSAID hypersensitivity (respiratory, cutaneous, and generalized anaphylactic symptoms). Med Clin North Am. 2010;94(4):853–64, xiii. [ Links ]
4. Berges-Gimeno MP, Simon RA, Stevenson DD. The natural history and clinical characteristics of aspirin- exacerbated respiratory disease. Ann Allergy Asthma Immunol. 2002;89(5):474–8. [ Links ]
5. Romano A, Torres MJ, Castells M, Sanz ML, Blanca M. Diagnosis and management of drug hypersensitivity reactions. J Allergy Clin Immunol. 2011;127(3 Suppl):S67–73. [ Links ]
6. Jenneck C, Juergens U, Buecheler M, Novak N. Pathogenesis, diagnosis, and treatment of aspirin intolerance. Ann Allergy Asthma Immunol. 2007;99(1):13–21. [ Links ]
7. Jenkins C, Costello J, Hodge L. Systematic review of prevalence of aspirin induced asthma and its implications for clinical practice. BMJ. 2004;328(7437):434. [ Links ]
8. Stevenson DD, Szczeklik A. Clinical and pathologic perspectives on aspirin sensitivity and asthma. J Allergy Clin Immunol. 2006;118(4):773–86; quiz 787–8. [ Links ]
9. Casadevall J, Ventura PJ, Mullol J, Picado C. Intranasal challenge with aspirin in the diagnosis of aspirin intolerant asthma: evaluation of nasal response by acoustic rhinometry. Thorax. 2000;55(11):921–4. [ Links ]
10. Patriarca G, Bellioni P, Nucera E, Schiavino D, Papa G, Schinco G, et al. Intranasal treatment with lysine acetylsalicylate in patients with nasal polyposis. Ann Allergy. 1991;67(6):588–92. [ Links ]
11. Lee RU, White AA, Ding D, Dursun AB, Woessner KM, Simon RA, et al. Use of intranasal ketorolac and modified oral aspirin challenge for desensitization of aspirin-exacerbated respiratory disease. Ann Allergy Asthma Immunol. 2010;105(2):130–5. [ Links ]
12. White A, Bigby T, Stevenson D. Intranasal ketorolac challenge for the diagnosis of aspirin-exacerbated respiratory disease. Ann Allergy Asthma Immunol. 2006;97(2):190–5. [ Links ]
13. Ogata N, Darby Y, Scadding G. Intranasal lysineaspirin administration decreases polyp volume in patients with aspirin-intolerant asthma. J Laryngol Otol. 2007;121(12):1156–60. [ Links ]
14. Sweet JM, Stevenson DD, Simon RA, Mathison DA. Long-term effects of aspirin desensitization- -treatment for aspirin-sensitive rhinosinusitis-asthma. J Allergy Clin Immunol. 1990;85(1 Pt 1):59–65. [ Links ]
15. Parikh AA, Scadding GK. Intranasal lysine-aspirin in aspirin-sensitive nasal polyposis: a controlled trial. Laryngoscope. 2005;115(8):1385–90. [ Links ]
16. Cardona R, Ramírez RH, Reina Z, Escobar MF, Morales E. [Allergy and intolerance to nonsteroidal antinflammatory drugs: successful desensitization in three cases]. Biomedica. 2009;29(2):181–90. [ Links ]
17. Sousa AR, Lams BE, Pfister R, Christie PE, Schmitz M, Lee TH. Expression of interleukin-5 and granulocytemacrophage colony-stimulating factor in aspirin-sensitive and non-aspirin-sensitive asthmatic airways. Am J Respir Crit Care Med. 1997;156(5):1384–9. [ Links ]
18. Varga EM, Jacobson MR, Masuyama K, Rak S, Till SJ, Darby Y, et al. Inflammatory cell populations and cytokine mRNA expression in the nasal mucosa in aspirin- sensitive rhinitis. Eur Respir J. 1999;14(3):610–5. [ Links ]
19. Sladek K, Dworski R, Soja J, Sheller JR, Nizankowska E, Oates JA, et al. Eicosanoids in bronchoalveolar lavage fluid of aspirin-intolerant patients with asthma after aspirin challenge. Am J Respir Crit Care Med. 1994;149(4 Pt 1):940–6. [ Links ]
20. Cowburn AS, Sladek K, Soja J, Adamek L, Nizankowska E, Szczeklik A, et al. Overexpression of leukotriene C4 synthase in bronchial biopsies from patients with aspirin-intolerant asthma. J Clin Invest. 1998;101(4):834–46. [ Links ]
21. Corrigan C, Mallett K, Ying S, Roberts D, Parikh A, Scadding G, et al. Expression of the cysteinyl leukotriene receptors cysLT(1) and cysLT(2) in aspirinsensitive and aspirin-tolerant chronic rhinosinusitis. J Allergy Clin Immunol. 2005;115(2):316–22. [ Links ]
22. Kowalski ML, Pawliczak R, Wozniak J, Siuda K, Poniatowska M, Iwaszkiewicz J, et al. Differential metabolism of arachidonic acid in nasal polyp epithelial cells cultured from aspirin-sensitive and aspirin-tolerant patients. Am J Respir Crit Care Med. 2000;161(2 Pt 1):391–8. [ Links ]
23. Pierzchalska M, Szabó Z, Sanak M, Soja J, Szczeklik A. Deficient prostaglandin E2 production by bronchial fibroblasts of asthmatic patients, with special reference to aspirin-induced asthma. J Allergy Clin Immunol. 2003;111(5):1041–8. [ Links ]
24. Schmid M, Göde U, Schäfer D, Wigand ME. Arachidonic acid metabolism in nasal tissue and peripheral blood cells in aspirin intolerant asthmatics. Acta Otolaryngol. 1999;119(2):277–80. [ Links ]
25. Kowalski ML, Ptasinska A, Bienkiewicz B, Pawliczak R, DuBuske L. Differential effects of aspirin and misoprostol on 15-hydroxyeicosatetraenoic acid generation by leukocytes from aspirin-sensitive asthmatic patients. J Allergy Clin Immunol. 2003;112(3):505–12. [ Links ]
26. Bandeira-Melo C, Bozza PT, Diaz BL, Cordeiro RS, Jose PJ, Martins MA, et al. Cutting edge: lipoxin (LX) A4 and aspirin-triggered 15-epi-LXA4 block allergen-induced eosinophil trafficking. J Immunol. 2000;164(5):2267–71. [ Links ]
27. Sanak M, Levy BD, Clish CB, Chiang N, Gronert K, Mastalerz L, et al. Aspirin-tolerant asthmatics generate more lipoxins than aspirin-intolerant asthmatics. Eur Respir J. 2000;16(1):44–9. [ Links ]
28. Dekker JW, Nizankowska E, Schmitz-Schumann M, Pile K, Bochenek G, Dyczek A, et al. Aspirin-induced asthma and HLA-DRB1 and HLA-DPB1 genotypes. Clin Exp Allergy. 1997;27(5):574–7. [ Links ]
29. Sanak M, Pierzchalska M, Bazan-Socha S, Szczeklik A. Enhanced expression of the leukotriene C(4) synthase due to overactive transcription of an allelic variant associated with aspirin-intolerant asthma. Am J Respir Cell Mol Biol. 2000;23(3):290–6. [ Links ]
30. Park JS, Chang HS, Park C-S, Lee J-H, Lee YM, Choi JH, et al. Association analysis of cysteinyl-leukotriene receptor 2 (CYSLTR2) polymorphisms with aspirin intolerance in asthmatics. Pharmacogenet Genomics. 2005;15(7):483–92. [ Links ]
31. Kalyoncu AF, Karakaya G, Bozkurt B, Artvinli M. A new method of oral drug provocation testing for determining safe alternatives for patients with non-steroidal anti-inflammatory drug intolerance: the triple test. Int Arch Allergy Immunol. 2005 Dec;138:319–23. [ Links ]
32. Celik G, Pasaoglu G, Bavbek S, Abadoglu O, Dursun B, Mungan D, et al. Tolerability of selective cyclooxygenase inhibitor, celecoxib, in patients with analgesic intolerance. J Asthma. 2005;42(2):127–31. [ Links ]
33. Nizankowska-Mogilnicka E, Bochenek G, Mastalerz L, Swierczynska M, Picado C, Scadding G, et al. EAACI/GA2LEN guideline: aspirin provocation tests for diagnosis of aspirin hypersensitivity. Allergy. 2007;62(10):1111–8. [ Links ]
34. Bochenek G, Niz Ankowska E, Szczeklik A. Testing for aspirin hypersensitivity. Allergy. 2002;57(7):562–5. [ Links ]
35. Szczeklik A, Sladek K, Dworski R, Nizankowska E, Soja J, Sheller J, et al. Bronchial aspirin challenge causes specific eicosanoid response in aspirin-sensitive asthmatics. Am J Respir Crit Care Med. 1996;154 (6 Pt 1):1608–14. [ Links ]
36. Szczeklik A, Gryglewski RJ, Czerniawska-Mysik G. Relationship of inhibition of prostaglandin biosynthesis by analgesics to asthma attacks in aspirin- sensitive patients. Br Med J. 1975;1(5949):67–9. [ Links ] 37. Szczeklik A, Gryglewski RJ, Czerniawska-Mysik G. Clinical patterns of hypersensitivity to nonsteroidal anti-inflammatory drugs and their pathogenesis. J Allergy Clin Immunol. 1977;60(5):276–84.
38. Nizankowska E, Szczeklik A. Glucocorticosteroids attenuate aspirin-precipitated adverse reactions in aspirin-intolerant patients with asthma. Ann Allergy. 1989;63(2):159–62. [ Links ]
39. Ortolani C, Mirone C, Fontana A, Folco GC, Miadonna A, Montalbetti N, et al. Study of mediators of anaphylaxis in nasal wash fluids after aspirin and sodium metabisulfite nasal provocation in intolerant rhinitic patients. Ann Allergy. 1987;59(5 Pt 2):106–12. [ Links ]
40. Nizankowska E, Bestynska-Krypel A, Cmiel A, Szczeklik A. Oral and bronchial provocation tests with aspirin for diagnosis of aspirin-induced asthma. Eur Respir J. 2000;15(5):863–9. [ Links ]
41. Alonso-Llamazares A, Martinez-Cócera C, Domínguez- Ortega J, Robledo-Echarren T, Cimarra-Alvarez M, Mesa del Castillo M. Nasal provocation test (NPT) with aspirin: a sensitive and safe method to diagnose aspirin-induced asthma (AIA). Allergy. 2002;57(7):632–5. [ Links ]
42. Milewski M, Mastalerz L, Nizankowska E, Szczeklik A. Nasal provocation test with lysine-aspirin for diagnosis of aspirin-sensitive asthma. J Allergy Clin Immunol. 1998;101(5):581–6. [ Links ]
43. Macy E, Bernstein JA, Castells MC, Gawchik SM, Lee TH, Settipane RA, et al. Aspirin challenge and desensitization for aspirin-exacerbated respiratory disease: a practice paper. Ann Allergy Asthma Immunol. 2007;98(2):172–4. [ Links ]
44. Szczeklik A, Sanak M. The broken balance in aspirin hypersensitivity. Eur J Pharmacol. 2006;533(1- 3):145–55. [ Links ]
45. Szczeklik A, Stevenson DD. Aspirin-induced asthma: advances in pathogenesis, diagnosis, and management. J Allergy Clin Immunol. 2003;111(5):913–21; quiz 922. [ Links ]
46. Juergens UR, Christiansen SC, Stevenson DD, Zuraw BL. Inhibition of monocyte leukotriene B4 production after aspirin desensitization. J Allergy Clin Immunol. 1995;96(2):148–56. [ Links ]
47. Arm JP, Austen KF. Leukotriene receptors and aspirin sensitivity. N Engl J Med. 2002;347(19):1524–6. [ Links ]
48. Stevenson DD, Simon RA. Selection of patients for aspirin desensitization treatment. J Allergy Clin Immunol. 2006;118(4):801–4. [ Links ]
49. Sousa AR, Parikh A, Scadding G, Corrigan CJ, Lee TH. Leukotriene-receptor expression on nasal mucosal inflammatory cells in aspirin-sensitive rhinosinusitis. N Engl J Med. 2002;347(19):1493–9. [ Links ]
50. Dahlén B, Nizankowska E, Szczeklik A, Zetterström O, Bochenek G, Kumlin M, et al. Benefits from adding the 5-lipoxygenase inhibitor zileuton to conventional therapy in aspirin-intolerant asthmatics. Am J Respir Crit Care Med. 1998;157(4 Pt 1):1187–94. [ Links ]
51. Dahlén S-E, Malmström K, Nizankowska E, Dahlén B, Kuna P, Kowalski M, et al. Improvement of aspirin- intolerant asthma by montelukast, a leukotriene antagonist: a randomized, double-blind, placebo-controlled trial. Am J Respir Crit Care Med. 2002;165(1):9–14. [ Links ]
52. Yoshida S, Sakamoto H, Ishizaki Y, Onuma K, Shoji T, Nakagawa H, et al. Efficacy of leukotriene receptor antagonist in bronchial hyperresponsiveness and hypersensitivity to analgesic in aspirin-intolerant asthma. Clin Exp Allergy. 2000;30(1):64–70. [ Links ]
53. Stevenson DD, Simon RA, Mathison DA, Christiansen SC. Montelukast is only partially effective in inhibiting aspirin responses in aspirin-sensitive asthmatics. Ann Allergy Asthma Immunol. 2000;85(6 Pt 1):477–82. [ Links ]
54. Schmitz-Schumann M, Schaub E, Virchow C. [Inhalation provocation test with lysine-acetylsalicylic acid in patients with analgetics-induced asthma (author's transl)]. Prax Klin Pneumol. 1982;36(1):17–21. [ Links ]
55. Pfaar O, Klimek L. Aspirin desensitization in aspirin intolerance: update on current standards and recent improvements. Curr Opin Allergy Clin Immunol. 2006;6(3):161–6. [ Links ]
56. Castells M. Desensitization for drug allergy. Curr Opin Allergy Clin Immunol. 2006;6(6):476–81. [ Links ]
57. White AA, Stevenson DD, Simon RA. The blocking effect of essential controller medications during aspirin challenges in patients with aspirin-exacerbated respiratory disease. Ann Allergy Asthma Immunol. 2005;95(4):330–5. [ Links ]
58. Berges-Gimeno MP, Simon RA, Stevenson DD. Long-term treatment with aspirin desensitization in asthmatic patients with aspirin-exacerbated respiratory disease. J Allergy Clin Immunol. 2003;111(1):180–6. [ Links ]
59. Lee JY, Simon RA. Does it make sense to ''desens''? Aspirin desensitization in the treatment of chronic rhinosinusitis. Curr Allergy Asthma Rep. 2006;6(3):183–4. [ Links ]
60. Baker TW, Quinn JM. Aspirin therapy in aspirin-exacerbated respiratory disease: a risk-benefit analysis for the practicing allergist. Allergy Asthma Proc. 2011;32(5):335–40. [ Links ]
61. Rozsasi A, Polzehl D, Deutschle T, Smith E, Wiesmiller K, Riechelmann H, et al. Long-term treatment with aspirin desensitization: a prospective clinical trial comparing 100 and 300 mg aspirin daily. Allergy. 2008;63(9):1228–34. [ Links ]
62. Dalziel K, Stein K, Round A, Garside R, Royle P. Endoscopic sinus surgery for the excision of nasal polyps: A systematic review of safety and effectiveness. Am J Rhinol.2006;20(5):506–19. [ Links ]