Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.27 no.3 Medellín July/Sept. 2014
CASO CLÍNICO DE CARDIOLOGÍA
Miocarditis fulminante, simuladora de síndrome coronario agudo
Fulminant myocarditis mimicking acute coronary syndrome
Juan Manuel Senior1; Édison Muñoz Ortiz2
1 Coordinador del posgrado en Cardiología Clínica y Cardiología Intervencionista, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. mmbt@une.net.co
2 Médico Internista, Residente de Cardiología Clínica, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
Recibido: mayo 5 de 2014
Aceptado: mayo 07 de 2014
RESUMEN
Informamos el caso de un hombre de 48 años, con el antecedente de enfermedad coronaria y enfermedad autoinmune, quien sufrió dolor torácico, con posterior desarrollo de falla cardíaca aguda y colapso hemodinámico. Se presentan su evolución clínica y las ayudas que permitieron llegar al diagnóstico de miocarditis fulminante de etiología lúpica. Se incluye también una revisión de los aspectos más importantes de esta enfermedad.
PALABRAS CLAVE
Falla Cardíaca Aguda, Miocarditis, Miopericarditis Lúpica
SUMMARY
We report the case of a 48 year-old man with chest pain and history of coronary and autoimmune diseases, who developed acute heart failure and hemodynamic collapse. We present his clinical evolution and the tests that allowed the diagnosis of fulminant myocarditis secondary to systemic lupus erythematosus. A review of the most important aspects of this disease is also included.
KEY WORDS
Acute Heart Failure, Lupus Myopericarditis, Myocarditis
INTRODUCCIÓN
La inflamación del miocardio es causada por infecciones, enfermedades autoinmunes, medicamentos y, con menor frecuencia, por vasculitis y otras enfermedades; genera disfunción ventricular aguda potencialmente reversible, con formas de presentación diversas que van desde cuadros con evolución rápida a choque cardiogénico, que pone en riesgo la vida del paciente, hasta formas larvadas que pueden pasar desapercibidas clínicamente o ser rotuladas de forma errónea como síndrome coronario agudo u otras enfermedades, pero con alta probabilidad de recuperación completa y en menor proporción de progresión a cardiopatía dilatada y falla cardíaca crónica (1). La cardiomiopatía dilatada idiopática es la principal secuela a largo plazo de la miocarditis aguda no diagnosticada en su fase inicial.
El pronóstico y el tratamiento dependen de la etiología específica y, dadas sus graves consecuencias y la necesidad de un reconocimiento oportuno para un tratamiento rápido y adecuado, es necesario mejorar el conocimiento respecto a esta enfermedad, para poder impactar de forma efectiva en los desenlaces de los pacientes.
Presentamos un caso clínico ilustrativo de miocarditis, que debutó como un síndrome coronario agudo, pero cuyas características clínicas y evolución confirmaron el diagnóstico de miocarditis, con el objetivo de resaltar este tipo de presentación y alertar a los clínicos hacia su búsqueda, teniendo siempre en mente esta enfermedad en el diagnóstico diferencial de los pacientes que acuden al servicio de urgencias como eventos coronarios agudos por dolor torácico y marcadores séricos elevados de necrosis.
DESCRIPCIÓN DEL CASO
Hombre de 48 años de edad, con antecedentes de extabaquismo de 40 años/paquete, síndrome antifosfolípido considerado primario hasta ese momento, diagnosticado 7 años antes, cuando debutó con un evento cerebrovascular isquémico. Antecedente de intervención coronaria percutánea con implante de dos estents medicados en la arteria descendente anterior, debido a disección arterial espontánea en el año 2011, con reevaluación por coronariografía 3 meses después del procedimiento por cuadro de dolor torácico, pero en la cual se encontró permeabilidad de los estents sin hallazgos angiográficos de reestenosis. El paciente venía en tratamiento con warfarina ajustada en la clínica de anticoagulación según el INR, ASA 100 mg día, carvedilol 6,25 mg cada 12 horas, dinitrato de isosorbide 10 mg 3 veces al día y atorvastatina 40 mg en la noche.
Consultó por cuadro clínico de 12 horas de evolución, consistente en dolor torácico punzante con intensidad 5/10, que se producía con actividad física mínima, y que había aumentado de intensidad en las últimas 8 horas llegando a calificarlo en 9/10. Al inicio del cuadro el paciente negaba disnea o presencia de síntomas vagales y refería sensación de mareo, sin otras alteraciones neurológicas.
Al examen físico se encontraron: presión arterial de 135/60 mm Hg, frecuencia cardíaca de 55 latidos por minuto, frecuencia respiratoria de 16 por minuto, saturación 98% al ambiente, sin alteraciones importantes en el examen físico por regiones, incluyendo la auscultación cardiopulmonar.
Se le solicitaron estudios de química sanguínea, hematológicos y de autoinmunidad, con los siguientes resultados: INR de 2,36; anticuerpos antinucleares 1:1.280 patrón homogéneo, anti-DNA 1:160, anticardiolipina IgG >120 GLP, creatinina 1,1 mg/dL, BUN 12 mg/dL, iones normales, hemograma sin alteraciones, uroanálisis con 25 mg de proteínas, pero sin células en el sedimento; dos mediciones iniciales de troponina fueron negativas.
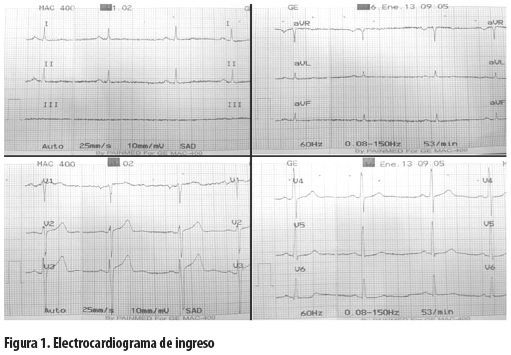
Se le hizo además electrocardiograma de 12 derivaciones que no mostró alteraciones en la repolarizacion, ni cambios isquémicos u otros hallazgos anormales (figura 1).
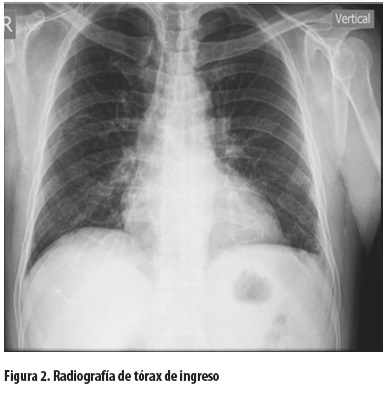
La radiografía inicial de tórax no mostró cardiomegalia, ni signos de sobrecarga hídrica, consolidación o derrame pleural (figura 2).
Dada la presencia de marcadores de autoinmunidad, se solicitó el concepto del servicio de Reumatología, el cual consideró que el paciente cumplía con los criterios de lupus eritematoso sistémico (LES). Los estudios iniciales se complementaron con ecocardiografía transtorácica, en la que se observó el ventrículo izquierdo sin trastornos de la contractilidad, con fracción de expulsión (FE) del 65%, cavidades derechas normales, sin compromiso pericárdico ni alteraciones estructurales.
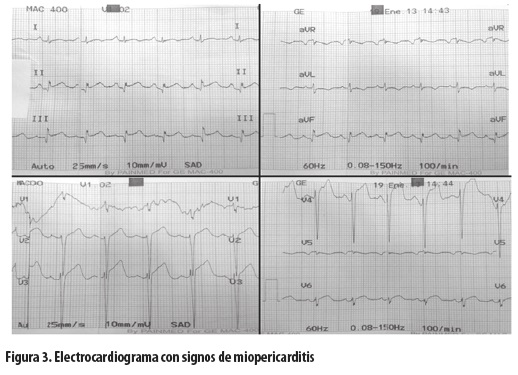
Al tercer día de hospitalización el paciente presentó nuevamente dolor torácico opresivo intenso, no irradiado, sin síntomas vagales, por lo que se le tomó un nuevo electrocardiograma (figura 3), en el cual se evidenció elevación del segmento ST en múltiples derivaciones, acompañada de descenso del PR especialmente en DII, y cambios opuestos en aVR (infradesnivel del ST con PR ascendente), con ondas Q en las derivaciones de la pared inferior y amputación de la onda R en todas las precordiales. En la evaluación por sus médicos tratantes se planteó descartar un evento coronario, por lo que solicitaron coronariografía en la que se encontró: en la arteria descendente anterior (ADA), vaso de buen calibre con flujo distal TIMI 3 y grado de perfusión miocárdica (GPM, TMP en inglés) 3, con dos estents previamente implantados con reestenosis severa del 70%, pero sin oclusión aguda. Se le hizo con éxito angioplastia con dos estents medicados en la ADA, pero dado el flujo distal óptimo se consideró que esta no era la causa de los cambios electrocardiográficos.
Con posterioridad al procedimiento, el paciente se tornó disneico, taquicárdico e hipotenso, y requirió el inicio de soporte vasopresor e inotrópico, por lo cual se lo trasladó a la unidad de cuidados intensivos (UCI) con requerimiento de ventilación mecánica no invasiva; allí presentó además daño renal agudo asociado al bajo gasto cardíaco, sin llegar a requerir terapia de reemplazo renal. Se tomó nueva radiografía de tórax (figura 4), que demostró sobrecarga hídrica con imagen de edema pulmonar en ''alas de mariposa o de murciélago''.
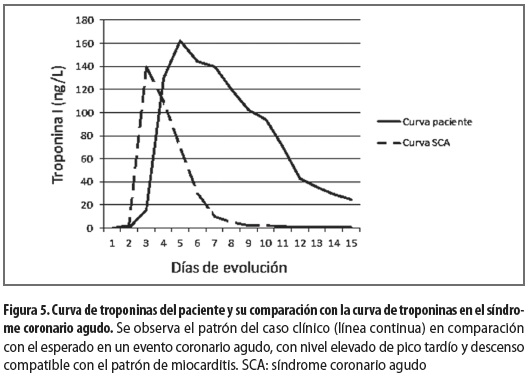
Se le hicieron nuevas mediciones seriadas de troponina que resultaron alteradas, con patrón de ascenso y descenso tardíos, y que persistieron altamente positivas hasta casi el día 15 después de la intervención (figura 5).
Se le hizo ecocardiografía de control en la que se halló dilatación del ventrículo izquierdo con hipocinesia en la cara anterior, el ápex y la cara inferior, con FE severamente deprimida del 17%, dilatación biauricular leve, sin alteraciones valvulares relevantes. Dado el deterioro agudo se solicitó un estudio para embolia pulmonar, gammagrafía de ventilación perfusión, que la descartó; presentó además durante su estancia en la UCI bacteriemia por Sthaphylococcus hominis resistente a meticilina, por lo que recibió 14 días de tratamiento con linezolid con respuesta adecuada; además, por el compromiso de la oxigenación, requirió ventilación mecánica no invasiva.
En este punto de la evolución el caso fue conocido por el grupo de Cardiología, en cuyo concepto el paciente presentaba una falla cardíaca aguda, con inestabilidad hemodinámica, electrocardiograma con cambios de miopericarditis (figura 3) y coronariografía que no mostró evento agudo, sino una reestenosis con flujo distal TIMI 3 y GPM 3; se tuvo en cuenta, además, el concepto del grupo de Reumatología según el cual el paciente cumplía con los criterios de LES, y por todo ello se definió que se trataba de una miopericarditis, con comportamiento fulminante que podría estar relacionada con su enfermedad autoinmune (miocarditis lúpica), por lo cual se decidió administrar inicialmente pulsos de metilprednisolona y luego prednisolona en dosis de 1 mg/kg día. Se solicitó resonancia magnética cardíaca contrastada con protocolo para evaluación de realce tardío y, de acuerdo con el resultado, hacer biopsia endomiocárdica para confirmación; sin embargo, el paciente presentó ese mismo día un episodio de fibrilación ventricular sin respuesta a las maniobras de reanimación y falleció.
DISCUSIÓN
La inflamación del miocardio tiene como consecuencia la aparición de disfunción ventricular sistólica, y es la causa de hasta 10% de los casos de falla cardíaca aguda. Esta enfermedad, que se considera autolimitada en muchos casos, realmente puede evolucionar hacia el deterioro rápido del paciente con riesgo para la vida (miocarditis fulminante), aunque en términos generales hay recuperación posterior de la función ventricular (90%), o con presentación aguda o subaguda, de curso lento y poco llamativo y deterioro progresivo de la función cardíaca, hasta la aparición de una cardiomiopatía dilatada; se considera que puede ser responsable hasta del 10% de los casos de cardiomiopatía dilatada sin una etiología claramente establecida (1). Sin embargo, estos datos epidemiológicos posiblemente están subvalorados, dada la falta de sospecha clínica en muchos casos y el bajo rendimiento de los métodos diagnósticos, incluyendo la biopsia endomiocárdica, que puede ser negativa por la afectación miocárdica en parches que produce la enfermedad (1,2). La resonancia magnética cardíaca ha cambiado el diagnóstico de los pacientes con sospecha de la enfermedad, por la descripción de edema miocárdico, hiperemia capilar, daño celular irreversible, disfunción ventricular izquierda y derrame pericárdico, con patrones diferentes a los descritos en pacientes con síndrome coronario agudo.
Los criterios patológicos para la definición de la enfermedad son los de Dallas, de acuerdo con los resultados de la biopsia endomiocárdica, para la búsqueda de infiltrado celular inflamatorio con o sin necrosis de los miocitos; sin embargo, este enfoque tiene muchas limitaciones por su baja sensibilidad y por carecer de buena correlación clínica y pronóstica (3); por ello se han buscado alternativas como los estudios de inmunoperoxidasa de antígenos de superficie, pero aún no está muy sedimentado su uso; o en estudios recientes la resonancia magnética cardíaca como herramienta de diagnóstico no invasivo, como ya se mencionó (4,5). Los hallazgos histológicos más frecuentes se describen como miocarditis linfocítica relacionada con infecciones virales o respuesta autoinmune postinfecciosa; con menor frecuencia se encuentra miocarditis eosinofílica, relacionada con el síndrome hipereosinofílico, el síndrome de Churg-Strauss, hipersensibilidad a drogas e infecciones parasitarias; se han observado otras alteraciones como miocarditis de células gigantes, sarcoidosis y carditis reumática activa.
La etiología de la miocarditis puede ser muy variada, pero se consideran causas frecuentes las infecciones virales, especialmente por Coxsackie B, citomegalovirus y el VIH; los medicamentos antracíclicos, la cocaína y el etanol. Causas menos frecuentes incluyen las enfermedades autoinmunes, entre ellas el LES, las infecciones bacterianas y micóticas, la toxicidad por metales pesados y las reacciones de hipersensibilidad a medicamentos como cefalosporinas, penicilina y sulfonamidas, entre otros (1,3). Específicamente en la miocarditis lúpica, que fue el diagnóstico considerado en el caso clínico expuesto, los estudios histológicos muestran que hay edema intersticial, áreas con focos pequeños de necrosis fibrinoide con infiltrados de células plasmáticas, monocitos, linfocitos y algunos neutrófilos en el intersticio miocárdico, depósito de complejos inmunes en áreas perivasculares, hiperplasia de la íntima, además de engrosamiento de la pared arterial con estrechez de la luz. Finalmente, la inflamación puede llevar a la aparición de pequeños focos de fibrosis miocárdica (6,7).
El síndrome antifosfolípido primario, antecedente principal del paciente, no genera compromiso cardíaco por miocarditis, sino que suele manifestarse por alteraciones valvulares, hipertrofía ventricular, hipertensión pulmonar, trombos intracardíacos y oclusión coronaria trombótica; sin embargo, no se encontró compromiso trombótico en la coronariografía y la disfunción cardíaca y la elevación de los biomarcadores no se podrían explicar por la reestenosis de los estents (8,9).
La fisiopatología de la enfermedad especialmente en las formas virales e idiopáticas no está claramente dilucidada, pero en términos generales se considera que la miocarditis aguda es el resultado de una infección viral que produce necrosis miocárdica y desencadena una respuesta inmune, en la que intervienen diferentes citocinas (interleucinas, factor de necrosis tumoral alfa, interferón gamma) y liberación de óxido nítrico, que generan activación de metaloproteinasas y reclutamiento de células inmunes como linfocitos T ayudadores y citotóxicos, linfocitos B y células plasmáticas productoras de anticuerpos, para eliminar el agente infeccioso, y que, en los casos con curso crónico, pueden persistir de tal manera que procesos inmunes o autoinmunes postinfecciosos, asociados con enfermedades autoinmunes sistémicas, o desarrollados por la persistencia del virus, generan la disfunción ventricular progresiva y permanente, arritmias y alteraciones cardíacas estructurales (1,6,10).
Hay estudios fisiopatológicos de la miocarditis lúpica en los que se describe que el daño miocárdico estaría mediado por un fenómeno inmunológico, en el que la activación de células plasmáticas lleva a la producción de complejos inmunes y al depósito de complemento en la pared de los vasos miocárdicos y en el tejido perivascular, lo cual explicaría el daño miocárdico y la aparición del proceso inflamatorio. Estos hallazgos apoyan la idea de que la miocarditis lúpica está mediada por un fenómeno vascular por complejos inmunes, que lleva a la activación del complemento, inflamación y daño miocárdico, más que a condiciones que impliquen directamente las miofibrillas. En este daño mediado por anticuerpos se han encontrado antirribonucleoproteínas, anti Ro y antifosfolípidos (6,7).
La presentación clínica de la enfermedad es variable, desde síntomas inespecíficos como fiebre, mialgias, palpitaciones y disnea con el ejercicio hasta la aparición de falla cardíaca aguda, arritmias, muerte súbita, dolor torácico que simula un evento coronario agudo o, incluso, colapso hemodinámico como en el caso aquí presentado (2). Se ha descrito que la presentación como miocarditis fulminante suele tener mayor correlación con cuadros virales previos, fiebre y síntomas agudos, con mayor deterioro funcional, aunque esta forma no descarta otras etiologías de la miocarditis como la autoinmune (1).
Algunas características clínicas particulares de la miocarditis lúpica provienen de pequeños reportes en los que se mencionan su mayor ocurrencia en mujeres y su aparición con índices altos de actividad de la enfermedad (11). En el contexto del LES, la miocarditis puede además acompañarse de otras manifestaciones cardíacas del lupus, tales como pericarditis (como en nuestro caso) o endocarditis. Aunque rara, la miocarditis aguda con falla cardíaca puede ser la manifestación inicial del LES (7).
Para el diagnóstico se deben tener en cuenta el cuadro clínico, el electrocardiograma que en general muestra cambios inespecíficos sugestivos de anormalidad auricular, presencia de arritmias o alteraciones en la conducción, cambios inespecíficos de la repolarización (11) y, en algunos pacientes, cambios de pericarditis, lo que correspondería a una miopericarditis (figura 3). Se han descrito algunos cambios electrocardiográficos de mal pronóstico que incluyen el QRS ancho, la presencia de ondas Q, el bloqueo de rama izquierda y el aumento del automatismo ventricular (5).
Puede encontrarse también elevación inespecífica de los reactantes de fase aguda (1-3), elevación de biomarcadores cardíacos como la troponina, que puede estar positiva por la necrosis cardíaca. Smith y colaboradores (12) hicieron un análisis de la troponina I del estudio sobre terapia inmunosupresora para miocarditis de Mason y colaboradores (13), y encontraron que este biomarcador estaba elevado en el 34% de los pacientes con inflamación miocárdica probada por biopsia; además, encontraron que la elevación de la troponina I estaba correlacionada con una corta duración de los síntomas de falla cardíaca (menos de 1 mes), sugiriendo que la mayor parte de la necrosis miocárdica se presenta temprano en el curso de la enfermedad, por lo que la ventana para el diagnóstico y el tratamiento puede ser estrecha (7); además, estos datos sugieren que la elevación persistente de los biomarcadores cardíacos podría indicar necrosis en curso y con una curva de ascenso y descenso diferente a la del infarto agudo de miocardio (figura 5). En muchos pacientes puede ser necesario hacer angiografía para descartar la enfermedad coronaria, pero los hallazgos descritos en nuestro paciente retardaron el diagnóstico de miocarditis y por lo tanto postergaron el inicio de la terapia inmunosupresora.
En cuanto a los estudios de imagen, la radiografía de tórax muestra alteraciones inespecíficas como cardiomegalia y congestión pulmonar por falla cardíaca, pero es útil en el diagnóstico diferencial (2). La ecocardiografía puede ser útil en el diagnóstico diferencial y para definir la gravedad de la afectación cardíaca, pero no hay hallazgos específicos, pues de hecho las alteraciones segmentarias de la contractilidad características de la cardiopatía isquémica se pueden encontrar en un paciente con miocarditis; también es importante para definir el tipo de miocarditis con que cursa el paciente, pues la dilatación ventricular sugiere miocarditis aguda o subaguda, mientras que un paciente con falla cardíaca aguda y ventrículo de tamaño normal, aunque con espesor aumentado del septo por edema, es sugestivo de miocarditis fulminante; además, se ha reportado que la disfunción ventricular derecha se ha encontrado como un predictor de muerte y trasplante (14).
La resonancia magnética cardíaca, tal como ya se había mencionado, ha aparecido como una ayuda diagnóstica no invasiva de gran utilidad para apoyar el diagnóstico de miocarditis; los hallazgos por esta modalidad de imagen incluyen la presencia de edema en la secuencia potenciada en T2, realce temprano debido a la hiperemia propia de la inflamación en las fases iniciales de la enfermedad y realce tardío luego del daño miocárdico con zonas de fibrosis, especialmente en la pared septal o lateral subepicárdica, con sensibilidad del 76% y especificidad del 96% (4,5).
La biopsia endomiocárdica sigue siendo la ayuda diagnóstica que confirma la inflamación miocárdica y clasifica la enfermedad de acuerdo con los criterios de Dallas, con las limitaciones previamente expresadas; en el contexto de miocarditis estaría indicada en los pacientes con falla cardíaca aguda, ventrículo izquierdo (VI) normal o dilatado, síntomas con evolución menor de 2 semanas y compromiso hemodinámico; también en aquellos con VI dilatado con síntomas de 2 semanas a 3 meses, nueva arritmia ventricular o bloqueo AV Mobitz II o de tercer grado, sin respuesta a la terapia usual en 1 a 2 semanas (6).
El tratamiento de la miocarditis está encaminado inicialmente a las medidas de soporte y para la falla cardíaca aguda, incluyendo el uso de vasopresores e inotrópicos en pacientes inestables y, si fueran necesarios, los dispositivos de asistencia ventricular, como ''terapia puente'' a la recuperación o el trasplante (1,3). Los pacientes con disfunción ventricular son candidatos al tratamiento estándar de la falla cardíaca crónica, con inhibidores de la enzima convertidora de angiotensina o antagonistas del receptor de angiotensina II, betabloqueadores, antialdosterónicos y diuréticos si es necesario. Se considera pertinente diferir (aunque no está claro por cuánto tiempo) el uso de dispositivos como resincronizador o desfibrilador implantable hasta definir si hay o no recuperación de la función ventricular (1).
El tratamiento de la miocarditis depende de la etiología: en los casos infecciosos no virales o en los tóxicos se deberá aplicar el tratamiento específico; en los pacientes con miocarditis de etiología reumatológica o miocarditis eosinofílica o de células gigantes se usa la inmunosupresión. En los casos de miocarditis viral se han hecho estudios con inmunosupresores, inmunoglobulina G intravenosa y antivirales, sin resultados satisfactorios que permitan hacer una recomendación clara acerca de su uso (1-3,6,8). En la miocarditis lúpica es necesario usar dosis altas de esteroides, incluso pulsos de metilprednisolona 1 gramo al día por 3 días en casos graves, seguidos por dosis orales altas de prednisona 1 mg/kg/día por 1 a 2 semanas. En casos seleccionados se pueden usar inmunosupresores como ciclofosfamida, azatioprina o inmunoglobulina intravenosa (6,7,10,15).
Otro aspecto del tratamiento es el desmonte de la terapia de falla cardíaca en los pacientes que tienen mejoría o recuperación completa de la función cardíaca, puesto que no está claro si su continuación por largos períodos pueda proteger de recurrencias o prevenir un nuevo deterioro de la fracción de eyección y la progresión a cardiomiopatía dilatada.
En cuanto al pronóstico, depende del tipo de miocarditis: los pacientes con la forma fulminante tienen una tasa de recuperación de la función ventricular mayor del 90% una vez superan la fase aguda e inestable de la enfermedad, mientras que aquellos con miocarditis aguda, si bien tienen un inicio menos grave de la enfermedad que el de los pacientes con miocarditis fulminante, tienen una mayor tasa de progresión a cardiomiopatía dilatada y muerte (9). Los pacientes con miocarditis lúpica tienen una tasa alta de recuperación de la función ventricular, similar a la informada para las de etiologia viral, luego del tratamiento inmunosupresor adecuado (16).
CONCLUSIONES
Presentamos el caso de un paciente con lupus eritematoso sistémico y síndrome antifosfolípido, con historia de intervención coronaria percutánea por disección espontánea de la arteria descendente anterior y con dolor torácico recurrente, interpretado inicialmente como un síndrome coronario agudo, con base en la presencia de angina y la elevación del segmento ST y de las troponinas; la reevaluación clínica y la evolución permitieron llegar al diagnóstico de miocarditis. Las características del dolor, los hallazgos electrocardiográficos que sugirieron miopericarditis, por la elevación tanto en las derivaciones del plano frontal como en las precordiales, con descenso del segmento PR, la demostración de flujo coronario óptimo (flujo TIMI 3 y GPM 3) en la coronariografía sin evidencia de trombosis, el patrón de ascenso y descenso tardíos de las troponinas y los hallazgos ecocardiográficos con trastornos segmentarios de la contractilidad remotos al sitio del compromiso coronario, el cual no fue en principio aterosclerótico, sugieren claramente el diagnóstico propuesto. Aunque no es posible descartar que el cuadro clínico correspondiese a compromiso microtrombótico por síndrome antifosfolípido catastrófico, los criterios deben incluir la afectación de al menos tres órganos, tejidos o sistemas y la exclusión de otro diagnóstico; en nuestro paciente el compromiso sistémico fue secundario a un único órgano: el corazón (9).
La miocarditis es una enfermedad inflamatoria muy posiblemente subdiagnosticada, responsable de un porcentaje importante de progresión a disfunción ventricular y falla cardíaca crónica; además es una enfermedad para tener en cuenta en pacientes con falla cardíaca aguda o con sospecha de evento coronario agudo con presentaciones graves con colapso hemodinámico, en los que es necesaria una identificación oportuna de la enfermedad para poder brindar todas las medidas terapéuticas disponibles que permitan obtener mejores resultados; se debe tener en cuenta, eso sí, que no hay en el momento terapias específicas con buenos resultados para la mayoría de los pacientes. La miocarditis lúpica, si bien es una manifestación rara del LES, debe considerarse en pacientes con aparición de falla cardíaca, dadas las implicaciones en el tratamiento que se debe implementar, aunque hace falta mayor investigación que permita mejores estrategias terapéuticas.
REFERENCIAS BIBLIOGRÁFICAS
1. Gupta S, Markham DW, Drazner MH, Mammen PP. Fulminant myocarditis. Nat Clin Pract Cardiovasc Med. 2008 Nov;5(11):693–706. [ Links ]
2. Magnani JW, Dec GW. Myocarditis: current trends in diagnosis and treatment. Circulation. 2006 Feb 14;113(6):876–90. [ Links ]
3. Cooper LT. Myocarditis. N Engl J Med. 2009 Apr 9;360(15):1526–38. [ Links ]
4. Karamitsos TD, Francis JM, Neubauer S. The current and emerging role of cardiovascular magnetic resonance in the diagnosis of nonischemic cardiomyopathies. Prog Cardiovasc Dis. 2011;54(3):253–65. [ Links ]
5. Mas-Stachurska A, Sitges M, Prat-Gonzalez S. Diagnóstico de la miocarditis: papel de las técnicas de imagen. Cardiocore. 2012;47(4):143–6. [ Links ]
6. Doria A, Iaccarino L, Sarzi-Puttini P, Atzeni F, Turriel M, Petri M. Cardiac involvement in systemic lupus erythematosus. Lupus. 2005 Jan;14(9):683–6. [ Links ]
7. Wijetunga M, Rockson S. Myocarditis in systemic lupus erythematosus. Am J Med. 2002 Oct 1;113(5):419–23. [ Links ]
8. Tenedios F, Erkan D, Lockshin MD. Cardiac involvement in the antiphospholipid syndrome. Lupus. 2005 Jan;14(9):691–6. [ Links ]
9. Cervera R, Rodríguez-Pintó I, Colafrancesco S, Conti F, Valesini G, Rosário C, et al. 14th International Congress on Antiphospholipid Antibodies Task Force Report on Catastrophic Antiphospholipid Syndrome. Autoimmun Rev. 2014 Jul;13(7):699–707. [ Links ]
10. Schultheiss H-P, Kühl U, Cooper LT. The management of myocarditis. Eur Heart J. 2011 Nov;32(21):2616–25. [ Links ]
11. Law WG, Thong BY, Lian TY, Kong KO, Chng HH. Acute lupus myocarditis: clinical features and outcome of an oriental case series. Lupus. 2005 Jan;14(10):827–31. [ Links ]
12. Smith SC, Ladenson JH, Mason JW, Jaffe AS. Elevations of cardiac troponin I associated with myocarditis. Experimental and clinical correlates. Circulation. 1997 Jan 7;95(1):163–8. [ Links ]
13. Mason JW, O'Connell JB, Herskowitz A, Rose NR, Mc- Manus BM, Billingham ME, et al. A clinical trial of immunosuppressive therapy for myocarditis. The Myocarditis Treatment Trial Investigators. N Engl J Med. 1995 Aug 3;333(5):269–75. [ Links ]
14. Kalke S, Balakrishanan C, Mangat G, Mittal G, Kumar N, Joshi VR. Echocardiography in systemic lupus erythematosus. Lupus. 1998 Jan;7(8):540–4. [ Links ]
15. Micheloud D, Calderón M, Caparrros M, D'Cruz DP. Intravenous immunoglobulin therapy in severe lupus myocarditis: good outcome in three patients. Ann Rheum Dis. 2007 Jul;66(7):986–7. [ Links ]
16. McCarthy RE, Boehmer JP, Hruban RH, Hutchins GM, Kasper EK, Hare JM, et al. Long-term outcome of fulminant myocarditis as compared with acute (nonfulminant) myocarditis. N Engl J Med. 2000 Mar 9;342(10):690–5. [ Links ]