Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.27 no.4 Medellín Oct./Dec. 2014
CONFERENCIA CLÍNICO-PATOLÓGICA (CPC)
Conferencia clínico-patológica (CPC): paciente con malformación cardíaca congénita y endocarditis infecciosa
Clinico-pathological conference (CPC): Patient with congenital heart malformation and infective endocarditis
Conferência clínico patológica (CPC): paciente com malformação cardíaca congênita e endocardites infecciosa
Zoraida Ramírez Ortiz1; Luis Fernando Arias2; Juan Carlos Cataño3
1 Residente de Medicina Interna, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
2 Médico Patólogo. Profesor, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
3 Médico Internista e Infectólogo. Profesor, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. kataju@hotmail.com
Recibido: junio 26 de 2014
Aceptado: julio 7 de 2014
RESUMEN
Se presenta el caso de un hombre de 17 años, sin antecedentes de importancia, quien consultó por deterioro de su clase funcional, fatigabilidad y disnea, de un mes de evolución, además de fiebre y síndrome de respuesta inflamatoria sistémica (SIRS), en quien se documentaron una malformación congénita de novo tipo situs inversus con levocardia y una comunicación interventricular (CIV), asociadas a transposición de grandes vasos; durante la hospitalización recibió varios tratamientos con antibióticos sin aislamiento microbiológico ni identificación de la causa de su descompensación hemodinámica. En el examen posmortem se identificó endocarditis por Aspergillus spp., con embolia a diferentes órganos.
PALABRAS CLAVE
Aspergilosis, Anomalías Congénitas, Defecto de los Septos Cardíacos, Endocarditis
SUMMARY
We present the case of a 17 year-old-man, with no remarkable past medical history, who had a one month history of worsening functional class, fatigability and dyspnea, in addition to fever and systemic inflammatory response syndrome (SIRS); a de-novo congenital heart malformation, situs inversus type, with levocardia and a ventricular septal defect (VSD) associated with transposition of great vessels were documented. During hospitalization he received several antibiotic treatments without microbiological isolation or identification of the cause of hemodynamic decompensation. An Aspergillus endocarditis with emboli to different organs was identified in the post-mortem examination.
KEY WORDS
Aspergillosis, Congenital Abnormalities, Endocarditis, Heart Septal Defects
RESUMO
Se apresenta o caso de um homem de 17 anos, sem antecedentes de importância, quem consultou por um mês de evolução de deterioração de sua classe funcional, fatigabilidade e dispneia, além de febre e síndrome de resposta inflamatória sistémica (SIRS) em quem se documentaram uma malformação congênita de novo tipo situs inversus com levocardia e uma comunicação interventricular (CIV), associada a transposição de grandes copos; durante a hospitalização recebeu vários tratamentos com antibióticos sem isolamento microbiológico nem identificação da causa de sua descompensação hemodinâmica. No exame post-mortem se identificou endocardites por Aspergillus spp., com embolia a diferentes órgãos.
PALAVRAS IMPORTANTES
Anomalias Congénitas, Aspergilose, Defeito dos septos cardíacos, Endocardite
HISTORIA CLÍNICA
Hombre de 17 años, natural y residente en Barbosa (Antioquia), área rural, agricultor, soltero, sin hijos, vive con sus padres, sin datos de escolaridad.
Antecedentes
En el momento de la consulta no estaba consumiendo medicamentos de forma crónica. Negó contactos con tuberculosis.
Enfermedad actual
Consultó por disminución en su clase funcional, fatigabilidad y disnea, de un mes de evolución. El cuadro empeoró en la semana previa al ingreso, aquejando dolor intenso de tipo cólico en el flanco derecho, irradiado al epigastrio, con asociación de varios episodios de vómito verdoso y diarrea. Consultó a la unidad local de salud donde le formularon omeprazol, ranitidina y metoclopramida, pero al no observar ninguna mejoría lo remitieron al Hospital Universitario San Vicente Fundación (HUSVF). En la revisión por sistemas la madre refirió que el paciente había tenido fiebre subjetiva tratada con antiinflamatorios no esteroides (AINE) y ''bebidas frescas''. El paciente informó que desde los 7 años comenzó a notar que se cansaba más rápido que los otros niños de su edad y que tenía episodios de disnea cuando presentaba enfermedades virales.
Examen físico
Paciente en regulares condiciones generales, consciente, orientado, con signos leves de deshidratación y palidez mucocutánea, pero sin dificultad respiratoria. Presión arterial 90/60 mm/Hg, frecuencia cardíaca 118 latidos por minuto, frecuencia respiratoria 20 por minuto, saturación de oxígeno 98%, temperatura 36 °C. Sin ingurgitación yugular. Ruidos cardíacos rítmicos con soplo pansistólico en el epigastrio. Pulmones bien ventilados sin ruidos agregados. Abdomen blando, depresible, doloroso a la palpación en el flanco derecho y el epigastrio, sin masas, hepatomegalia sin esplenomegalia, peristaltismo positivo, Blumberg negativo, microblumberg positivo, puño-percusión bilateral negativa. Extremidades inferiores con edema grado 2, llenado capilar menor de dos segundos. Sin signos de irritación meníngea ni déficit neurológico aparente.
Evolución
Una hora después del ingreso fue evaluado por el Servicio de Medicina Interna; lo encontraron en regulares condiciones generales, hipotenso, taquicárdico, taquipneico, sin desaturación. Describieron al examen físico presencia de ondas A en cañón. Ruidos cardíacos rítmicos con soplo sistodiastólico audible en todos los focos, con predominio en la línea paraesternal izquierda. Punto de máximo impulso cardíaco a nivel epigástrico. Ruidos respiratorios conservados sin agregados. No se hallaron cambios en el resto del examen físico. Se lo enfocó como un paciente con posible falla cardíaca descompensada y cardiopatía congénita, sin indicios de un foco infeccioso.
Diez horas después, el Servicio de Enfermería solicitó evaluación porque el paciente presentaba palidez, taquicardia, diaforesis y desaturación. En ese momento el paciente refirió sed intensa y disnea, pero negó dolor torácico; se le encontró presión arterial de 80/40 mm/Hg, frecuencia cardíaca 110 latidos por minuto, frecuencia respiratoria 28 por minuto, temperatura 36,3 °C y saturación de oxígeno 95% con FIO2 al 0,28. Tenía signos claros de hipoperfusión y sobrecarga hídrica; se consideró que cursaba con choque cardiogénico, se iniciaron vasodilatador e inotrópico y se lo trasladó a la unidad de cuidado intensivo (UCI). En esta se sospechó choque mixto (cardiogénico y séptico) por tener aumento de los reactantes de fase aguda, infiltrados pulmonares y un episodio febril, por lo que decidieron iniciar antibioticoterapia empírica con meropenem. Al tercer día estaba con alto requerimiento de soporte vasopresor y choque refractario, por lo que se adicionó linezolid al tratamiento y se hizo punción lumbar con resultado normal. Al séptimo día presentó paro cardiorrespiratorio con ritmo de fibrilación ventricular, por lo que requirió reanimación cardiopulmonar y desfibrilación, además de intubación orotraqueal y ventilación mecánica. Se decidió iniciar metronidazol por sospecha de absceso hepático (según la imagen descrita en la tomografía del abdomen). Al día siguiente lo encontraron con compromiso neurológico y anisocoria, por lo que fue evaluado por el Servicio de Neurocirugía; en la tomografía de cráneo se evidenció sangrado intraparenquimatoso y ventricular; ante la situación clínica del paciente, Neurocirugía decidió ofrecerle solo tratamiento médico. Al décimo día se encontraba en muy malas condiciones, con progresión de la hipoxemia, retención de CO2, acidosis metabólica, sangrado por el tubo orotraqueal, hipotensión y colapso hemodinámico con midriasis bilateral paralítica. Nuevamente hizo paro cardiorrespiratorio; se le hizo reanimación con norepinefrina, adrenalina IV y masaje cardíaco, pero falleció.
EXÁMENES PARACLÍNICOS
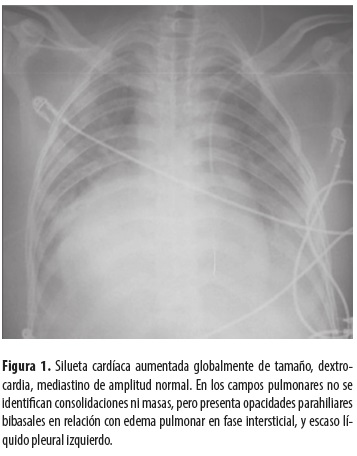
Radiografía de tórax (tomada con equipo portátil) (figura 1).
Ecografía de abdomen. Alteración en la localización usual de los órganos abdominales; el hígado es de tamaño normal, está ubicado en el hipocondrio izquierdo, y se extiende hacia el hipocondrio derecho, en donde se encuentra el lóbulo hepático izquierdo; sin lesiones focales, la vasculatura intrahepática está permeable; vesícula biliar sin enfermedad, sin dilatación de la vía biliar. El páncreas no presenta lesiones focales ni signos inflamatorios, la cabeza se encuentra a nivel del epigastrio con el cuerpo y la cola dirigidos hacia el hipocondrio derecho. El bazo está localizado en el hipocondrio derecho y es de tamaño normal, sin lesiones focales, hay un pequeño bazo accesorio; la aorta está a la derecha de la cava; no se identifican adenopatías retroperitoneales; ambos riñones son de forma, tamaño y posición normales, sin lesiones focales o dilatación de las cavidades pielocolectoras, la vejiga es normal; se observa una cantidad moderada de líquido intraabdominal. Como hallazgos casuales se observaron líquido pleural bilateral de predominio izquierdo con crecimiento de las cavidades cardíacas y líquido pericárdico en cantidad moderada. Conclusión: situs inversus, ascitis en cantidad moderada, derrames pleural y pericárdico.
Ecocardiografía transesofágica. Situs inversus total. Concordancia aurículo-ventricular y ventrículo-arterial normal. Ventrículo izquierdo y aurícula izquierda con leve dilatación de 21 cm2, sin hipertrofia, contractilidad segmentaria normal, fracción de eyección del 40%; ventrículo derecho dilatado con contractilidad y función sistólica disminuidas. Aurícula derecha de 54 cm2, insuficiencia mitral moderada con engrosamiento de sus valvas, insuficiencia tricuspídea severa por dilatación del anillo. Hipertensión pulmonar severa de 68 mm/Hg, tabiques íntegros, sin vegetaciones ni trombos intracavitarios. Aorta ascendente, cayado y descendente normales.
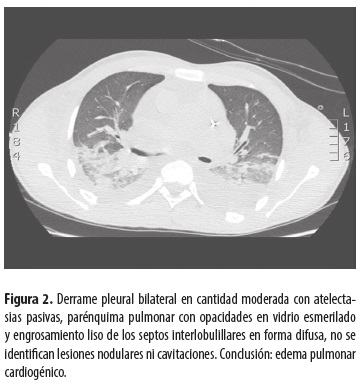
Tomografía de tórax de alta resolución (figura 2)
AngioTAC de tórax. Crecimiento de las cavidades derechas, líquido pericárdico escaso, atelectasias basales con derrame pleural bilateral, ocupación del parénquima pulmonar por edema versus hemorragia alveolar; sin embargo, por la configuración de la lesión no se descarta compromiso infeccioso sobreagregado; no hay imágenes que sugieran tromboembolismo pulmonar (TEP), no hay neumotórax.
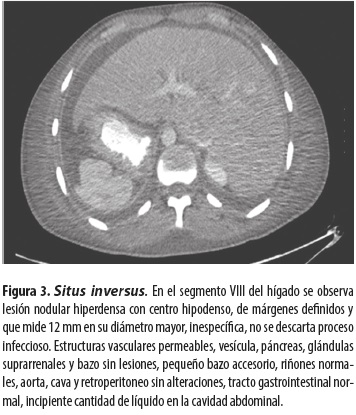
Tomografía contrastada de abdomen (figura 3)
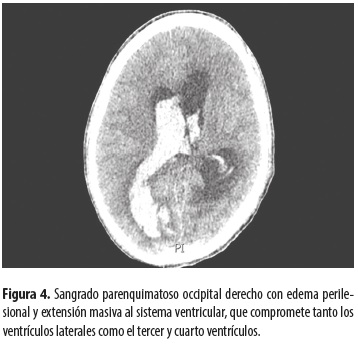
Tomografía de cráneo (figura 4).
Otros exámenes paraclínicos: dos series de hemocultivos negativos; urocultivos en los días 2 y 4: negativos; IgM para Leptospira negativa; T3: 0,55 ng/dL (normal); T4: 1,15 µg/dL (normal); TSH: 1,03 mUI/L (normal); ferritina: 214,87 ng/mL. Troponinas con diferencia de 14 horas: negativas. Serologías virales: antígeno de superficie de hepatitis B: negativo; anticuerpos contra el antígeno de superficie: negativos; anticuerpos contra el antígeno core de hepatitis B: negativos: IgM para hepatitis A: negativa. No se hizo prueba de VIH. (tabla 1)
DISCUSIÓN DEL INTERNISTA
En resumen, se trata de un hombre joven, aparentemente sin ningún antecedente patológico, que ingresó al hospital por cuadro de disnea y choque posiblemente cardiogénico-séptico, en quien se diagnosticaron malformación congénita de tipo situs inversus e hipertensión pulmonar con concordancia aurículo-ventricular según la ecocardiografía. Ingresó con síndrome de respuesta inflamatoria sistémica (SIRS), acidótico, con hepatitis hipóxico-isquémica y coagulación intravascular diseminada (CID), y finalmente falleció por sangrado intracerebral. En este contexto el diagnóstico diferencial es amplio; si tenemos en cuenta las causas de choque cardiogénico (1), descartamos el infarto agudo de miocardio porque el paciente nunca presentó clínica de dolor anginoso y no hubo elevación de las troponinas; tampoco fue el comportamiento clínico de una miocarditis; el diagnóstico de fiebre reumática lo apoyan la ecocardiografía, en la que se halló engrosamiento de las valvas, y la edad del paciente, pero la clínica no sugirió este diagnóstico y desconocemos si tuvo faringoamigdalitis en la infancia o 2 a 3 semanas antes de haberse iniciado el cuadro.
Entre las posibilidades diagnósticas no se descarta la insuficiencia mitral aguda (2) ocasionada por la ruptura espontánea del músculo papilar, aunque este evento es muy raro y generalmente ocurre como consecuencia de un infarto de miocardio; otras buenas posibilidades son la comunicación interventricular (CIV), la embolia pulmonar o la depresión miocárdica severa secundaria a choque séptico; sin embargo, la ecocardiografía descartó la CIV y la angioTAC descartó el TEP. Entre las causas de soplo presumiblemente nuevo asociado a insuficiencia mitral en un paciente con choque mixto (cardiogénico y séptico) se debe pensar siempre en la posibilidad de endocarditis bacteriana o por otros agentes patógenos.
Ahora bien, si enfocamos al paciente partiendo de la presencia de SIRS y le sumamos la CID (3), más el compromiso hepático (hepatitis hipóxico-isquémica), renal y cardíaco, y teniendo en cuenta los hallazgos en las ayudas paraclínicas, se plantean tres posibilidades diagnósticas: absceso hepático (4), endocarditis infecciosa (5) y enfermedad de Weil (6).
Aunque en la tomografía y la ecografía no quedó claro que la imagen descrita en el hígado correspondiera a un absceso hepático (no se describió la presencia de niveles hidroaéreos ni hubo evidencia de que el ''absceso'' se hubiera drenado a la cavidad pleural, peritoneal o pericárdica para explicar las manifestaciones sistémicas del paciente), pero sí tenemos a favor de este diagnóstico el dolor abdominal, el vómito y la diarrea; los abscesos hepáticos, sobre todo los bacterianos, afectan más a personas mayores de 50 años; las causas más comunes son las enfermedades gastrointestinales y biliares; y con respecto a los abscesos amebianos los factores de riesgo más importantes son ser hombre homosexual, estar inmunosuprimido o mentalmente comprometido (4). En conclusión, no creemos que la causa de la enfermedad del paciente haya sido un absceso hepático primario; la imagen vista en la tomografía, si bien puede corresponder a un absceso hepático, probablemente tenga un origen embólico (siembra séptica).
Con respecto a las características clínicas de la enfermedad de Weil, cabe destacar que el paciente presentó fiebre intermitente, dolor abdominal, vómito y diarrea, disfunción hepática y renal, trombocitopenia y una afectación pulmonar que se podría describir como neumonitis hemorrágica (6). En la enfermedad de Weil se han descrito compromiso cardíaco, en relación con miocarditis intersticial, y sangrado intracerebral debido a la inflamación perivascular que se produce como parte de la respuesta inflamatoria a esta infección (7). Sin embargo, tampoco pensamos que el paciente haya cursado con enfermedad de Weil porque la IgM para Leptospira fue negativa, y está descrito que esta prueba tiene sensibilidad cercana al 90% y especificidad del 94% (6). Tampoco apoya el diagnóstico de dicha enfermedad el hecho que la función renal del paciente se haya recuperado por completo sin presentar hematuria, leucocituria, cilindruria o proteinuria; además, el compromiso hepático en la enfermedad de Weil es predominantemente colestásico sin necrosis, y el paciente del caso clínico presentó un patrón hepático por compromiso isquémico.
Finalmente, pensamos que la endocarditis infecciosa (EI) es una buena posibilidad diagnóstica; en efecto, si tratamos de enmarcar al paciente en la tabla de condiciones médicas que la sugieren, propuesta por las guías (5), vemos que presentó fiebre, elevación de los reactantes de fase aguda, compromiso sistémico y posiblemente compromiso embólico evidenciado por la presencia de una lesión en el hígado sospechosa de absceso, todo ello sumado a la probable embolia al sistema nervioso central, que se manifestó por hemorragia intracerebral. Es también importante recordar que la presentación de la EI puede ser aguda, como una infección rápidamente progresiva, pero que también se puede manifestar como una infección subaguda con fiebre de bajo grado y síntomas inespecíficos, lo cual dificulta el diagnóstico precoz (5).
Si tratamos de encuadrar la condición clínica del paciente dentro de los criterios de Duke para el diagnóstico de endocarditis infecciosa, vemos que solo cumple uno de los mayores, la regurgitación valvular mitral, asumiendo que esta sea nueva; y de los criterios menores cumple el de la fiebre con temperatura mayor de 38 °C y los fenómenos vasculares, que han sido descritos como infartos pulmonares por embolia séptica a las arterias principales o la presencia de hemorragia intracraneal por ruptura de aneurismas micóticos (5). Recordemos que el paciente en discusión presentó al final de sus días hemorragia alveolar e intracerebral, que no se pueden explicar completamente por la CID, y es grande la posibilidad de que hayan sido secundarias a émbolos sépticos. Si contabilizamos estrictamente cuántos criterios de Duke cumplía este paciente para el diagnóstico de EI, vemos que tenía la insuficiencia mitral como criterio mayor y de uno a tres de los menores, lo cual hace el diagnóstico de EI posible, pero no definitivo como quisiéramos. Sin embargo, es importante también aclarar que los criterios de Duke tienen sensibilidad y especificidad por encima del 80%, pero no reemplazan el juicio clínico.
Por esta razón pensamos que el paciente cursó con una EI que lo llevó a las complicaciones vasculares que finalmente le produjeron la muerte. Ahora bien, dos series de hemocultivos fueron negativas y en la ecocardiografía no se vieron vegetaciones. Está descrito que del 2,5% al 31% de los pacientes con EI pueden cursar con hemocultivos negativos, debido principalmente al uso previo de antibióticos y/o a la presencia de un germen de crecimiento difícil en los hemocultivos tradicionales o en el tiempo esperado (5,8). Las ecocardiografías que no muestren inicialmente la vegetación se deben repetir en los 7 a 10 días siguientes, si la sospecha clínica persiste, porque en ese intervalo, en algunos casos, la vegetación puede alcanzar el tamaño detectable y se pueden llegar a evidenciar también abscesos o trayectos fistulosos (9).
Con esta información, se concluye que la EI del paciente debió ser ocasionada por un microorganismo de crecimiento difícil como las bacterias del grupo HACEK (Haemophilus influenzae o parainfluenzae, Aggregatibacter actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae) o por alguno de los hongos, que son más probables en pacientes inmunocomprometidos, portadores de válvulas protésicas, líneas venosas, dispositivos cardíacos o con falla renal (10). Son estos últimos los que más probablemente podrían estar afectando al paciente, dadas la inmunosupresión generada por su cardiopatía y la falta de respuesta a los antibióticos.
Conclusión del internista
En conclusión, considero que se trata de un paciente con una anomalía congénita cardíaca, pulmonar y abdominal que lo puso en condición de inmunosupresión; quien ingresó al hospital con un síndrome de falla cardíaca debido a choque mixto (séptico y cardiogénico) originado por un proceso infeccioso larvado. Pienso que cursó con endocarditis infecciosa probablemente por un germen de crecimiento difícil o un hongo, con embolias sépticas pulmonar y cerebral manifestadas por múltiples infartos en diferentes tejidos, y los consecuentes sangrados (hemorragia alveolar e intracerebral) que lo llevaron a la muerte.
ANATOMÍA PATOLÓGICA
Estudio macroscópico
El cadáver mostraba edema e ictericia generalizados. En el encéfalo se encontró hemorragia intraventricular extensa con coágulos en todo el sistema ventricular y dilatación del mismo; además de un punteado hemorrágico en el cerebelo, el cuerpo calloso y los lóbulos frontal y occipital. El pulmón localizado en el lado derecho tenía dos lóbulos y língula, el localizado en el lado izquierdo tenía tres lóbulos; a ambos lados había múltiples lesiones abscedadas en la superficie pleural; los pulmones eran de consistencia sólida, con hepatización; al corte del parénquima tenían un color pardo y rojizo y eran sólidos, con pérdida de la arquitectura normal y múltiples nódulos purulentos bilaterales (figura 5).
Corazón de localización retroesternal, aumentado de peso: 600 g. Ambas aurículas con aspecto morfológico izquierdo (isomerismo); superficie interna lisa, sin músculos pectíneos. El ventrículo localizado en el lado derecho tenía morfología de ventrículo derecho: septo trabeculado con trabéculas carnosas gruesas, cresta supraventricular que separaba la válvula tricúspide de la semilunar y presencia de músculo papilar septal. El ventrículo localizado en el lado izquierdo tenía morfología de ventrículo izquierdo: superficie septal lisa, continuidad fibrosa entre la válvula mitral y la semilunar y ausencia de músculo papilar septal. Pequeña comunicación interventricular en la porción superior del septo, con área blanquecina engrosada y friable compatible con una vegetación.
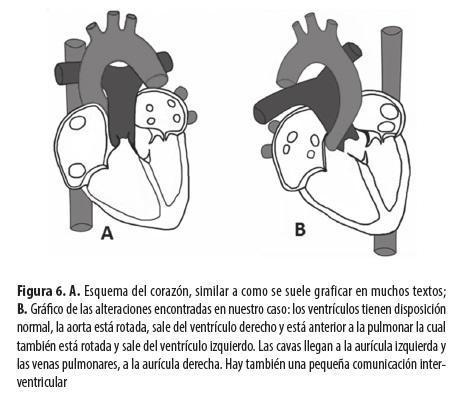
El vaso que salía del ventrículo derecho correspondía a la aorta y estaba anterior, el que salía del ventrículo izquierdo correspondía a la arteria pulmonar y estaba posterior; la aorta descendente estaba al lado derecho y la cava inferior, al izquierdo; las venas cavas desembocaban en la aurícula del lado izquierdo y las venas pulmonares, en la aurícula ubicada en el lado derecho; es decir, la circulación sistémica llegaba a la aurícula localizada en el lado izquierdo, salía por la arteria pulmonar y de allí regresaba por las venas pulmonares a la aurícula ubicada en el lado derecho, de allí pasaba al ventrículo del mismo lado y salía por la aorta a la circulación sistémica (figura 6). En resumen: corazón con levocardia (ventrículo derecho al lado derecho e izquierdo al lado izquierdo), transposición corregida de grandes vasos, isomerismo auricular izquierdo y comunicación interventricular con vegetación. No se encontró comunicación interauricular ni había ductus arterioso permeable.
Orientación visceral abdominal anormal: bazo, cola del páncreas y estómago al lado derecho; hígado, ciego y apéndice cecal al lado izquierdo. Bazo aumentado de tamaño, friable y hemorrágico; dos bazos accesorios de 1,5 cm y 0,8 cm. Mucosas del tubo digestivo sin alteraciones. Hígado marcadamente congestivo con aspecto ''en nuez moscada''.
Estudio microscópico
Múltiples áreas de hemorragia alrededor del sistema ventricular cerebral, con muchos microabscesos en cerebro, cerebelo, tallo y meninges, en cuyo material se identifican hifas septadas en ángulo agudo, compatibles con Aspergillus spp. Pulmones con múltiples nódulos abscedados que contienen también el hongo. Áreas de daño alveolar, edema y hemorragia (figura 7). En el miocardio también se identifican abscesos con hongos. En el defecto interventricular hay calcificaciones y una vegetación formada por fibrina e infiltrado de polimorfonucleares con estructuras micóticas similares a las descritas en el encéfalo y los pulmones (figura 8). Estos hongos también se identifican en microabscesos en el parénquima renal y en la pared de las venas de varios órganos (figura 9). El hígado muestra necrosis masiva de tipo isquémico que compromete las zonas 2 y 3, sin afectación de los espacios porta. En otros órganos hay congestión vascular, sin otras alteraciones específicas.
Diagnósticos finales: situs inverso con levocardia, comunicación interventricular, transposición corregida de los grandes vasos, isomerismo auricular izquierdo, endocarditis micótica (Aspergillus spp.), aspergilosis invasiva sistémica, hemorragia intracerebral, necrosis hepática masiva isquémica y polisplenia.
DISCUSIÓN FINAL
En muchos casos de situs inversus el corazón puede estar localizado en el lado derecho, con el ápex apuntando a dicho lado: dextrocardia; sin embargo, con menor frecuencia puede estar ubicado en el lado izquierdo o más central, con el ápex apuntando al lado izquierdo, como ocurre normalmente: levocardia; en este último caso son más comunes las malformaciones cardíacas, como ocurrió en nuestro paciente. La transposición de los grandes vasos es la salida de la aorta del ventrículo derecho y del tronco pulmonar del izquierdo; si la aorta surge de un ventrículo morfológicamente derecho y la pulmonar, de uno morfológicamente izquierdo se denomina transposición completa de grandes vasos, y hay concordancia aurículo-ventricular (cada aurícula se comunica con su ventrículo apropiado). En dicha transposición completa la sangre oxigenada que llega a la aurícula izquierda pasa al ventrículo izquierdo y de allí a los pulmones para retornar al ventrículo izquierdo; a su vez, la circulación sistémica solo pasaría por el lado derecho, y así las circulaciones pulmonar y sistémica están en paralelo y no en serie como es normal, ya que sin ninguna comunicación la vida extrauterina no podría mantenerse. Usualmente hay un foramen oval permeable, algún defecto interauricular o interventricular y un ductus arterioso permeable, pero aun así es una cardiopatía cianosante que se manifiesta en los primeros días de vida.
En la transposición corregida de los grandes vasos hay además discordancia aurículo-ventricular, es decir, la circulación sistémica llega a la aurícula que se comunica con el ventrículo del que surge la arteria pulmonar y la circulación pulmonar, a la aurícula que se comunica con el ventrículo del que surge la aorta (11). En nuestro paciente la sangre oxigenada llegaba a la aurícula del lado derecho, de allí pasaba al ventrículo derecho y luego a la aorta, para retornar por las cavas a la aurícula izquierda, el ventrículo izquierdo y luego a la arteria pulmonar para ir a los pulmones. Las alteraciones clínicas en la transposición corregida de grandes vasos dependen de otras malformaciones asociadas, o de alteraciones en el sistema de conducción. Entre las malformaciones asociadas con mayor frecuencia están las anormalidades de la válvula tricúspide, la estenosis o atresia pulmonar, el ductus arterioso permeable y defectos del septo ventricular, como ocurrió en nuestro paciente. Esta comunicación interventricular era pequeña y no generaba alteraciones clínicas notorias; los episodios de ''asfixia'' con actividad física intensa, como relató la madre, y que fueron considerados como ''asma'', pueden haberse debido a esta alteración.
La comunicación interventricular encontrada en el paciente presentaba una vegetación con infección micótica, o sea, una endocarditis micótica que fue muy probablemente el origen de los múltiples émbolos detectados en el pulmón, el sistema nervioso central, los riñones y vasos sanguíneos. La endocarditis de un defecto interventricular es muy infrecuente (11) y más aún si es producida por infecciones micóticas (12). La extensa afectación pulmonar produjo insuficiencia respiratoria, que sumada a la infección micótica con abscedación intramiocárdica produjo hipoxia grave, lo cual explica la necrosis de tipo isquémico en el hígado.
La endocarditis infecciosa por hongos es una entidad rara con tasa alta de mortalidad incluso con diagnóstico y tratamiento médico y quirúrgico oportunos (13). Representa un bajo porcentaje del total de las endocarditis, aunque se describe un aumento en el número de casos, que alcanza entre 1% y 6%, y en algunas series hasta un 10%, del total de casos de endocarditis principalmente en pacientes con prótesis valvular (14).
Candida spp., es el agente etiológico más frecuente de las endocarditis por hongos (50% a 70% de los casos) seguida por Aspergillus spp., (20% a 30%); la mayoría son causadas por A. fumigatus (54%), seguido por A. terreus (18%), A. niger (7%) y A. flavus (7%) (15).
Entre los principales factores de riesgo para desarrollar una endocarditis por Aspergillus se encuentra una serie de anormalidades cardíacas (41% de los casos), prótesis valvulares (39%), enfermedades malignas (18%), trasplante de órgano sólido (18%) y trasplante de médula ósea (18%), en el que la tasa de mortalidad puede alcanzar hasta el 57% (14). También se han informado otros factores de riesgo como el tratamiento con esteroides (55%), la exposición prolongada a antibióticos (31%) y el uso de quimioterapia (28%); además se ha descrito que en las series pediátricas el factor de riesgo más común es la presencia de enfermedad congénita cardíaca (16).
La característica ecocardiográfica más significativa es la presencia de vegetaciones de gran tamaño, que conlleva un alto riesgo de complicaciones como la embolia periférica y central, la obstrucción de la vasculatura de las extremidades, la embolia pulmonar, alteraciones en el sistema nervioso central y falla cardíaca (17).
El diagnóstico de endocarditis por Aspergillus requiere un altísimo índice de sospecha; casi en el 21% de los casos el diagnóstico se establece posmortem, los cultivos de sangre son casi siempre negativos; la mayoría de las veces se logra demostrar la vegetación por ecocardiografía transesofágica, debido a su gran tamaño (17). La prueba de ELISA para el antígeno galactomanán puede ser una herramienta útil para establecer el diagnóstico de aspergilosis invasiva (18), pero no ha sido estudiada en el escenario de las endocarditis. Pueden ocurrir falsos positivos en otras infecciones fúngicas como histoplasmosis, blastomicosis, criptococosis y penicilinosis; también con el uso concomitante de suplementos nutricionales contaminados y el de soluciones electrolíticas como la plasma light (19). Sin embargo, es una opción usar las pruebas antigénicas mientras se tienen los resultados de los estudios histopatológicos y los cultivos del tejido para confirmar el diagnóstico.
El tratamiento de la endocarditis por Aspergillus requiere la combinación de la terapia antifúngica y el desbridamiento quirúrgico. El medicamento de primera línea es el voriconazol, que ha resultado superior a la anfotericina B, con mejores tasas de supervivencia, menor nefrotoxicidad y menos anormalidades electrolíticas (20). Sin embargo, otros estudios han logrado demostrar que la terapia combinada, ya sea de voriconazol con anfotericina B o de voriconazol con caspofungina, puede aumentar la tasa de supervivencia de los pacientes principalmente en casos de aspergilosis invasiva grave (21). Aún sigue siendo motivo de estudio la duración apropiada de la terapia antifúngica, pero la mayoría de los autores recomiendan mantener de por vida la terapia supresora.
El pronóstico de la endocarditis por Aspergillus es malo, la tasa de mortalidad está cerca del 65%, lo cual se debe principalmente al estado de inmunosupresión del hospedero, al retardo en el diagnóstico y a las complicaciones embólicas; es incluso mucho más alta (100%) en los pacientes que solo reciben tratamiento médico.
REFERENCIAS BIBLIOGRÁFICAS
1. Patel AK, Hollenberg SM. Cardiovascular failure and cardiogenic shock. Semin Respir Crit Care Med. 2011 Oct;32(5):598–606. [ Links ]
2. Mokadam NA, Stout KK, Verrier ED. Management of acute regurgitation in left-sided cardiac valves. Tex Heart Inst J. 2011 Jan;38(1):9–19. [ Links ]
3. Levi M, Toh CH, Thachil J, Watson HG. Guidelines for the diagnosis and management of disseminated intravascular coagulation. British Committee for Standards in Haematology. Br J Haematol. 2009 Apr;145(1):24–33. [ Links ]
4. Mangukiya DO, Darshan JR, Kanani VK, Gupta ST. A prospective series case study of pyogenic liver abscess: recent trands in etiology and management. Indian J Surg. 2012 Oct;74(5):385–90. [ Links ]
5. Habib G, Hoen B, Tornos P, Thuny F, Prendergast B, Vilacosta I, et al. Guidelines on the prevention, diagnosis, and treatment of infective endocarditis (new version 2009): the Task Force on the Prevention, Diagnosis, and Treatment of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by the European. Eur Heart J. 2009 Oct;30(19):2369–413. [ Links ]
6. Picardeau M. Diagnosis and epidemiology of leptospirosis. Médecine Mal Infect. 2013 Jan;43(1):1–9. [ Links ]
7. Abuauad MC, Osorio G, Rojas JL, Pino L. [Leptospirosis: report of a fulminant fatal case and review]. Rev Chilena Infectol. 2005 Mar;22(1):93–7. [ Links ]
8. Molina FJ, Díaz CA, Barrera L, De La Rosa G, Dennis R, Dueñas C, et al. [Microbiological profile of infections in the Intensive Care Units of Colombia (EPISEPSIS Colombia]. Med Intensiva. 2011 Mar;35(2):75–83. [ Links ]
9. Math RS, Sharma G, Kothari SS, Kalaivani M, Saxena A, Kumar AS, et al. Prospective study of infective endocarditis from a developing country. Am Heart J. 2011 Oct;162(4):633–8. [ Links ]
10. Lamas CC, Eykyn SJ. Blood culture negative endocarditis: analysis of 63 cases presenting over 25 years. Heart. 2003 Mar;89(3):258–62. [ Links ]
11. Calleja Subirán MC, Taboada Vilariño F. [Bacterial endocarditis in an adult on the interventricular septal congenital defect]. An Med Interna. 2005 Jan;22(1):47–9. [ Links ]
12. Tacke D, Koehler P, Cornely OA. Fungal endocarditis. Curr Opin Infect Dis. 2013 Dec;26(6):501–7. [ Links ]
13. Falcone M, Barzaghi N, Carosi G, Grossi P, Minoli L, Ravasio V, et al. Candida infective endocarditis: report of 15 cases from a prospective multicenter study. Medicine (Baltimore). 2009 May;88(3):160–8. [ Links ]
14. Pierrotti LC, Baddour LM. Fungal endocarditis, 1995- 2000. Chest. 2002 Jul;122(1):302–10. [ Links ]
15. Kalokhe AS, Rouphael N, El Chami MF, Workowski KA, Ganesh G, Jacob JT. Aspergillus endocarditis: a review of the literature. Int J Infect Dis. 2010 Dec;14(12):e1040–7. [ Links ]
16. Hoen B, Duval X. Clinical practice. Infective endocarditis. N Engl J Med. 2013 Apr 11;368(15):1425–33. [ Links ]
17. McCormack J, Pollard J. Aspergillus endocarditis 2003-2009. Med Mycol. 2011 Apr;49 Suppl 1:S30–4. [ Links ]
18. Verdaguer V, Walsh TJ, Hope W, Cortez KJ. Galactomannan antigen detection in the diagnosis of invasive aspergillosis. Expert Rev Mol Diagn. 2007 Jan;7(1):21–32. [ Links ]
19. Hope WW, Walsh TJ, Denning DW. Laboratory diagnosis of invasive aspergillosis. Lancet Infect Dis. 2005 Oct;5(10):609–22. [ Links ]
20. Walsh TJ, Anaissie EJ, Denning DW, Herbrecht R, Kontoyiannis DP, Marr KA, et al. Treatment of aspergillosis: clinical practice guidelines of the Infectious Diseases Society of America. Clin Infect Dis. 2008 Feb 1;46(3):327–60. [ Links ]
21. Marr KA, Boeckh M, Carter RA, Kim HW, Corey L. Combination antifungal therapy for invasive aspergillosis. Clin Infect Dis. 2004 Sep 15;39(6):797–802. [ Links ]