Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.28 no.2 Medellín Apr./June 2015
https://doi.org/10.17533/udea.iatreia.v28n2a06
ARTÍCULO DE REVISIÓN
DOI 10.17533/udea.iatreia.v28n2a06
Infección por el virus de la hepatitis A: epidemiología y diversidad genética
Hepatitis A virus infection: Epidemiology and genetic diversity
Infecção pelo vírus da hepatite A: epidemiologia e diversidade genética
María Cristina Navas Navas1; Paula Andrea Báez Triana2
1 Profesora Asociada, Departamento de Microbiología y Parasitología, Facultad de Medicina, Universidad de Antioquia. Coordinadora, Grupo de Gastrohepatología, Universidad de Antioquia, Medellín, Colombia. maria.navas@udea.edu.co
2 Estudiante de Maestría. Grupo de Gastrohepatología, Universidad de Antioquia, Medellín, Colombia
Recibido: enero 17 de 2014
Aceptado: julio 10 de 2014
RESUMEN
La infección por el virus de la hepatitis A es un problema global de salud pública. El virus está ampliamente distribuido y es la principal causa de hepatitis aguda de transmisión entérica en Latinoamérica. La partícula viral es estable en el medio ambiente y conserva su infectividad por varias semanas, lo que facilita su transmisión por agua y alimentos contaminados. Mundialmente se han descrito distintos patrones epidemiológicos, que pueden cambiar en el tiempo al modificarse variables socioeconómicas en la población como las condiciones sanitarias básicas y la vacunación. Esto deja al descubierto nuevas poblaciones susceptibles a la infección. En Latinoamérica se ha descrito la circulación del genotipo I y los subgenotipos A y B, pero se requieren más investigaciones que aporten el conocimiento necesario para gestionar planes de prevención y control para la disminución mundial de la prevalencia de la infección. Para este artículo se hizo una revisión de la literatura en las bases de datos SciELO, PubMed y ScienceDirect bajo los términos de búsqueda ''Virus de la hepatitis A'', ''Epidemiología'', ''Seroprevalencia'' e ''Infección''. De los resultados obtenidos se incluyeron únicamente las publicaciones en inglés y español que describieran estudios epidemiológicos y moleculares de interés en Latinoamérica.
PALABRAS CLAVE
Epidemiología, Hepatitis, Salud Pública, Virus de la Hepatitis A
SUMMARY
Hepatitis A virus infection is a global public health problem. The virus has a wide range of distribution and it is the main cause of acute hepatitis transmitted by the enteric route in Latin America. The viral particle is stable under environmental conditions and conserves its infectivity for several weeks, enabling its transmission by contaminated water and food. Worldwide, different epidemiological patterns have been identified, which may change over time by modification of social and economic variables in the population such as vaccination and the improvement of hygiene and primary health conditions. This leaves new populations susceptible to infection. In Latin America the circulation of genotype I and subgenotypes A and B has been described, but more research is needed to provide the knowledge needed to manage the prevention and control plans for the worldwide reduction of the prevalence of infection. For this paper, a literature review was performed on the SciELO, PubMed and ScienceDirect databases under the search terms "Hepatitis A", "Epidemiology," "Seroprevalence" and "Infection." From the results obtained, only papers published in English and Spanish to describe epidemiological and molecular studies of interest in Latin America were included.
KEY WORDS
Epidemiology, Hepatitis, Hepatitis A Virus, Public Health
RESUMO
A infecção pelo vírus da hepatite A é um problema global de saúde pública. O vírus está amplamente distribuído e é a principal causa de hepatite aguda de transmissão entérica na América Latina. A partícula viral é estável no médio ambiente e conserva sua infecciosidade por várias semanas, o que facilita sua transmissão por água e alimentos contaminados. Mundialmente se descreveram diferentes padrões epidemiológicos, que podem mudar no tempo ao modificar- se variáveis socioeconômicas na população como as condições sanitárias básicas e a vacinação. Isto deixa ao descoberto novas populações susceptíveis à infecção. Na América Latina se descreveu a circulação do genótipo I e os sub-genótipos A e B, mas são necessárias mais investigações que contribuam o conhecimento necessário para gerir planos de prevenção e controle para a diminuição mundial da prevalência da infecção. Para este artigo se fez uma revisão da literatura nas bases de dados SciELO, Pub- Med e ScienceDirect sob os termos de busca ''Vírus da hepatite A'', ''Epidemiologia'', ''Seroprevalência'' e ''Infecção''. Dos resultados obtidos se incluíram unicamente os estudos publicados em inglês e espanhol que descrevessem estudos epidemiológicos e moleculares de interesse na América Latina.
PALAVRAS CHAVES
Epidemiologia, Hepatite, Saúde Pública, Vírus da Hepatite A
INTRODUCCIÓN
El virus de la hepatitis A (VHA) es el agente etiológico más frecuente de hepatitis aguda entérica en América Latina (1). Su principal ruta de transmisión es la fecaloral por consumo de agua y alimentos contaminados (2-5); también se puede transmitir por el contacto de persona a persona y, en raras ocasiones, por transfusiones de sangre o por vía sexual (4,6-9). La epidemiología de la infección por VHA se relaciona estrechamente con los bajos niveles de higiene (8,10,11).
La enfermedad se desarrolla en dos etapas: la preictérica y la ictérica, que se presenta generalmente en adolescentes y adultos jóvenes (7,12). La infección en niños preescolares y escolares generalmente tiene un curso asintomático (3,7,8). Los brotes causados por este virus pueden aparecer de manera esporádica en regiones endémicas y con tendencia periódica en áreas de baja endemicidad (13,14). Adicionalmente, la infección por VHA tiene implicaciones económicas y sociales dado que la recuperación puede tardar de semanas a meses, retrasando las actividades laborales y escolares (3,15).
Se hizo la búsqueda de estudios epidemiológicos y moleculares y de revisiones sistemáticas tanto en inglés como en español en las bases de datos SciELO, PubMed y ScienceDirect. En los términos de búsqueda se incluyeron las palabras ''Virus de la hepatitis A'', ''Epidemiología'', ''Seroprevalencia'' e ''Infección''. De los resultados se incluyeron artículos publicados de 1912 hasta 2014 que presentaran evidencia de circulación del VHA en diferentes países así como datos epidemiológicos y moleculares de interés, con especial énfasis en América Latina.
DESCRIPCIÓN DE LA PARTÍCULA VIRAL
El VHA fue descrito en 1973 por análisis de inmunomicroscopía electrónica (IME) a partir de muestras de suero y materia fecal de pacientes infectados con la cepa MS-1 identificada en Nueva York en 1964 (16). Es un virus de 27 a 32 nm de diámetro, sin envoltura lipídica cuya cápside se caracteriza por tener simetría icosaédrica. Pertenece a la familia Picornaviridae y es el único miembro del género Hepatovirus. Se diferencia de otros picornavirus porque no produce efecto citopático (17) y por su alta estabilidad tanto genética como antigénica, entre otras características (18).
DESCRIPCIÓN DEL GENOMA
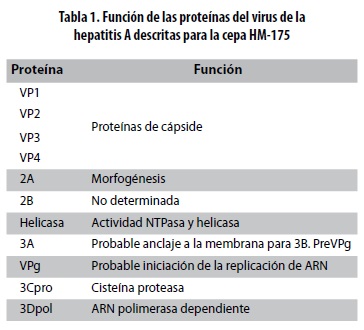
El genoma del VHA está constituido por una cadena sencilla de ARN lineal de 7,5 kb en sentido positivo, flanqueada en sus extremos 5' y 3' por regiones no codificantes o NCR (por la sigla en inglés de non-codifying regions); contiene un solo marco de lectura abierto (ORF, por la sigla en inglés de open reading frames) que codifica para una poliproteína de 2.227 aminoácidos (19). La NCR 3', de aproximadamente 60 nucleótidos, se encuentra unida a una señal de poliadenilación, y la NCR 5', de aproximadamente 750 nucleótidos, contiene un sitio interno de entrada al ribosoma (IRES, por la sigla en inglés de internal ribosome entry site) que direcciona el ribosoma hacia el codón de iniciación para la síntesis de la poliproteína (8,20-22). La poliproteína generada puede organizarse en tres regiones principales (figura 1) (8,21), a saber: P1 que codifica para las cuatro proteínas de cápside, VP1, VP2, VP3 y VP4. Y P2 y P3, que comprenden proteínas no estructurales con funciones bioquímicas que soportan la replicación viral, como la 2A que interviene en la morfogénesis de la cápside, la 2C con función helicasa, la 3C con función proteasa y la 3D como ARN polimerasa (tabla1) (8,23).
El virus se une al receptor celular HAVcr-1 (por la sigla en inglés de Hepatitis A virus cellular receptor 1), una glicoproteína integral de membrana clase I caracterizada por dominios similares a los de mucinas e inmunoglobulinas (5,20,24,25). Sin embargo, se propone que otros receptores deben intervenir en el proceso de unión y entrada del virus a la célula puesto que HAVcr-1 está presente en otras poblaciones celulares además de los hepatocitos (24,25).
PROPIEDADES FÍSICAS
Las partículas del VHA son estables en el medio ambiente, permanecen de días a meses en suelos, fuentes de agua, sedimento marino y ostras (5,26-30). Son resistentes al pH en un rango de 3 a 10; se requiere un pH superior a 10 para inactivarlas. Sin embargo, a pH 1 pueden retener su infectividad por 8 horas a temperatura ambiente y a 38 °C por más de 90 minutos, a diferencia de otros picornavirus (5,6,31). También resiste temperaturas de refrigeración y congelación. Es relativamente resistente a temperaturas altas, pues retiene su infectividad a 60 °C por aproximadamente una hora (20,31). El VHA se inactiva en minutos de 98 °C a 100 °C y por autoclavado y radiación ultravioleta (6,20,31).
La eficiencia de compuestos clorados como el hipoclorito de sodio para la inactivación del VHA es relativa teniendo en cuenta que en escenarios ambientales las partículas virales se asocian a la materia orgánica presente en el medio, lo que dificulta la inactivación (6,31-33). En Colombia según la resolución 2115 del 2007 el valor de cloro residual libre en el agua para consumo humano es admisible en un rango de 0,3 a 2,0 mg/L.
EPIDEMIOLOGÍA
La Organización Mundial de la Salud (OMS) estima que en el 2005 hubo en el mundo aproximadamente 119.000.000 de personas infectadas y 34.000 muertes por VHA (11). Actualmente se registran en el mundo alrededor de 1.400.000 casos anuales de infección por VHA (3,13,34,35). El porcentaje de letalidad fue menor del 1,5% en los pacientes hospitalizados (5,36). Para los pacientes menores de 15 años la tasa de letalidad estimada fue de 0,1%; para los de 15 a 32 años, de 0,3% y para los mayores de 40 años, de 2,1% (7).
Existen cuatro diferentes patrones de seroprevalencia de la infección por VHA relacionados con el nivel de desarrollo socioeconómico y las condiciones sanitarias básicas de cada país y región. Según la OMS, en regiones de alta endemicidad se observa una seroprevalencia en población infantil de 90% o más a la edad de 10 años, mientras que en regiones de endemicidad intermedia la seroprevalencia a dicha edad es menor de 90% y a los 15 años, de 50% o menos. En regiones de endemicidad baja, la seroprevalencia es de 50% o menos a la edad de 30 años y menor de 50% a la edad de 15 años; para regiones de muy baja endemicidad, la seroprevalencia es menor de 50% a la edad de 30 años (7,14,35,37-39).
Las regiones del Sureste de Asia y África Subsahariana presentan una alta endemicidad (14,26,40); el Mediterráneo Oriental, Asia Central, África del Norte, Centroamérica y Suramérica presentan endemicidad intermedia (1,14). Europa Central y Oriental presentan baja endemicidad mientras que Europa Occidental, Norteamérica y la región del Suroeste de Oceanía presentan muy baja endemicidad (38).
En Latinoamérica la seroprevalencia ha evolucionado gracias a la inversión en infraestructura en acueductos y sistemas de alcantarillado en diferentes regiones de cada país, lo que asegura el suministro de agua a la población con calidad ecológica y sanitaria y el saneamiento ambiental de las cuencas; sin embargo, estas mejoras no incluyen a la totalidad de la población (1,2,14). En un extenso análisis efectuado por la OMS, con base en los resultados de diferentes estudios de seroprevalencia en la región, Latinoamérica era considerada una región de alta endemicidad en las décadas de los 70 y los 80 (7,14). Sin embargo, a finales de la década de los 90 se evidenció en la región un patrón de endemicidad intermedia (1,7,37,41). Dicho cambio pudo atribuirse a un rápido desarrollo económico durante esa década. Bajo este nuevo patrón de endemicidad, disminuyó el número de casos de infección en la primera infancia como se registró en México, donde en 1982 la seroprevalencia de la infección por VHA era del 75% en niños menores de 5 años y en 1987 disminuyó a 37% en esta población infantil (1), aunque también se incrementó el número de brotes en adolescentes y adultos, asociado con un aumento en las tasas de morbilidad y mortalidad en comparación con los índices registrados en el período de alta endemicidad (1,41,42).
En 1999 República Dominicana y México presentaban las tasas más altas de seroprevalencia en comparación con Argentina, Chile, Brasil y Venezuela. Las poblaciones de niños entre 1 y 10 años de edad de Brasil, Venezuela, Argentina y México presentaron una tasa de seroprevalencia de alrededor del 30% al 60%, característica de las regiones de endemicidad intermedia (1,42); también se observaron diferencias en las tasas de seroprevalencia entre las zonas urbanas y las rurales (1).
Entre el 2007 y el 2009 se llevó a cabo un estudio para evaluar la hipótesis según la cual el acceso al agua potable y la disposición de aguas residuales eran deficientes y estarían relacionadas con un patrón de alta endemicidad. El estudio se hizo en la población rural de tres ciudades de Brasil: Río de Janeiro, Cuiabá y Manaos. La seroprevalencia en niños de 10 a 14 años de edad fue mayor del 50%, lo que indica una población de niños entre 1 y 4 años susceptibles a la infección por VHA (42). Estos resultados, similares a los hallados en el estudio hecho en 1999, son característicos de regiones de endemicidad intermedia. En comparación con estudios previos en estas zonas rurales, se pudo concluir que las tasas de seroprevalencia han disminuido del 70% al 40% en los últimos 9 años (42). Aunque la población rural tenía un bajo ingreso económico, sus viviendas contaban con buenos sistemas de disposición de aguas residuales y acceso a agua potable. Es importante aclarar que el estatus socioeconómico es una de las variables relacionadas con la prevalencia de VHA cuando describe directamente los niveles de sanidad y acceso a agua potable (42).
En Colombia se publicó en 1985 un estudio de hepatitis viral en comunidades de la Sierra Nevada de Santa Marta, en donde habita una población con condiciones sanitarias deficientes; en tal estudio se describió una prevalencia de IgM anti-VHA del 98% al 100% en niños menores de 15 años, lo que corresponde a un patrón de alta endemicidad (43). En 1997 se estudió en la ciudad de Medellín la prevalencia de anticuerpos IgG anti-VHA en población de los estratos 1, 2 y 3 y se encontró una frecuencia de 93,5% para niños de 3 a 6 años. En 2003 se dio continuidad a la investigación en los estratos 4, 5 y 6; se recolectaron muestras de individuos entre 2 y 40 años de edad, de las cuales 24,2% fueron positivas para IgG anti-VHA (44); el grupo de 20 a 29 años presentó mayor seroprevalencia, lo que comenzó a evidenciar el cambio de patrón epidemiológico en Colombia, siguiendo la tendencia de otros países latinoamericanos.
Posteriormente, en el 2012, se estudió una población de niños de 1 a 15 años de edad en cinco ciudades de Colombia. Se halló una tasa de seroprevalencia del 33,1% en el grupo de 10 a 15 años de edad y se determinó la edad promedio de infección entre los 10 y 12 años (35).
El cambio en el patrón epidemiológico que se evidenció durante los últimos años, previo a la introducción de la vacuna en Latinoamérica, expuso una nueva población de niños susceptibles (42), de tal manera que el VHA es el agente etiológico de un número importante de casos de falla hepática aguda en niños y adolescentes en la región. Esta aseveración se confirma con el estudio llevado a cabo durante 2001-2002 en pacientes de 1 a 20 años hospitalizados por sospecha de falla hepática aguda en Argentina, Brasil, Chile, Colombia, Costa Rica y México. El 43% de dichos pacientes fue positivo para IgM anti-VHA y de este grupo 73% tenían de 3 a 5 años de edad (41).
Colombia es actualmente considerado un país de endemicidad intermedia para VHA (15). Y aunque la hepatitis A es un evento vigilado por la Red Nacional de Laboratorios del Instituto Nacional de Salud (INS), son limitados los estudios nacionales de prevalencia de esta infección viral (45,46). En la figura 2 se presenta una gráfica de la notificación de casos de hepatitis A en Colombia en el período 2000-2013, en la que se observa variabilidad en el número anual de casos reportados. Cabe señalar que antes del 2003 los casos notificados de hepatitis A incluian tanto los probables como los confirmados; a partir del 2003, los casos notificados corresponden únicamente a los confirmados por laboratorio por la detección de IgM anti-VHA y por nexo epidemiológico (47).
Cabe destacar que aunque la vacuna para hepatitis A está disponible desde la década de los 90 (48), en Colombia solo hace parte del Programa Ampliado de Inmunizaciones (PAI) desde 2013 (15). Durante los últimos años la incidencia nacional de casos de VHA ha disminuido significativamente, de 20,2/100.000 habitantes en el 2008 a 12,1/100.000 habitantes en el 2012 debido probablemente a mejoras en el acceso a agua potable y en el sistema de tratamiento de aguas residuales (15). En el 2012 se reportaron 5.546 casos de hepatitis A en el territorio nacional; los departamentos de Sucre (644 casos) y Antioquia (602 casos) fueron los que presentaron el mayor número de reportes, con una incidencia de 77,8 y 9,7 casos por cada 100.000 habitantes, respectivamente. Se estima que globalmente la incidencia real de VHA puede ser hasta 10 veces más de la reportada, teniendo en cuenta los casos asintomáticos y el subregistro (36).
Según los resultados preliminares de un estudio de genotipificación de hepatitis A del Instituto Nacional de Salud, el subgenotipo A del genotipo I circula en Colombia. En la actualidad el Grupo de Gastrohepatología de la Universidad de Antioquia investiga la circulación de los virus de la hepatitis A y la hepatitis E en agua natural y residual en nueve municipios del departamento de Antioquia. Los resultados de estos estudios podrían aportar información relevante sobre la epidemiología de la hepatitis A en Colombia.
GENOTIPOS DEL VHA
Para estudiar la diversidad genética del VHA, se utilizó en un principio el método de clasificación genética empleado por Rico-Hesse y colaboradores para explorar la distribución geográfica del poliovirus, en el que las cepas se agruparon comparando la región VP1-2A (18,23,49). En 1992 se analizaron 152 cepas de VHA recuperadas de muestras de suero, heces y tejido hepático provenientes de humanos y simios, recolectadas alrededor del mundo (18). Los resultados demostraron la existencia de siete genotipos (I-VII) y cuatro subgenotipos (IA, IB, IIIA, IIIB). En el estudio se encontró que la variabilidad nucleotídica entre genotipos fue de alrededor del 15%, y entre subgenotipos, del 7,5% (18).
En el 2002, Costa-Mattioli y colaboradores, con base en la secuencia completa de 900 nucleótidos de la proteína VP1, reportaron una nueva clasificación, de seis genotipos (I-VI) y seis subgenotipos (IA, IB, IIA, IIB, IIIA y IIIB), con un porcentaje de variabilidad nucleotídica de aproximadamente 15% entre los genotipos y 7% entre los subgenotipos (18,22,23,50). El antiguo genotipo VII representado por la cepa SFL88 aislada en Sierra Leona, se reclasificó como genotipo II, subgenotipo B (51). Los genotipos I, II y III han sido aislados de muestras de origen humano (6,23,52). Los genotipos IV, V y VI, representados cada uno por una cepa única, han sido aislados de simios de los géneros Aotus, Macaca, Cercopithecus y Saguinus (10,18,22,53). Cabe aclarar que el genotipo III es el único grupo que incluye aislamientos de humanos y de primates. Los aislamientos de simios pueden diferenciarse por un polimorfismo característico en la unión VP3-VP1 que no poseen las cepas aisladas de humanos (54-56).
Se ha estudiado la diversidad genética del VHA utilizando principalmente tres regiones del genoma: la C-terminal de VP3, la N-terminal de VP1 y la VP1-2A (22,23,57), aunque también se han usado las regiones VP1-2B (58), VP3-2B y VP1(59). En 2008, Joshi y colaboradores (50) comprobaron mediante diferentes métodos filogenéticos que estas regiones tienen del 80% al 85% de identidad nucleotídica, por lo que no son candidatas para genotipificar y subgenotipificar. Por el contrario, se ha denominado la ''prueba estándar de oro'' al análisis de la región VP1; el porcentaje de identidad nucleotídica entre genotipos de esta región es del 75% al 85% lo que, respaldado por su longitud, la hace una región óptima para estudios filogenéticos y sustenta la nueva clasificación de VHA reportada en 2002 por Costa-Mattioli y colaboradores (59).
También se ha sugerido la región 2C para genotipificación, pero aún no se han desarrollado suficientes estudios que comprueben este supuesto. Sin embargo, para reconstruir con la mayor certeza posible las relaciones ancestrales entre los diferentes aislamientos del VHA se debe utilizar la secuencia del genoma completo. Este supuesto fue comprobado en el presente trabajo para la clasificación de los aislamientos hechos en Latinoamérica a la fecha presentados en la figura 3. El VHA difiere de otros integrantes de la familia Picornaviridae en el tamaño de las proteínas que codifica y en las secuencias de nucleótidos y aminoácidos (19).
Se ha descrito un solo serotipo del VHA caracterizado por un dominio antigénico único constituido por epítopes conformacionales que corresponden a los residuos 102, 171 y 176 de VP1 y a los residuos 70 y 74 de VP3; estos epítopes se encuentran muy cerca de la superficie de la partícula viral. Se ha propuesto un segundo sitio de neutralización, conformado por los residuos 11 a 25 de la VP1 (TVSTEQNVPDPQVGI), 96 a 107 de la VP2 (GLLRYHTYARFG) y 110 a 121 de la VP3 (FWRGDLVFDFQV) (6,24,60), aunque este sitio se caracteriza por inducir una respuesta neutralizante débil (8). Cabe señalar que se ensayaron anticuerpos monoclonales específicos para enterovirus para los sitios antigénicos mencionados sin obtener ningún tipo de reacción; por ello se clasificó el VHA en el género Hepatovirus. Aunque la organización del genoma del VHA y algunas de sus características fisicoquímicas se asemejan a las de otros picornavirus, se ha evidenciado que diverge significativamente de otros miembros de la familia Picornaviridae. En comparación con otros virus ARN, el VHA no acumula cambios genéticos con alta frecuencia; en efecto, su tasa de mutación es de alrededor de 10-4 a 10-5 sustituciones por base/ciclo de replicación contrario al caso de otros picornavirus como los poliovirus, cuya tasa de mutación es de 2 x 10-3 sustituciones por base/ciclo de replicación, es decir, que del 10% al 20% de los genomas virales mutan por ciclo de replicación (6,23,61).
Los virus ARN se caracterizan por presentar altas tasas de mutación que les permiten evolucionar rápidamente (62,63). La recombinación homóloga es uno de los mecanismos utilizados por el VHA para promover y asegurar su supervivencia, aunque en un principio se pensó que este escenario no era posible de forma espontánea en la naturaleza (23,63,64).
La primera cepa recombinante de VHA se aisló en el 2003 de una niña hospitalizada en Francia luego de pasar una temporada de vacaciones en Marruecos. El aislamiento, que se denominó 9F94, proviene de las cepas parentales SLF88 (genotipo II) y MBB (genotipo IB) aisladas en África, una región endémica con alta cocirculación de múltiples genotipos (23). El evento de recombinación para este caso fue en la secuencia que codifica para la proteína VP1 de la cápside. El VHA existe también in vivo en formas denominadas cuasiespecies, que son variantes genómicas relacionadas muy estrechamente con aproximadamente 1% de divergencia; poseen una dinámica característica, que consiste en la generación continua de estas variantes y la competencia y la selección de la mutante más apta para adaptarse finalmente a un medio dado (22,23,61). El entendimiento de la dinámica y la evolución de las cuasiespecies virales pueden llevar a modelar la progresión de la enfermedad, lo cual es de gran importancia como fundamento para planear y ejecutar estrategias de prevención y control del virus.
DISTRIBUCIÓN DE GENOTIPOS
El VHA se encuentra distribuido mundialmente (1,5,11,38). La diversidad genética, la estabilidad ambiental y las vías de transmisión le permiten diseminarse rápidamente sin mayor restricción (6). El genotipo I se encuentra distribuido ampliamente y el subgenotipo IA es el que se reporta con mayor frecuencia (20,23,51). El genotipo IA es prevalente en Europa Occidental y en América (23,61,65) y comprende la mayoría de las cepas de origen humano estudiadas (18). En este genotipo se han encontrado tres cladas con relación geográfica, conformadas por aislamientos de Estados Unidos, Japón y China. Teniendo en cuenta que estas regiones presentan baja o muy baja endemicidad, la formación de cladas sugiere la presencia y circulación de una población endémica de VHA. En Argentina también se han estudiado dos conglomerados dentro del genotipo IA, uno de ellos constituido solo por cepas suramericanas, lo que sugiere la circulación de este genotipo entre países vecinos (Argentina, Uruguay y Brasil), y el segundo constituido solo por aislamientos argentinos (22). Algunos investigadores sugieren que las cepas del VHA mantienen una baja tasa de mutaciones durante un largo período de tiempo y pueden desarrollarse en nichos ecológicos específicos (8,18). También se ha demostrado la cocirculación de IA y IB en Sudáfrica, Brasil, Francia, China y Japón lo que constituye un primer escenario para facilitar la ocurrencia de eventos de recombinación (23).
El genotipo II es infrecuente. Cada uno de los subgenotipos IIA y IIB se definió por una cepa única, a saber: la CF53/Berna aislada en Francia en 1979 y la SLF88 aislada en Sierra Leona en 1988, respectivamente (18,23,66). Se han identificado eventos de recombinación del genotipo IIA con el genotipo IB en la región genómica P1, mencionada previamente. Los aislamientos identificados de este genotipo provienen de ciudadanos franceses que han viajado a África Occidental o han tenido contacto con personas que hayan viajado a dicha región. Esto supone que este genotipo puede ser autóctono de tal región africana, aunque se deben hacer más estudios que esclarezcan este escenario (51). Asimismo, se han publicado investigaciones sobre cocirculación de IIIA y IB en la India (67).
El genotipo III es prevalente en Asia Central (51); el primer aislamiento (PA21) se hizo de monos búho en Panamá (Aotus trivirgatus) (68), pero los demás aislamientos de este genotipo provienen de muestras de origen humano de pacientes de India, Nepal, Sri Lanka, Malasia, Japón, Suecia, Dinamarca y Estados Unidos. Para este genotipo también se ha reportado la cocirculación con IA en India (18).
En la tabla 2 se presenta un resumen de la distribución geográfica de los genotipos de VHA. Los genotipos IV, V y VI se han aislado exclusivamente de simios del Viejo Mundo; cada uno de ellos está representado por una cepa única y difieren genéticamente entre sí, como también lo hacen con respecto a aislamientos humanos (18).
CONCLUSIÓN
El VHA causa mundialmente una de las enfermedades prevenibles más comunes. Las condiciones sanitarias deficientes, la falta de acceso a agua potable, los alimentos contaminados, la disposición inadecuada de aguas residuales y el hacinamiento son factores que promueven la transmisión del virus, la generación de brotes y epidemias. Al mejorar estas condiciones, disminuyen las tasas de infección en la primera infancia y se evidencia un cambio de patrón epidemiológico como sucede en Latinoamérica; paradójicamente esta mejora deja susceptibles a las futuras poblaciones adolecentes y adultas en las cuales la enfermedad se desarrolla con mayor agresividad. Por la alta resistencia y la facilidad con que se transmite el VHA, no basta con mejorar la calidad de las condiciones sanitarias básicas, sino que también debe seguirse la recomendación de la OMS sobre la implementación de la vacuna para hepatitis A en el programa ampliado de inmunización en Latinoamérica para combatir con eficacia la enfermedad y avanzar hacia la erradicación del VHA. Aunque en Colombia ya se encuentra activo el plan de vacunación contra VHA, son necesarios más estudios que brinden información sobre la circulación de los genotipos y subgenotipos del virus y demás información epidemiológica que permita definir planes de prevención y control de la infección.
AGRADECIMIENTOS
Esta publicación hace parte del proyecto 20113600115373 Financiado por el Departamento administrativo de ciencia, tecnología e innovación-COLCIENCIAS y el Proyecto de Sostenibilidad, Vicerrectoría de Investigación, Universidad de Antioquia.
Decaración de conflictos de interés: los autores declaran no tener conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Tapia-Conyer R, Santos JI, Cavalcanti AM, Urdaneta E, Rivera L, Manterola A, et al. Hepatitis A in Latin America: a changing epidemiologic pattern. Am J Trop Med Hyg. 1999 Nov;61(5):825–9. [ Links ]
2. Arguedas MR, Fallon MB. Hepatitis A. Curr Treat Options Gastroenterol. 2004 Jan;7(6):443–50. [ Links ]
3. Lavanchy D. Public health measures in the control of viral hepatitis: a World Health Organization perspective for the next millennium. J Gastroenterol Hepatol. 2002 Dec;17 Suppl:S452–9. [ Links ]
4. Cockayne EA. Catarrhal jaundice, sporadic and epidemic, and its relation to acute yellow atrophy of the liver. QJM. 1912 Oct;os6(1):1-29. [ Links ]
5. Cuthbert JA. Hepatitis A: old and new. Clin Microbiol Rev. 2001 Jan;14(1):38–58. [ Links ]
6. Nainan O V, Xia G, Vaughan G, Margolis HS. Diagnosis of hepatitis a virus infection: a molecular approach. Clin Microbiol Rev. 2006 Jan;19(1):63–79. [ Links ]
7. Jacobsen KH. The Global Prevalence of Hepatitis A Virus Infection and Susceptibility: A Systematic Review [Internet]. Geneva: World Health Organization; 2010. Available from: http://whqlibdoc.who.int/hq/2010/WHO_IVB_10.01_eng.pdf [ Links ]
8. Hollinger F, Emerson S. Hepatitis A Virus. In: FieldsBN, Knipe DM, Howley PM, editors. Fields virology. 5th ed. Philadelphia: Williams & Wilkins; 2007. [ Links ]
9. Llorente-Molina D, Cedeño- Llorente S, Guzmán García J, Fuentes Príncipe PM. Actualidad en infecciones de transmisión sexual de etiología viral. Arch Med. 2009;5(2) [ Links ].
10. Deinhardt F, Holmes AW, Capps RB, Popper H. Studies on the transmission of human viral hepatitis to marmoset monkeys. I. Transmission of disease, serial passages, and description of liver lesions. J Exp Med. 1967 Apr;125(4):673–88. [ Links ]
11. OMS. Prevención y control de las hepatitis virales: marco para la acción mundial. Ginebra: Organización Mundial de la Salud; 2012. [ Links ]
12. Arauz-Ruiz P, Sundqvist L, García Z, Taylor L, Visoná K, Norder H, et al. Presumed common source outbreaks of hepatitis A in an endemic area confirmed by limited sequencing within the VP1 region. J Med Virol. 2001 Nov;65(3):449–56. [ Links ]
13. OMS. Hepatitis A. World Health Organization; (cited 2014 Nov 21); Available from: http://www.who.int/mediacentre/factsheets/fs328/es/ [ Links ]
14. Tanaka J. Hepatitis A shifting epidemiology in Latin America. Vaccine. 2000 Feb;18 Suppl 1:S57–60. [ Links ]
15. Instituto Nacional de Salud. Lineamiento Estratégico para la Introducción de la Vacuna contra la Hepatitis A en el Esquema del Programa Ampliado de Inmunizaciones –PAI.Colombia 2013 [Internet]. Bogotá; 2013 p. 29. Disponible en: http://www.minsalud.gov.co/Documentos%20y%20Publicaciones/Lineamientos%20estrat%C3%A9gicos%20para%20la%20Introducci%C3%B3n%20de%20la%20vacuna%20contra%20la%20Hepatitis%20A.pdf [ Links ]
16. Feinstone SM, Kapikian AZ, Purceli RH. Hepatitis A: detection by immune electron microscopy of a viruslike antigen associated with acute illness. Science. 1973 Dec;182(4116):1026–8. [ Links ]
17. Provost PJ, Hilleman MR. Propagation of human hepatitis A virus in cell culture in vitro. Proc Soc Exp Biol Med. 1979 Feb;160(2):213–21. [ Links ]
18. Robertson BH, Jansen RW, Khanna B, Totsuka A, Nainan O V, Siegl G, et al. Genetic relatedness of hepatitis A virus strains recovered from different geographical regions. J Gen Virol. 1992 Jun;73 ( Pt 6):1365–77. [ Links ]
19. Cohen JI, Ticehurst JR, Purcell RH, Buckler-White A, Baroudy BM. Complete nucleotide sequence of wildtype hepatitis A virus: comparison with different strains of hepatitis A virus and other picornaviruses. J Virol. 1987 Jan;61(1):50–9. [ Links ]
20. Jameel S, Aggarwal R. Tropical Infectious Diseases: Principles, Pathogens and Practice. In: Guerrant RL, Walker DH, Weller PF, editors. Tropical Infectious Diseases: Principles, Pathogens and Practice. 13th ed. Elsevier; 2011. p. 420–6. [ Links ]
21. Weitz M, Baroudy BM, Maloy WL, Ticehurst JR, Purcell RH. Detection of a genome-linked protein (VPg) of hepatitis A virus and its comparison with other picornaviral VPgs. J Virol. 1986 Oct;60(1):124–30. [ Links ]
22. Aguirre S, Malirat V, Scodeller E, Mattion N. First full-length genomic sequence of a hepatitis A virus isolated in Argentina shows recombination between subgenotypes IA and IB. Virus Res. 2011 Jan;155(1):316–24. [ Links ]
23. Cristina J, Costa-Mattioli M. Genetic variability and molecular evolution of hepatitis A virus. Virus Res. 2007 Aug;127(2):151–7. [ Links ]
24. Debing Y, Neyts J, Thibaut HJ. Molecular biology and inhibitors of hepatitis A virus. Med Res Rev. 2014 Sep;34(5):895–917. [ Links ]
25. Feigelstock D, Thompson P, Mattoo P, Zhang Y, Kaplan GG. The human homolog of HAVcr-1 codes for a hepatitis A virus cellular receptor. J Virol. 1998 Aug;72(8):6621–8. [ Links ]
26. Chigor VN, Okoh AI. Quantitative RT-PCR detection of hepatitis A virus, rotaviruses and enteroviruses in the Buffalo River and source water dams in the Eastern Cape Province of South Africa. Int J Environ Res Public Health. 2012 Nov;9(11):4017–32. [ Links ]
27. Abad FX, Pintó RM, Bosch A. Survival of enteric viruses on environmental fomites. Appl Environ Microbiol. 1994 Oct;60(10):3704–10. [ Links ]
28. Mbithi JN, Springthorpe VS, Sattar SA. Comparative in vivo efficiencies of hand-washing agents against hepatitis A virus (HM-175) and poliovirus type 1 (Sabin). Appl Environ Microbiol. 1993 Oct;59(10):3463–9. [ Links ]
29. Prado T, Fumian TM, Miagostovich MP, Gaspar AMC. Monitoring the hepatitis A virus in urban wastewater from Rio de Janeiro, Brazil. Trans R Soc Trop Med Hyg. 2012 Feb;106(2):104–9. [ Links ]
30. Yanez LA, Lucero NS, Barril PA, Díaz MDP, Tenaglia MM, Spinsanti LI, et al. Evidence of hepatitis A virus circulation in central Argentina: seroprevalence and environmental surveillance. J Clin Virol. 2014 Jan;59(1):38–43. [ Links ]
31. Appleton H, Banks M, Dentinger C, Chong GT. Foodborne viral hepatitis. In: Simjee S, editor. Foodborne diseases. New Jersey: Humana Press; 2007. p. 175–214. [ Links ]
32. Peterson DA, Hurley TR, Hoff JC, Wolfe LG. Effect of chlorine treatment on infectivity of hepatitis A virus. Appl Environ Microbiol. 1983 Jan;45(1):223–7. [ Links ]
33. Li JW, Xin ZT, Wang XW, Zheng JL, Chao FH. Mechanisms of inactivation of hepatitis A virus in water by chlorine dioxide. Water Res. 2004 Mar;38(6):1514–9. [ Links ]
34. Vaughan G, Xia G, Forbi JC, Purdy MA, Rossi LMG, Spradling PR, et al. Genetic relatedness among hepatitis A virus strains associated with food-borne outbreaks. PLoS One. 2013 Jan;8(11):e74546. [ Links ]
35. Rincón CJ, Rodríguez-Malagón N, Mariño C, Mojica JA, de la Hoz-Restrepo F. [Assessing the force of hepatitis A virus infection in Colombia by applying catalytic models]. Rev Salud Publica (Bogota). 14(2):282–95. [ Links ]
36. Franco E, Meleleo C, Serino L, Sorbara D, Zaratti L. Hepatitis A: Epidemiology and prevention in developing countries. World J Hepatol. 2012 Mar;4(3):68–73. [ Links ]
37. Gust ID. Epidemiological patterns of hepatitis A in different parts of the world. Vaccine. 1992 Jan;10 Suppl 1:S56–8. [ Links ]
38. Jacobsen KH, Wiersma ST. Hepatitis A virus seroprevalence by age and world region, 1990 and 2005. Vaccine. 2010 Sep;28(41):6653–7. [ Links ]
39. Organización Mundial de la Salud. Vacunas contra la hepatitis A. Documento de posición de la OMS – Junio de 2012. Boletín epidemiológico Semanal [Internet]. 2012 Jul;87(28-29):261–76. Disponible en: http://www.who.int/immunization/position_papers/WER_Position_Paper_HepatitisA_Spanish_Aug.2012.pdf [ Links ]
40. David AM. Hepatitis A outbreaks--methods of intervention in South-East Asian countries. Int J Infect Dis. 2004 Jul;8(4):201–9. [ Links ]
41. Ciocca M, Moreira-Silva SF, Alegría S, Galoppo MC, Ruttiman R, Porta G, et al. Hepatitis A as an etiologic agent of acute liver failure in Latin America. Pediatr Infect Dis J. 2007 Aug;26(8):711–5. [ Links ]
42. Vitral CL, Ospina FLN, Artimos S, Melgaço JG, Cruz OG, de Paula VS, et al. Declining prevalence of hepatitis A virus antibodies among children from low socioeconomic groups reinforces the need for the implementation of hepatitis A vaccination in Brazil. Mem Inst Oswaldo Cruz. 2012 Aug;107(5):652–8. [ Links ]
43. Ljunggren KE, Patarroyo ME, Engle R, Purcell RH, Gerin JL. Viral hepatitis in Colombia: a study of the ''hepatitis of the Sierra Nevada de Santa Marta''. Hepatology. 1985 Apr;5(2):299–304. [ Links ]
44. Vega M, Alvarez C, Arango AE, Yepes N, Sepúlveda E, Restrepo JC, et al. Frecuencia y distribución de anticuerpos positivos contra la hepatitis A. Acta Med Colomb. 2003;28(2):71-75. [ Links ]
45. Moreno S, Alvarado MV, Bermúdez A, Gutiérrez MF. Análisis filogenético de las cepas de rotavirus y virus de la hepatitis A encontradas en agua de consumo en el municipio de Quibdó, Chocó. Biomédica. 2009;(29):209–17. [ Links ]
46. Peláez D, Rodríguez JA, Rocha EL, Rey GJ. Estandarización de un método de concentración y detección de virus entéricos en aguas de consumo. Biomédica. 2010;30(2):276-86. [ Links ]
47. Instituto Nacional de Salud. Protocolo de Vigilancia en Salud Pública. Hepatitis A [Internet]. Bogotá; 2014 p. 32. Disponible en: http://www.ins.gov.co/lineas-deaccion/Subdireccion-Vigilancia/sivigila/ProtocolosSIVIGILA/PRO Hepatitis A.pdf [ Links ]
48. Ott JJ, Irving G, Wiersma ST. Long-term protective effects of hepatitis A vaccines. A systematic review. Vaccine. 2012;31(1):3-11. [ Links ]
49. Rico-Hesse R, Pallansch MA, Nottay BK, Kew OM. Geographic distribution of wild poliovirus type 1 genotypes. Virology. 1987 Oct;160(2):311–22. [ Links ]
50. Joshi MS, Walimbe AM, Chitambar SD. Evaluation of genomic regions of hepatitis A virus for phylogenetic analysis: Suitability of the 2C region for genotyping. J Virol Methods. 2008 Oct;153(1):36–42. [ Links ]
51. Desbois D, Couturier E, Mackiewicz V, Graube A, Letort M-J, Dussaix E, et al. Epidemiology and genetic characterization of hepatitis A virus genotype IIA. J Clin Microbiol. 2010 Sep;48(9):3306–15. [ Links ]
52. Holmes AW, Deinhardt F, Wolfe L, Froesner G, Paterson D, Casto B, et al. Specific neutralization of human hepatitis type A in marmoset monkeys. Nature. 1973 Jun;243(5407):419–20. [ Links ]
53. Theamboonlers A, Abe K, Thongmee C, Poovorawan Y. Complete coding sequence and molecular analysis of hepatitis A virus from a chimpanzee with fulminant hepatitis. J Med Primatol. 2012 Feb;41(1):11–7. [ Links ]
54. Nainan O V, Margolis HS, Robertson BH, Balayan M, Brinton MA. Sequence analysis of a new hepatitis A virus naturally infecting cynomolgus macaques (Macaca fascicularis). J Gen Virol. 1991 Jul;72 ( Pt 7): 1685–9. [ Links ]
55. Tsarev SA, Emerson SU, Balayan MS, Ticehurst J, Purcell RH. Simian hepatitis A virus (HAV) strain AGM-27: comparison of genome structure and growth in cell culture with other HAV strains. J Gen Virol. 1991 Jul;72 ( Pt 7):1677–83. [ Links ]
56. Endo K, Takahashi M, Masuko K, Inoue K, Akahane Y, Okamoto H. Full-length sequences of subgenotype IIIA and IIIB hepatitis A virus isolates: characterization of genotype III HAV genomes. Virus Res. 2007 Jun;126(1-2):116–27. [ Links ]
57. Jansen RW, Siegl G, Lemon SM. Molecular epidemiology of human hepatitis A virus defined by an antigen-capture polymerase chain reaction method. Proc Natl Acad Sci U S A. 1990 Apr;87(8):2867–71. [ Links ]
58. Hutin YJ, Pool V, Cramer EH, Nainan O V, Weth J, Williams IT, et al. A multistate, foodborne outbreak of hepatitis A. National Hepatitis A Investigation Team. N Engl J Med. 1999 Feb 25;340(8):595–602. [ Links ]
59. Costa-Mattioli M, Cristina J, Romero H, Perez-Bercof R, Casane D, Colina R, et al. Molecular evolution of hepatitis A virus: a new classification based on the complete VP1 protein. J Virol. 2002 Sep;76(18):9516– 25. [ Links ]
60. Bosch A, González-Dankaart JF, Haro I, Gajardo R, Pérez JA, Pintó RM. A new continuous epitope of hepatitis A virus. J Med Virol. 1998 Feb;54(2):95–102. [ Links ]
61. Sulbaran Y, Gutierrez CR, Marquez B, Rojas D, Sanchez D, Navas J, et al. Hepatitis A virus genetic diversity in Venezuela: exclusive circulation of subgenotype IA and evidence of quasispecies distribution in the isolates. J Med Virol. 2010 Nov;82(11):1829–34. [ Links ]
62. Worobey M, Holmes EC. Evolutionary aspects of recombination in RNA viruses. J Gen Virol. 1999 Oct;80 ( Pt 10):2535–43. [ Links ]
63. Costa-Mattioli M, Ferré V, Casane D, Perez-Bercoff R, Coste-Burel M, Imbert-Marcille BM, et al. Evidence of recombination in natural populations of hepatitis A virus. Virology. 2003 Jun;311(1):51–9. [ Links ]
64. Lemon SM, Murphy PC, Shields PA, Ping LH, Feinstone SM, Cromeans T, et al. Antigenic and genetic variation in cytopathic hepatitis A virus variants arising during persistent infection: evidence for genetic recombination. J Virol. 1991 Apr;65(4):2056–65. [ Links ]
65. Betancourt WQ, Querales L, Sulbaran YF, Rodriguez- Diaz J, Caraballo L, Pujol FH. Molecular characterization of sewage-borne pathogens and detection of sewage markers in an urban stream in Caracas, Venezuela. Appl Environ Microbiol. 2010 Mar;76(6): 2023–6. [ Links ]
66. Lu L, Ching KZ, de Paula VS, Nakano T, Siegl G, Weitz M, et al. Characterization of the complete genomic sequence of genotype II hepatitis A virus (CF53/Berne isolate). J Gen Virol. 2004 Oct;85(Pt 10):2943–52. [ Links ]
67. Chitambar S, Joshi M, Lole K, Walimbe A, Vaidya S. Cocirculation of and coinfections with hepatitis A virus subgenotypes IIIA and IB in patients from Pune, western India. Hepatol Res. 2007 Feb;37(2):85–93. [ Links ]
68. Costa-Mattioli M, Di Napoli A, Ferré V, Billaudel S, Perez- Bercoff R, Cristina J. Genetic variability of hepatitis A virus. J Gen Virol. 2003 Dec;84(Pt 12):3191–201. [ Links ]