Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.28 no.4 Medellín Oct./Dec. 2015
https://doi.org/10.17533/udea.iatreia.v28n4a10
PRESENTACIÓN DE CASOS
DOI 10.17533/udea.iatreia.v28n4a10
Tuberculosis multisistémica: una forma inusual de presentación
Multisystemic tuberculosis: An unusual form of presentation
Tuberculose multisistêmica: uma forma infrequente de apresentação
Cristian Sepúlveda-Otálvaro1; Olga Lucía Morales-Múnera2; Silvia Palacio-Petri3
1 Pediatra Facultad de Medicina, Universidad de Antioquia. Grupo de Investigación Pediaciencias, Medellín, Colombia. chrisep.82@gmail.com
2 Neumóloga pediatra. Profesora de Neumología pediátrica, Facultad de Medicina, Universidad de Antioquia. Grupo de Investigación Pediaciencias, Medellín, Colombia.
3 Pediatra del Hospital Universitario San Vicente Fundación, Medellín, Colombia.
Recibido: febrero 20 de 2015
Aceptado: abril 8 de 2015
RESUMEN
En todo el mundo la tuberculosis continúa siendo una causa inaceptablemente alta de enfermedad y muerte en los niños. Ellos son particularmente vulnerables a la enfermedad diseminada y grave. Los dos principales factores de riesgo para su progresión son el estado inmunológico y la edad: con mayor frecuencia se afectan los neonatos y lactantes. La enfermedad diseminada, que a menudo es consecuencia de una primoinfección en la infancia, puede ser fatal o dejar secuelas permanentes. El tratamiento apropiado mejora la supervivencia y reduce la mortalidad a largo plazo. Por la importancia de esta forma de presentación de la TB en niños y por el bajo índice de sospecha, describimos el caso de una lactante indígena colombiana con enfermedad tuberculosa extensa, y discutimos acerca de los factores de riesgo y las manifestaciones clínicas de la tuberculosis diseminada en esta población.
PALABRAS CLAVE
Extrapulmonar, Niños, Tuberculosis
SUMMARY
Worldwide, tuberculosis is still an important cause of illness and death among children. They are particularly vulnerable to this disease when it is disseminated and severe. The two main risk factors for the progression of the disease are age and the immune status; neonates and infants are most frequently affected. Disseminated disease is often the result of a primary infection in childhood and may be fatal or leave permanent sequelae. Proper treatment improves survival and reduces long-term mortality. Given the importance of this type of tuberculosis in children, and the low index of suspicion, the description of clinical cases is important in order to get a better understanding of its mechanisms. We report the case of a Colombian indigenous infant with an extensive tuberculosis; risk factors and clinical manifestations of disseminated tuberculosis in this population are discussed.
KEY WORDS
Children, Extrapulmonary, Tuberculosis
RESUMO
Em todo mundo a tuberculose continua sendo uma causa inaceitavelmente alta de doença e morte nos meninos. Eles são particularmente vulneráveis à doença disseminada e grave. Os dois principais fatores de risco para sua progressão são o estado imunológico e a idade: com maior frequência se afetam os neonatos e lactantes. A doença disseminada, que com frequência é consequência de uma primo-infeção na infância, pode ser fatal ou deixar sequelas permanentes. O tratamento apropriado melhora a sobrevivência e reduz a mortalidade a longo prazo. Pela importância desta forma de apresentação da TB em meninos e pelo baixo índice de suspeita, descrevemos o caso de uma lactente indígena colombiana com doença tuberculosa extensa, e discutimos a respeito dos fatores de risco e as manifestações clínicas da tuberculose disseminada nesta população.
PALAVRAS CHAVE
Extrapulmonar, Meninos, Tuberculose
Cómo citar: Sepúlveda-Otálvaro C, Morales-Múnera OL, Palacio-Petri S. Tuberculosis multisistémica: una forma inusual de presentación. Iatreia. 2015 Oct-Dic;28(4):449-55. DOI 10.17533/udea.iatreia.v28n4a10.
INTRODUCCIÓN
La tuberculosis (TB), causada por Mycobacterium tuberculosis y menos comúnmente por otras especies del complejo Mycobacterium, es bien conocida como causa de infección grave en la población pediátrica. Su forma diseminada se presenta a menudo luego de la infección primaria, especialmente en niños menores de 5 años, quienes tienen un mayor riesgo de diseminación, probablemente por la inmadurez de su sistema inmune, reflejada en menor actividad microbicida de los macrófagos alveolares, menor capacidad de reclutamiento de los monocitos al sitio de infección, presentación deficiente del antígeno por parte de las células células T nativas al antígeno y algunos defectos en las vías del interferón-γ/IL-12. El diagnóstico temprano y el tratamiento adecuado son fundamentales para mejorar la tasa de supervivencia y disminuir la morbilidad y las secuelas a largo plazo (1). Reportamos el caso de una niña indígena colombiana con TB diseminada multisistémica: pulmonar, ganglionar, meníngea y cutánea. Nuestro objetivo es ilustrar la importancia de la sospecha diagnóstica en niños para evitar la diseminación de la enfermedad, las secuelas y la muerte en esta población, además de resaltar la importancia del estudio de contactos y el uso de quimioprofilaxis.
PRESENTACIÓN DEL CASO
Niña indígena embera de 14 meses de edad, residente en el área rural de Andes (Antioquia); no tuvo control prenatal y el parto fue domiciliario; sin vacunación ni datos sobre el neurodesarrollo o la alimentación. Con antecedente de contactos sintomáticos respiratorios en la comunidad. Consultó al hospital local por un cuadro clínico de 2 meses de evolución de masa vulvar derecha con aumento progresivo de tamaño y ulceración (figuras 1a y 1b); además, fiebre, pérdida de peso, tos y disnea que fueron más importantes en las últimas semanas. Al examen físico de ingreso se la encontró en regulares condiciones generales, consciente e irritable, sin signos meníngeos, caquéctica, con pupilas isocóricas normorreactivas, paresia del VI par derecho y del III par izquierdo, hemiparesia derecha y adenopatías cervicales visibles. Signos vitales: frecuencia cardíaca de 170 por minuto, presión arterial 85/48 mm Hg, frecuencia respiratoria de 64 por minuto, temperatura de 36,9 °C, saturación del 99 % con oxígeno a 2 litros/minuto, peso 6,4 kg y talla 64 cm (P/E -3.2 DE, T/E -4.6 DE, P/T -0.75 DE). A la auscultación pulmonar se encontró murmullo vesicular simétrico en ambos campos pulmonares, con crépitos finos bilaterales, y a la inspección, retracciones intercostales. En el abdomen presentaba el hígado a 6 cm bajo el reborde costal derecho y una masa palpable en el mesogastrio, sin signos de irritación peritoneal. Tenía una masa vulvar derecha ulcerada. Con estos hallazgos se establecieron las siguientes posibilidades diagnósticas: sepsis de origen pulmonar, tuberculosis miliar con compromiso meníngeo, masa abdominal en estudio, úlcera genital de causa por establecer, desnutrición global y crónica grave.
Una vez hospitalizada se inició la recuperación nutricional con el protocolo de la Organización Mundial de la Salud (OMS), antibióticos de amplio espectro y antiparasitarios. Se solicitaron estudios paraclínicos en los que se hallaron anemia moderada microcítica e hipocrómica y aumento de la proteína C reactiva (PCR). El ionograma y el perfil hepático fueron normales; ELISA-VIH, VDRL y hemocultivos fueron negativos.
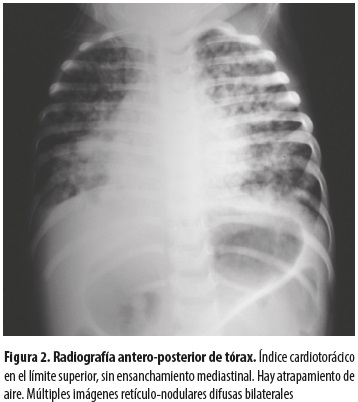
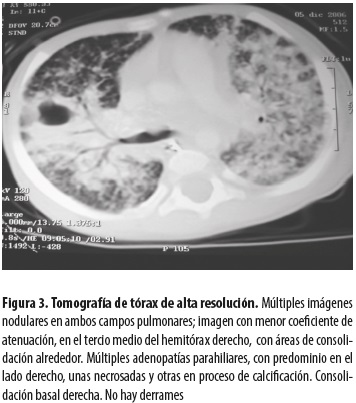
No se hicieron otros estudios inmunológicos. En la radiografía de tórax se evidenciaron lesiones retículonodulares en ambos campos pulmonares (figura 2); en la tomografía de tórax de alta resolución se hallaron múltiples imágenes nodulares, consolidación con necrosis en su interior en el hemitórax derecho y adenopatías mediastinales con algunas calcificaciones (figura 3).
Se hizo ecografía para aclarar el origen de la masa abdominal; en ella se hallaron: hepatomegalia, con aumento generalizado de la ecogenicidad; adenopatías pequeñas alrededor del páncreas; conglomerado de adenopatías en el retroperitoneo, adyacente a la aorta; asas distendidas de paredes engrosadas y escaso líquido libre entre ellas, y leve esplenomegalia.
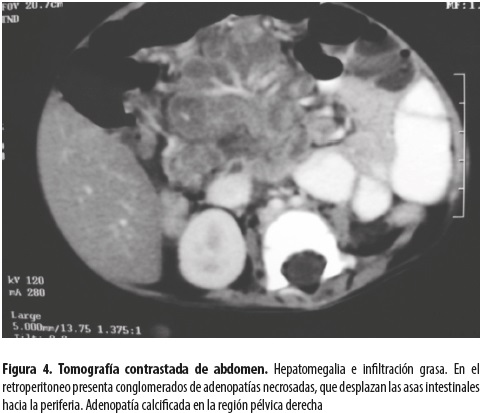
Se hizo tomografía abdominal para aclarar dichas imágenes (figura 4).
Por las alteraciones de los pares craneanos se hizo tomografía de cráneo en la que se identificaron tuberculomas, algunas áreas de isquemia e hidrocefalia no comunicante (figuras 5a y 5b). Posteriormente se realizó punción ventricular y los hallazgos en el líquido cefalorraquídeo fueron los siguientes: hipoglucorraquia (54 mg/mL en el LCR con glicemia de 183 mg/mL), proteínas normales, acelularidad y adenosina deaminasa (ADA) de 4 U/L (valor normal: menor de 6 U/L).
La tuberculina (Mantoux) dio 0 mm; el directo y el cultivo para M. tuberculosis en tres muestras de jugo gástrico y una de líquido cefalorraquídeo fueron negativos; la tinción de Ziehl-Neelsen de la secreción vulvar fue positiva (++) para bacilos ácido-alcohol resistentes (BAAR) y en la biopsia de la piel de esta lesión se identificaron BAAR (figura 6).
Se hizo el diagnóstico de tuberculosis diseminada con compromiso ganglionar, pulmonar, cutáneo y del sistema nervioso central. Se hizo tratamiento antituberculoso tetraconjugado con isoniazida, rifampicina pirazinamida y estreptomicina por 2 meses, y luego biconjugado con isoniazida y rifampicina por 10 meses más, además de piridoxina y prednisona por vía sistémica. No presentó signos de toxicidad medicamentosa ni deterioro clínico importante. Su evolución fue lenta hacia la mejoría y se remitió a otra institución para la recuperación nutricional. No regresó a los controles programados.
DISCUSIÓN
La tuberculosis diseminada se presenta en 1 % a 2 % de todos los casos de TB (1-5). Se debe a la diseminación linfohematógena de la micobacteria a múltiples órganos: ganglios linfáticos (67 %), sistema nervioso central (13 %), pleura (6 %), huesos (4 %), además de una forma multisistémica (miliar/diseminada) en el 5 % de los casos (6). Dicha diseminación puede iniciarse entre los 2 y 6 meses después de la primoinfección (7).
Los siguientes son factores de riesgo para la progresión y diseminación de la enfermedad: la edad (neonatos y lactantes), el estado inmune (infección por VIH, enfermedades reumatológicas, uso de medicamentos inmunosupresores y desnutrición) (7,8) y la situación socioeconómica desfavorable (8). Sin embargo, en algunos pacientes no se logra demostrar una condición de alto riesgo asociada a la diseminación (9,10).
Se ha demostrado que en niños pequeños hay una alteración en la respuesta inmune innata y en la mediada por células (10-14). Además, hay una reducción en la capacidad para activar los mecanismos antimicobacterianos, por defectos en las vías del interferón-γ/ IL-12, secundarios a la inmadurez del sistema inmune, de lo que resulta una enfermedad grave por micobacterias (15).
El diagnóstico de TB en niños presenta dificultades que van desde la falta de sospecha clínica, porque las manifestaciones en la edad pediátrica son inespecíficas y comunes a otras enfermedades, hasta la comprobación microbiológica que es el estándar de oro, pero que pocas veces se logra dado que en niños la enfermedad es generalmente paucibacilar; las ayudas diagnósticas no siempre están disponibles ni son totalmente específicas (16). Las dificultades para establecer el diagnóstico bacteriológico en niños han llevado a tener en cuenta consideraciones epidemiológicas y a aceptar el diagnóstico mediante una combinación de criterios: clínico, radiológico, tuberculínico, epidemiológico, histopatológico, además del bacteriológico, y algunos aceptan la respuesta terapéutica (17-20).
En conclusión, el espectro de la enfermedad tuberculosa está influenciado por factores como la edad y el estado inmune. Aunque la forma de presentación más común es la intratorácica, se debe plantear la posibilidad de enfermedad diseminada en neonatos, niños pequeños e inmunocomprometidos. Se necesita un alto índice de sospecha para llegar a un diagnóstico rápido y adecuado, así como a un tratamiento que permita reducir las secuelas a largo plazo y mejorar la supervivencia.
REFERENCIAS BIBLIOGRÁFICAS
1. Smith BB, Hazelton BJ, Heywood AE, Snelling TL, Peacock KM, Macartney KK. Disseminated tuberculosis and tuberculous meningitis in Australian-born children; case reports and review of current epidemiology and management. J Paediatr Child Health. 2013 Mar;49(3):E246-50. [ Links ] DOI 10.1111/jpc.12035.
2. World Health Organization. Global tuberculosis report 2012 [Internet]. Chapter 1. Geneva: WHO; 2012. (Cited 2014.12.02). Available from: http://apps.who.int/iris/bitstream/10665/75938/1/9789241564502_eng.pdf [ Links ] Arial, Helvetica, sans-serif">
3. World Health Organization. Global tuberculosis control: epidemiology, strategy, financing [Internet]. Chapter 1. Geneva: WHO; 2009. (Cited 2014.12.05). Available from: http://goo.gl/jXXPMK [ Links ] Arial, Helvetica, sans-serif">
4. Marais BJ, Gie RP, Schaaf HS, Beyers N, Donald PR, Starke JR. Childhood pulmonary tuberculosis: old wisdom and new challenges. Am J Respir Crit Care Med. 2006 May;173(10):1078-90. [ Links ]
5. Sharma SK, Mohan A, Sharma A, Mitra DK. Miliary tuberculosis: new insights into an old disease. Lancet Infect Dis. 2005 Jul;5(7):415-30. [ Links ]
6. Starke J. Tuberculosis. In: Jenson HB, Baltimore RS, editors. Pediatric infectious diseases: principles and practices. 2ª ed. Philadelphia: Saunders; 2002. p. 396-419. [ Links ]
7. Cruz AT, Starke JR. Clinical manifestations of tuberculosis in children. Paediatr Respir Rev. 2007 Jun;8(2):107-17. [ Links ]
8. Myers JN. Miliary, central nervous system, and genitourinary tuberculosis. Dis Mon. 2007 Jan;53(1):22-31. [ Links ]
9. Marais BJ, Gie RP, Schaaf HS, Hesseling AC, Obihara CC, Starke JJ, et al. The natural history of childhood intra-thoracic tuberculosis: a critical review of literature from the pre-chemotherapy era. Int J Tuberc Lung Dis. 2004 Apr;8(4):392-402. [ Links ]
10. Newton SM, Brent AJ, Anderson S, Whittaker E, Kampmann B. Paediatric tuberculosis. Lancet Infect Dis. 2008 Aug;8(8):498-510. [ Links ] DOI 10.1016/S1473-3099(08)70182-8.
11. Upham JW, Rate A, Rowe J, Kusel M, Sly PD, Holt PG. Dendritic cell immaturity during infancy restricts the capacity to express vaccine-specific T-cell memory. Infect Immun. 2006 Feb;74(2):1106-12. [ Links ]
12. Upham JW, Lee PT, Holt BJ, Heaton T, Prescott SL, Sharp MJ, et al. Development of interleukin-12-producing capacity throughout childhood. Infect Immun. 2002 Dec;70(12):6583-8. [ Links ]
13. Goriely S, Vincart B, Stordeur P, Vekemans J, Willems F, Goldman M, et al. Deficient IL-12(p35) gene expression by dendritic cells derived from neonatal monocytes. J Immunol. 2001 Feb;166(3):2141-6. [ Links ]
14. White GP, Watt PM, Holt BJ, Holt PG. Differential patterns of methylation of the IFN-gamma promoter at CpG and non-CpG sites underlie differences in IFN-gamma gene expression between human neonatal and adult CD45RO-T cells. J Immunol. 2002 Mar;168(6):2820-7. [ Links ]
15. Kampmann B, Hemingway C, Stephens A, Davidson R, Goodsall A, Anderson S, et al. Acquired predisposition to mycobacterial disease due to autoantibodies to IFN-gamma. J Clin Invest. 2005 Sep;115(9):2480-8. [ Links ]
16. Restrepo A, Trujillo M, Garcés C. Tuberculosis. En: Correa JA, Gómez JF, Posada R, editores. Fundamentos de pediatría: Infectología y neumología. 4th ed. Vol. 3. Medellín: CIB; 2013. p. 247-62. [ Links ]
17. Calle M. Tuberculosis en niños. En: Reyes MA, Aristizábal Duque G, Leal Quevedo J. Neumología pediátrica. 5ª ed. Bogotá: Panamericana; 2006. p. 304-14. [ Links ]
18. Moreno-Pérez D, Andrés Matín A, Altet Gómez N, Baquero-Artigao F, Escribano Montaner A, Gómez- Pastrana Durán D, et al. Diagnóstico de la tuberculosis en la edad paediátrica. Documento de consenso de la Sociedad Española de Infectología Pediátrica (SEIP) y la Sociedad Española de Neumología Pediátrica (SENP). An Pediatr (Barc). 2010 Sep;73(3):143.e1-43.e14. DOI 10.1016/j.anpedi.2009.12.017. [ Links ]
19. Pérez-Vélez CM. Pediatric tuberculosis: new guidelines and recommendations. Curr Opin Pediatr. 2012 Jun;24(3):319-28. DOI 10.1097/MOP.0b013e32835357c3. [ Links ]
20. World Health Organization. Treatment of Tuberculosis Guidelines. 4th ed. [Internet]. Chapter 8, pag 95-98. Geneva: WHO; 2010. (Cited 2014.12.05). Available from: http://apps.who.int/iris/bitstream/10665/44165/1/9789241547833_eng.pdf?ua=1ua=1 [ Links ]