Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.28 no.4 Medellín Oct./Dec. 2015
https://doi.org/10.17533/udea.iatreia.v28n4a11
CASO CLÍNICO DE CARDIOLOGÍA
DOI 10.17533/udea.iatreia.v28n4a11
Endocarditis infecciosa
Infective endocarditis
Endocardite infecciosa
Juan Manuel Sénior1; Jairo Alfonso Gándara-Ricardo2
1 Coordinador del posgrado en Cardiología Clínica y Cardiología Intervencionista y del Grupo para la Investigación de Enfermedades Cardiovasculares, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. mmbt@une.net.co
2 Residente de Cardiología Clínica y miembro del Grupo para la Investigación de Enfermedades Cardiovasculares, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
Recibido: julio 21 de 2015
Aceptado: julio 28 de 2015
RESUMEN
La endocarditis infecciosa es una enfermedad producida por la colonización y proliferación de agentes infecciosos en la superficie endotelial del corazón. Su presentación clínica es variable pues depende de condiciones propias del hospedero, tales como el estado inmunológico, la presencia de material protésico y el uso de drogas endovenosas, y del agente causal. El diagnóstico se establece, usualmente, mediante la suma de elementos como la historia clínica, el examen físico, los hemocultivos, el ecocardiograma y otras ayudas. Presentamos el caso de un hombre adulto que acudió al hospital con un cuadro clínico de fiebre e insuficiencia cardíaca aguda. Se documentó la presencia de soplo sistólico en el foco aórtico y el ecocardiograma reveló insuficiencia valvular grave y una lesión vegetante sobre la válvula aórtica bicúspide. Requirió reemplazo valvular y completó el tratamiento antibiótico, dirigido por la sensibilidad demostrada, luego de hemocultivos positivos para Streptococcus mitis.
PALABRAS CLAVE
Bacteriemia, Endocarditis, Insuficiencia cardíaca congestiva
SUMMARY
Infective endocarditis is a disease caused by colonization and proliferation of infectious agents on the endothelial surface of the heart. Its clinical presentation is variable, depending upon conditions of the patient, such as immunosuppression, presence of prosthetic material, intravenous drug use, and the etiologic agent. Diagnosis is usually established through the addition of elements such as medical history, physical examination, results of blood cultures, echocardiography and other aids. We present the case of an adult male who came to the hospital with fever and symptoms and signs of acute heart failure. The presence of a systolic murmur was documented in the aortic area, and the echocardiogram revealed severe valve regurgitation and a vegetating lesion on the bicuspid aortic valve. He required valve replacement and completed antibiotic treatment based on the sensitivity of the Streptococcus mitis strain that was demonstrated in the blood cultures.
KEY WORDS
Acute heart failure, Bacteremia, Infectious endocarditis
RESUMO
A endocardite infecciosa é uma entidade clínica produzida pela colonização e proliferação de agentes infecciosos, na superfície endotelial do coração. Sua apresentação clínica é variável pois depende de condições próprias do hospedeiro, tais como o estado imunológico, a presença de material protético e o uso de drogas endovenosas, e do agente causal. O diagnóstico se estabelece, usualmente, mediante a soma de elementos como a história clínica, o exame físico, os resultados de hemocultura, o ecocardiograma e outras ajudas. Apresentamos o caso de um homem adulto que foi ao hospital com quadro clínico de febre e insuficiência cardíaca aguda. Documentouse a presença de sopro sistólico no foco aórtico e o ecocardiograma revelou insuficiência valvular grave e uma lesão vegetante sobre a válvula aórtica bicúspide. Requereu substituição valvular e completou o tratamento antibiótico, dirigido pela sensibilidade demonstrada, depois de hemocultivos positivos para Streptococcus mitis.
PALAVRAS CHAVES
Endocardite, Insuficiência cardíaca congestiva, Bacteriemia
Cómo citar: Senior JM, Gándara-Ricardo JA. Endocarditis infecciosa. Iatreia. 2015 Oct-Dic;28(4):456-71. DOI 10.17533/udea.iatreia.v28n4a11.
INTRODUCCIÓN
Por varias razones, la endocarditis infecciosa (EI) continúa siendo una enfermedad importante en la práctica clínica diaria, entre ellas: el poco efecto que han tenido los adelantos en el diagnóstico y en las intervenciones terapéuticas sobre la supervivencia y la morbilidad asociada, lo que resulta en mortalidad significativa y secuelas valvulares (1). Además, su forma de presentación es muy heterogénea, debido a que está influida por las características clínicas de base de cada paciente, así como por el microorganismo que la genera y el efecto final sobre la estructura y función cardíacas, lo que lleva en muchos casos a dificultades en el diagnóstico temprano (2). A ello se agrega que la naturaleza de la enfermedad dificulta hacer estudios clínicos controlados, que permitan depurar las intervenciones sobre la misma. Por tanto, actualmente la gran mayoría de las recomendaciones de las guías de práctica clínica se basan en estudios de cohorte o en la opinión de expertos (3).
CASO CLÍNICO
Hombre de 46 años, sin antecedentes médicos de importancia, residente en área rural, oficial de construcción, con cuadro de cinco meses de evolución de fiebre objetiva, episódica, con frecuencia semanal, vespertina, que mejora con antipiréticos de venta libre. Consultó previamente al hospital local donde le hicieron estudios, según el paciente, sin hallazgos anormales. Dos semanas antes del ingreso aumentaron la frecuencia e intensidad de la fiebre, hasta dos veces por día y hasta 40 °C, asociadas a deterioro rápido de la clase funcional, hasta disnea de reposo, ortopnea, disnea paroxística nocturna y edema vespertino de miembros inferiores.
En la revisión por sistemas informó la pérdida de aproximadamente 6 kg de peso en lo corrido del cuadro clínico; además, dolor abdominal difuso, sordo, de predominio en el hipocondrio derecho.
Negaba déficit neurológico focal o cefalea así como síntomas urinarios. Refirió lesiones plantares de aspecto violáceo de una semana de evolución.
Fue remitido a un hospital de segundo nivel, donde hicieron una serie de tres hemocultivos y solicitaron tomografía axial computarizada (TAC) torácica, abdominal y pélvica, sin hallazgos anormales, según el informe de remisión; le administraron dosis de ceftriaxona y vacomicina y, en atención al estado general, lo remitieron a nuestro hospital para continuar con el diagnóstico y el tratamiento.
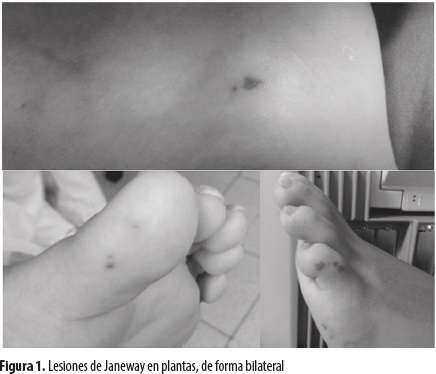
Al ingreso estaba tranquilo, con dificultad respiratoria leve y oxígeno suplementario. Al examen físico no tenía signos de deshidratación; presentaba distensión venosa yugular a 45°, punto de máximo impulso (PMI) en el sexto espacio intercostal izquierdo (EII) con la línea axilar anterior (LAA), corazón rítmico, soplo sistólico en los focos de la base, grado III/VI, no irradiado, con presencia de S3, sin frote pericárdico; murmullo vesicular normal, sin agregados patológicos. Abdomen sin distensión, blando, hígado doloroso a 4 cm debajo del reborde costal. Extremidades: pulsos simétricos, llenado capilar normal, edema simétrico grado I de miembros inferiores y lesiones violáceas en las plantas (figura 1).
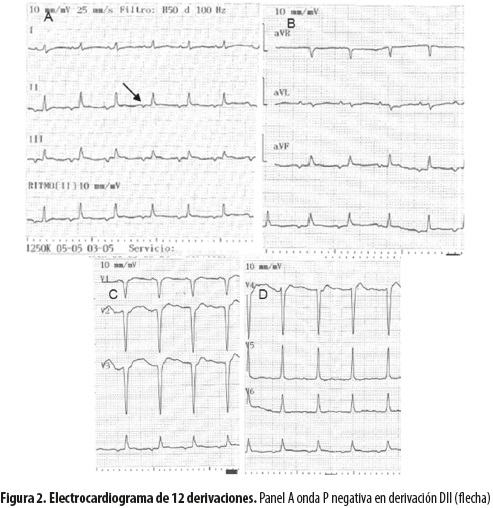
El electrocardiograma mostró taquicardia con onda P negativa en la derivación DII (figura 2, flecha), interpretada como taquicardia atrial; además, con poca progresión de la onda R en las derivadas precordiales (figura 2, panel C y D).
La radiografía inicial mostró cardiomegalia por crecimiento de ambas cavidades y signos de hipertensión pulmonar poscapilar; no había signos de consolidación ni hallazgos de derrame pleural (figura 3).
Los exámenes sanguíneos dieron los siguientes resultados: Hb 10,1 g/dL, leucocitos 15.200/µL, neutrófilos 13.400/µL, linfocitos 1.300/µL, plaquetas 247.000/µL, VSG: 51 mm, PCR 11,6 mg/dL, AST 106 U/L, ALT 84 U/L, bilirrubina total y directa 0,6/0,37 mg/dL, ionograma y función renal normales, Elisa para VIH negativa, VDRL negativa, troponina 0,8 ng/mL y péptido natriurético tipo B 1.500 ng/L.
Se le hizo ecocardiografía transesofágica, en la que se evidenció válvula aórtica bicúspide (figura 4 panel A) con lesión vegetante, móvil, en la valva anterior, con extensión a la luz aórtica en sístole y regurgitación a la cavidad ventricular izquierda en diástole (figura 4 panel A), acompañada de lesión sacular paravalvular, con comunicación a la luz aórtica, correspondiente a la formación de pseudoaneurisma (panel B). Se catalogó como grave la insuficiencia valvular. Se estimó la fracción de expulsión del 48 % y la fracción de acortamiento del 25 % por modo M, el diámetro de fin de diástole fue de 7,2 cm y el de fin de sístole, de 5,4 cm.
Se hospitalizó al paciente en sala general y se solicitó evaluación por cirugía cardiovascular para tratamiento quirúrgico de la endocarditis, con la indicación de falla cardíaca aguda progresiva, a pesar de tratamiento médico, con insuficiencia valvular grave y complicación perivalvular; se hizo reemplazo valvular por prótesis mecánica, con éxito quirúrgico y se completaron cuatro semanas de tratamiento con ampicilina sulbactam. Los hemocultivos, hechos en un centro de referencia, fueron positivos para Streptococcus mitis.
DISCUSIÓN
Desde el punto de vista sindromático se debe orientar este caso como un síndrome febril asociado a falla cardíaca, aunque en el cuadro clínico de esta última se ha descrito fiebre (4). Las causas más frecuentes para considerar son: endocarditis infecciosa, fiebre reumática y enfermedad del colágeno tipo lupus eritematoso sistémico (LES). La fiebre reumática es una enfermedad que afecta el tejido conectivo, más frecuente en adultos jóvenes y cuya principal manifestación se debe al compromiso endocárdico, miocárdico y/o pericárdico; el LES es una enfermedad inflamatoria sistémica de predominio en mujeres, que se caracteriza por afectación multiorgánica, tal como nefritis, artritis, compromiso de la piel y con menor frecuencia carditis y alteración valvular (5).
GENERALIDADES Y CLASIFICACIÓN
La EI consiste en la infección de la superficie endocárdica del corazón e implica la presencia de microorganismos en la lesión; con mayor frecuencia afecta las válvulas, pero también se puede comprometer cualquier componente de esta superficie, incluyendo los cortocircuitos, los defectos septales, la pared ventricular, el material protésico o los dispositivos endocárdicos (6).
En el pasado, se clasificaba la EI como aguda, subaguda o crónica, con base en su historia natural sin tratamiento, pero esta clasificación tiene hoy solo interés histórico. La forma aguda se presentaba usualmente de forma agresiva, con fiebre alta, compromiso sistémico y disfunción orgánica en un período inferior a seis semanas. Usualmente estaba asociada a infección por Staphylococcus aureus, Streptococcus pyogenes, Streptococcus pneumoniae o Neisseria gonorrhoeae; la forma subaguda abarcaba entre las seis semanas y los tres meses, y la forma crónica, después de los tres meses. Esta última presentación tenía un curso menos llamativo, con fiebre de bajo grado, malestar, pérdida de peso y diaforesis nocturna. Con mayor frecuencia se debía a infección por estreptococos orales (7).
Actualmente se prefiere clasificar la EI por su localización: el compromiso de válvulas izquierdas o derechas; la asociación con material protésico: válvula nativa (70 % a 80 %) versus válvula protésica; modo de adquisición: en la comunidad (50 % a 70 %) versus asociada al cuidado de la salud o a abuso de drogas endovenosas (5 %), y según la etiología microbiológica (8).
EPIDEMIOLOGÍA
Es difícil establecer la incidencia de EI, entre otras razones por la heterogeneidad de las poblaciones estudiadas y la disparidad de criterios aplicados para el diagnóstico (9,10). Estudios en países industrializados han establecido una incidencia de 3 a 9 casos por 100.000 habitantes por año en la población general, pero se reconoce que hay poblaciones con mayor incidencia como son los portadores de válvulas protésicas o dispositivos intracardíacos, los pacientes con cardiopatías congénitas cianosantes no corregidas y el antecedente de EI previa (8). La presentación de la EI ha permanecido estable en las últimas décadas, a pesar de los adelantos en el diagnóstico y la modificación de conductas como la profilaxis antibacteriana (11).
La relación hombre mujer es de 1,7:1, con reportes desde 1:1 hasta 3:1 (8). Se ha observado un aumento progresivo en la edad media de presentación, probablemente relacionado con el mayor envejecimiento de la población, la presencia de enfermedad valvular degenerativa asociada, el mayor requerimiento de cuidados sanitarios para esta población y el uso más frecuente de material protésico y dispositivos endocavitarios. Actualmente la media de edad de presentación es de 50,7 años, más del 50 % de los casos se presentan en adultos mayores de 50 años y el 20 % ocurren en personas mayores de 80 años (12,13).
FACTORES DE RIESGO
Entre los factores de riesgo reconocidos están los defectos estructurales cardíacos, como el prolapso de la válvula mitral, especialmente en presencia de engrosamiento e insuficiencia valvular; la válvula aórtica bicúspide, la enfermedad cardíaca reumática, la enfermedad valvular adquirida, la enfermedad cardíaca congénita, el antecedente de EI y la miocardiopatía hipertrófica; la presencia de válvula protésica o dispositivos es un factor de riesgo reconocido. De igual forma, algunas situaciones clínicas como la hemodiálisis de larga data, la mala higiene dental, los procedimientos o lesiones en el tracto gastrointestinal, el uso de drogas endovenosas y la infección por el virus de la inmunodeficiencia adquirida (VIH) (8,14,15).
FISIOPATOLOGÍA
El endotelio valvular normal es por naturaleza resistente a la colonización bacteriana, por lo que muy pocos microorganismos de alta virulencia son capaces de infectarlo, aunque esta es la excepción. Se reconocen dos elementos importantes en la fisiopatología de la EI: el primero de ellos es la lesión endotelial, ocasionada por la presencia de flujo turbulento en el endocardio, usualmente sobre la superficie ventricular de las válvulas semilunares y la auricular de las auriculoventriculares, que lleva a la exposición de proteínas de la matriz extracelular, producción de factor tisular y depósito de plaquetas y fibrina, con la formación final de la llamada endocarditis trombótica no bacteriana (16). El segundo elemento es la bacteriemia, como, por ejemplo, la que ocurre de forma intermitente por la microflora oral con las actividades cotidianas de higiene o los procedimientos dentales; dependiendo de su virulencia, estas bacterias son capaces de adherirse al material trombótico localizado en las válvulas o en otros sitios, lo que lleva a mayor acúmulo de plaquetas y a formación de fibrina, proliferación de bacterias y crecimiento progresivo de la vegetación; la adhesión depende de componentes de la superficie microbiana que reconocen moléculas en la matriz como fibronectina o colágeno, y posteriormente, de la activación de integrinas que permiten la internalización del microorganismo por las células endoteliales, en las que puede persistir protegido de las defensas del hospedero y de los antibióticos administrados (16,17).
ETIOLOGÍA
Los principales microorganismos causantes de EI son especies de estafilococo y estreptococo, que producen más del 80 % de los casos; la frecuencia de uno u otro germen depende de variables como la edad, las comorbilidades, el compromiso de válvulas nativas o protésicas y la fuente de la infección. Sin embargo, en la actualidad los estafilococos explican la mayoría de las endocarditis, probablemente por el aumento de las infecciones relacionadas con el cuidado de la salud. Paralelamente, ha disminuido la incidencia de EI por estreptococos (8,17), posiblemente por el cambio en la prevalencia de los factores predisponentes, en especial la enfermedad cardíaca reumática. La taxonomía de los gérmenes causantes de EI ha cambiado por la descripción de nuevas especies con base en microbiología molecular, lo que hace más compleja la clasificación para los clínicos; Streptococcus bovis (EB) se asocia con EI en 10 % a 15 % de los casos; se origina en el tracto gastrointestinal, está asociado a pólipos y cáncer colónico y ha sido reclasificado de la siguiente manera: EB biotipo I como Streptoccocus gallolyticus subespecie gallolyticus; EB biotipo II/1 como Streptoccocus lutetiensis y EB biotipo II/2 como Streptoccocus gallolyticus subespecie pasteurianus. Las bacterias gramnegativas no HACEK (por la sigla de Haemophilus, Aggregatibacter, Cardiobacterium, Eikenella, Kingella) explican el 1,8 % de las EI (18,19).
La endocarditis con hemocultivos negativos se presenta en 5 % a 10 % de los casos, está relacionada con el comienzo de los antibióticos antes de obtener las muestras para hemocultivos y en algunas ocasiones se explica por la presencia de gérmenes de difícil crecimiento (3,7); los organismos aislados en esta forma de presentación son bacterias exigentes, como los estreptococos nutricionalmente variantes de los géneros Gemella, Abiotrophia y Granulicatella, los bacilos gramnegativos del grupo HACEK como Haemophilus parainfluenzae, H. aphrophilus, H. paraphrophilus, H. influenzae, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae y K. dentrificans, y otros como Brucella y los hongos (7); Haemophilus paraphrophilus y Actinobacillus actinomycetemcomitans han sido reclasificados en el género Aggregatibacter.
MANIFESTACIONES CLÍNICAS
El espectro clínico de la EI es sumamente amplio, puesto que la forma de presentación depende de muchos factores, entre ellos: la susceptibilidad del hospedero, el germen causal, la duración de la enfermedad y las comorbilidades. Aunque los síntomas son inespecíficos, se presenta como un cuadro infeccioso sistémico en más del 80 % de los casos con fiebre, anorexia, malestar y pérdida de peso; la presentación más frecuente es la aguda, pero también se puede presentar de manera subaguda o crónica. Se debe hacer una historia clínica completa que incluya los procedimientos quirúrgicos o médicos y la historia reciente de infección bacteriana. Especial atención deben recibir las lesiones cardíacas preexistentes así como el abuso de drogas endovenosas (20) (tabla 1).
El examen físico debe incluir la determinación del punto de máximo impulso y la palpación del precordio; la auscultación cardíaca permite detectar los soplos, especialmente los debidos a insuficiencia o el cambio en las características del soplo ya conocido.
Es importante definir si hay signos de falla cardíaca como complicación de la EI (3).
Se deben buscar lesiones embólicas en el fondo de ojo, las conjuntivas, la piel y los dedos. Las petequias son las lesiones más frecuentes en la piel, las conjuntivas (eversión del párpado inferior) o el paladar. Las hemorragias en astilla se presentan como lesiones lineales de color marrón rojizo, que se extienden por todo el lecho ungueal; su localización proximal las relaciona más fuertemente con el diagnóstico de EI (8).
Las lesiones de Janeway, los nódulos de Osler y las manchas de Roth son hallazgos más específicos de la EI; se presentan con mayor frecuencia cuando la bacteriemia es prolongada y por tanto son relativamente escasas en la actualidad. Las lesiones de Janeway (figura 1) son maculares, no dolorosas, eritematosas en las palmas y plantas. Los nódulos de Osler son áreas pequeñas induradas, dolorosas y violáceas que se encuentran en el pulpejo de los dedos de manos y pies y se ven con más frecuencia en las formas subagudas. Las manchas de Roth son lesiones de la retina hemorrágicas, exudativas, edematosas, de centro pálido. Estos dos últimos tipos de lesión son ocasionados por el depósito de complejos inmunes y la vasculitis focal (3,8).
Se debe hacer una exploración neurológica completa para determinar la presencia de compromiso focal, derivado de posibles fenómenos embólicos al sistema nervioso central (8). Entre las complicaciones extracardíacas de la EI, las cerebrales son las más graves y las más frecuentes: se producen en 15 % a 20 % de los pacientes (21,22). Incluyen el accidente cerebrovascular isquémico y/o hemorrágico que puede preceder al diagnóstico en el 60 % de los pacientes, la isquemia cerebral transitoria, la embolia cerebral silente, el aneurisma micótico, el absceso cerebral y la meningitis (23,24). Igual atención debe recibir el compromiso de otros órganos, como la osteomielitis vertebral por metástasis de la infección, y los infartos renales y esplénicos. La endocarditis de cavidades derechas puede llevar a embolia séptica pulmonar y a la formación de abscesos (20).
DIAGNÓSTICO
El diagnóstico de EI es un reto clínico en la mayoría de los casos. La guía más reciente de la American Heart Association y el American College of Cardiology para el diagnóstico y tratamiento de la enfermedad valvular propone los criterios modificados de Duke para el diagnóstico de la EI (25,26), que tienen sensibilidad y especificidad superiores al 80 % (tablas 2 y 3).
Los hemocultivos son fundamentales para el diagnóstico y el tratamiento adecuados de la EI, puesto que es vital la identificación etiológica de la enfermedad para lograr una terapia efectiva, sin someter al paciente a los efectos indeseados de los antibióticos administrados en forma empírica. Tres series, con al menos una aeróbica y una anaeróbica entre ellas, cada una con 10 mL de sangre, de una vena periférica con cumplimiento de las normas asépticas, logran identificar los microorganismos habituales; el rendimiento diagnóstico de repetir las muestras a partir de entonces es escaso (3). No se deben tomar muestras de líneas centrales por el alto riesgo de contaminación (27).
Teóricamente, la bacteriemia de la EI es constante por ser una infección intravascular, por lo cual las muestras para hemocultivos se pueden tomar en cualquier momento, independientemente de la presencia de fiebre. En pacientes inestables con sepsis grave o choque séptico o cardiogénico en la fase aguda se recomienda tomar dos series de hemocultivos con diferencia de una hora, antes de comenzar el tratamiento. Se debe plantear la posibilidad de suspender los antibióticos en pacientes con sospecha de EI que estén clínicamente estables y hacerles tres series de hemocultivos. Con el advenimiento de los sistemas automatizados de hemocultivos y las técnicas moleculares modernas, no se recomienda la extensión del tiempo de cultivo más allá de los 5 días, puesto que la posibilidad de aislamiento de gérmenes es muy baja. Cuando la fiebre persiste 7 días después de iniciar un tratamiento adecuado se deben repetir los hemocultivos (28).
La EI con hemocultivos negativos puede estar asociada con la administración previa de antibióticos, pero también puede relacionarse con la infección causada por microorganismos de crecimiento lento o de aislamiento difícil. En estos pacientes se recomienda hacer serología para Coxiella, Bartonella y Brucella. En caso de ser negativa, puede considerarse la serología para Chlamydia, Legionella y Mycoplasma, aunque son extremadamente raros como causa de EI.
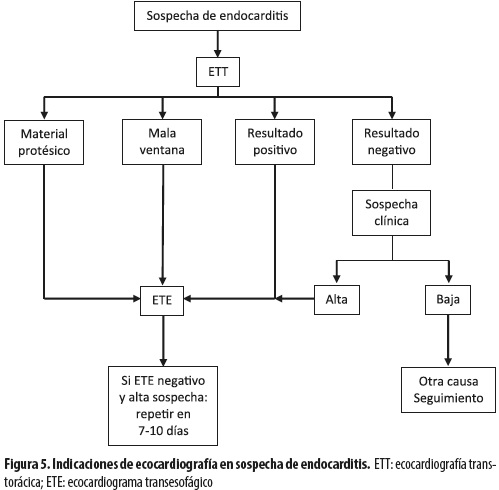
La ecocardiografía transtorácica (ETT) tiene sensibilidad y especificidad menores que las de la ecocardiografía transesofágica; sin embargo, es el punto de partida para el estudio imaginológico de todos los pacientes y se la debe hacer lo más rápido posible ante la sospecha, idealmente en las primeras 24 horas. A los pacientes que tengan mala ventana acústica transtorácica, válvula protésica o dispositivo endocárdico se les debe hacer inicialmente la ETT y seguidamente el ecocardiograma transesofágico (ETE), puesto que las mediciones realizadas en el modo M de la ETT son importantes (3). Si la ETT es positiva y hay características de alto riesgo para complicación perivalvular, al paciente se le debe hacer ETE. Si la ETT inicial es negativa, pero existe una sólida presunción clínica del diagnóstico de EI, también se debe hacer ETE. Si la ETT es negativa y la sospecha clínica es baja, se deben suspender los esfuerzos diagnósticos (3,29,30) (figura 5).
Otras modalidades de imágenes
La TAC multicorte puede detectar la presencia de vegetaciones y abscesos perivalvulares, pero su mayor utilidad radica en la detección de complicaciones extracardíacas como fenómenos embólicos, aneurismas micóticos, hemorragias y lesiones sépticas a distancia. La resonancia magnética, aunque puede detectar alteraciones valvulares, se utiliza para la detección de alteraciones cerebrovasculares subclínicas, que pueden estar presentes hasta en el 50 % de los casos y llevar a cambios en la terapia. La tomografía por emisión de positrones (PET-CT) con fosfodeoxiglucosa (FDG) permite identificar la actividad metabólica, en este caso de las células inflamatorias presentes en el foco infeccioso. Estudios preliminares han demostrado sensibilidad y especificidad altas para el diagnóstico de EI en válvula protésica, cambiando la sensibilidad de los criterios de Duke, al ingreso, de 70 % a 97 %. Su limitación radica en el aumento de falsos positivos cuando se hace muy tempranamente después del procedimiento quirúrgico. También es útil para la detección de infección en presencia de dispositivos (31).
TRATAMIENTO
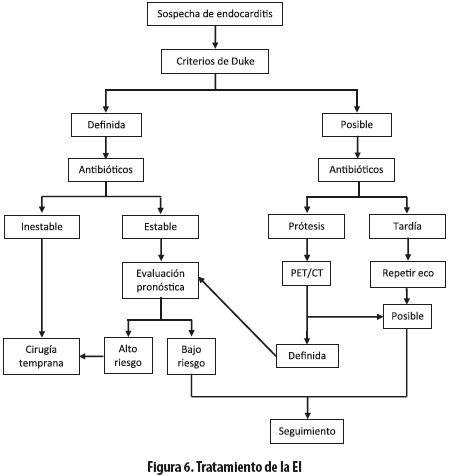
Se recomienda un equipo multidisciplinario para el tratamiento del paciente con EI; debe incluir cardiólogo clínico, cirujano cardiovascular, anestesiólogo cardiovascular y especialista en enfermedades infecciosas. La selección, duración y vía de la terapia antibiótica irán de la mano de la identificación del germen responsable, su perfil de sensibilidad (concentración inhibidora mínima de los antibióticos) y los factores asociados, por lo que se insiste en el esfuerzo para su correcta caracterización (25) (figura 6).
Las guías de práctica clínica tienen en cuenta esta información para sus recomendaciones sobre el tratamiento antibiótico (16). El tratamiento quirúrgico se ofrece a cerca de la mitad de los pacientes con EI. Esto, con base en el reconocimiento de las características de alto riesgo que impiden que el tratamiento antibiótico per se resuelva por completo la infección; entre tales características están: la insuficiencia cardíaca progresiva, la infección no controlada y fenómenos embólicos a repetición, a pesar del tratamiento antibiótico apropiado. El tratamiento quirúrgico es de alta morbilidad, por lo que se debe seleccionar cuidadosamente a los pacientes, con el fin de obtener los mayores beneficios de la intervención, y aunque el tiempo depende de cada situación específica, se sugiere que sea en forma temprana, idealmente en las primeras 48 horas (32). Las indicaciones más frecuentes para plantear el tratamiento quirúrgico fueron: desarrollo de falla cardíaca, fenómenos embólicos recurrentes a pesar de un tratamiento médico óptimo, bacteriemia persistente, formación de abscesos perivalvulares, el tamaño de la vegetación y el tipo de microorganismo (32,33).
La insuficiencia cardíaca, que se presenta en 50 % a 60 % de los pacientes con EI, es la causa más frecuente de indicación quirúrgica (29); usualmente se debe al daño valvular agudo, con la insuficiencia correspondiente; en 29 % de los casos se afecta la válvula aórtica y en 20 %, la mitral (34). Las fístulas o la obstrucción de las cavidades cardíacas por vegetaciones gigantes son causas menos frecuentes de falla cardíaca. Las manifestaciones clínicas de esta tienen todo el espectro de gravedad desde síntomas leves hasta el choque cardiogénico y el edema pulmonar refractario. En una cohorte prospectiva de 4075 pacientes, 1359 (33,3 %) desarrollaron falla cardíaca, de los cuales 906 (66,7 %) se encontraban en la clase funcional NYHA III o IV; en el análisis de riesgos proporcionales de Cox con ajuste por puntaje de propensión (propensity score) se demostró que la mortalidad a 1 año en pacientes con tratamiento quirúrgico estaba relacionada no solo con la presencia de falla cardíaca, sino también con la edad avanzada, la diabetes mellitus, la infección asociada al cuidado de la salud, microorganismos como S. aureus u hongos, la enfermedad cerebrovascular y las complicaciones perivalvulares (35). Estas mismas variables se deben tener en cuenta en pacientes con válvulas protésicas implantadas por vía percutánea (36-38).
La infección no controlada es la segunda razón para intervenir quirúrgicamente a los pacientes con EI; esta situación se debe sospechar ante la persistencia de la fiebre a pesar del tratamiento antibiótico óptimo y siempre obliga a investigar la presencia de extensión local de la infección como la formación de abscesos, pseudoaneurismas o fístulas (31,32,39). La infección extracardíaca puede ser la causa de la persistencia de la fiebre, por lo que se debe hacer una búsqueda exhaustiva. La identificación de gérmenes resistentes como S. aureus meticilino-resistente (MRSA) o enterococos resistentes a la vancomicina, y también las infecciones raras causadas por bacterias gramnegativas u hongos constituyen otra posible indicación para la intervención quirúrgica (40-42).
El inicio de la terapia antibiótica es la intervención más significativa para controlar el riesgo embólico; los émbolos se presentan en 30 % a 50 % de los pacientes antes de iniciar el antibiótico y la frecuencia baja hasta el 6 % una vez se comienza la terapia antimicrobiana. Existen varias características clínicas que predicen el alto riesgo embólico, especialmente durante la primera semana de tratamiento, tales como el compromiso de la válvula mitral, la infección por ciertos microorganismos como S. aureus y el tamaño de las vegetaciones mayor de 10 mm (y especialmente si es mayor de 15 mm) (43,44). Las vegetaciones localizadas en la válvula mitral, en especial en su valva anterior, tienen mayor riesgo de embolización (45), máxime si son de gran tamaño y móviles (46). Otro aspecto importante es el tamaño de la vegetación durante el seguimiento, puesto que se asocia con mayor riesgo de embolismo (47): durante el tratamiento antibiótico la vegetación debe disminuir de tamaño o permanecer estable, porque, en caso contrario es mayor el riesgo de eventos embólicos. Las características de la vegetación se pueden determinar también por técnicas nuevas como la ecocardiografía tridimensional, aunque en este caso hay diferencias en la medición del tamaño de la vegetación con respecto a la bidimensional, y el mejor punto de corte parece ser más de 20 mm (48). Estas variables se pueden integrar en un modelo de predicción clínica para establecer el riesgo de embolismo, utilizando la edad, la diabetes mellitus, la fibrilación auricular, el evento embólico antes de iniciar los antibióticos, el tamaño de la vegetación y la infección por S. aureus (49). La decisión de operar con rapidez para prevenir la embolia siempre es difícil y se debe individualizar, de acuerdo con el riesgo basal y las posibles complicaciones (50). Aunque algunos estudios observacionales demuestran que el tratamiento quirúrgico disminuye la mortalidad (51), en especial en ciertos subgrupos de pacientes, el único ensayo clínico con diseño metodológico aceptable llevado a cabo hasta el momento, solo pudo demostrar reducción de los eventos embólicos en una población altamente seleccionada de pacientes con enfermedad valvular grave y vegetación mayor de 10 mm (52). A la hora de decidir el tratamiento quirúrgico se debe tener en cuenta que el EUROSCORE II (European System for Cardiac Operative Risk Evaluation) subestima la mortalidad, especialmente en pacientes con riesgo predicho mayor del 10 % (53).
CONCLUSIONES
La EI es una enfermedad infrecuente, con síntomas y signos inespecíficos y altas tasas de morbilidad y mortalidad, por lo que es necesario tener un alto índice de sospecha, con el fin de hacer un diagnóstico precoz, que mejore los desenlaces de los pacientes. Un punto fundamental en su diagnóstico y tratamiento es la identificación del microorganismo responsable, por lo que se insiste en una adecuada técnica para la toma de los hemocultivos, siempre antes de comenzar el antibiótico, y en diferir la terapia antibiótica empírica, mientras la condición clínica del paciente lo permita.
El tratamiento antibiótico depende de la identificación del germen y de su perfil de sensibilidad, la asociación con válvulas protésicas y otras características propias de cada paciente; por tal razón, es altamente individualizado. El tratamiento quirúrgico se ofrece a un número importante de pacientes con diagnóstico de EI. Se basa en el reconocimiento de características de alto riesgo que ameritan la intervención quirúrgica para el adecuado control de la enfermedad o sus consecuencias. Tiene alta morbimortalidad por lo cual se debe selccionar cuidadosamente a los pacientes. Por la complejidad de estos pacientes, siempre los debe evaluar un equipo multidisciplinario en el que participen cardiólogos, cirujanos cardiovasculares, anestesiólogos cardiovasculares y especialistas en enfermedades infecciosas.
REFERENCIAS BIBLIOGRÁFICAS
1. Moreillon P, Que YA. Infective endocarditis. Lancet. 2004 Jan;363(9403):139-49. [ Links ]
2. Habib G. Management of infective endocarditis. Heart. 2006 Jan;92(1):124-30. [ Links ]
3. Habib G, Hoen B, Tornos P, Thuny F, Prendergast B, Vilacosta I, et al. Guidelines on the prevention, diagnosis, and treatment of infective endocarditis (new version 2009): the Task Force on the Prevention, Diagnosis, and Treatment of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by the European Society of Clinical Microbiology and Infectious Diseases (ESCMID) and the International Society of Chemotherapy (ISC) for Infection and Cancer. Eur Heart J. 2009 Oct;30(19):2369-413. DOI 10.1093/eurheartj/ehp285. [ Links ]
4. Kinsey D, White PD. Fever in congestive heart failure. Arch Intern Med. 1940 Jan;65(1):163-70. DOI 10.1001/archinte.1940.00190070173012. [ Links ]
5. Jensen-Urstad K, Svenungsson E, de Faire U, Silveira A, Witztum JL, Hamsten A, et al. Cardiac valvular abnormalities are frequent in systemic lupus erythematosus patients with manifest arterial disease. Lupus. 2002;11(11):744-52. [ Links ]
6. Reddy G, Chatterjee A, Leon K. Left atrial mural endocarditis secondary to mitral valve jet lesion. Circulation. 2015 Apr;131(17):1529-30. DOI 10.1161/CIRCULATIONAHA.115.015626. [ Links ]
7. Fowler VG, Scheld WM, Bayer AS. Cardiovascular infections. In: Bennett JE, Dolin R, Blaser MJ. Mandell, Douglas, and Bennett's. Principles and Practice of Infectious Diseases. 8th ed. Elsevier 2015. p. 990-1027. [ Links ]
8. Hoen B, Duval X. Clinical practice. Infective endocarditis. N Engl J Med. 2013 Apr;368(15):1425-33. DOI 10.1056/NEJMcp1206782. Erratum in: N Engl J Med. 2013 Jun 27;368(26):2536. [ Links ]
9. Von Reyn CF, Levy BS, Arbeit RD, Friedland G, Crumpacker CS. Infective endocarditis: an analysis based on strict case definitions. Ann Intern Med. 1981 Apr;94(4 pt 1):505-18. [ Links ]
10. Steckelberg JM, Melton LJ 3rd, Ilstrup DM, Rouse MS, Wilson WR. Influence of referral bias on the apparent clinical spectrum of infective endocarditis. Am J Med. 1990 Jun;88(6):582-8. [ Links ]
11. Duval X, Delahaye F, Alla F, Tattevin P, Obadia JF, Le Moing V, et al. Temporal trends in infective endocarditis in the context of prophylaxis guideline modifications: three successive population-based surveys. J Am Coll Cardiol. 2012 May;59(22):1968-76. DOI 10.1016/j.jacc.2012.02.029. [ Links ]
12. Murdoch DR, Corey GR, Hoen B, Miró JM, Fowler VG Jr, Bayer AS, et al. Clinical presentation, etiology, and outcome of infective endocarditis in the 21st century: the International Collaboration on Endocarditis-Prospective Cohort Study. Arch Intern Med. 2009 Mar;169(5):463-73. DOI 10.1001/archinternmed.2008.603. [ Links ]
13. Durante-Mangoni E, Bradley S, Selton-Suty C, Tripodi MF, Barsic B, Bouza E, et al. Current features of infective endocarditis in elderly patients: results of the International Collaboration on Endocarditis Prospective Cohort Study. Arch Intern Med. 2008 Oct;168(19):2095- 103. DOI 10.1001/archinte.168.19.2095. [ Links ]
14. Richey R, Wray D, Stokes T; Guideline Development Group. Prophylaxis against infective endocarditis: summary of NICE guidance. BMJ. 2008 Apr;336(7647):770-1. DOI 10.1136/bmj.39510.423148.AD. [ Links ]
15. Ruotsalainen E, Sammalkorpi K, Laine J, Huotari K, Sarna S, Valtonen V, et al. Clinical manifestations and outcome in Staphylococcus aureus endocarditis among injection drug users and nonaddicts: a prospective study of 74 patients. BMC Infect Dis. 2006 Sep;6:137. [ Links ]
16. Wilson W, Taubert KA, Gewitz M, Lockhart PB, Baddour LM, Levison M et al. Prevention of infective endocarditis: guidelines from the American Heart Association: a guideline from the American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee, Council on Cardiovascular Disease in the Young, and the Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia, and the Quality of Care and Outcomes Research Interdisciplinary Working Group. Circulation. 2007;116(15):1736-54. DOI 10.1161/CIRCULATIONAHA.106.183095. [ Links ]
17. Bashore TM, Cabell C, Fowler V Jr. Update on infective endocarditis. Curr Probl Cardiol. 2006 Apr;31(4):274-352. [ Links ]
18. Slipczuk L, Codolosa JN, Davila CD, Romero-Corral A, Yun J, Pressman GS, et al. Infective endocarditis epidemiology over five decades: a systematic review. PLoS One. 2013 Dec;8(12):e82665. [ Links ] DOI 10.1371/journal.pone.0082665. Erratum in: PLoS One. 2014;9(10):e111564.
19. Morpeth S, Murdoch D, Cabell CH, Karchmer AW, Pappas P, Levine D, et al. Non-HACEK gram-negative bacillus endocarditis. Ann Intern Med. 2007 Dec;147(12):829-35. [ Links ]
20. Paterick TE, Paterick TJ, Nishimura RA, Steckelberg JM. Complexity and subtlety of infective endocarditis. Mayo Clin Proc. 2007 May;82(5):615-21. [ Links ]
21. Thuny F, Avierinos JF, Tribouilloy C, Giorgi R, Casalta JP, Milandre L, et al. Impact of cerebrovascular complications on mortality and neurologic outcome during infective endocarditis: a prospective multicentre study. Eur Heart J. 2007 May;28(9):1155-61. [ Links ]
22. Sonneville R, Mirabel M, Hajage D, Tubach F, Vignon P, Perez P, et al. Neurologic complications and outcomes of infective endocarditis in critically ill patients: the ENDOcardite en REAnimation prospective multicenter study. Crit Care Med. 2011 Jun;39(6):1474-81. DOI 10.1097/CCM.0b013e3182120b41. [ Links ]
23. Dickerman SA, Abrutyn E, Barsic B, Bouza E, Cecchi E, Moreno A, et al. The relationship between the initiation of antimicrobial therapy and the incidence of stroke in infective endocarditis: an analysis from the ICE Prospective Cohort Study (ICE-PCS). Am Heart J. 2007 Dec;154(6):1086-94. [ Links ]
24. Thuny F, Di Salvo G, Belliard O, Avierinos JF, Pergola V, Rosenberg V, et al. Risk of embolism and death in infective endocarditis: prognostic value of echocardiography: a prospective multicenter study. Circulation. 2005 Jul;112(1):69-75. Erratum in: Circulation. 2005 Aug;112(9):e125. [ Links ]
25. Nishimura RA, Otto CM, Bonow RO, Carabello BA, Erwin JP 3rd, Guyton RA, et al. 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Thorac Cardiovasc Surg. 2014 Jul;148(1):e1-e132. DOI 10.1016/j.jtcvs.2014.05.014. Erratum in: J Thorac Cardiovasc Surg. 2014 Oct;64(16):1763. [ Links ]
26. Li JS, Sexton DJ, Mick N, Nettles R, Fowler VG Jr, Ryan T, et al. Proposed modifications to the Duke criteria for the diagnosis of infective endocarditis. Clin Infect Dis. 2000 Apr;30(4):633-8. [ Links ]
27. Raoult D, Casalta JP, Richet H, Khan M, Bernit E, Rovery C, et al. Contribution of systematic serological testing in diagnosis of infective endocarditis. J Clin Microbiol. 2005 Oct;43(10):5238-42. [ Links ]
28. Gould FK, Denning DW, Elliott TS, Foweraker J, Perry JD, Prendergast BD, et al. Guidelines for the diagnosis and antibiotic treatment of endocarditis in adults: a report of the Working Party of the British Society for Antimicrobial Chemotherapy. J Antimicrob Chemother. 2012 Feb;67(2):269-89. DOI 10.1093/jac/dkr450. Erratum in: J Antimicrob Chemother. 2012 May;67(5):1304. [ Links ]
29. Sachdev M, Peterson GE, Jollis JG. Imaging techniques for diagnosis of infective endocarditis. Infect Dis Clin North Am. 2002 Jun;16(2):319-37, ix. [ Links ]
30. Greaves K, Mou D, Patel A, Celermajer DS. Clinical criteria and the appropriate use of transthoracic echocardiography for the exclusion of infective endocarditis. Heart. 2003 Mar;89(3):273-5. [ Links ]
31. Thuny F, Grisoli D, Cautela J, Riberi A, Raoult D, Habib G. Infective endocarditis: prevention, diagnosis, and management. Can J Cardiol. 2014 Sep;30(9):1046-57. DOI 10.1016/j.cjca.2014.03.042. [ Links ]
32. Chu VH, Park LP, Athan E, Delahaye F, Freiberger T, Lamas C, et al. Association between surgical indications, operative risk, and clinical outcome in infective endocarditis: a prospective study from the International Collaboration on Endocarditis. Circulation. 2015 Jan;131(2):131-40. DOI 10.1161/CIRCULATIONAHA.114.012461. [ Links ]
33. Herregods MC, Herijgers P. Early surgery in infective endocarditis with large vegetations significantly reduced mortality compared with conventional treatment. Evid Based Med. 2013 Aug;18(4):145-6. DOI 10.1136/eb-2012-100982. [ Links ]
34. Tornos P, Iung B, Permanyer-Miralda G, Baron G, Delahaye F, Gohlke-Bärwolf Ch, et al. Infective endocarditis in Europe: lessons from the Euro heart survey. Heart. 2005 May;91(5):571-5. [ Links ]
35. Kiefer T, Park L, Tribouilloy C, Cortes C, Casillo R, Chu V, et al. Association between valvular surgery and mortality among patients with infective endocarditis complicated by heart failure. JAMA. 2011 Nov;306(20):2239-47. [ Links ] DOI 10.1001/jama.2011.1701.
36. Amat-Santos IJ, Messika-Zeitoun D, Eltchaninoff H, Kapadia S, Lerakis S, Cheema AN, et al. Infective endocarditis after transcatheter aortic valve implantation: results from a large multicenter registry. Circulation. 2015 May;131(18):1566-74. DOI 10.1161/CIRCULATIONAHA.114.014089. [ Links ]
37. Amat-Santos IJ, Ribeiro HB, Urena M, Allende R, Houde C, Bédard E, et al. Prosthetic valve endocarditis after transcatheter valve replacement: a systematic review. JACC Cardiovasc Interv. 2015 Feb;8(2):334- 46. [ Links ] DOI 10.1016/j.jcin.2014.09.013.
38. Martínez-Sellés M, Bouza E, Díez-Villanueva P, Valerio M, Fariñas MC, Muñoz-García AJ, et al. Incidence and clinical impact of infective endocarditis after transcatheter aortic valve implantation. EuroIntervention. 2015 Feb;10(11). pii: 20140826-07. DOI 10.4244/EIJY15M02_05. [ Links ]
39. Anguera I, Miro JM, Evangelista A, Cabell CH, San Roman JA, Vilacosta I, et al. Periannular complications in infective endocarditis involving native aortic valves. Am J Cardiol. 2006 Nov;98(9):1254-60. [ Links ]
40. Ellis ME, Al-Abdely H, Sandridge A, Greer W, Ventura W. Fungal endocarditis: evidence in the world literature, 1965-1995. Clin Infect Dis. 2001 Jan;32(1):50-62. [ Links ]
41. Senior JM, Moncayo A. Endocarditis por Citrobacter. Acta Med Col. 1998;23:309-10. [ Links ]
42. Senior JM, Saldarriaga C. Endocarditis infecciosa por Paecilomyces variotii. Biomédica. 2009 Apr- Jun;29(2):177-80. [ Links ]
43. Hill EE, Herijgers P, Claus P, Vanderschueren S, Peetermans WE, Herregods MC. Clinical and echocardiographic risk factors for embolism and mortality in infective endocarditis. Eur J Clin Microbiol Infect Dis. 2008 Dec;27(12):1159-64. DOI 10.1007/s10096-008-0572-9. [ Links ]
44. Rizzi M, Ravasio V, Carobbio A, Mattucci I, Crapis M, Stellini R, et al. Predicting the occurrence of embolic events: an analysis of 1456 episodes of infective endocarditis from the Italian Study on Endocarditis (SEI). BMC Infect Dis. 2014 Apr;14:230. DOI 10.1186/1471-2334-14-230. [ Links ]
45. Habib G, Badano L, Tribouilloy C, Vilacosta I, Zamorano JL, Galderisi M, et al. Recommendations for the practice of echocardiography in infective endocarditis. Eur J Echocardiogr. 2010 Mar;11(2):202-19. [ Links ] DOI 10.1093/ejechocard/jeq004.
46. Di Salvo G, Habib G, Pergola V, Avierinos JF, Philip E, Casalta JP, et al. Echocardiography predicts embolic events in infective endocarditis. J Am Coll Cardiol. 2001 Mar;37(4):1069-76. [ Links ]
47. Vilacosta I, Graupner C, San Román JA, Sarriá C, Ronderos R, Fernández C, et al. Risk of embolization after institution of antibiotic therapy for infective endocarditis. J Am Coll Cardiol. 2002 May;39(9):1489-95. [ Links ]
48. Berdejo J, Shibayama K, Harada K, Tanaka J, Mihara H, Gurudevan SV, et al. Evaluation of vegetation size and its relationship with embolism in infective endocarditis: a real-time 3-dimensional transesophageal echocardiography study. Circ Cardiovasc Imaging. 2014 Jan;7(1):149-54. DOI 10.1161/CIRCIMAGING.113.000938. [ Links ]
49. Hubert S, Thuny F, Resseguier N, Giorgi R, Tribouilloy C, Le Dolley Y, et al. Prediction of symptomatic embolism in infective endocarditis: construction and validation of a risk calculator in a multicenter cohort. J Am Coll Cardiol. 2013 Oct;62(15):1384-92. DOI 10.1016/j.jacc.2013.07.029. [ Links ]
50. Biteker FS, Basaran Ö, Dogan V, Biteker M. What is the optimal timing for surgical treatment of infective endocarditis? Mayo Clin Proc. 2015 Mar;90(3):415. DOI 10.1016/j.mayocp.2014.12.020. [ Links ]
51. Gálvez-Acebal J, Almendro-Delia M, Ruiz J, de Alarcón A, Martínez-Marcos FJ, Reguera JM, et al. Influence of early surgical treatment on the prognosis of left-sided infective endocarditis: a multicenter cohort study. Mayo Clin Proc. 2014 Oct;89(10):1397-405. DOI 10.1016/j.mayocp.2014.06.021. [ Links ]
52. Kang DH, Kim YJ, Kim SH, Sun BJ, Kim DH, Yun SC, et al. Early surgery versus conventional treatment for infective endocarditis. N Engl J Med. 2012 Jun;366(26):2466-73. DOI 10.1056/NEJMoa1112843. [ Links ]
53. Patrat-Delon S, Rouxel A, Gacouin A, Revest M, Flécher E, Fouquet O, et al. EuroSCORE II underestimates mortality after cardiac surgery for infective endocarditis. Eur J Cardiothorac Surg. 2015 Jun. pii: ezv223. [ Links ]