Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.29 no.1 Medellín Jan./Mar. 2016
https://doi.org/10.17533/udea.iatreia.v29n1a02
INVESTIGACIÓN ORIGINAL
DOI 10.17533/udea.iatreia.v29n1a02
Supresión del eje hipotálamo-hipófisis-suprarrenal después de la quimioterapia de inducción en niños con leucemia linfoide aguda
Hypothalamus-pituitary-adrenal axis suppression following induction chemotherapy in children with acute lymphoblastic leukemia
Supressão do eixo hipotálamo-hipófises-suprarrenal depois da quimioterapia de indução em crianças com leucemia linfoide aguda
Iván Perdomo-Ramírez1; Adriana Linares-Ballesteros2; Lorena Acevedo-Sedano3; Mauricio Coll-Barrios4
1 Pediatra. Intensivista pediátrico. Unidad de Cuidado Intensivo, Fundación Hospital La Misericordia, Bogotá, Colombia.
2 Profesor Asociado de Pediatría. Especialista en Oncohematología pediátrica. Fundación Hospital La Misericordia, Bogotá, Colombia. Universidad Nacional de Colombia, sede Bogotá. talinaresb@unal.edu.co
3 Pediatra. Residente de Cuidado Crítico Pediátrico. Universidad Nacional de Colombia, sede Bogotá.
4 Endocrinólogo pediatra. Profesor Asociado de Pediatría y Endocrinología pediátrica. Universidad Nacional de Colombia, sede Bogotá.
Recibido: noviembre 17 de 2014
Aceptado: abril 15 de 2015
RESUMEN
Introducción: se ha informado insuficiencia suprarrenal (IS) en 46 % a 81,5 % de los niños con leucemia linfoide aguda (LLA) que reciben esteroides durante la quimioterapia.
Materiales y métodos: para evaluar la frecuencia de dicha IS se hizo un estudio prospectivo de 40 pacientes menores de 18 años (media: 8,5 años) con diagnóstico nuevo de LLA. Se les midieron el cortisol basal y la adrenocorticotropina (ACTH). Todos recibieron prednisolona (60 mg/m2/día) durante 5 semanas; tres días después de suspendidos los esteroides se hizo una prueba de estimulación con 1 µg de ACTH. En los que tenían el cortisol anormal (<18 µg /dL) se hicieron pruebas de estimulación con ACTH en los días 7, 14 y 30 hasta que se normalizó el cortisol (>18 µg /dL).
Resultados: en 29 de los 40 pacientes (72,5 %) se halló IS después del primer estímulo con ACTH, pero al día 30 en todos se había normalizado el nivel de cortisol. Todos los pacientes con IS fueron mayores de 5 años (HR: 4,69; IC95 %: 1,44-15,32; p = 0,011).
Conclusiones: los esteroides empleados durante el tratamiento de la LLA pueden causar IS, y el riesgo es más alto en los niños mayores de 5 años. Se sugiere hacer seguimiento durante los episodios de estrés porque es posible que requieran suplencia con esteroides.
PALABRAS CLAVE
ACTH, Insuficiencia Suprarrenal, Leucemia Linfoide Aguda, Niños
SUMMARY
Background: Adrenal insufficiency has been reported in 46 % to 81.5 % of children receiving corticosteroids for acute lymphoblastic leukemia (ALL).
Methodology: To assess the frequency of such insufficiency, 40 patients under 18 years (mean: 8.5 years) with new diagnosis of ALL were studied. Base-line cortisol and adrenocorticotropin (ACTH) levels were measured, and they received 5-week therapy with prednisolone. After 3 days off-steroid therapy, a stimulation test with ACTH 1 µg was done. In patients with abnormal cortisol (<18 µg /dL) new ACTH tests were done and cortisol levels were determined at days 7, 14 and 30 until cortisol post-stimulation levels were normal.
Results: Three days after the last steroid dose 29/40 (72.5 %) had adrenal insufficiency after ACTH stimulus. At day 30 no one had abnormal cortisol levels after ACTH stimulus. All patients with adrenal suppression were over 5 years (HR 4.69; CI95 %: 1.44-15.32; p = 0.011).
Conclusion: Steroids used during ALL treatment may cause adrenal insufficiency. Patients over 5 years are at high risk of developing adrenal suppression. We suggest to follow-up those patients with stress episodes after induction chemotherapy as steroid supplementation may be indicated.
KEY WORDS
ACTH, Acute Lymphoid Leukemia, Adrenal Insufficiency, Children
RESUMO
Introdução: informou-se insuficiência suprarrenal (IS) em 46 % a 81,5 % das crianças com leucemia linfoide aguda (LLA) que recebem esteroides durante a quimioterapia.
Materiais e métodos: para avaliar a frequência de dita IS se fez um estudo prospectivo de 40 pacientes menores de 18 anos (média: 8,5 anos) com diagnóstico novo de LLA. Se lhes mediram o cortisol basal e a adrenocorticotrófica (ACTH). Todos receberam prednisona (60 mg/m2/dia) durante 5 semanas; três dias depois de suspendidos os esteroides se fez uma prova de estimulação com 1 µg de ACTH. Nos que tinham o cortisol anormal (<18 µg /DL) fizeram-se provas de estimulação com ACTH nos dias 7, 14 e 30 até que se normalizou o cortisol (>18 µg /DL).
Resultados: em 29 dos 40 pacientes (72,5 %) achouse IS depois do primeiro estímulo com ACTH, mas ao dia 30 em todos se tinha normalizado o nível de cortisol. Todos os pacientes com IS foram maiores de 5 anos (HR: 4,69; IC95 %: 1,44-15,32; p = 0,011).
Conclusões: os esteroides empregados durante o tratamento da LLA podem causar IS, e o risco é mais alto nas crianças maiores de 5 anos. Sugere-se fazer seguimento durante os episódios de estresse porque é possível que requeiram suplência com esteroides.
PALAVRAS CHAVE
ACTH, Crianças, Insuficiência Suprarrenal, Leucemia Linfoide Aguda
Cómo citar: Perdomo-Ramírez I, Linares-Ballesteros A, Acevedo-Sedano L, Coll-Barrios M. Supresión del eje hipotálamo-hipófisis-suprarrenal después de la quimioterapia de inducción en niños con leucemia linfoide aguda. Iatreia. 2016 Ene-Mar;29(1):18-26. DOI 10.17533/udea.iatreia.v29n1a02.
INTRODUCCIÓN
La leucemia linfoide aguda (LLA) es la causa más frecuente de cáncer en niños; las estadísticas internacionales revelan una tasa anual de LLA en niños de 30 a 40 casos nuevos por millón, con mayor incidencia en los de dos a tres años de edad (más de 80 casos por millón); en Colombia la tasa se calcula en 41,7 casos por millón. Esta enfermedad constituye aproximadamente el 25 % de los casos nuevos de cáncer infantil diagnosticados por año en el mundo (1,2).
Los esteroides son un medicamento fundamental en la fase inicial del tratamiento de la LLA; durante la inducción, en el protocolo Berlín-Frankfurt-Munich (BFM), se hace la identificación de la respuesta temprana a ellos y si es buena (menos de 1.000 blastos absolutos en sangre periférica después de una semana de prednisona) constituye un factor de buen pronóstico en la respuesta al tratamiento. Se usan de forma continua en toda la fase de inducción que dura 28 días, a dosis entre 40 y 60 mg/m2/día de prednisolona o 10 mg/m2/día de dexametasona con descenso gradual (3-10).
El establecimiento del ritmo diurno del eje hipotálamo- hipófisis-suprarrenal (HHS) se inicia hacia el primer año de vida, pero hay estudios que muestran variabilidad en esta edad desde 2 semanas hasta 9 meses (11). La supresión del eje por administración exógena de esteroides se puede observar tan tempranamente como al quinto día de administración del medicamento. La insuficiencia suprarrenal (IS) puede llevar a colapso cardiovascular que amenaza la vida, por hipotensión refractaria (12).
Se han propuesto pruebas funcionales que dan información suficiente para el diagnóstico de IS y tienen menos complicaciones médicas. Actualmente se puede hacer una estimulación con dosis baja de ACTH (1 µg ), o test de dosis bajas, con la cual hay menos efectos adversos, sin reducir la sensibilidad y la especificidad. Algunos autores consideran que esta prueba es más sensible que la estimulación con la dosis usual de 250 µg (11-17).
Algunas publicaciones informan frecuencias de IS entre 46 % y 81,5 % en niños con LLA después de la administración de esteroides durante la quimioterapia de inducción (13-15).
En Latinoamérica existen muy pocos informes en la literatura de estudios con metodología y evaluación adecuadas en cuanto a la frecuencia, caracterización y factores de riesgo asociados a la IS durante el tratamiento de la LLA (18). Se calcula que en el curso de dicho tratamiento los niños hacen alrededor de seis episodios de neutropenia febril, infecciones graves y otras situaciones de estrés; muchos de estos eventos ocurren durante la fase de inducción y pueden contribuir a la mortalidad; los adolescentes tienen más complicaciones y mortalidad relacionadas con el tratamiento especialmente por infecciones (19). Es importante tener en cuenta e identificar si hay o no IS debido a la necesidad de hacer suplencia en casos de estrés (infecciones).
El presente estudio se diseñó para evaluar la frecuencia de la supresión adrenal y los posibles factores asociados a ella durante la quimioterapia de inducción en niños con LLA.
MATERIALES Y MÉTODOS
Se hizo un estudio observacional analítico de casos y controles anidado en una cohorte. Pacientes menores de 18 años con diagnóstico de LLA desde noviembre del 2010 hasta octubre del 2011. La unidad de estudio fueron los pacientes que cumplieron con los criterios de inclusión. Se consideraron como casos (29 pacientes) quienes cumplieron el criterio de diagnóstico de supresión del eje HHS, es decir, que en cualquiera de las mediciones de cortisol después de la estimulación presentaron un valor menor de 18 µg /dL. Se definieron como controles (11 pacientes) quienes no cumplieron con este criterio, es decir, que en todas las mediciones después de la estimulación presentaron valores de cortisol por encima de 18 µg /dL.
Por tratarse de una cohorte se pudo calcular la frecuencia con que ocurrió la supresión adrenal. Mediante el diseño de casos y controles anidado en ella se estudiaron los factores potencialmente asociados con la ocurrencia de supresión del eje HHS luego de la quimioterapia de inducción.
Definición de los sujetos
Criterios de inclusión: pacientes menores de 18 años con diagnóstico nuevo de LLA y actividad normal del eje HHS interpretada como nivel de cortisol basal de 6-30 µg /dL y ACTH de 4,4-22 pmol/L previa al inicio de la quimioterapia de inducción; consentimiento informado por parte de los padres o representantes legales para participar en el estudio.
Criterios de exclusión: pacientes con cortisol basal y ACTH alterados (disminuidos o elevados con respecto al valor de referencia normal), antes del inicio de la quimioterapia de inducción; pacientes con cuadro de endocrinopatías que pudieran alterar el eje HHS (hiperplasia adrenal congénita, enfermedad de Addison, panhipopituitarismo, craneofaringioma, acromegalia); pacientes con cromosomopatías asociadas con compromiso endocrinológico y que por tanto pueden alterar el eje HHS (síndrome de Down, síndrome de Turner); pacientes que se encontraran recibiendo corticoides por cualquier vía por lo menos durante los 2 meses previos al momento de confirmar el diagnóstico de LLA; pacientes que estuvieran recibiendo corticoides por cualquier vía, pero con una indicación diferente a la establecida por el protocolo del estudio.
Intervenciones
Se tomaron pruebas de cortisol antes de iniciar la fase de inducción (basales) y una vez suspendida la administración de corticoides en los días establecidos por el flujograma. Se utilizó la batería de Abbot Axsym System para la medición de cortisol por el método de ELISA de última generación (valor normal: 6 a 30 µg / dL). Las ampollas con dosis bajas de ACTH (1 µg /mL) se prepararon en una cámara de flujo laminar diluyendo una ampolla de 250 µg (Synacthen) en 240 mL de solución salina estéril. Esta dilución se conservó a -4 °C. La estimulación se hizo inyectando por vía intravenosa 1 mL (1 µg ) de esta dilución a temperatura ambiente, previa toma de la muestra para cortisol y ACTH basales. Luego, 30 y 60 minutos después de la estimulación, se tomó una nueva muestra de sangre para determinar el nivel de cortisol, según la técnica anteriormente descrita.
Procedimientos
A todos los pacientes se les midieron, antes del inicio de la quimioterapia, los niveles de cortisol basal y ACTH. A quienes los tuvieron en el rango normal se les ofreció entrar al estudio previa la firma del consentimiento informado. Se inició el tratamiento para LLA según el protocolo establecido en la institución, que incluye la administración de prednisolona 60 mg/ m2/día por 28 días con una fase posterior de descenso de 9 días, en la cual se disminuyó la dosis en 50 % cada 3 días hasta la suspensión. El día siguiente a esta fue el día 1 del estudio. Al tercer día después de la suspensión de los corticoides, se hizo una medición de cortisol basal y a los 30 y 60 minutos después de la estimulación con ACTH (1 µg ) IV; si el paciente tenía el cortisol después de la estimulación con ACTH por encima de 18 µg /dL se consideraba que no tenía supresión adrenal (control); si por el contrario su nivel de cortisol después de la estimulación con ACTH era menor de 18 µg /dL, se consideraba con supresión del eje HHS (caso).
Los pacientes con supresión del eje HHS (casos) en esta primera toma, se evaluaron con nuevas estimulaciones de ACTH (1 µg IV) en el día 7; aquellos que tenían el nivel de cortisol por debajo de 18 µg /dL, se volvían a evaluar en los días 14 y 30. Si el nivel de cortisol se encontraba por debajo de 18 µg /dL al día 30 después de haber suspendido los esteroides, se consideraba que el paciente tenía una supresión prolongada del eje HHS.
En el caso de episodios infecciosos, sin importar el día en que se presentaran, se determinaron los niveles de cortisol basal y después del estímulo con ACTH (1 µg ); se consideró que los pacientes con cortisol post-ACTH menor de 18 µg /dL tenían supresión del eje HHS y se les administró suplencia de corticoides. Estos pacientes se excluyeron del estudio. Los que no recibieron corticoides nuevamente se citaron a la siguiente estimulación, tal como ya se describió. Cuando se encontró insuficiencia del eje HHS, se hizo el correspondiente tratamiento médico.
Análisis estadístico
Según su distribución, las variables continuas se describieron utilizando las medidas de tendencia central media o mediana. Se estimó la frecuencia de supresión del eje HHS mediante el cálculo de proporción de incidencia, y se usó el análisis de supervivencia para la frecuencia de recuperación del fenómeno a los días 7, 14 y 30, así como para el riesgo instantáneo de supresión del eje. Como medida de dispersión se utilizó el intervalo de confianza del 95 %. Las variables discretas se expresaron por medio de proporciones.
En el análisis bivariado, las variables continuas se compararon mediante la prueba t de Student o la de U de Mann-Whitney, según la normalidad de las variables. Las variables categóricas se compararon mediante la prueba de chi-cuadrado. Se calculó la magnitud de la asociación entre insuficiencia suprarrenal aguda y cada una de las siguientes variables: edad, sexo, desnutrición y subtipo de leucemia mediante el cálculo del hazard ratio o razón de peligros (HR) de presentar la alteración, y el riesgo relativo (RR) para desarrollar el evento.
No se dispuso de datos para calcular el tamaño de muestra; en principio se planteó la inclusión de 40 a 50 pacientes en el período de 11 meses del estudio. Finalmente se estudiaron 40. El protocolo fue aprobado por el comité de ética institucional.
RESULTADOS
Se estudiaron 40 pacientes (21 hombres y 19 mujeres); 29 fueron casos (tenían supresión adrenal en la primera estimulación) y 11, controles (no tenían supresión adrenal); 34 (85 %) tenían estado nutricional normal, 5 (12,5 %) presentaban desnutrición leve aguda y uno tenía sobrepeso. Un paciente (2,5 %) tuvo compromiso del sistema nervioso central; 17 (42,5 %) presentaron hiperuricemia, 17 (42,5 %) tuvieron la deshidrogenasa láctica (DHL) por encima de 800 UI/L y uno falleció por tuberculosis miliar al finalizar la inducción. Como esteroide, todos recibieron prednisolona 60 mg/m2/día por 28 días.
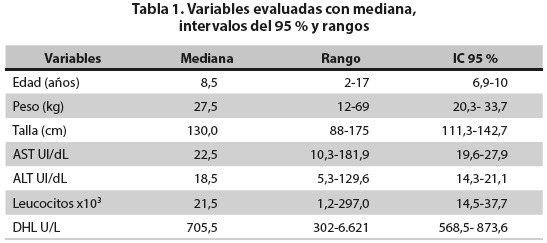
El recuento de leucocitos en el momento del diagnóstico fue variable: 23 pacientes (57,5 %) lo tenían por encima de 20.000/µL. En la tabla 1 se presentan los valores de la mediana con IC95 % y los rangos de las variables: edad, peso, talla, aminotransferasas, DHL y recuento de leucocitos.
Al terminar la inducción 29 de los 40 pacientes (72,5 %) presentaron supresión adrenal; uno de ellos, que tenía tuberculosis miliar, falleció antes de la evaluación del séptimo día después de la suspensión de los esteroides; de los 28 restantes, 17 (60,7 %) se recuperaron a los 7 días después de dicha suspensión, 8 (28,6 %) a los 14 días y 3 (10,7 %) a los 30 días de finalizar la fase de inducción. En otras palabras, ninguno de los pacientes tuvo bloqueo del eje por más de 30 días. En la tabla 2 se presentan los valores basales de cortisol y ACTH así como los de cortisol 30 y 60 minutos después de la estimulación en los días 3, 7 14 y 30.
Se diagnosticó IS en 29 pacientes, todos mayores de 5 años: de ellos, 17 (58,6 %) tenían cortisol y ACTH basales normales al tercer día después de suspender los esteroides, pero los niveles de cortisol a los 30 y 60 minutos después de la estimulación fueron anormales. Los restantes 12 pacientes (41,4 %) tenían anormales el cortisol y el ACTH basales y el cortisol 30 y 60 minutos después de la estimulación. En los mayores de 10 años la probabilidad de presentar bloqueo del eje HHS fue 2,3 veces mayor (HR) por cada año que se superara esa edad. En los mayores de 5 años el riesgo relativo (HR) de desarrollar IS después de la inducción con esteroides fue de 4,69 (p = 0,011).
Las siguientes variables no tuvieron relación estadísticamente significativa con la IS: sexo masculino (HR; 0,95; p = 0,86); desnutrición (p = 0,582); compromiso del SNC (p = 0,61); lisis tumoral (p = 0,64); hiperuricemia (p = 0,404); elevación de las aminotransferasas (p = 0,938 y 0,863, respectivamente), leucopenia (p = 0,159) y el subtipo de leucemia de precursores de células B con CD 79 A (p = 0,61). En la tabla 3 se presentan los datos de algunas variables.
DISCUSIÓN
La IS es común en niños que reciben esteroides como parte de los protocolos de quimioterapia de inducción para LLA; muchos casos son asintomáticos, pero en situaciones de estrés como las infecciones dicha insuficiencia puede llevarlos a complicaciones graves como choque refractario y muerte (13-15,20). La IS se asocia con mayor tasa de mortalidad en la población pediátrica (21). En una revisión de las causas de mortalidad en pacientes pediátricos oncológicos admitidos a la UCI, se encontró que el choque séptico y el requerimiento de soporte hormonal y vasopresor fueron factores asociados a mortalidad (información personal no publicada, Ortiz y colaboradores, servicio de Oncohematología, Hospital La Misericordia, Bogotá).
Se utilizan diversas pruebas para evaluar la integridad del eje HHS, especialmente en cuanto a las dosis de ACTH para la estimulación, pero no se han mostrado diferencias entre ellas en la detección de la IS después de dosis altas y prolongadas de esteroides en niños con LLA: a la dosis de 250 µg la frecuencia encontrada ha sido entre 67 % y 70 % (22,23); a la dosis de 1 µg la frecuencia ha variado en diferentes estudios entre 40 % y 81,5 % (13-15,20). Este estudio incluyó 40 pacientes con LLA estimulados con ACTH (1 µg ) y en 29 de ellos (72,5 %) se encontró IS; este hallazgo es similar al 67 % informado por Vestergaard y colaboradores (23). De los 29 pacientes con IS después de la estimulación con dosis bajas de ACTH, 17 (58,6 %) tenían normales las pruebas de cortisol y ACTH sin estímulo, lo que refuerza la necesidad de hacer la prueba de estímulo con dosis bajas para establecer el diagnóstico de dicha insuficiencia. Varios autores han utilizado para este propósito la prueba con dosis bajas y han hallado frecuencias entre 46 % y 67 % (15,18) de supresión adrenal a los 2 días de suspendidos los esteroides. En 2008, Einaudi y colaboradores (13) estudiaron 64 pacientes y en 62 % encontraron supresión del eje a las 24 horas de suspender los esteroides, con niveles basales de cortisol muy bajos (menos de 6 µg /dL), y en 81,5 % de ellos el cortisol después de la estimulación estaba por debajo de 18 µg /dL. La asociación de la IS con la edad mayor de 5 años solo ha sido informada por un autor (15). En nuestro estudio se encontró la edad como factor de riesgo para la supresión del eje HHS: todos los niños que tuvieron IS eran mayores de 5 años (HR: 4,69; p = 0,011).
Solo falleció un paciente durante el estudio, una adolescente de 15 años, quien tras finalizar la fase de inducción presentó tuberculosis miliar. En la evaluación al tercer día de haber finalizado la inducción se le halló supresión del eje HHS, con los niveles más bajos del estudio de cortisol y ACTH basales y de cortisol después de la estimulación.
La duración de la IS reportada en la literatura ha sido variable. En este trabajo 89,6 % de los pacientes que presentaron supresión adrenal tuvieron recuperación a las dos semanas de finalizar los esteroides y todos se habían recuperado al día 30. Otros autores han hallado tiempos prolongados de recuperación de la integridad del eje HHS: 4-20 semanas (13,15,22,23); en uno de los trabajos (15) la recuperación ocurrió más allá de las 20 semanas. En este estudio las condiciones en el momento del diagnóstico (estado nutricional, recuento de leucocitos, subtipo de LLA y elevación de la DHL) no se asociaron a mayor probabilidad de desarrollar IS. Vestergaard y colaboradores (23) encontraron asociación entre el subtipo de leucemia y la duración de la IS. En una revisión sistemática de la literatura de la colaboración Cochrane se menciona que los antifúngicos pueden contribuir a la mayor duración de la supresión adrenal; ninguno de nuestros pacientes recibió dichos fármacos durante el tiempo del estudio (24).
CONCLUSIONES
Se puede concluir que la evaluación del eje HHS se debe hacer con pruebas dinámicas como las de estimulación; utilizar el cortisol basal aislado puede dejar por fuera algunos pacientes con IS; los niveles de cortisol basal no son lo suficientemente sensibles para evidenciar el compromiso del eje HHS, ya que pueden ser normales en tal situación y solo después de un estímulo como el de ACTH a la dosis de 1 µg se logra evidenciar la reserva y el grado de funcionalidad de dicho eje. Este estudio comprobó que las pruebas de estimulación ofrecen mayores sensibilidad y especificidad para la evaluación de este eje endocrinológico tal y como lo describen otras publicaciones (15,18,23,25).
Muy pocos trabajos en Latinoamérica han caracterizado la IS en la población de pacientes pediátricos al finalizar la fase de inducción para el tratamiento de la LLA. En este estudio la edad mayor de 5 años fue el único factor de riesgo para presentar esta alteración endocrina grave, que pone al paciente con LLA en alto riesgo de una respuesta inadecuada a los eventos estresantes a los que se enfrenta durante el tratamiento antineoplásico. Otras variables como sexo, estado nutricional, subtipo de leucemia, presencia de lisis tumoral, alteración de las aminotransferasas y compromiso del SNC por el proceso neoplásico no constituyeron en este estudio factores de riesgo para presentar supresión del eje HHS.
RECOMENDACIONES
A la luz de los hallazgos de este estudio se considera pertinente evaluar el eje hipotálamo-hipófisis-suprarrenal como parte del seguimiento de todo paciente mayor de 5 años en tratamiento para LLA que reciba dosis altas y prolongadas de esteroides. Se recomienda hacer la evaluación utilizando una prueba de estimulación con dosis de ACTH de 1 µg y en caso de encontrar supresión iniciar la suplencia con hidrocortisona a la dosis de 12 mg/m2/día y duplicarla si el paciente está bajo algún estado de estrés biológico como infección, trauma, cirugía u otros. Hacer nueva evaluación en los días 14 y 30 cuando la mayoría regresan a la normalidad del funcionamiento del eje para definir la suspensión de la suplencia.
Esta caracterización de la IS busca evidenciar esta condición médica y llamar la atención sobre la necesidad de la suplencia esteroide como herramienta para enfrentar las complicaciones y los procesos de estrés biológico a los que frecuentemente se ven abocados los pacientes durante el tratamiento de la LLA.
CONFLICTO DE INTERESES
Ninguno que declarar.
FINANCIACIÓN
Este estudio fue financiado con recursos del Premio de Investigación Josefa Cualla de Barberi.
AGRADECIMIENTOS
A los pacientes y sus padres por participar en este estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Surveillance, Epidemiology, and End Results Program [Internet]. Rockville: Surveillance Research Program, NCI; 1999 (cited 2012 Dec 8). Ries LA, Kosary CL, Hankey BF, Miller BA, Clegg L, Edwards BK, editors. SEER Cancer Statistics Review, 1973-1996. Available from: http://seer.cancer.gov/archive/csr/1973_1996/ [ Links ] Arial, Helvetica, sans-serif">
2. Howard SC, Metzger ML, Wilimas JA, Quintana Y, Pui CH, Robinson LL, et al. Childhood cancer epidemiology in low income countries. Cancer. 2008 Feb;112(3): 461-72. [ Links ]
3. Steinherz PG, Gaynon PS, Breneman JC, Cherlow JM, Grossman NJ, Kersey JH, et al. Cytoreduction and prognosis in acute lymphoblastic leukemia- -the importance of early marrow response: report from the Childrens Cancer Group. J Clin Oncol. 1996 Feb;14(2):389-98. [ Links ]
4. Schrappe M, Reiter A, Ludwig WD, Harbott J, Zimmermann M, Hiddemann W, et al. Improved outcome in childhood acute lymphoblastic leukemia despite reduced use of anthracyclines and cranial radiotherapy: results of trial ALL-BFM 90. German-Austrian-Swiss ALLBFM Study Group. Blood. 2000 Jun;95(11):3310-22. [ Links ]
5. Pui CH, Relling MV, Downing JR. Acute lymphoblastic leukemia. N Engl J Med. 2004 Apr;350(15):1535-48. [ Links ]
6. Manabe A, Ohara A, Hasegawa D, Koh K, Saito T, Kiyokawa N, et al. Significance of the complete clearance of peripheral blasts after 7 days of prednisolone treatment in children with acute lymphoblastic leukemia: the Tokyo Children's Cancer Study Group Study L 99-15. Haematologica. 2008 Aug;93(8):1155- 60. DOI 10.3324/haematol.12365. [ Links ]
7. Aricò M, Basso G, Mandelli F, Rizzari C, Colella R, Barisone E, et al. Good steroid response in vivo predicts a favorable outcome in children with T-cell acute lymphoblastic leukemia. The Associazione Italiana Ematologia Oncologia Pediatrica (AIEOP). Cancer. 1995 Apr;75(7):1684-93. [ Links ]
8. Möricke A, Zimmermann M, Reiter A, Henze G, Schrauder A, Gadner H, et al. Long-term results of five consecutive trials in childhood acute lymphoblastic leukemia performed by the ALL-BFM study group from 1981 to 2000. Leukemia. 2010 Feb;24(2):265-84. DOI 10.1038/leu.2009.257. [ Links ]
9. Kato GJ, Quddus FF, Shuster JJ, Boyett J, Pullen JD, Borowitz MJ, et al. High glucocorticoid receptor content of leukemic blasts is a favorable prognostic factor in childhood acute lymphoblastic leukemia. Blood. 1993 Oct;82(8):2304-9. [ Links ]
10. Pui CH, Dahl GV, Rivera G, Murphy SB, Costlow ME. The relationship of blast cell glucocorticoid receptor levels to response to single-agent steroid trial and remission response in children with acute lymphoblastic leukemia. Leuk Res. 1984;8(4):579-85. [ Links ]
11. de Weerth C, Zijl RH, Buitelaar JK. Development of cortisol circadian rhythm in infancy. Early Hum Dev. 2003 Aug;73(1-2):39-52. [ Links ]
12. Shulman DI, Palmert MR, Kemp SF; Lawson Wilkins Drug and Therapeutics Committee. Adrenal insufficiency: still a cause of morbidity and death in childhood. Pediatrics. 2007 Feb;119(2):e484-94. [ Links ]
13. Einaudi S, Bertorello N, Masera N, Farinasso L, Barisone E, Rizzari C, et al. Adrenal axis function after high-dose steroid therapy for childhood acute lymphoblastic leukemia. Pediatr Blood Cancer. 2008 Mar;50(3):537-41. [ Links ]
14. Rix M, Birkebaek NH, Rosthøj S, Clausen N. Clinical impact of corticosteroid-induced adrenal suppression during treatment for acute lymphoblastic leukemia in children: a prospective observational study using the low-dose adrenocorticotropin test. J Pediatr. 2005 Nov;147(5):645-50. [ Links ]
15. Mahachoklertwattana P, Vilaiyuk S, Hongeng S, Okascharoen C. Suppression of adrenal function in children with acute lymphoblastic leukemia following induction therapy with corticosteroid and other cytotoxic agents. J Pediatr. 2004 Jun;144(6):736-40. [ Links ]
16. Dorin RI, Qualls CR, Crapo LM. Diagnosis of adrenal insufficiency. Ann Intern Med. 2003 Aug;139(3):194- 204. Erratum in: Ann Intern Med. 2004 Feb;140(4):315. [ Links ]
17. Schmidt IL, Lahner H, Mann K, Petersenn S. Diagnosis of adrenal insufficiency: Evaluation of the corticotropin- releasing hormone test and Basal serum cortisol in comparison to the insulin tolerance test in patients with hypothalamic-pituitary-adrenal disease. J Clin Endocrinol Metab. 2003 Sep;88(9):4193-8. [ Links ]
18. Silva IN, Cunha CF, Finch FL, Colosimo EA. [Evaluation of hypothalamic-pituitary-adrenal axis recovery after corticotherapy by using basal cortisol secretion]. Arq Bras Endocrinol Metabol. 2006 Feb;50(1):118-24. [ Links ] Portuguese.
19. Pichler H, Reismüller B, Steiner M, Dworzak MN, Pötschger U, Urban C, et al. The inferior prognosis of adolescents with acute lymphoblastic leukaemia (ALL) is caused by a higher rate of treatment-related mortality and not an increased relapse rate – a population- based analysis of 25 years of the Austrian ALL-BFM (Berlin-Frankfurt-Mu€nster) Study Group. Brit J Haemato. 2013 May;161(4):556-65. DOI 10.1111/bjh.12292. [ Links ]
20. Bélien-Pallet V, Cabrol S, Fasola S, Petit A, Landman- Parker J, Auvrignon A, et al. [Is there a risk of steroid-induced adrenal deficit after induction treatment of acute lymphoblastic leukemia?]. Arch Pediatr. 2010 Dec;17(12):1637-44. DOI 10.1016/j.arcped.2010.09.001. French. [ Links ]
21. Liu D, Ahmet A, Ward L, Krishnamoorthy P, Mandelcorn ED, Leigh R, et al. A practical guide to the monitoring and management of the complications of systemic corticosteroid therapy. Allergy Asthma Clin Immunol. 2013 Aug;9(1):30. DOI 10.1186/1710-1492-9-30. [ Links ]
22. Petersen KB, Müller J, Rasmussen M, Schmiegelow K. Impaired adrenal function after glucocorticoid therapy in children with acute lymphoblastic leukemia. Med Pediatr Oncol. 2003 Aug;41(2):110-4. [ Links ]
23. Vestergaard TR, Juul A, Lausten-Thomsen U, Lausen B, Hjalgrim H, Kvist TK, et al. Duration of adrenal insufficiency during treatment for childhood acute lymphoblastic leukemia. J Pediatr Hematol Oncol. 2011 Aug;33(6):442-9. DOI 10.1097/MPH.0b013e3182260cbe. [ Links ]
24. Gordijn MS, Gemke RJ, van Dalen EC, Rotteveel J, Kaspers GJ. Hypothalamic-pituitary-adrenal (HPA) axis suppression after treatment with glucocorticoid therapy for childhood acute lymphoblastic leukaemia. Cochrane Database Syst Rev. 2012 May 16;5:CD008727. DOI 10.1002/14651858.CD008727.pub2. [ Links ]
25. Kuperman H, Damiani D, Chrousos GP, Dichtchekenian V, Manna TD, Filho VO, et al. Evaluation of the hypothalamic-pituitary-adrenal axis in children with leukemia before and after 6 weeks of high-dose glucocorticoid therapy. J Clin Endocrinol Metab. 2001 Jul;86(7):2993-6. [ Links ]