Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.29 no.2 Medellín Apr./June 2016
https://doi.org/10.17533/udea.iatreia.v29n2a04
DOI 10.17533/udea.iatreia.v29n2a04
INVESTIGACIÓN ORIGINAL
Evaluación del método químico-enzimático de descelularización para la obtención de matrices extracelulares de tráquea en el modelo porcino
Evaluation of the chemical-enzymatic decellularization method for obtaining extracellular trachea matrixes in a porcine model
Avaliação do método químico-enzimático de descelularização para a obtenção de matrizes extracelulares de traqueia no modelo suíno
Mariana Morales-Valencia1; María Isabel Patiño-Vargas2; Luis Alfonso Correa-Londoño3; Luz Marina Restrepo-Múnera4
1 Grupo Ingeniería de Tejidos y Terapias Celulares; estudiante de maestría Corporación Ciencias Básicas Biomédicas, Universidad de Antioquia, Medellín, Colombia.
2 Grupo Ingeniería de Tejidos y Terapias Celulares; estudiante de Microbiología y Bioanálisis, Universidad de Antioquia, Medellín, Colombia.
3 Grupo Ingeniería de Tejidos y Terapias Celulares; coordinador del departamento de patología, Laboratorio Clínico VID, obra de la Congregación Mariana, Medellín, Colombia.
4 Grupo Ingeniería de Tejidos y Terapias Celulares; Instituto de Investigaciones Médicas, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. grupoingenieriadetejidos@udea.edu.co
Recibido: marzo 26 de 2015
Aceptado: agosto 5 de 2015
RESUMEN
Introducción: diferentes enfermedades afectan la tráquea y deterioran la calidad de vida. La ingeniería tisular es una alternativa terapéutica para los pacientes con esas enfermedades: matrices de tráquea descelularizadas y sembradas con células del receptor no generan respuesta inmune y pueden prevenir incluso el rechazo de zootrasplantes.
Objetivo: evaluar un método de descelularización para obtener matrices extracelulares de tráquea en el modelo porcino.
Materiales y métodos: a partir de 5 tráqueas porcinas se formaron dos grupos de estudio, controles y tratados con un método químico-enzimático. Se hizo análisis histológico con hematoxilina-eosina, coloración tricrómica de Masson y safranina O. Se evaluaron las propiedades biomecánicas de ambos grupos, mediante la determinación del módulo de Young, la fuerza máxima y el porcentaje de deformación.
Resultados: en las muestras tratadas se observó una disminución del 66 % del contenido celular en comparación con los controles. Se preservó el colágeno y se detectó reducción de los glucosaminoglucanos. Las pruebas biomecánicas revelaron una diferencia estadísticamente significativa del porcentaje de deformación, sin alteración de los demás parámetros.
Conclusiones: el método evaluado demostró ser eficiente para descelularizar tráqueas de cerdo, con una disminución importante en el costo y el tiempo de tratamiento, por lo que podría ser una buena opción en las condiciones socioeconómicas de Colombia.
PALABRAS CLAVE
Ingeniería de Tejidos, Matriz Descelularizada, Matriz Recelularizada, Tráquea, Regeneración, Vía Aérea
SUMMARY
Introduction: Different diseases may affect the trachea and, therefore, the quality of life. Tissue engineering may be a therapeutic alternative for patients with such diseases, using decellularized trachea matrixes seeded with cells from the recipient, which do not generate immune response and may even prevent rejection of zoo-transplants.
Objective: To evaluate a decellularization method to obtain tracheal extracellular matrixes in the porcine model.
Materials and methods: Two study groups, treated and control, were obtained from 5 porcine tracheas. A chemical-enzymatic method for decellularization was used. Histological analyses were performed with hematoxylin-eosin, Masson's trichromic stain and safranin O. Biomechanical properties of both groups were evaluated by determining the Young modulus, maximum strength and deformation rate.
Results: Compared to the controls, there was a 66 % decrease in the cell content in the treated specimens. Collagen was preserved and a reduction of glycosaminoglycans was detected. Biomechanical tests revealed a significant difference in the percentage of deformation, with no alteration of the remaining parameters.
Conclusions: The evaluated decellularization method proved to be efficient to reduce the cellular content of porcine tracheas, with a considerable decrease in cost and production time. These advantages could make it a good option for the socio-economic Colombian conditions.
KEY WORDS
Decellularized Matrix, Recellularized Matrix, Regeneration, Airway, Trachea, Tissue Engineering
RESUMO
Introdução: diferentes doenças afetam a traqueia e deterioram a qualidade de vida. A engenheira tissular é uma alternativa terapêutica para os pacientes com essas doenças: matrizes de traqueia descelularizadas e semeadas com células do receptor não geram resposta imune e podem prevenir incluso a rejeição de zoo-transplantes.
Objetivo: avaliar um método de descelularização para obter matrizes extracelulares de traqueia no modelo suíno.
Materiais e métodos: a partir de 5 traqueias suínas se formaram dois grupos de estudo, controles e tratados com um método químico-enzimático. Se fez análise histológico com hematoxilina-eosina, corante tricrómica de Masson e safranina O. Se avaliaram as propriedades biomecânicas de ambos grupos, mediante a determinação do módulo de Young, a força máxima e a porcentagem de deformação.
Resultados: Nas amostras tratadas se observou uma diminuição de 66 % do conteúdo celular em comparação com os controles. Se preservou o colágeno e se detectou redução dos glucosaminoglucanos. As provas biomecânicas revelaram uma diferença estatisticamente significativa da porcentagem de deformação, sem alteração dos demais parâmetros.
Conclusões: O método avaliado demostrou ser eficiente para descelularizar traqueias de porco, com uma diminuição importante no custo e o tempo de tratamento, pelo que poderia ser uma boa opção nas condições socioeconómicas da Colômbia.
PALAVRAS CHAVE
Engenharia de Tecidos, Matriz Descelularizada, Matriz Recelularizada, Traqueia, Regeneração, Via Aérea
Cómo citar: Morales-Valencia M, Patiño-Vargas MI, Correa-Londoño LA, Restrepo-Múnera LM. Evaluación del método químico-enzimático de descelularización para la obtención de matrices extracelulares de tráquea en el modelo porcino. Iatreia. 2016 Abr-Jun;29(2):144-156. DOI 10.17533/udea.iatreia.v29n2a04.
INTRODUCCIÓN
La tráquea, órgano primordial del sistema respiratorio superior, es un tubo cilíndrico flexible compuesto por tejido conjuntivo fibroelástico y cartilaginoso, que permanece dilatado durante la inspiración y se relaja pasivamente en la espiración (1). Su función es proporcionar un espacio abierto para la circulación del aire que entra y sale de los pulmones. A su vez, la circulación de aire endoluminal permite la hematosis y la fonación.
Muchas situaciones patológicas y traumas pueden alterar la anatomía de la tráquea, lo que tiene consecuencias serias en la calidad de vida de los pacientes (2). En Colombia las causas más comunes que afectan la anatomía y funcionalidad de la vía aérea son las siguientes: estenosis traqueal, granulomas, tumores traqueales benignos, cáncer y tuberculosis, esta última con cerca de 9 millones de casos nuevos reportados en el 2010 (3). Por otro lado, de acuerdo con el primer informe del Observatorio Nacional de Salud (ONS), los cánceres de la tráquea, los bronquios o los pulmones fueron los eventos con mayor letalidad en el país en el 2011(4). Además, los traumas ocasionados por accidentes con objetos cortopunzantes, proyectiles de arma de fuego, golpes con objetos contundentes y estrangulación son otras causas que pueden producir un daño igual o mayor en este órgano.
Entre las escasas opciones para tratar a estos pacientes está la resección traqueal; sin embargo, dicho tratamiento solo se puede utilizar cuando el segmento de tráquea que se va a remover no excede el 30 % de la longitud total del órgano, lo cual constituye una importante limitación puesto que existen traumas o enfermedades que afectan un porcentaje mayor de tejido (5). Por tanto, se han desarrollado diferentes alternativas terapéuticas para atender estas necesidades. Una de ellas es el trasplante de tráquea, pero esto requiere un programa de trasplantes establecido, pruebas para la selección del donante y esquema inmunosupresor; además, tiene la posibilidad de rechazo. Otra opción es la que ofrecen la medicina regenerativa y la ingeniería de tejidos, mediante el uso de matrices descelularizadas que han surgido como andamios biológicos derivados de diferentes órganos nativos. En años recientes, órganos provenientes de donación, tales como corazón, hígado, pulmones y riñones, se han utilizado para proporcionar matrices acelulares y demostrar el potencial de recelularización con diferentes poblaciones celulares, particularmente con células madre (6). Las matrices descelularizadas de tráquea sembradas posteriormente con células del receptor son una estrategia sencilla y novedosa para dar origen a órganos artificiales que no generan respuesta inmune ni liberan productos biodegradables tóxicos; además, pueden provenir incluso de animales, lo que incrementa las posibilidades de tratamiento y la esperanza de vida de los pacientes que requieren este tipo de tejido (7).
Para aumentar las opciones de éxito de estos órganos artificiales, se debe contar con un protocolo de descelularización que garantice la remoción de todo el material celular y nuclear. La eficacia de este procedimiento se puede cuantificar mediante el análisis del ADN que permanece en la matriz extracelular, puesto que se han establecido límites permisibles en el tamaño de los fragmentos que no generan respuesta inmune, los cuales pueden oscilar entre 100 y 200 pb (8). De esta forma, es posible obtener sustitutos no inmunogénicos y minimizar los efectos adversos sobre la composición e integridad mecánica de la matriz, conservando su estructura y proteínas funcionales en buenas condiciones para utilizarlas como soporte de crecimiento de nuevas células (9,10)
Existen diversos métodos de descelularización que se pueden combinar para lograr una mayor remoción del contenido celular, los cuales, a su vez, buscan disminuir el daño a la matriz y conservar sus propiedades mecánicas y biológicas. Entre los más comunes se encuentran los siguientes (11,12):
a. Métodos físicos: incluyen congelación, presión, ultrasonido (sonicación) y agitación. Se usan principalmente para lisar las células.
b. Tratamientos ácidos y alcalinos: ácidos como el peracético, desoxicólico y acético. Bases como el hidróxido de amonio, sulfuro de sodio, hidróxido de sodio e hidróxido de calcio se usan para solubilizar el contenido citoplasmático y remover los ácidos nucleicos.
c. Detergentes no iónicos: en este grupo se destaca el Tritón X-100, usado extensamente porque no produce efectos graves en la estructura del tejido. Estos detergentes rompen las interacciones lípidolípido y lípido-proteína.
d. Detergentes iónicos: solubilizan tanto las membranas citoplasmáticas como las nucleares, pero tienden a desnaturalizar las proteínas al romper las interacciones proteína-proteína.
e. Solventes orgánicos: el más utilizado es el tri(nbutil) fosfato, con el que se ha logrado remover el contenido nuclear en algunos tipos de tejidos, pero puede causar disminución en la cantidad de colágeno de la matriz.
f. Tratamientos hipotónicos e hipertónicos: soluciones hipotónicas como el tris buffer 10 mM o el ácido etilendiamino-tetraacético (EDTA) 5 mM, e hipertónicas como la solución salina 3 M, la sacarosa 1 M, el cloruro de potasio 0,6 M o el yoduro de potasio 1 M, producen lisis celular por medio de choques osmóticos, pero no remueven los remanentes.
g. Métodos enzimáticos: incluyen la digestión con proteasas y nucleasas. La exposición prolongada a estos agentes puede causar daños en los componentes de la matriz extracelular.
La evaluación de un soporte animal para la construcción de una tráquea artificial puede contribuir en gran medida al tratamiento de diferentes situaciones clínicas, reduciendo los efectos colaterales de los esquemas de inmunosupresión y la posibilidad de rechazo implicados en el trasplante convencional de órganos. El uso de un modelo porcino para la aplicación de un método químico-enzimático de descelularización que permita la obtención de matrices extracelulares de tráquea aumenta la disponibilidad de órganos para la regeneración de la vía aérea, y disminuye los costos de hospitalización y medicamentos de los pacientes a la espera de un reemplazo traqueal.
MATERIALES Y MÉTODOS
Obtención de las muestras
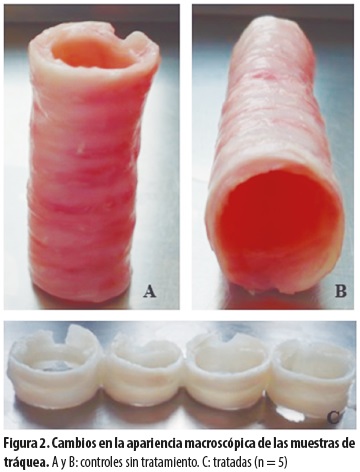
El estudio se efectuó previo aval del Comité de Bioética para Animales de Experimentación. Incluyó las tráqueas de 5 cerdos comerciales de raza Yorkshire, provenientes de la misma distribuidora de carnes, con un peso entre 20 y 30 kg. Las tráqueas se tomaron en horas de la mañana (8-10 a. m.) el día en que iban a ser procesadas, para evitar posibles sesgos asociados a su almacenamiento. Se las dividió en 8 segmentos, cada uno compuesto por dos anillos de cartílago, más el tejido fibroelástico que los une. A estos segmentos se los denominó probetas (figura 1). De cada tráquea se seleccionaron aleatoriamente 4 probetas para someterlas al proceso de descelularización. Las 4 restantes se utilizaron como controles.
Método químico-enzimático de descelularización
1. Limpieza de la muestra
Antes de escindir las probetas que serían utilizadas en el estudio, se hizo la limpieza de las tráqueas con tijeras y pinzas de disección, retirando todo el tejido conectivo, la grasa y el tejido vascular circundantes, para obtener únicamente el tejido traqueal. De las probetas elegidas como controles se tomaron 3 por cada tráquea para almacenarlas en PBS (phosphate buffered saline) (Gibco) y utilizarlas en las pruebas biomecánicas como controles no tratados. Las sobrantes se fijaron en formaldehído al 10 % para los análisis histológicos.
2. Choque osmótico
Las probetas seleccionadas para someterlas al proceso de descelularización se pusieron en un frasco de vidrio estéril con 200 mL de agua y luego se almacenaron a 4 °C durante 72 horas, con agitación magnética.
3. Tratamiento químico
Una vez finalizado el primer choque osmótico, el agua de lavado se reemplazó por una solución de desoxicolato de sodio (Sigma) a una concentración de 4 % w/v y se almacenó a 4 °C durante 4 horas, con agitación magnética. Transcurrido este tiempo se hizo un lavado durante 30 minutos con agua destilada, con agitación magnética a 4 °C.
A continuación se descartó el agua de lavado y se adicionó Tritón X-100 (Sigma) al 1 % v/v, se dejó actuar por 48 horas, con agitación magnética a 4 °C, cambiando el detergente cada 24 horas. Posteriormente se reemplazó el Tritón X-100 por SDS (sodium dodecyl sulphate) (Sigma), a la concentración de 0,5 % w/v y con pH 9, y se dejó con agitación magnética a 4 °C, por 72 horas, con cambio del detergente cada 24 horas. Para terminar, se hizo nuevamente un choque osmótico por 48 horas más. Los procedimientos 2 y 3 se repitieron cinco veces en las condiciones descritas.
4. Digestión enzimática
Al finalizar el último choque osmótico se llevó a cabo una digestión enzimática de las muestras utilizando una solución de desoxirribonucleasa- I (ADN-asa) (Sigma) con una actividad específica de 2000 Kunitz, en cloruro de sodio (Corpaúl) 0,15 M durante 4 horas, a temperatura ambiente. Para finalizar, se lavó con agua destilada durante 10 minutos.
5. Almacenamiento de las muestras
Luego del tratamiento, se seleccionó una probeta de cada tráquea y se fijó en formaldehído al 10 % hasta el análisis histológico. Las demás se almacenaron en un frasco estéril con PBS a 4 °C. Estas últimas se emplearon en las pruebas biomecánicas.
Análisis histológico
1. Hematoxilina/eosina
Para evaluar la presencia de células en las muestras controles y tratadas, se utilizaron cortes histológicos de 1 µm embebidos en parafina y teñidos con hematoxilina/ eosina. Los cortes se observaron con un microscopio óptico (Leica DFC425C). La densidad celular se determinó contando los núcleos y remanentes celulares, en 10 campos aleatorios visualizados en 40X. Por cada grupo de estudio se contaron seis secciones o placas.
La densidad celular se expresó como:
2. Coloración tricrómica de Masson
Para evaluar la presencia de fibras de colágeno se tomaron secciones de las tráqueas de 1 µm embebidas en parafina y se tiñeron con la coloración tricrómica de Masson.
3. Safranina O
Se emplearon secciones de tráquea con las mismas características ya descritas teñidas con safranina O, para evaluar el contenido de glucosaminoglucanos (GAG), como marcadores de la calidad de la matriz cartilaginosa del tejido.
Pruebas biomecánicas
Con el fin de verificar las posibles alteraciones ocurridas en la matriz con respecto a las propiedades biomecánicas de las tráqueas, luego de aplicar el método químico- enzimático de descelularización, se hicieron las siguientes mediciones: módulo de Young (Mpa), fuerza máxima (N) y porcentaje de deformación (%), para lo cual se tomaron 15 probetas por cada grupo de estudio.
A las probetas tratadas se les determinó el tamaño inicial y se les aplicó un ensayo de tracción en dirección circunferencial, con una tasa fija de deformación de 5 mm/min. El mismo ensayo se hizo con las probetas controles sin descelularizar. Las mediciones se efectuaron en una máquina de ensayos para tracción y compresión TC500 (Digimess®), con capacidad de 500 kilogramos-fuerza (kgF) y un rango de menor división de 0,5 kgF.
Análisis estadístico
Para el análisis de las variables cuantitativas se determinó la media ± la desviación estándar (DE). El análisis bivariado se hizo mediante el test de Shapiro-Wilk. De acuerdo con la distribución de los datos se utilizó la prueba paramétrica T de Student o la no paramétrica U de Mann-Whitney. Las diferencias se consideraron estadísticamente significativas si el valor p era menor de 0,05. Los datos se analizaron en el programa IBM SPSS Statistics 21.
RESULTADOS
Método químico-enzimático de descelularización e histología
La inspección macroscópica de las tráqueas reveló que al avanzar los ciclos de tratamiento las muestras tratadas se volvían más claras en comparación con los controles (figura 2).
En los cortes histológicos de los segmentos controles teñidos con H&E, se observa la estructura típica del tejido traqueal: las capas submucosa, cartilaginosa y adventicia con alta celularidad. El cartílago aparece como una amplia extensión de matriz avascular en la que se observan una elevada población de condrocitos, y alrededor, el pericondrio (figuras 3A y 3B). En las tráqueas tratadas, antes de la digestión enzimática, se evidencia la completa remoción del contenido celular en las regiones submucosa y adventicia, conservando la arquitectura tridimensional. En el cartílago aún es evidente el material celular residual, principalmente en la región central, mientras que la periferia se observa completamente acelular (figuras 3C, 3D y 3E). Una vez hecho el tratamiento con ADNasa se observa una mayor cantidad de lagunas vacías, pero siguen siendo visibles los remanentes celulares (figura 3F).
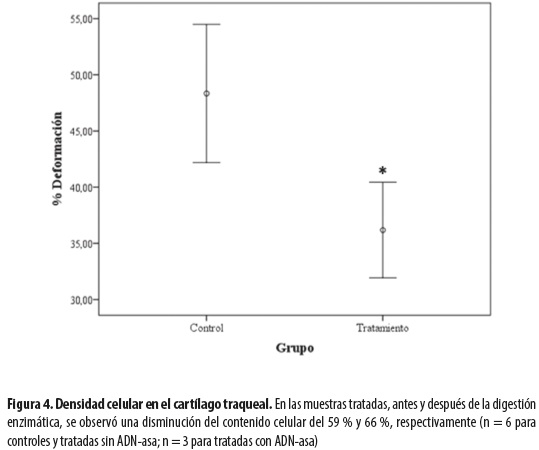
El análisis cuantitativo muestra una disminución del 66 % en el número total de células al finalizar el tratamiento. Es importante aclarar que no se hallaron células íntegras en la capa cartilaginosa, por lo cual se tuvieron en cuenta únicamente los detritos celulares (figura 4).
En las muestras controles, la coloración tricrómica de Masson reveló una densificación fibrosa de colágeno en la superficie del anillo traqueal.
Se observó además una matriz hialina en la que no fue posible diferenciar las fibrillas colágenas tipo II, puesto que las enmascara la sustancia fundamental en la que están incluidas (figura 5A). En las muestras tratadas se demostraron la preservación del colágeno y la arquitectura general de la matriz extracelular (figura 5B).
Se evaluaron los GAG porque contribuyen a la función de los proteoglucanos en la formación de una matriz altamente hidratada, y se necesita un equilibrio entre estos y las fibras de colágeno para mantener la homeostasis de la matriz (13). Por tanto, se utilizó el colorante safranina O como marcador de integridad de la matriz, puesto que se une por cargas a los grupos carboxilo y sulfato (ambos con carga negativa) de los GAG. La intensidad de la tinción es directamente proporcional al contenido de GAG, por lo que el análisis histológico de los controles no reveló alteraciones al ser fuertemente positiva en el cartílago traqueal (figura 6A). En las muestras tratadas, por el contrario, se observó una disminución de la apetencia por la tinción, lo que indica una reducción del contenido de GAG en esta región (figura 6B). Estos resultados coinciden con los hallazgos en los cortes histológicos teñidos con H&E, en los que se demostró pérdida de la basofilia natural exhibida por los GAG sulfatados con la hematoxilina.
Pruebas biomecánicas
Con estas pruebas se buscó caracterizar las propiedades mecánicas de los tejidos traqueales controles y tratados, comparar los resultados y definir si el método químico-enzimático de descelularización tuvo efectos adversos sobre los componentes de la matriz extracelular alterando de manera significativa estas propiedades. Se les hicieron las pruebas biomecánicas a 15 probetas de cada grupo de estudio, en dirección circunferencial, a una tasa de deformación constante de 5 mm/min. Las probetas que se utilizaron consistían en dos anillos de tráquea más el tejido fibroelástico que los une.
No se observaron diferencias estadísticamente significativas en el módulo de Young ni en la fuerza máxima aplicada al tejido. Por el contrario, el valor medio del porcentaje de deformación disminuyó de forma significativa en las muestras tratadas (figura 7). Esto sugiere que el proceso de descelularización no afectó la elasticidad del tejido, ni la fuerza máxima que puede soportar antes de llegar a una deformación plástica. Sin embargo, disminuyó su capacidad para deformarse antes de llegar al punto de ruptura.
DISCUSIÓN
La ingeniería de tejidos se basa en la combinación de tres factores: las células vivas, una matriz que soporte el crecimiento y desarrollo de las células y un sistema de señalización celular que estimule a la célula y su ambiente para mantener, reparar, reemplazar o mejorar la función de un tejido u órgano (2). De estos tres elementos, la matriz juega un papel fundamental, ya que no solo provee el sostén mecánico y estructural al tejido, sino que también influye sobre la migración, la morfogénesis y el comportamiento celular. Las interacciones dinámicas matriz extracelular-integrinas son conocidas por facilitar la adhesión celular al sustrato, favorecer la resistencia a la tensión mecánica y facilitar el flujo bidireccional de las señales celulares (14). Asimismo, varias familias de moléculas, que incluyen los GAG, colágenos y glicoproteínas no colágenas, presentan propiedades físicas que promueven la invasión y migración celulares (15,16). En años recientes se ha demostrado que las matrices descelularizadas provenientes de fuentes naturales proporcionan una estructura y composición casi idénticas a su estado nativo, favoreciendo la unión celular, la migración y la interacción con el tejido del hospedero (17). En el año 2008, se publicó el reporte de caso del grupo de Macchiarini (18) relacionado con un trasplante de tráquea utilizando el sistema mencionado; los resultados exitosos descritos por este grupo han abierto enormes posibilidades para los pacientes con alteraciones en la vía aérea. Además, en el año 2012, se describió el caso de un niño al que se le practicó un reemplazo traqueal utilizando una matriz descelularizada, sembrada posteriormente con células madre autólogas (19). Tras dos años de seguimiento se reportó la supervivencia y completa recuperación del paciente.
Los esfuerzos por desarrollar matrices extracelulares derivadas de material protésico no han sido satisfactorios hasta el momento, puesto que no proporcionan las señales específicas para que se lleven a cabo las interacciones célula-matriz (17). Esto se debe en gran parte a la diversidad de componentes de la matriz extracelular, que pueden ser similares en una amplia gama de tejidos, pero cada uno contiene su propia combinación de macromoléculas que proporcionan las señales celulares necesarias (20,21).
El análisis cuantitativo de los condrocitos presentes en el cartílago de las muestras tratadas, antes de la digestión enzimática, mostró una disminución del 59 % con respecto a los controles; el porcentaje restante de células en las muestras tratadas corresponde seguramente a detritos celulares que no fueron removidos durante el proceso de descelularización. El material intracelular, principalmente los ácidos nucleicos liberados de las células lisadas, puede desencadenar reacciones inflamatorias después de la implantación del tejido a su receptor (22); por tanto, se hace necesario un tratamiento con una ADN-asa capaz de eliminar estos componentes. Al evaluar el contenido celular en las muestras tratadas con ADN-asa se observó una disminución del 66 % en comparación con los controles, por lo que dicho proceso contribuyó en gran medida a la eliminación de los remanentes nucleares presentes en la matriz hialina después de aplicar el tratamiento químico (figuras 3 y 4). Estudios previos que han evaluado diferentes procesos de descelularización han demostrado que no es posible eliminar por completo todos los componentes celulares de un tejido debido a su unión estrecha con la matriz circundante, especialmente en aquellos relativamente densos como el cartílago traqueal (22). Sin embargo, se han propuesto rangos de aceptación para los desechos celulares tales como restos de ADN, que pueden promover una respuesta proinflamatoria (12). En la mayoría de las matrices extracelulares de origen biológico disponibles comercialmente se reporta la presencia de pequeños fragmentos de ADN (8) con una eficacia clínica muy positiva. Aunque el análisis cuantitativo del contenido celular en este trabajo coincide con los hallazgos morfológicos, se deberán hacer otras pruebas, como extracción y cuantificación de ADN para determinar más acertadamente la cantidad de células presentes en el cartílago traqueal después del tratamiento.
Es esencial la eliminación adecuada del material potencialmente inmunogénico; sin embargo, es importante asegurar que se mantenga un equilibrio cuidadoso entre los componentes de la matriz extracelular, que contiene una variedad de fibras, como las colágenas y elásticas, que forman una red estructural compleja que rodea y sostiene las células del tejido conectivo (23). En este estudio se evaluó la presencia de colágeno mediante la coloración tricrómica de Masson (figura 5). En las muestras tratadas se observó la preservación de las fibras colágenas alrededor del cartílago, mientras que en la zona correspondiente a la matriz hialina fue evidente una disminución de esta sustancia.
Además, se hace necesaria la retención de moléculas que brinden resistencia mecánica al tejido para apoyar la funcionalidad de la vía aérea; por tanto, se evaluó la presencia de GAG, por ser estos los polisacáridos más abundantes en la sustancia fundamental de la matriz y los responsables de las propiedades físicas de dicha sustancia (23). En este estudio se analizaron cortes histológicos teñidos con safranina O, en los que fue posible evidenciar una disminución del contenido de GAG al finalizar el tratamiento (figura 6). En estudios recientes se ha informado la pérdida de GAG asociada a la descelularización (24); sin embargo, también se ha demostrado una disminución paulatina del contenido de GAG en las tráqueas no sometidas a procesos de descelularización; por ello se considera que tales procesos solo pueden acelerar la disminución de estos polisacáridos en el tiempo (16). Por lo anterior, es probable que al reducir el tiempo de exposición del tejido al método de descelularización se logre una mejor retención de GAG e incluso se podría moderar la pérdida del colágeno presente en la matriz. El cartílago hialino juega un papel estructural importante, porque los anillos traqueales permiten que se mantenga la vía aérea permeable, incluso en presencia de los cambios de presión intratorácica que ocurren durante la respiración (16). Esta propiedad estructural es el resultado del acoplamiento funcional entre la alta presión osmótica proporcionada por los GAG y la resistencia a la tracción conferida por las fibrillas de colágeno. Por tanto, cualquier alteración en las proporciones de estas moléculas en la matriz extracelular podría tener efectos adversos en las propiedades funcionales de la tráquea, especialmente en el aspecto biomecánico.
En el presente trabajo se evaluaron las propiedades biomecánicas de las tráqueas controles y tratadas, para lo cual se efectuaron ensayos de tracción en dirección circunferencial, con una tasa de deformación fija de 5 mm/min, a 15 probetas de cada grupo de estudio (figura 7). Los resultados mostraron alteraciones en el porcentaje de deformación del tejido sometido al proceso de descelularización, lo que puede asociarse a la pérdida de GAG en el cartílago traqueal, que podrían ser recuperados al repoblar la matriz con las células del receptor. Es de notar que no se hallaron diferencias estadísticamente significativas en los demás parámetros evaluados, por lo que es posible que la matriz extracelular obtenida por el método químicoenzimático de descelularización utilizado proporcione el soporte mecánico necesario para el crecimiento de nuevas células.
Durante el estudio se corroboró la premisa que dependiendo del tejido tratado se deben emplear protocolos de descelularización específicos para cada tipo de matriz extracelular, ya que en los resultados se logró evidenciar que el método químico-enzimático elimina de manera efectiva el contenido celular en la mayoría de las regiones de la tráquea, aunque no fue lo suficientemente efectivo para remover los remanentes celulares de la capa cartilaginosa (figuras 3E, 3F). Estos hallazgos son similares a los descritos en estudios previos, en los que se utilizaron otros métodos de descelularización con tres componentes fundamentales: PBS, desoxicolato de sodio y ADN-asa I (5). Sin embargo, el número de ciclos es mayor en comparación con el método químico-enzimático de descelularización evaluado, puesto que en dichos trabajos se describen 17 ciclos para obtener una matriz traqueal en condiciones similares a las descritas en este trabajo con solo 5 ciclos.
CONCLUSIÓN
El método reportado en este trabajo resultó igualmente eficiente en comparación con otros procesos de descelularización reportados previamente, con una disminución importante del costo y tiempo de tratamiento, lo que podría hacerlo más viable y adaptable a las condiciones de nuestro entorno.
AGRADECIMIENTOS
Al Comité para el Desarrollo de la Investigación (CODI) de la Universidad de Antioquia por su aporte en el marco del programa de jóvenes investigadores. Al Sistema General de Regalías para Ciencia, Tecnología e Innovación en el proyecto Biobanco, regional Antioquia: optimización y mejoramiento de componentes anatómicos, una opción al alcance de todos. Al Laboratorio Clínico VID, obra de la Congregación Mariana, por el procesamiento de las muestras.
CONFLICTO DE INTERESES
Ninguno que declarar.
REFERENCIAS BIBLIOGRAFICAS
1. Otorrinoweb.com [Internet]. España: Otorrinoweb; 2010. [consultado 2015 Abr 17]. Leiva SM, Montero WR, Reula FR, Sánchez Negrette JL, Steinschütz CM, Steinschütz CA, et al. Anatomía de la Tráquea. Disponible en: http://otorrinoweb.com/es/temas-de-cuello/133-t701/2921-701o02-anatomia-de-la-traquea.html [ Links ]
2. Kalathur M, Baiguera S, Macchiarini P. Translating tissue-engineered tracheal replacement from bench to bedside. Cell Mol Life Sci. 2010 Dec;67(24):4185-96. DOI 10.1007/s00018-010-0499-z. [ Links ]
3. Ministerio de Protección Social, Instituto Nacional de Salud, Organización Panamericana de la Salud. Plan Estratégico Colombia libre de la tuberculosis 2010-2015: Para la expansión y fortalecimiento de la estrategia alto a la TB. 3ª ed. Bogotá: Ministerio de Protección Social; 2009. [ Links ]
4. Castañeda-Orjuela C, Chaparro-Narváez P, De la Hoz-Restrepo F. El Observatorio Nacional de Salud y la gestión del conocimiento en salud del país. Supersalud. 2014 Ene-Jun;(5):76-80. [ Links ]
5. Jungebluth P, Go T, Asnaghi A, Bellini S, Martorell J, Calore C, et al. Structural and morphologic evaluation of a novel detergent-enzymatic tissue-engineered tracheal tubular matrix. J Thorac Cardiovasc Surg. 2009 Sep;138(3):586-93; discussion 592-3. DOI 10.1016/j.jtcvs.2008.09.085. [ Links ]
6. Rana D, Zreiqat H, Benkirane-Jessel N, Ramakrishna S, Ramalingam M. Development of decellularized scaffolds for stem cell-driven tissue engineering. J Tissue Eng Regen Med. 2015 Jun. DOI 10.1002/term.2061. [ Links ]
7. Lehr EJ, Rayat GR, Chiu B, Churchill T, McGann LE, Coe JY, et al. Decellularization reduces immunogenicity of sheep pulmonary artery vascular patches. J Thorac Cardiovasc Surg. 2011 Apr;141(4):1056-62. DOI 10.1016/j.jtcvs.2010.02.060. [ Links ]
8. Gilbert TW, Freund JM, Badylak SF. Quantification of DNA in biologic scaffold materials. J Surg Res. 2009 Mar;152(1):135-9. DOI 10.1016/j.jss.2008.02.013. [ Links ]
9. Sasaki S, Funamoto S, Hashimoto Y, Kimura T, Honda T, Hattori S, et al. In vivo evaluation of a novel scaffold for artificial corneas prepared by using ultrahigh hydrostatic pressure to decellularize porcine corneas. Mol Vis. 2009 Oct;15:2022-8. [ Links ]
10. Bolland F, Korossis S, Wilshaw SP, Ingham E, Fisher J, Kearney JN, et al. Development and characterisation of a full-thickness acellular porcine bladder matrix for tissue engineering. Biomaterials. 2007 Feb;28(6):1061-70. [ Links ]
11. Gilbert TW, Sellaro TL, Badylak SF. Decellularization of tissues and organs. Biomaterials. 2006 Jul;27(19):3675-83. [ Links ]
12. Badylak SF. Decellularized allogeneic and xenogeneic tissue as a bioscaffold for regenerative medicine: factors that influence the host response. Ann Biomed Eng. 2014 Jul;42(7):1517-27. DOI 10.1007/s10439-013-0963-7. [ Links ]
13. Partington L, Mordan NJ, Mason C, Knowles JC, Kim HW, Lowdell MW, et al. Biochemical changes caused by decellularization may compromise mechanical integrity of tracheal scaffolds. Acta Biomater. 2013 Feb;9(2):5251-61. DOI 10.1016/j.actbio.2012.10.004. [ Links ]
14. Rozario T, DeSimone DW. The extracellular matrix in development and morphogenesis: a dynamic view. Dev Biol. 2010 May;341(1):126-40. DOI 10.1016/j.ydbio.2009.10.026. [ Links ]
15. Kleinman HK, Philp D, Hoffman MP. Role of the extracellular matrix in morphogenesis. Curr Opin Biotechnol. 2003 Oct;14(5):526-32. [ Links ]
16. Rosso F, Giordano A, Barbarisi M, Barbarisi A. From cell-ECM interactions to tissue engineering. J Cell Physiol. 2004 May;199(2):174-80. [ Links ]
17. Baiguera S, Jungebluth P, Burns A, Mavilia C, Haag J, De Coppi P, et al. Tissue engineered human tracheas for in vivo implantation. Biomaterials. 2010 Dec;31(34):8931-8. DOI 10.1016/j.biomaterials.2010.08.005. [ Links ]
18. Macchiarini P, Jungebluth P, Go T, Asnaghi MA, Rees LE, Cogan TA, et al. Clinical transplantation of a tissueengineered airway. Lancet. 2008 Dec;372(9655):2023-30. DOI 10.1016/S0140-6736(08)61598-6. Erratum in: Lancet. 2009 Feb;373(9662):462. [ Links ]
19. Elliott MJ, De Coppi P, Speggiorin S, Roebuck D, Butler CR, Samuel E, et al. Stem-cell-based, tissue engineered tracheal replacement in a child: a 2-year followup study. Lancet. 2012 Sep;380(9846):994-1000. DOI 10.1016/S0140-6736(12)60737-5. [ Links ]
20. Badylak SF. The extracellular matrix as a biologic scaffold material. Biomaterials. 2007 Sep;28(25):3587-93. [ Links ]
21. Brown BN, Barnes CA, Kasick RT, Michel R, Gilbert TW, Beer-Stolz D, et al. Surface characterization of extracellular matrix scaffolds. Biomaterials. 2010 Jan;31(3):428-37. [ Links ] DOI 10.1016/j.biomaterials.2009.09.061.
22. Badylak SF, Gilbert TW. Immune response to biologic scaffold materials. Semin Immunol. 2008 Apr;20(2):109-16. [ Links ]
23. Michael HR, Wojciech P. Tejido conjuntivo. En: Histología: Texto y Atlas color con Biología Celular y Molecular. 5th ed. Buenos Aires: Panamericana; 2007. p. 117-81. [ Links ]
24. Haykal S, Soleas JP, Salna M, Hofer SO, Waddell TK. Evaluation of the structural integrity and extracellular matrix components of tracheal allografts following cyclical decellularization techniques: comparison of three protocols. Tissue Eng Part C Methods. 2012 Aug;18(8):614-23. DOI 10.1089/ten.TEC.2011.0579. [ Links ]